Гаплоидия у томата
Автор: Шмыкова Н.А.
Журнал: Овощи России @vegetables
Рубрика: Современные направления селекции овощных культур
Статья в выпуске: 1 (3), 2009 года.
Бесплатный доступ
В статье рассматривается перспектива создания гомозиготных линий томата через гаплоиды. Гаплоиды могут быть получены как из клеток женского, так и мужского га-метофита. Обсуждаются достижения в области гаплоидии томата, полученные за последние 40 лет, отражены успехи и проблемы получения дигаплоидов через андрогенез и гиногенез.
Томат, гаплоиды, гиногенез, андрогенез
Короткий адрес: https://sciup.org/14024763
IDR: 14024763 | УДК: 635.64:576.356.52
Текст научной статьи Гаплоидия у томата
Т омат является наиболее распространенной овощной культурой во всём мире (Anonymous, 2004). В производстве преобладают гибриды F1, имеющие высокую урожайность, устойчивость к болезням и неблагоприятным условиям. Процесс создания гибридов F1 длительный и трудоёмкий, что делает гибридные семена дорогостоящими. На создание линии требуется несколько лет, наименьшее количество инбредных поколений у самоопыляемых культур составляет 5-7 (Ellialtioglu et al., 2001). В настоящее время развиваются альтернативные методы ускоренного получения гомозиготных линий через гаплоиды. Гаплоиды могут быть получены как из клеток женского, так и мужского гаметофитов, соответственно через культуру неопыленных семяпочек и культуру пыльников и микроспор. Обычно различают: андрогенез – получение гаплоидных растений на искусственных питательных средах из изолированных пыльников, микроспор; гиногенез – получение гаплоидных растений на искусственной питательной среде из изолированных семяпочек. После удвоения числа хромосом гаплоиды становятся 100% гомозиготными формами и могут быть использованы непосредственно как родительские линии в производстве гибридов.
Сегодня накоплена большая информация в области генетики, физиологии и биохимии томата, он используется как модельное растение в цитологических и цитогенетических исследованиях, составлены его генетические карты и разработаны молекулярные маркерные системы
(Foolad, 2007). Производство гаплоидов томата может значительно облегчить фундаментальные исследования и ускорить селекционный процесс. Для получения гаплоидов томата разрабатываются различные методы.
Гиногенез
Получение гаплоидых растений в культуре in vitro неопыленных семяпочек является результатом перехода клеток зародышевого мешка с гаметофитного пути развития на спорофитный с образованием из них эмбриоидов или морфогенного каллуса. Однако первые гаплоидные растения томата сорта Мэрглоуб были получены задолго до начала развития биотехнологии растительных клеток и тканей – в 1930 году за счет партеногенетического развития яйцеклетки (Morrison, 1932; Cook, 1936). Lindstrom E.W. с коллегой (1931) провели цитогенетическое исследование гаплоидной формы томата и её диплоидного и тетраплоидного потомства. В 1957 году гаплоидные растения томата были получены от опыления гибрида F1 (сорт Бизон х сорт Штамбовый Алпа-тьева) пыльцой сорта Бизон, облученной рентгеновскими лучами (500 р). Из 8964 растений выделено 56 с 12 хромосомами (Кириллова, Богданова, 1978). В 2001 году появились сообщения о цитогенетическом исследовании гаплоидов томата сорта Микадо, полученных в Саратовском Госуниверситете. Автором было показано, что доза генов не сказывается на проявлении качественных признаков (габитусе ку- ста, маркерных признаках: форме листа, окраске плода), но в значительной мере определяет количественные, такие как число хлоропластов в замыкающих клетках устьиц, размеры листьев, количество компонентов цветка, пыльцевых зерен в цветке (Иванова, 2001). Использование метода индукции партеногенеза через опыление облученной пыльцой успешно применяется в настоящее время и на других овощных культурах, например у огурца (Truong-Andre, 1988; Sauton, 1989; Przyborowski, Niemirowicz-Czczytt, 1994; Caglar, Abak, 1996). Однако, в исследованиях, проведенных в Турции, этот метод положительных результатов не дал. Для опыления цветков нескольких сортов томата использовалась пыльца, облученная 1000 и 800 Gys, и только при опылении пыльцой облученной 800 Gys происходило успешное развитие пыльцевых трубок и вход их в семяпочки, но развитие гаплоидного эмбриода было прервано на очень ранних стадиях (Bal, Abak, 2007).
Наряду с опылением облученной пыльцой для индукции гиногенеза часто используется опыление чужеродной пыльцой, которая способна прорастать на рыльце пестика, а пыльцевые трубки достигать семяпочки, но оплодотворение не должно происходить. У томата рядом исследователей для этой цели использовалась пыльца Solanum sisymbriifolium Lam. (Chambonnet, 1996; Bal, Abak, 2003 a). Chambonnet (1996) сообщил о получении 8 фертильных растений, имеющих главным образом 24 хромосомы, но в некоторых клетках было по 12 хромосом. В исследованиях других авто- ров, проведенных in vitro, при опылении культурных сортов томата пыльцой S. sisymbriifolium пыльцевая трубка достигала яйцеклетки через 24 часа после опыления, и было получено несколько плодов (Bal, Abak, 2003 а). Часть плодов не содержала семян, в других имелись семяпочки, из которых при культивировании in vitro образовались растения-регенеранты. Сеянцы достигли 10 см в высоту. При подсчете хромосом в клетках кончиков корней выявлено 24, 25, 26 хромосом. Однако растения не были выращены, и дальнейшая информация о них отсутствует. Авторы предполагают, что они были удвоенными гаплоидами.
Число работ по культивированию завязей in vitro ограничено, полученные в них результаты противоречивы. В одних исследованиях показано, что происходит образование каллуса из соматических тканей, который препятствует развитию семяпочек (San, Gelebart, 1986). В других работах предполагается, что успех в культуре семяпочек возможен (Bal, Abak, 2003). Для подавления каллусообразова-ния из стенок завязей семяпочки культивировали на среде с добавлением маннита вместо сахарозы. Предкультивирова-ние было выполнено при 10°С в темноте в течение семи дней на 1 / 2 среды МS, содержащей регуляторы роста и аминокислоты. Впоследствии завязи были культивированы на среде NLN c гидролизатом казеина. Во время культивирования каллус из тканей стенок завязи не развивался, стенки разрушались, семяпочки становились видимыми. Семяпочки были двух типов: шаровидные с круглыми контурами и почти прямоугольные. Гистологический анализ показал наличие массы клеток внутри зародышевого мешка, которая напоминала глобулярные эмбриоиды. Хотя дальнейшее развитие их не происходило, деление клеток зародышевого мешка прослеживалось.
Анализ немногочисленных сообщений показал, что методы индукции гиногенеза у томата недостаточно разработаны и получение дигаплоидов с использованием этого метода возможно.
Андрогенез
Число и возможности индукции эмбриогенеза из микроспор томата ограничены, а полученные результаты далеки от тех, которые известны для табака и рапса. Первые сообщения об андрогенезе у томата, появились в 1972 году, спустя почти десятилетие после первых положительных результатов культивирования пыльников (Guha, Maheshwari, 1964). Было предложено несколько вариантов питательных сред для культивирования пыльников томата, которые затем часто применялись в подобных экспериментах (Gresshoff, Doy,
1972). В первом сообщении (Sharp et al., 1971;1972) использовали не культуру пыльников непосредственно а, точнее, ткани пыльников служили для поддержания микроспор, – так называемая «культура няньки». Микроспоры были помещены на бумажные фильтровальные диски, лежащие на неповрежденных пыльниках, культивируемых на агаризованной среде. Эти авторы первыми сообщили о получении каллуса и корней, образовавшихся из него, в культуре пыльников. Позже в последующих исследованиях, индуцируя ан-дрогенез в культуре пыльников и микроспор, также получали каллус, реже побеги, которые погибали на ранних стадиях развития (Debergh, Nitsch, 1973; Нгуен, Шамина, 1978; Cheyah et al., 1990; Jaramillo, Summer, 1990, 1991; Summer et al., 1992). Некоторые авторы сообщали о получении не гаплоидных растений, а растений с более высокой плоидностью, то есть 2n, 4n. Однако в ряде экспериментов у растений-регенерантов наблюдали проявление рецессивного маркера (tf), что указывает их гаплоидное происхождение (Ziv et al., 1982, 1984).
Известно, что на индукцию андрогене-за влияет целый ряд факторов. Наиболее значимым у томата является генотип растения (Gresshoff и Doy1972; Chlyah,Taarji, 1984). Использование в эксперименте мужских стерильных линий позволило получить растения-регенеранты (Zamer et al.,1980). Изучение влияния таких факторов, как состав питательных сред, тип желирующих веществ, темнота, освещенность, предобработки, стадии развития, проводились в многочисленных экспериментах по культивированию пыльников томата (Jaramillo, Summers, 1990, 1991; Summers et al.,1992; Ozzambak, Atasayar 1994; Paksoy, Abak, 1994; Brasileiro et al.,1999). Однако при использовании этого метода было получено лишь несколько растений-регенерантов (Ancora et al., 1977; Zamir et al., 1980; Ziv et al., 1984). Наиболее полное и всестороннее исследование факторов, влияющих на андроге-нез, было исследовано в работах болгарских ученых, ими были получены в культуре пыльников многочисленные растения-регенеранты (Zagorska et al.,1998; 2004). Наименьшее число работ посвящено культуре микроспор томата (Yinnan et al., 1999; Bal, Abak, 2005).
Факторы, влияющие на результативность культуры пыльников in vitro
Регенерация растений в культуре пыльников томата зависит от различных факторов, взаимодействующих друг с другом. Генотип – один из важных факторов, определяющий ответ пыльника на состав питательной среды и условий предобработки. Zagorska c коллегами (1998) нашли, что из 80 проверенных культурных сортов томата,
53 были отзывчивы, у них происходило кал-лусообразование, но только маленькая доля была способна дифференцироваться и развиваться в растения-регенеранты. Однако культурные сорта, несущие ген ms 1035 мужской стерильности, могли образовывать каллус, сопровождающийся органогенезом и регенерацией. Ранее, путем воздействия на микроспоры, находящиеся на необходимой стадии развития, был продемонстрирован высокий уровень индукции каллуса от пыльников мужских стерильных линий, несущих ген ms 1035 (Zamer et al.,1980). Это исследование показало, что из четырех протестированных культурных сортов и селекционных линий одна фертильная линия продуцировала каллус с очень низкой частотой – 0,7%, тогда как изогенные стерильные линии образовывали каллус до 37,7%. Другие авторы наблюдали каллусообразование только у трех культурных сортов, а побеги – у одного из 43 протестированных (Gresshoff, Doy 1972).
Вторым значимым фактором для индукции андрогенеза является стадия развития микроспор, на которой происходит культивирование пыльников или микроспор. У большинства видов растений период отзывчивости микроспоры к индукции андрогенеза соответствует переходу от стадии вакуолизированной микроспоры к ранней двухклеточной пыльце, то есть это период накануне и после первого пыльцевого митоза (Hause et al., 1993; Reynolds, 1997; Binarova et al, 1997). В большинстве цитируемых работ для культивируемых in vitro пыльников томата характерным является образование каллуса с последующей регенерацией растений, что не дает четкого ответа о его происхождении. Информация, накопленная в мировой практике за последние 35 лет, противоречива. Первоначально ряд исследователей указывали на отзывчивость пыльников, содержащих мейоциты (Gresshof, Doy, 1972; Zamer et al., 1980). В прошлом десятилетии появилось несколько работ, где указывается, что критический период совпадает с мейоти-ческим развитием и тетрадами (Summens et al., 1992; Shtereva et al., 1998; Brasileiro et al., 1999). В более поздних работах внесено уточнение, что этот период находится между метафазой I и телофазой II (Sequi-Simarro, Nuez, 2005). Подтверждением этому может служить способность к каллу-сообразованию пыльников стерильных линий с геном 1035 (Zagorska et al., 1998).
Однако существуют и другие мнения, например, стадия молодых микроспор (Levenko et al., 1977; Gulshan, Sharma, 1981), последняя стадия вакуолизированных микроспор ( Нгуен, Шамина, 1978; Evans et al., 1989; Yinnan et al., 1999; Bal, Abak, 2005;). Наши исследования (Шмы-кова, 2006), проведенные на сорте Грунтовый Грибовский 1180, показали, что у томата образованию эмбриогенной пыльцы предшествуют отклонения от нормы в асимметричном митозе, происходит замена его на симметричное деление (рис. 1), при этом из каждой клетки может развиваться эмбриогенная структура. В случае асимметричного митоза и образования двухклеточной пыльцы, на ранних этапах также возможен переход на споро-фитный путь развития (рис. 1).
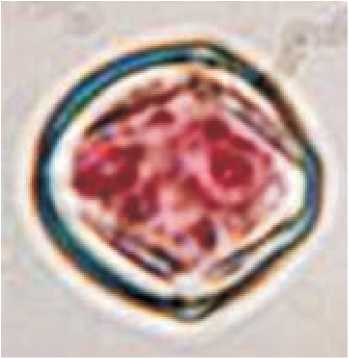
А
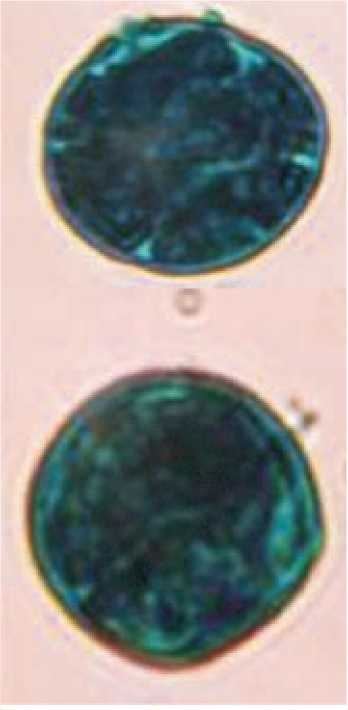
Б
Рис.1. Образование эмбриоидов в пыльниках томата (сорт Грунтовый Грибовский), культивируемых in vitro, из микроспор, находящихся на поздних стадиях развития:
А – равный тип деления; Б – неравный тип деления
Аналогичные изменения в культуре пыльников этого же сорта наблюдали другие исследователи: эмбриоиды развивались до стадии 20-32 клеток, после чего процесс останавливался (Нгуен, Шамина,1978). В другом эксперименте при культивировании пыльников с микроспорами на поздней вакуолизированной стадии были получены гаплоидные растения межвидового гибрида L. esculentum x L. pennellii (Evans et al.,1989). Однако наряду с вышеописанными изменениями в культивируемых in vitro пыльниках томата мы прослеживали дополнительные деления микроспор в тетрадах (рис. 2) в пыльниках сорта Грунтовый Грибовский 1180 (Шмыкова, 2006).
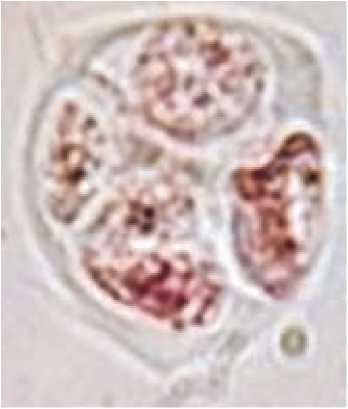
Рис.2. Деление микроспоры в тетраде в период культивирования пыльника томата (сорт Грунтовый Грибов-ский) in vitro
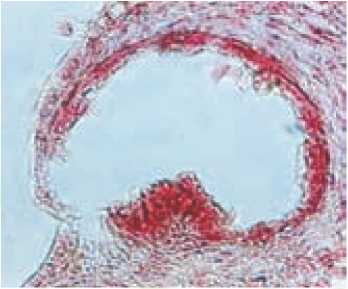
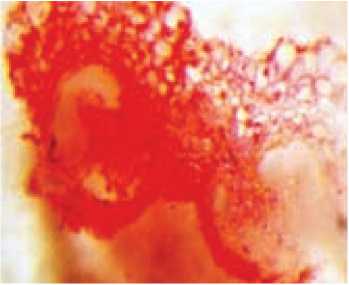
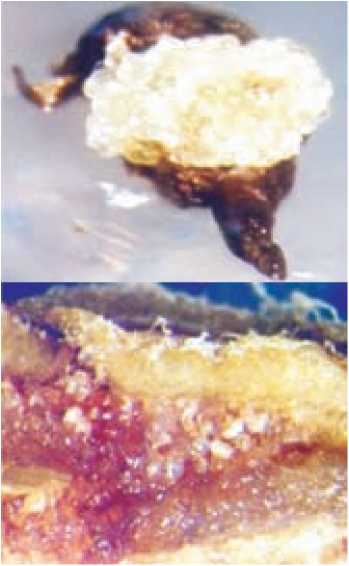
Каллус также может развиваться из соматических клеток стенок пыльника (рис. 3). В этом процессе могут участвовать клетки средних слоев, эндоте-ция и связника, которые сохраняются мало измененными на протяжении всего периода микроспорогенеза (Шмы-кова, 2006).
А
Б
В
Рис. 3. Образование каллуса из соматических клеток стенок пыльника томата:
А – поперечный срез пыльника до культивирования in vitro; Б – поперечный срез пыльника, культивируемого in vitro; В – каллус, образовавшийся на поверхности культивированных in vitro пыльников
В большинстве случаев андрогенез индуцируется путем воздействия различными физическими или химическими факторами до культивирования или в период культивирования. Для томата используют чаще два типа предобработок: первая – пониженными температурами, вторая – повышенными. Chlyah и Taarji (1984) показали, что холодовые предобработки в течение 24 часов до культивирования или после культивирования вызывали каллусообразование 48,5% и 44,5 % соответственно. В контроле каллус развивался у 37% пыльников. Побегообразование ни в одном из вариантов не наблюдалось. Shtereva с коллегами (1998) исследовали эффект предобра- боток температурой 4, 7, 10 и 35°С различной продолжительностью воздействия. Evans с коллегами (1989) рекомендуют соцветие инкубировать в течение 2-6 суток при температуре 3…5°С, а пыльники культивировать при 34…38°С в течение 7-9 суток в темноте и только затем при 22°С с фотопериодом 12-18 часов. Нгуен и Шамина (1978) перед культивированием пыльников помещали бутоны томата на 12 часов в холодильник при температуре 4°С. Bal и Abak (2005) предкультивировали бутоны на среде с маннитом при температуре 10°С.
Много исследований в культуре пыльников томата было сфокусировано на основных компонентах питательных сред, использовались различные варианты макро- и микроэлементов и регуляторов роста (Gresshof, Doy 1972; Sharp et al., 1972; Debergh, Nitsch, 1973). Для индукции андрогенеза в пыльниках томата использовались питательные среды разного состава. В первоначальных протоколах чаще всего упоминаются три основных питательных среды DBM I, DBM II и DBM III с различными концентрациями НУК и кинетина (Gresshof, Doy 1972). При испытании 7 вариантов сред, каллусообразование наблюдалось на среде DBM I с 2 мг/л НУК и 5 мг/л кинетина и DBM II с 2 мг/л НУК и 1 мг/л кинетина. DBM среды в дальнейшем включались в эксперименты по культивированию пыльников томата целым рядом других исследователей (Нгуен, Шамина, 1978; Chlyah, Taarji, 1984; Jaramillo, Summers, 1990; 1991; Summers et al., 1992). Напротив, Zamir с коллегами (1980) использовал MS среду
(Murashige, Skoog, 1962) с 1-2% сахарозы, 0,8 % агара, рН 5,8, а в качестве регуляторов роста – зеатин 0,25мг/л и ИУК 0,5 мг/л. При этом было выявлено, что линии с мужской стерильностью образуют каллус у 30 % культивируемых пыльников. Evans с коллегами (1989) рекомендуют на начальных этапах использовать среду типа Sibi (Sibi et al., 1979) c 7-12 % сахарозой, с 5х10-8 – 5х10-9 М 2,4Д и 5х10-8 – 5х10-9 М цитокинина с последующим переносом на среду с 3% сахарозой 5х10-7 – 5х10-8 М цитокинина. В исследованиях других авторов было протестировано 20 вариантов сред, содержащих питательные вещества по прописи MS (Murashige, Skoog, 1962), Ls (Linsmaier, Skoog, 1965) и Нича (Nitsch, 1969) с различным сочетанием регуляторов роста (Shtereva et al.,1998). Они выявили, что две среды MS, содержащие 2 мг/л 2ip и 2 мг/л ИУК, или 0,5 мг/л зеатина и 0,5 мг/л ИУК, показали лучшие результаты индукции каллуса из пыльников томата. Исследования проводили на линиях с мужской стерильностью и фертильных. Было показано, что среда MS-1 наиболее благоприятна для индукции каллуса, доля пыльников образующих каллус была на 10% выше, чем MS-2. Однако регенерация растений и развитие побегов и листьев были выше на среде MS-2. Число хромосом у регенерантов изменялось от 12 до 36 (Zagorska et al, 1998; 2004).
Результативность использования культуры пыльников томата далека от удовлетворения производства гаплоидов, а получаемые результаты часто вызывают сомнения по поводу происхождения растений-регенерантов. В этом случае более перспективной и надежной является культура микроспор. Фактически еще в первых работах Sharp с коллегами (1972) культивировали микроспоры, а сам пыльник служил культурой-нянькой. Не смотря на то, что ими был получен каллус, в дальнейшем этот способ использовался крайне редко (Debergh, Nitsch, 1973; Varshese, Yadav, 1986; Yinnan et al., 1999; Bal, Abak, 2005). Yinnan с коллегами (1999) сообщили о развитии глобулярных и сердечковидных эмбриоидов из изолированных микроспор, культивируемых на среде NLN (Lichter, 1981), содержащей гидролизаты казеина и лактоальбумина. В качестве предобработки бутоны были инокулированы на среде с маннитом (среда голодания) и инкубированы в темноте при 10°С в течение 7 дней. Однако гаплоидные растения не были получены.
Используемые приемы в технике культивирования пыльников не дают однозначных удовлетворительных результатов и вряд ли это возможно, так как соматические ткани пыльников у томата способны к образованию каллуса на протяжении всего периода микроспорогенеза (Шмыкова, 2006), поэтому использование культуры микроспор может оказаться более плодотворным.
Заключение
Несмотря на экономическую значимость томата, исследования в области получения гаплоидов у этой культуры заслуживают намного большего внимания, чем это происходит на практике.

Список литературы Гаплоидия у томата
- Иванова С.В. Мейоз у гаплоидного томата как возможный индуктор генотипической изменчивости//Известия ТСХА -М.,2001. -Вып.1. -С. 72 -82.
- Кириллова Г.А., Богданова Е.Н. Сравнительное изучение длительно существующей гаплоидной формы томата и гомозиготной полученной из неё//Генетика -1978. -Т. 9. -С. 1030-1037.
- Нгуен Тхи Дао, Шамина З.Б. Культура изолированных пыльников томата//Физиология растений -1978. -Т. 25. -№1. -С. 155-160.
- Шмыкова Н.А. разработка системы биотехнологических методов, направленных на ускорение селекционного процесса овощных культур//Автореф. дис. М., 2006. -47 с.
- Ancora G., Sree Ramula K., Devreus M. In vitro culture of anthers and stems internodes of L. esculentum: nuclear DNA determination in calli and cytological analysis of regenerated plants//Z. Pflanzenphysiol -1977. -Vol. 82. -P. 377-388.
- Anonymous Food and Organization (FAO), FAOSTAT. Statistics Database (Agriculture Data) 2003. -2004. -On the internet, http://www. apps. fao.org.
- Bal U., Abak K. Attempts of haploid induction in tomato (Lycopersicon esculentum Mill.) via ginogenesis I.: Pollination with Solanum sisymbriifolium Lam. Pollen.//Pak. J. Biol. Sci. -2003. Vol. 6. -P. 745-749.
- Bal U., Abak K. Attempts of haploid induction in tomato (Lycopersicon esculentum Mill.) via ginogenesis II: In vitro non-fertilized ovary culture.//Pak. J. Biol. Sci. -2003. Vol. 6. -P. 750-755.
- Bal U., Abak K. Induction of symmetrical nucleus division and multicellular structures from the isolated microspore of Lycopersicon esculentum Mill.//Biotechnol Biotechnol Equip. -2005. -Vol. 19. -P. 35 -42.
- Binarova P., Straatman K., Hause G., Hause P., Pehan P., van Lammeren A. A. M. Nuclear DNA synthesis during the induction of embryogenesis in cultured microspores and pollen of Brassica napus L.//Theoretical and Applied Genetics -1993. -Vol. 87. -P. 9-16.
- Brasileiro A.C.R.,Willadino L., Guerra M., Colaco W., Meunier I., Camara T.R. Anther development stage and gamma radiation effects on tomato anther-derived callus formation.//Scientia Agricola -1999. -Vol. 56. -P. 835-842.
- Caglar G., Abak K. The effects of seasons and irradiation doses on haploid embryo production in cucumber (Cucumis sativus L.)//Proc. Fifth Eucarpia Meeting on Cucurbit Genetics and Breeding, Malaga, Spain, 28-30 May 1996. -P. 25-30.
- Chambonnet D. Assais d'haploidisation de la tomate//In: Rapport D'Activite 1995-1996 Station D'Amelioration Des Plantes Maraicheres D'Avignon-Montfavet. -1996. -P. 84-85.
- Chlyah A., Taarji H., Chlyah H. Tomato (Lycopersicon esculentum Mill.) Anther culture and induction of androgenesis.//In: Bajaj YPS (ed) Haploids in crop improvement I. Biotechnology in agriculture and forestry 12. Spriger-Verlag, Berlin. -1990.
- Chlyah A., Taarji H. Androgenesis in tomato//In: Proc. Int. Symp. Plant tissue and cell culture application to crop improvement. 24 -29 Sept. 1984.
- Novak F.J., Havel L., Dolezel J. (eds). -1984. -P241-242.
- Cook R.C. A haploid Marglobe tomato: Practical application of «short cut» for making pure lines//J. Heredity -1936. -Vol. 27. -P. 432-435.
- Debergh P., Nitsch C. Histophysiologie vegetale-premiers resultants sur la culture in vitro de grains de pollenisoles chez la Tomate. C.R. Acad. Sci Paris 276 Serie D.-1973. -P. 1281-1286.
- Ellialtioglu S., Sari N., Abak K. Production of haploid plants//In: Babaoglu M., Guzel E., Ozcan S. (eds) Plant biotechnology I., Selcuk Univ. Press. -2001. -P137-189.
- Foolad M.R. Genome mapping and molecular breeding of tomato//International J. of Plant -2007. Vol. 2007 Genomics Artkle ID 64358.-52 p.
- Gresshoff P.M., Doy C.H. Development and differentiation of haploid Lycopersicon esculentum (tomato)//Planta -1972. -Vol. 107. -P. 161-170.
- Guha S., Maheswari S.C. In vitro production of embryos from anthers of Datura//Nature -1964. -Vol. 204. -P. 497.
- Gulshan T.M.V., Sharma D.R. Studies on anther cultures of tomato -Lycopersicon esculentum Mill.//Biol. Plant. -1981. -Vol. 23. -P. 414-420.
- Hause G., Hause P., Pehan P., van Lammeren A. A. M., Cytoskeleton changes and induction of embryogenesis in microspore and pollen cultures of Brassica napus L.//Cell Biol. Int. -1993. -Vol. 17. -P. 153-166.
- Jaramillo J., Summers W.L. Dark-light treatments influence induction of tomato anther callus//HortScience -1991. -Vol. 26. -P. 915-916.
- Jaramillo J., Summers W.L. Tomato anther callus production: solidifying agent and concentration influence induction of callus//J. Amer. Soc. Hort. Sci. -1990. -Vol. 115. -P. 1047-1050.
- Levenko B.A., Kunakh V.A., Yurkova G.N. Studies on callus tissue from anthers. I. Tomato//Phytomorphology -1977. -Vol. 27. -P. 377-383.
- Lichter B. Anther culture of Brassica napus in liquid culture medium//Z. Pflanzenphysiol -1981. -Vol. 103. -P. 229-237.
- Lindstrom E.W., Koos K. Cytogenetic investigation of haploid tomato and its diploid and tetraploid progeny//Amer. J. Bot. -1931. -Vol. 18. -P. 398-410.
- Linsmaier E.M., Skoog F. Organic growth factor requirements of tobacco tissue cultures//Physiol Plant. -1965. -Vol. 18. -P. 100-127.
- Morrison G. The occurrence and use of haploid plants in tomato with special refence to the variety Marglobe//Proc. IV Intern. Congr. Genet. 1932. -Vol. 2. -P. 132.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures//Physiologia Plantarum -1962. -Vol. 15. -P. 473497.
- Nitsch J.P. Experimental androgenesis in Nicotiana//Phytomorphology -1969. -Vol. 19. -P 389-404.
- Ozzambak E., Atasayar A. Anther culture of tomatoes and eggplants//Acta Hort -1994. -Vol. 366. -P. 299-233.
- Paksoy M., Abak K. Investigations on factors affecting in vitro androgenesis in tomato (Lycopersicon esculentum Mill) IInd National Biotechnology Symposium, 22-23 September 1994 Beytepe-Ankara. -1994. -P. 15.
- Przyborowski J., Niemirowicz-Czczytt K. Mein factor affecting cucumber (Cucumis sativus L.) haploid embryo development and plant characteristics//Plant Breeding -1994.-Vol. 112. -P 70-75.
- Reynolds T.L. Pollen embryogenesis//Plant Mol. Biol. -1997. -Vol. 33. -P. 1-10.
- Sauton A. Haploid Gynogenesis in cucumis induced by irradiated pollen//Cucurbit Genet Coop. -1989. -Vol. 12. P. 22-23.
- Sharp W.R., Dougall D.K.,Paddock E.F. Haploid plantlets and callus from immature pollen grains of Nicotiana and Lycopersicon//Bull Torrey Bot Club -1971. -Vol. 98. -P. 219-222.
- Sharp W.R., Raskin R.S., Sommer H. E. The use of nurse culture in the development of haploid clones of tomato//Planta -1972. -Vol. 104. -P. 357-361.
- Shtereva L.A., Zagorska N.A., Dimitrov B.D., Kruleva M.M., Oanh H.K. Induced androgenesis in tomato (Lycopersicon esculentum Mill.). I.I. Factors affecting induction of androgenesis//Plant Cell Rep -1998. -Vol. 18. -P. 312-317.
- Summers W.L., Jaramillo J., Bailey T. Microspore developmental stage and anther length influence the induction of tomato anther callus//Hort Science -1992. -Vol. 27. -P. 838-840.
- Truong-Andre I. In vitro haploid plants derived from pollination by irradiated pollen on cucumber//Proc. Eucarpia Meeting on Cucurbitaceae. France -1988. -P. 143-144.
- Varghese T.M., Yadav G. Production of embryoids and calli from isolated microspore of tomato (Lycopersicon esculentum Mill.) in liquid media//Biol Plant (Prague) -1986. -Vol. 28. -P. 126-129.
- Yinnan Y., Dewei Z. Yong L., Shansu D. Production of embryoids and calli from isolated microspores of tomato in liquid medium//J. Agric Biotechnol. -1999. -No 1. http://www.cau.edu.cn/agrocbi/periodi-cal/nyswjsxb/nysw99/nysw9901/990115. htm
- Zagorska N.A., Shtereva L.A., Dimitrov B.D., Kruleva M.M. Induced androgenesis in tomato (Lycopersicon esculentum Mill.) I. Influence of genotype on androgenesis ability//Plant Cell Rep. -1998. -Vol. 17. -P968-973.
- Zagorska N.A., Shtereva L.A., Kruleva M.M., Sotirova V.G., Baralieva D.L., Dimitrov B.D. Induced androgenesis in tomato (Lycopersicon esculentum Mill.). III Characterization of the regenerants//Plant Cell Rep. -2004. -Vol. 22. -P. 449-456.
- Zamir D., Jones R.A., Kedar N. Anther culture of malesterile tomato (Lycopersicon esculentum Mill.) mutants//Plant Sci Lett. -1980. -Vol. 17. -P. 353-361.
- Ziv M., Hadary D., Kedar N. Dihaploid plants regenerated from tomato anther in vitro//Proc 5th Int Congr Plant Tissue and Cell Culture, Tokyo -1982. -P. 549-550.
- Ziv M., Hadary D., Kedar N., Ladizinsky G. Lycopersicon esculentum -trifoliate plants recovered from anther cultures of heterozygous tftf plants//Plant Cell Rep. -1984. -Vol. 3. -P. 10-13.


