Гаплоидный партеногенез in vitro у сахарной свеклы (Beta vulgaris L.): факторы и диагностические признаки
Автор: Жужжалова Т.П., Подвигина О.А., Знаменская В.В., Васильченко Е.Н., Карпеченко Н.А., Землянухина О.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Селекция: культура тканей, молекулярный анализ
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Традиционное получение инбредных линий и гибридов в селекции сахарной свеклы -трудоемкий процесс, требующий длительного времени из-за 2-летнего цикла развития растений, само- и перекрестной несовместимости, инбредной депрессии. Для индукции генотипического многообразия в исходной популяции перспективны биотехнологии, в том числе гаплоидный партеногенез. Мы показали, что при индуцировании гаплоидов in vitro у сахарной свеклы ( Beta vulgaris L.) эффективна экспресс-диагностика по фенотипическим, эмбриологическим признакам, отражающим периоды развития цветоносных побегов, органов, бутонов, стадии формирования зародышевого мешка семязачатка и пыльцевых зерен. Регенерационная активность наблюдается в семязачатках с 1 по 25 бутоны, расположенных по колосовидному цветоносу плейохазия вверх от раскрывшегося цветка. Ядра и клетки женского гаметофита изолированных семязачатков этих бутонов в условиях in vitro способны к новообразованиям на всех этапах развития, но 8-ядерные или 7-клеточные зародышевые мешки наиболее компетентны к морфогенезу и переключению программы развития с гаметофитного на спорофитный путь. Наступление критического периода развития зародышевых мешков предварительно определяли по сопутствующим эмбриологическим признакам - наличию одноядерных микроспор и двух-трехклеточных пыльцевых зерен пыльников, находящихся с семязачатками в одном бутоне. Полученные нами результаты свидетельствуют, что гормональный состав питательной среды по Гамборгу (В5) служит важным фактором, который эффективно регулирует направление морфогенетического развития у изолированных семязачатков - через прямую регенерацию (эмбриоидогенез) или через каллус (гемморизогенез), что свидетельствует о тотипотентности как половых, так и соматических клеток экспланта. Полученные данные о воспроизведении in vitro гаплоидных регенерантов углубляют имеющиеся научные представления о специфике морфогенетического потенциала у растений сахарной свеклы. Стабилизирующий отбор при создании линий удвоенных гаплоидов способствует выявлению ценных морфологических признаков регенерантов. Определение числа хромосом и хлоропластов в замыкающих клетках устьиц, а также электрофоретическая подвижность изоферментов (по локусам Adh-1, Mdh-1, Mdh-2, Me-1, Idh-1, Idh-2, Gdh-1 ) могут служить маркерами при индуцировании гаплоидии и создании гомозиготных реституционных линий сахарной свеклы. Показана эффективность метода RFLP-анализа с использованием рестриктазы Hind III, позволившего впервые идентифицировать гаплоидные микроклоны по типу цитоплазмы. Молекулярные маркеры свидетельствовали, что регенеранты с нормальной цитоплазмой (N) имели один ПЦР-продукт длиной 800 п.н., у форм (S) с цитоплазматической мужской стерильностью (ЦМС) обнаруживались два продукта рестрикции (320 п.н. и 480 п.н.). Выявление гаплоидных регенерантов со стерильной цитоплазмой из исходных популяций имеет важное теоретическое и прикладное значение для селекции, облегчая задачу создания гомозиготных линий с ЦМС и высокопродуктивных гибридов на стерильной основе.
Сахарная свекла, гаплоидный партеногенез, женский гаметофит, удвоенные гаплоиды, эмбриоидогенез, органогенез, изоферменты, rflp-анализ днк
Короткий адрес: https://sciup.org/142213966
IDR: 142213966 | УДК: 633.63:631.52:581.3 | DOI: 10.15389/agrobiology.2016.5.636rus
Текст научной статьи Гаплоидный партеногенез in vitro у сахарной свеклы (Beta vulgaris L.): факторы и диагностические признаки
Современный отечественный генофонд сахарной свеклы достаточен для создания сортов с требуемыми свойствами, однако традиционное получение инбредных линий и гибридизация длительны и трудоемки, что обусловлено 2-летним циклом развития растений, само- и перекрестной несовместимостью, инбредной депрессией (1). Биотехнологический метод гаплоидии, предполагающий культивирование растений в условиях in vitro (2), эффективен для индукции генотипического многообразия в исходной популяции, но его применение ограничено узкой специфичностью этих условий не только для разных генотипов одного вида, но и в зависимости от этапа культивирования. Варьирование, наблюдаемое при культивирова-
∗ Работа выполнена при поддержке гранта Президента РФ «Научная школа РФ» (НШ=5282.2014.4 — проект «Разработка теории репродукции растений с позиции проблемы целостности и надежности биосистем. Поливариантность морфогенетических программ развития, естественные и искусственные модели их реализации».
нии репродуктивных органов растений, может значительно расширить пределы изменчивости и облегчить получение форм для селекционных целей (в том числе на основе удвоенных гаплоидов) (3).
Для усовершенствования метода гаплоидного партеногенеза у сахарной свеклы оптимизируются условия индукции неоплодотворенных семязачатков и культивирования гаплоидных регенерантов с ценными генетическими рекомбинациями, отрабатываются приемы включения реституционных линий в селекционный процесс (4-8). Наиболее сложная проблема — гормональный состав питательных сред при культивировании in vitro (отметим, что принцип эмпирического подбора условий для индукции гаплоидии остается доминирующим) (9-10). Представляет интерес использование жидких сред, значительно повышающее выход гаплоидных регенерантов (11), спонтанная диплоидизация гаплоидов при длительном (более 1 года) культивировании (12), предобработка семязачатков агентами (колхицин, трифлуралин и др.), вызывающими антимитотическую активность клеток женского гаметофита и повышающими частоту гаплоидной регенерации (13). Сравнение морфологии гаплоидов и удвоенных гаплоидных регенерантов выявило преимущества первых по скорости развития побегов и размножения in vitro. На этом основании предлагается использовать гаплоиды сахарной свеклы не только для получения удвоенных гаплоидов, но и в специализированных проектах, касающихся геномного анализа, или при генетической трансформации, когда гаплоидные ткани служат исходным материалом (14).
У сахарной свеклы культивирование in vitro неоплодотворенных семязачатков и получение из них гаплоидов позволило направленно создавать гомозиготные линии для селекции (9, 15). Однако коммерческое применение этих технологий ограничивается низким выходом гаплоидных регенерантов и недостаточной методической разработанностью в том, что касается критических периодов в развитии зародышевого мешка, установления морфогенетической компетентности его элементов для переключения с гаметофитной на спорофитную программу развития, биохимической и молекулярно-генетической оценки создаваемых гомозиготных линий.
Мы впервые проанализировали признаки, связанные с морфогенезом и воспроизведением растений-регенерантов сахарной свеклы in vitro при гаплоидном партеногенезе, и показали возможность их использования в качестве диагностических для оценки критических периодов в развитии женского гаметофита при переходе на спорофитный путь морфогенеза. Кроме того, применение RFLP-анализа с рестриктазой Hind III впервые позволило выделять гаплоидные микроклоны по типу цитоплазмы (N или S) из сортовых популяций сахарной свеклы, облегчая задачу создания линий с ЦМС.
Цель работы — выявить признаки, позволяющие повысить эффективность гаплоидного партеногенеза у сахарной свеклы in vitro, в том числе в сочетании с биохимическими и молекулярными маркерами.
Методика . Для культивирования органов и тканей использовали гибриды Beta vulgaris L. (коллекция Всероссийского НИИ сахарной свеклы и сахара им. А.Л. Мазлумова). Применяли общепринятую технику стерилизации и приготовления питательных сред по Р.Г. Бутенко (2).
Активность фермента NADP-изоцитратдегидрогеназы определяли в гомогенатах растительных тканей (16). Электрофорез изоферментов в крахмальном геле и ПААГ проводили согласно описанию (17).
RFLP-анализ (restriction fragment length polymorphism) с Hind III (18) применяли для выявления стерильных и фертильных гаплоидных регенерантов. Продукты разделяли электрофорезом в 1 % агарозном геле с добавлением бромистого этидия.
Плоидность определяли на проточном цитофотометре Ploidy Analys- er PA-2 («Partec GmbH», Германия) (11).
Достоверность цитоэмбриологических данных оценивали с помощью коэффициента вариации Сv (19).
Результаты . При культивировании in vitro неоплодотворенных семязачатков сахарной свеклы была обнаружена уникальная способность эмбриогенных клеток к реализации потенциала развития под влиянием экзогенных факторов (20), что позволило разработать технологию получения гомозиготных линий. Благодаря этому приему генетически и морфологически разнообразный материал от обогащенных в генетическом отношении растений-доноров получают без многократного самоопыления. Предложенная технология обеспечивает выход до 38 гаплоидных регенерантов от одного растения-донора и создание гомозиготного материала сахарной свеклы за 2-3 года (вместо 8-10 лет при традиционных методах). В настоящее время свыше 100 таких гомозиготных линий используются в селекционных программах (20). Эксперименты выявили ряд морфологических, цитоэмбриологических, биохимических и молекулярно-генетических признаков, повышающих эффективность обнаружения гаплоидов при индукции гаплоидного партеногенеза in vitro, что ускоряет создание гомозиготных линий.
На этапе введения семязачатков в культуру к критическим факторам, влияющим на эффективность гаплоидной регенерации, относится период развития цветоносных побегов у донорских растений. У сахарной свеклы оптимальна фаза бутонизации в конце периода раннего генеративного состояния соцветий (VII и VIII этапы органогенеза) (21). Бутоны с семязачатками, более способные к индуцированию гаплоидии и максимально пригодные для эксплантации, находятся в центральном колосе кистевидной части плейохазия. Регенерационная активность наблюдается в семязачатках с 1-го по 25-й бутон (расположены по колосовидному цветоносу вверх от раскрывшегося цветка).
Для успешного культивирования семязачатков также необходимо выбрать оптимальную стадию развития зародышевого мешка. Цитоэмбрио-логические наблюдения показали, что ядра и клетки женского гаметофита у сахарной свеклы способны к новообразованиям in vitro на всех этапах развития. По-видимому, это связано с особенностями женского гаметофита, в первую очередь с хорошо выраженной полярностью, дифференцирующими делениями и тотипотентностью его элементов, что в условиях in vitro стимулирует инициацию программы формирования гаплоидных регенерантов. По нашим данным, поляризация начиналась в одноядерном зародышевом мешке, который по мере развития увеличивался в размере и вытягивался в направлении к микропиле. В результате последующих трех митотических делений образуется 8-ядерный зародышевый мешок. После последнего митоза от каждого полюса к центру отходит по одному полярному ядру. Вокруг ядер локализуется цитоплазма и происходит цитокинез, который завершается образованием семи клеток зародышевого мешка (22).
Культивирование изолированных семязачатков, содержащих 8-ядерные (или 7-клеточные, но 8-ядерные) зародышевые мешки, наиболее благоприятно для индуцирования гаплоидии и регенерации (8). Можно предположить, что строгая полярность зародышевого мешка в этот период, а также тотипотентность его ядер и неспециализированных клеток женского гаметофита обеспечивают наибольшую способность к морфогенезу. Это критический фактор для переключения на спорофитный тип развития.
Определение стадий развития зародышевого мешка — сложный и длительный процесс. Здесь критический период диагностируется по эмбриологическим признакам — наличию одноядерных микроспор и 2-3638
клеточных пыльцевых зерен пыльников, находящихся в одном бутоне с семязачатками. В зависимости от погодных условий в период цветения эти признаки можно наблюдать за 1-5 сут до раскрытия бутонов.
Диагностическими признаками также могут служить аномалии мужского и женского гаметофитов, которые проявлялись у некоторых генотипов, полученных при длительном самоопылении и полиплоидии, а также у ЦМС-гибридов, где с частотой до 40 % встречался апомиксис. Возможно, рецессивные гены, вовлеченные в контроль апомиксиса (23), в том числе в гаплоидный партеногенез, по-разному накапливаются при селекции. Генотипы с наибольшими аномалиями более склонны к индукции гаплоидии in vitro.
Существенный недостаток гаплоидной технологии in vitro — низкая частота регенерации (1,7-10,5 %). Ее повышают стрессовые воздействия, например предобработка семязачатков холодом (4-6 ° С, 2-4 сут) или рентгеновским облучением (1000-5000 Р, 50 мин) (24). Возможно, in vitro у семязачатков сахарной свеклы (по аналогии с микроспорами пшеницы) (25) низкие положительные температуры, изменяя метаболизм, задерживают развитие зародышевого мешка и индуцируют спорофитный морфогенез.
Гормональный состав сред при культивировании семязачатков тоже был ключевым фактором, определяя тип морфогенеза — через регенерацию (эмбриоидогенез) или через каллус (гемморизогенез) (26).
В наших опытах индукцию и морфогенез гаплоидных регенерантов по типу спорофита лимитировала среда на основе минеральных солей по Гамборгу (В5) с витаминами по Уайту и различным гормональным составом (26). Так, добавление гиббереллина (2 мг/л) индуцировало эмбриоидо-генез гаплоидных регенерантов. В зародышевом мешке семязачатка с первых дней культивирования наблюдали деление клеток яйцевого аппарата с образованием уже на 3-и сут многоклеточного (5-8 ярусов клеток) про-эмбрио. К 5-м сут зародыш принимал форму шара и увеличивался в размере за счет делений в поперечном и продольном направлениях, заполняя на 8-12-е сут все пространство зародышевого мешка (при этом гаусториаль-ный вырост в нуцеллус не увеличивался). Центральная клетка, не приступая к делению, сохранялась до 5-8-х сут, затем дегенерировала. Иногда формировалось несколько ядер эндосперма, которые также дегенерировали. Крахмал в клетках нуцеллуса не откладывался, перисперм и оболочки семени не формировались. На 28-е сут зародыш разрывал интегументы и проросток появлялся на поверхности семязачатка с образованием небольших семядольных листочков, гипокотиля и первичного корешка. Это свидетельствует о сходстве гаплоидного эмбриоидогенеза и эмбриогенеза зиготического зародыша, однако эмбриоид формируется только с использованием минеральных солей среды культивирования (без участия питательных веществ эндосперма, который в условиях in vitro вообще не образуется).
Ауксины стимулировали рост каллусных структур наряду с гиноге-нетическими зародышами. Гиббереллин (2 мг/л), 6-бензиламинопурин (0,1 мг/л) и индолил-3-масляная кислота (0,1 мг/л) индуцировали развитие гаплоидных эмбриоидов, а затем вторичных регенерантов из каллусных тканей гипокотиля, что 6-10-кратно увеличивало выход гаплоидов (20). Поскольку тотипотентность клеток гетерогенного каллуса неодинакова, возможно формирование двух основных типов каллуса — морфогенного и неморфогенного. Неморфогенный состоит из паренхимных клеток и не регенерирует. В морфогенном каллусе (имел более плотную мелкозернистую структуру) происходили формообразовательные процессы — либо ризогенез, либо гем-могенез (появление почек), либо гемморизогенез. Гемморизогенез начинался в субэпидермальном слое каллуса. В условиях in vitro появлялись инициаль- ные клетки с утолщенной клеточной оболочкой и более крупным ядром, из которых de novo развивались зоны меристемы (в виде бугорков). В результате периклинальных делений на внешней стороне бугорков формировался апекс (серповидный валик) и примордий 1-го листа, то есть ростовая почка. Апексы корней закладывались в боковой или базальной части каллуса. Между корнем и почкой формировался проводящий пучок. Воспроизведение растений через каллус происходило при гемморизогенезе или геммоге-незе с последующей индукцией корневой системы по истечении 3-4 нед.
Культивирование неоплодотворенных семязачатков в жидкой питательной среде усиливало пролиферацию клеток женского гаметофита, длительно (до 4-6 мес) сохраняя их жизнеспособность. Перенос этих эксплантов на агаризованную среду того же состава стимулировал регенерацию (на 13,7 и 18,9 % — через каллусо- и эмбриоидогенез). Отметим, что каллус — система с непрямым органогенезом, что увеличивает время получения регенерантов, поэтому прямая регенерация in vitro более перспективна для селекции.
Этап стабилизации включает отбор нормально развитых гаплоидных растений-регенерантов (27) с высокой способностью к формированию адвентивных побегов и микроклональному размножению. Для повышения эффективности на этом этапе использовали морфологические и цитологические признаки. Так, у гаплоидных регенерантов высота и размер всех органов обычно меньше, чем у диплоидов. У нормально развитых гаплоидных форм в зависимости от генотипа более узкие листовые пластинки с длинными черешками или, наоборот, широкие листья с волнистым краем и короткими черешками. Характерный цитологический признак гаплоидов — 9 хромосом, которые выявляются при микроксопировании или цитофотометрически по содержанию ядерной ДНК (28). Последний метод быстрее, надежнее и может широко применяться для выявления растений с измененной плоидностью. К цитоэмбриологическим признакам следует отнести наличие 8-10 хлоропластов в замыкающих клетках устьиц, среди которых встречаются аномальные или не формирующие хлоропласты либо имеющие одну бобовидную клетку. Так как цитоэмбриологические признаки у гаплоидов варьировали незначительно, их можно использовать в качестве морфологических маркеров для идентификации и отбора гаплоидных регенерантов. Это позволяет проводить оценку на самых ранних этапах развития регенерантов, когда анализ хромосомного набора крайне затруднен и приводит к гибели эксплантов.
При колхицинировании гаплоидов (27) происходила полиплоидиза-ция с образованием диплоидных, триплоидных и тетраплоидных форм. При повышении плоидности увеличивалось число хлоропластов в паре замыкающих клеток устьиц: с 9-11 у гаплоидов до 12-14, 15-17 и 18-21 соответственно у ди-, три- и тетраплоидов. Изменялось и соотношение площади замыкающих клеток у гаплоидных и ди-, три и тетраплоидных форм — соответственно 1:1,56; 1:1,87; 1:2,68 (табл. 1).
1. Цитоморфологические характеристики пар замыкающих клеток устьиц у растений сахарной свеклы ( Beta vulgaris L.) при разной плоидности
|
Плоидность |
Просмотрено пар клеток |
Число хлоропластов, шт. |
Cv , % |
Площадь, мкм2 |
Cv , % |
|
|
среднее |
min-max |
|||||
|
Гаплоидный (½) |
250 |
10,2 |
9,4-10,9 |
9,3 |
0,95 |
0,9 |
|
Дигаплоидный (2½) |
250 |
13,2 |
11,8-14,5 |
9,7 |
1,48 |
1,6 |
|
Триплоидный (3½) |
250 |
15,5 |
14,4-16,6 |
5,8 |
1,78 |
1,8 |
|
Тетраплоидный (4½) |
250 |
19,7 |
18,5-20,9 |
6,4 |
2,55 |
1,3 |
Отметим, что у некоторых удвоенных гаплоидов при размножении (in vitro и в грунте) восстанавливалось гаплоидное состояние, что, возможно, объясняется более коротким митотическим циклом у гаплоидных регенеран-640
тов. Поэтому при колхицинировании и внутриклеточном отборе возможно увеличение доли гаплоидных клеток в миксоплоидной меристеме регенерантов, что отрицательно сказывается на диплоидизации. Для усиления эффекта диплоидизации гаплоидов in vitro мы изменяли гормональный состав питательной среды, добавляя цитокинины и гиббереллин, тормозящие рост гаплоидной ткани. Высокой способностью стимулировать клеточное деление у диплоидов и тормозить — у гаплоидов обладал кинетин при добавлении до 0,25 мг/л, что позволяло получать до 90 % регенерантов с постоянным диплоидным набором хромосом.
Удобным инструментом выявления гаплоидных регенерантов сахарной свеклы служит сравнение изоферментных спектров. При исследовании электрофоретической подвижности изоформ NADP-изоцитратдегидрогеназы (NADP-ИДГ, КФ 1.1.1.42) нами обнаружены отличия гаплоидных регенерантов от исходного диплоидного растения. Ранее мы показали присутствие двух изоформ NADP-ИДГ — цитоплазматической ( ∼ 95 % активности) и митохондриальной ( ∼ 5 % активности) в листьях контрольных растений, что согласуется с результатами электрофореза: у контрольных вариантов имелись две изоформы NADP-ИДГ (Rf 0,31 и 0,39) с полосами одинаковой интенсивности, а у гаплоидов фермент был представлен двумя зонами активности — мономорфной (Rf 0,37) и полиморфной (Rf 0,26 и 0,31).
Изоферментный анализ можно также использовать для определения степени гомозиготности формируемых в результате стабилизирующего отбора реституционных линий. Теоретически все линии удвоенных гаплоидов должны быть гомозиготными. Однако у реституционных линий, полученных после обработки колхицином, выявляется в среднем 4 % гетерозиготных локусов (29). Не исключено, что такой полиморфизм можно объяснить эпигенетической изменчивостью у удвоенных гаплоидов сахарной свеклы (30, 31). Индекс изоферментной гомозиготности (Iiz) в проанализированных линиях, определенный как средний процент гомозиготности по семи изофер-ментным локусам, варьировал от 0,81 до 1 (29) и в среднем составил 0,96 (табл. 2). Вероятно, гомозиготность этих реституционных линий достоточна высока, несмотря на возможные эпигенетические изменения.
2. Показатели изоферментной гомозиготности у реституционных линий сахарной свеклы ( Beta vulgaris L.)
|
Линия |
Доля гомозигот по изоферментным локусам, % |
Индекс изоферментной |
||||||
|
Adh-1 1 |
Mdh |
1 1 Mdh-2 1 |
Me-1 |
Idh-1 1 |
Idh-2 |
1 Gdh-1 |
гомозиготности Iiz |
|
|
1 |
100 |
87 |
93 |
88 |
100 |
100 |
100 |
0,95 |
|
2 |
100 |
97 |
100 |
68 |
100 |
100 |
96 |
0,94 |
|
3 |
100 |
40 |
93 |
42 |
100 |
100 |
93 |
0,81 |
|
4 |
100 |
87 |
93 |
100 |
100 |
100 |
100 |
0,97 |
|
5 |
100 |
100 |
100 |
100 |
100 |
100 |
100 |
1,00 |
|
6 |
100 |
100 |
100 |
96 |
100 |
96 |
100 |
0,99 |
|
7 |
100 |
100 |
100 |
96 |
93 |
96 |
100 |
0,98 |
|
8 |
97 |
79 |
84 |
96 |
100 |
100 |
100 |
0,94 |
|
Среднее |
99 |
86 |
95 |
98 |
99 |
99 |
99 |
0,96 |
Молекулярные маркеры нейтральны по отношению к фенотипу, нетканеспецифичны, их можно обнаружить на любой стадии развития растений. Они позволяют контролировать передачу генетического материала от растений-доноров и вести отбор на искомый селекционный признак, например на цитоплазматическую мужскую стерильность (32, 33). Известно, что в популяциях сахарной свеклы присутствуют растения с нормальной (N) и стерильной (S) цитоплазмой. У N-растений пыльца фертильна и жизнеспособна, у S-растений она может быть как фертильной, так и стерильной в зависимости от взаимодействия стерильной (S) цитоплазмы с рецессивными генами ядра rf1 и rf2. Стерильность цитоплазмы у сахарной свеклы обусловлена изменением нуклеотидной последовательности в митохондриальном и хлоропластном геномах (34, 35).
Наши исследования показали, что PCR и RFLP-анализ с использованием рестриктазы Hind III позволяет идентифицировать тип цитоплазмы у создаваемых гаплоидов по числу рестриктов. У гаплоидных микроклонов с нормальной и стерильной цитоплазмой амплифицировался один фрагмент (800 п.н.), который рестрицировался только у стерильных (S) форм (рис.; видны два рестрикта и остатки фрагмента 800 п.н.).
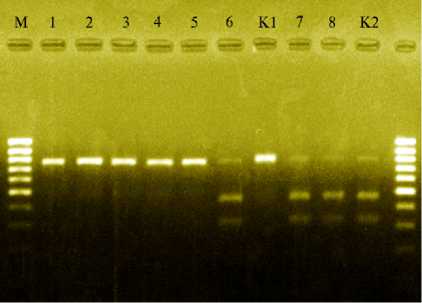
Электрофореграмма рестриктов ампли-фицированных фрагментов ДНК (RFLP-анализ, рестриктаза Hind III ) у гаплоидных растений-регенерантов сахарной свеклы ( Beta vulgaris L.): К1 — контрольные фертильные растения, К2 — контрольные стерильные растения; 1-5 — формы с нормальной (N) цитоплазмой, 6-8 — формы со стерильной (S) цитоплазмой; М — маркеры молекулярных масс (ДНК-маркер MassRuler™, 80-1031 п.н., SM0383, «Thermo Scientific», США).
Гаплоиды, у которых этот фрагмент не рестрицировался Hind III, были представлены полностью фертильными формами с нормальной цитоплазмой (N) и ядерными генами в рецессивном состоянии ( rf ). В остальных образцах наблюдался полиморфизм фрагментов, что, по-видимому, предполагает наличие у соответствующих гаплоидных форм стерильной цитоплазмы (S) и разное сочетание рецессивных и доминантных аллелей ядерных генов Rf1 / rf1 и Rf2 / rf2 . Отметим, что PCR-профили у всех стерильных регенерантов (как гаплоидов, так и удвоенных гаплоидов) одинаковы. Поэтому выявление растений-регенерантов со стерильной цитоплазмой на разных этапах культивирования представляет значительный интерес для селекции сахарной свеклы, облегчая создание линий с ЦМС и высокопродуктивных гибридов на стерильной основе. Таким образом, показана эффективность использования комплекса диагностических признаков для совершенствования метода гаплоидного партеногенеза in vitro у сахарной свеклы. Выявленные маркерные фенотипические, морфологические, цитоэмбриологические показатели надежно характеризуют критические периоды для развития генеративных органов растений-доноров и индукции гаплоидии, а также стадии морфогенеза in vitro, наиболее благоприятные при стабилизирующих отборах гаплоидов и удвоенных гаплоидов. Определение электрофоретической подвижности изоферментов и молекулярное маркирование позволяют оценивать степень гомозиготности созданных линий. Использование RFLP-анализа дает возможность вести отбор гаплоидных регенерантов на искомый селекционный признак, например цитоплазматическую мужскую стерильность (ЦМС), и формировать линии, гомозиготные по ЦМС.
Список литературы Гаплоидный партеногенез in vitro у сахарной свеклы (Beta vulgaris L.): факторы и диагностические признаки
- Буренин В.И. Генетические ресурсы рода Beta L. (Свекла). СПб, 2007.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М., 1999.
- Baenziger P.S., Russell W.K., Groef G.L., Campbell B.T. Improving lives: 50 years of crop breeding genetics and cytology. Crop Sci., 2006, 46: 2230-2244 ( ) DOI: 10.2135/cropsci2005.11.0404gas
- Atanassov A.I. Method for continuous bud for mation in tissne culture of sugar beet (Beta vulgaris L.). Pflazenzuchtg, 1980, 84: 23-29.
- Slavova J. Effective method for sugar beet haploids obtained from unpollinated ovules. Biotechnology & Biotechnological Equipment, 2014, 7(2): 34-35 ( ) DOI: 10.1080/13102818.1993.10818689
- Chen J.F., Cui L., Malik A.A., Mbira K.G. In vitro haploid and diploid production via unfertilized ovule culture. Plant Cell Tiss. Organ Cult., 2011, 104(3): 311-319 ( ) DOI: 10.1007/s11240-010-9874-6
- Murovec J., Bohanec B. Haploids and doubled haploids in Plant breeding. In: Plant breeding/I. Abdurakhmonov (ed.). InTech d.o.o., Croatia, 2012: 87-106 (doi: 10.5772/1389).
- Знаменская В.В., Жужжалова Т.П., Подвигина О.А. Индукция гиногенеза у сахарной свеклы. Мат. Российского симпозиума «Новые методы по биотехнологии растений». Пущино, 1993: 111.
- Подвигина О.А. Морфогенетическое развитие эксплантов сахарной свеклы в условиях in vitro. Сахарная свекла, 2003, 10: 22-24.
- Nagl N., Mezei S., Kovačev L., Vasić D., Čačić N. Induction and micropropagation potential of sugar beet haploids. Genetica, 2004, 36(3): 187-194 ( ) DOI: 10.2298/GENSR0403187N
- Sliwinska E., Pedersen H. Flow cytometric analsis of nuclear replication stages during germination of sugar-beet seeds different in vigour. Electronic Journal of Polish Agricultural Universities, 1999, 2(1).
- Svirshchevskaya A.M., Doležel J. Production and performance of gynogenetic sugarbeet lines. Journal of Sugar Beet Research, 2000, 37(4): 117-133 ( ) DOI: 10.5274/jsbr.37.4.117
- Gürel S., Gürel E., Kaya Z., Erdal M., Güler E. Effects of antimitotic agents on haploid plant production from unpollinated ovules of sugar beet (Beta vulgaris L.). Biotechnology & Biotechnological Equipment, 2003, 17(2): 97-101 ( ) DOI: 10.1080/13102818.2003.10817065
- Klimek-Chodacka M., Baranski R. Comparison of haploid and doubled haploid sugar beet clones in their ability to micropropagate and regenerate. Electron. J. Biotechn., 2013, 16(2): 1-12 ( ) DOI: 10.2225/vol16-issue2-fulltext-3
- Свирщевская А.М. Триплоиды, диплоиды и гаплоиды в селекции сахарной свеклы (Beta vulgaris L.). Весцi нацыянальнай Акадэмii навук Беларусi, 2008, 2: 48-55.
- Землянухин А.А., Землянухин Л.А. Метаболизм органических кислот растений. Воронеж, 1995.
- Левитес Е.В., Свирщевская А.М., Кирикович А.А., Милько Л.В. Удвоенные гаплоиды в изучении эпигенетической изменчивости сахарной свеклы. Информационный вестник ВОГИС, 2005, 9(4): 512-517.
- Beckmann J.S., Soller M. Restriction fragment length polymorphisms in genetic improvement: methodologies, mapping and costs. Theor. Appl. Genet., 1983, 67: 35-43 ( ) DOI: 10.1007/BF00303919
- Зайцев Г.Н. Методика биометрических расчетов. М., 1973.
- Подвигина О.А. Индуцирование гаплоидии из неоплодотворенных семяпочек сахарной свеклы в условиях in vitro. В сб.: Энциклопедия рода Вeta. Биология, генетика и селекция свеклы (науч. тр. Института цитологии и генетики СО РАН). Новосибирск, 2010: 455-465.
- Жужжалова Т.П., Фоменко Н.Р. Возрастные изменения сахарной свеклы в онтогенезе. Сахарная свекла, 2003, 7: 26-27.
- Жужжалова Т.П., Знаменская В.В., Подвигина О.А., Ярмолюк Г.И. Репродуктивная биология сахарной свеклы. Воронеж, 2007.
- Петров Д.Ф. Генетические основы апомиксиса. Новосибирск, 1979.
- Таратонов Н.А. Влияние экзогенных факторов на рост и развитие регенерантов в процессе формирования дигаплоидных форм сахарной свеклы. Канд. дис. Рамонь, 1999.
- Батыгина Т.Б., Круглова Н.Н., Горбунова В.Ю., Титова Г.Е., Сельдимирова О.А. От микроспоры -к сорту. М., 2010.
- Жужжалова Т.П., Подвигина О.А., Знаменская В.В. Пути воспроизведения нового организма сахарной свеклы в культуре in vitro. В сб.: Энциклопедия рода Вeta. Биология, генетика и селекция свеклы (науч. тр. Института цитологии и генетики СО РАН). Новосибирск, 2010: 403-419.
- Знаменская В.В. Микроклонирование in vitro как метод поддержания и размножения линий сахарной свеклы. В сб.: Энциклопедия рода Вeta. Биология, генетика и селекция свеклы (науч. тр. Института цитологии и генетики СО РАН). Новосибирск, 2010: 420-437.
- Васильченко Е.Н., Жужжалова Т.П. Изменчивость морфологических и биохимических признаков межвидовых гибридов свеклы. Сахарная свекла, 2011, 1: 18-21.
- Федулова Т.П. Теоретические и практические аспекты молекулярно-генетического маркирования в селекции сахарной свеклы (Beta vulgaris L.). Докт. дис. Рамонь, 2005.
- Kirikovich S.S., Svirshchevskaya A.M., Levites E.V. Variation at isozyme loci in seed offspring of sugar beet gynogenetic lines. Sugar Tech., 2003, 5(4): 289-292 ( ) DOI: 10.1007/BF02942487
- Levites E.V., Svirshchevskaya A.M., Kirikovich S.S., Mil’ko L.V. Variation at isozyme loci in cultured in vitro sugar beet regenerants of gynogenetic origin. Sugar Tech., 2005, 7(1): 71-75 ( ) DOI: 10.1007/BF02942421
- Nishizawa S., Kubo T., Mikami T. Variable number of tandem repeat loci in the mitochondrial genomes of beets. Curr. Genet., 2000, 37: 34-38 ( ) DOI: 10.1007/s002940050005
- Nishizawa S., Mikami T., Kubo T. Mitochondrial DNA phylogeny of cultivated and wild beets: relationships among cytoplasmic male-sterility-inducing and nonsterilizing cytoplasms. Genetics, 2007, 177: 1703-1712 ( ) DOI: 10.1534/genetics.107.076380
- Cheng D., Kitazaki K., Xu D., Mikami T., Kubo T. The distribution of normal and male-sterile cytoplasms in Chinese sugar-beet germplasm. Euphytica, 2009, 165: 345-354 ( ) DOI: 10.1007/s10681-008-9796-0
- Moritani M., Taguchi K., Kitazaki K., Matsuhira H., Katsuyama T., Mikami T., Kubo T. Identification of the predominant nonrestoring allele for Owen-type cytoplasmic male sterility in sugar beet (Beta vulgaris L.): development of molecular markers for the maintainer genotype. Mol. Breeding, 2013, 32: 91-100 ( ) DOI: 10.1007/s11032-013-9854-8


