Гастрэктомия с формированиемкишечного резервуара: парадигмы прошлого и настоящего
Автор: Евсеев М.А., Мусаилов В.А., Фомин В.С., Евсеев А.М.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 2 (92), 2025 года.
Бесплатный доступ
Введение. Сравнительный анализ непосредственных и отдаленных результатов различных вариантов реконструкции при гастрэктомии по Ру позволил представить кишечный резервуар как функциональный элемент пищеварительной трубки с выраженной протективной функцией, способствующий более эффективной адаптации процессов пищеварения после оперативного удаления желудка. Материал и методы исследования. Для определения характерных особенностей послеоперационного течения, непосредственных и функциональных результатов гастрэктомии с формированием проксимального кишечного резервуара на Ру-петле был проведен ретро- и проспективный сравнительный мультипараметрический когортный анализ течения ближайшего и отдаленного послеоперационного периода у 133 пациентов (средний возраст 63,3±6,1 года), перенесших гастрэктомию с общей схемой реконструкции по Ру и различными вариантами эзофаго-энтеростомии, за период с 2019 по 2024 год. Результаты. Формирование проксимального кишечного резервуара на Ру-петле с инвагинационным поперечный эзофаго-энтероанастомозом сопровождалось минимальным числом интра- и экстраабдоминальных осложнений, отсутствием летальных исходов, ранним восстановлением моторно-эвакуаторной функции пищеварительной трубки, минимальным числом пациентов с послеоперационным рефлюкс-эзофагитом и достоверно более высоким показателем качества жизни. Заключение. Представленные функциональные результаты использования методики формирования проксимального кишечного резервуара на Ру-петле с инвагинационным поперечный эзофаго-энтероанастомозом дают возможность считать использование данного оперативного приема в современной хирургической клинике правомочным и целесообразным.
Гастрэктомия, кишечный резервуар на Ру-петле, анализ результатов
Короткий адрес: https://sciup.org/142244469
IDR: 142244469 | УДК: 616-08-039.76, 617-089.844 | DOI: 10.17238/2072-3180-2025-2-55-64
Текст научной статьи Гастрэктомия с формированиемкишечного резервуара: парадигмы прошлого и настоящего
В ходе исследования сравнительному анализу были подвергнуты непосредственные и функциональные результаты хирургического лечения 133 пациентов после следующих вариантов оперативных вмешательств: группа 1 – гастрэктомия из лапаротомного доступа с инвагинационным поперечным эзофаго-энтероанастомозом (ЭЭА) «конец в бок» на Ру-петле (n=48); группа 2 – гастрэктомия из лапаротомного доступа с формирования ЭЭА на Ру-петле «конец в бок» циркулярным сшивающим аппаратом (n=12); группа 3 – гастрэктомия из лапаротомного доступа инвагинационным поперечным ЭЭА «конец в бок» и формированием проксимального кишечного резервуара на Ру-петле (n=38); группа 4 – гастрэктомия из лапароскопического доступа с формирования ЭЭА «бок в бок» на Ру-петле линейным сшивающим аппаратом (n=35) (табл. 1). Выбор того или иного варианта реконструкции не зависел от пола и возраста пациентов, характера и распространенности основного патологического процесса, выраженности сопутствующей патологии и определялся поиском оптимального варианта анатомических взаимоотношений и технологии соединения сегментов пищеварительной трубки.
Таблица 1
Общая характеристика клинического материала
General characteristics of the clinical material
Table 1
|
1 группа/1 group |
2 группа/2 group |
3 группа/3 group |
4 группа/4 group |
|
|
Число пациентов, n/ Number of patients, n |
48 |
12 |
38 |
35 |
|
Вариант реконструк-ции/Reconstruction option |
Инвагинационный поперечный ЭЭА «конец в бок» на Ру-петле/ Invagination transverse end-to-side EEA on a hand loop |
ЭЭА на Ру-петле «конец в бок» циркулярным сшивающим аппаратом/EEA on an end-to-side loop with a circular stitching device |
Инвагинационный поперечный ЭЭА «конец в бок» с формированием проксимального кишечного резервуара на Ру-петле/ Invagination transverse end-to-side EEA with formation of a proximal intestinal reservoir on the loop |
ЭЭА «бок в бок» на Ру-петле линейным сшивающим аппаратом/ EEA «side to side» on a hand-loop with a linear stitching device |
|
Доступ/ Access |
Лапаротомный/ Laparotomy |
Лапаротомный/ Laparotomy |
Лапаротомный/ Laparotomy |
Лапароскопический/ Laparoscopic |
|
Средний возраст, лет/ Average age, years |
63,4±2,2 |
64,1±3,2 |
62,3±2,7 |
61,7±2,5 |
|
Оценка функциональных результатов, n/%/ Evaluation of functional results, n/% |
23/47,9 |
7/58,3 |
23/60,5 |
20/57,1 |
Общая схема проведенной Roux-en-Y реконструкции была однотипной для всех операций: формировались алиментарная петля (эзофаго-энтероанастомоз – межкишечный Y-анастомоз) длиной 45–50 см и дуоденальная петля (связка Трейтца – межкишечный Y-анастомоз) длиной 60 см. Инвагинационный поперечный эзофаго-энтероанастомоз «конец в бок» формировался по стандартной технике [2] двухрядными швами с наружным рядом кулисных швов. Для формирования аппаратных анастомозов применялись: циркулярные двухрядные сшивающие аппараты с диаметром рабочей части 21 и 25 мм (ЭЭА «конец в бок» лапаротомным доступом), линейные трехрядные сшивающие аппараты 60 мм (эзофаго-энтероанастомоз «бок в бок» лапароскопическим доступом).
1 2 3
4 5 6
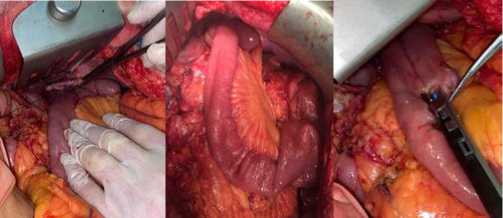
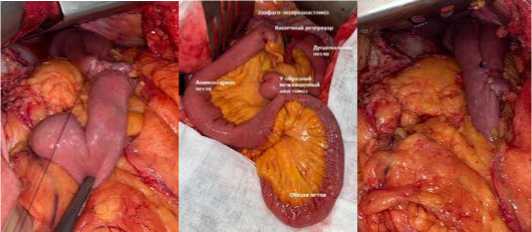
Рис. 1. Формирование проксимального кишечного резервуара на Ру-петле: 1, 2 – формирование на алиментарной петле инвагинационного поперечного ЭЭА «конец в бок» с наружным рядом кулисных швов;
3 – формирование межкишечного аппаратного анастомоза между приводящим и отводящим сегментами тонкой кишки; 4 – закрытие единого технологического отверстия; 5 – окончательный вид кишечного резервуара; 6 – общий вид реконструкции по Ру
Fig. 1. Formation of the proximal intestinal reservoir on the loop: 1, 2 – formation of an invagination transverse EEA “end to side” on the alimentary loop with an outer row of back–channel sutures; 3 – formation of an inter–intestinal hardware anastomosis between the adducting and diverting segments of the small intestine; 4 – closure of a single technological opening; 5 – final view intestinal reservoir; 6 – general view of reconstruction according to Ru
Формирование проксимального кишечного резервуара на Ру-петле (рис. 1) осуществлялось следующим образом: на алиментарной отключенной по Ру петле тонкой кишки длиной 50 см в на расстоянии 12 см от проксимального ее конца формировался описанный выше инвагинационный поперечный эзофаго-энтероанастомоз «конец в бок» двухрядными швами с наружным рядом кулисных швов; приводящий и отводящий к эзофаго-энтероанастомозу сегменты кишечной трубки сопоставлялись по типу двустволки; через технологические отверстия в противобрыжеечных поверхностях отводящего и приводящего сегментов, расположенных в 10 см от эзофаго-энтероанастомоза, в просвет тонкой кишки в проксимальном направлении вводились бранши трехрядного линейного сшивающего аппарата (типа NTLC, EndoGIA, Echelon), одновременным прошиванием рассечением аппарата формировался межкишечный анастомоз «бок в бок» длиной 75–80 мм; ставшее единым технологическое отверстие ушивалось в поперечном направлении однорядным серозно-мышечно-подслизистым швом [2, 9, 10].
Всем пациентам после формирования эзофаго-энтероа-настомоза в алиментарную петлю проводился зонд для энтерального питания. С начала вторых суток послеоперационного периода в зонд непрерывной инфузией вводились смеси для энтерального питания, с этого же времени пациенты начинали пероральный прием жидкостей (30 мл на 2–4 сутки с последующим прогрессивным увеличением объема). После контрольной рентгеноскопии зоны оперативного вмешательства с пероральным контрастированием на 5 сутки зонд удаляли.
Непосредственные результаты оперативных вмешательств оценивались по числу пациентов с несостоятельностью эзо-фаго-энтероанастомоза, имевшей своим следствием перитонит, интраабдоминальный абсцесс или первичный наружный кишечный свищ, а также по числу и экстраабдоминальных осложнений, числу релапаротомий / релапароскопий, показателю послеоперационной летальности. Отдельному анализу в ближайшем послеоперационном периоде были подвергнуты: 1) электрическая активность кишечника методом электрога-строэнтерографии [11] на селективном полиграфе ЖКТ (В.С. Фомин, 2018; патент РФ № 2023419) у 20 пациентов – по 5 пациентов каждой группы – на 1–7 сутки после операции; 2) характер эвакуации методом рентгеноскопии пищевода и тонкой кишке с пероральным контрастированием.
Отдаленные функциональные результаты операций оценивались в сроки от 7 до 12 месяцев после вмешательства [12, 13]. Анализ отдаленных результатов проведен по клинико-эндоскопическому обследованию 76 (57,1 %) пациентов. Оценка отдаленных результатов включала: 1) фиброэндоскопическую оценку состояния слизистой пищевода с диагностикой наличия и выраженности эзофагита (Los Angeles Classification System, 1994 [14]), 2) оценку качества жизни пациентов. Оценка качества жизни больных проводилась при помощи функциональной шкалы модульного опросника Европейской организации изучения и лечения рака – EORTC QLQ С3О/3.0 ST0 [15]. Результаты ответов стандартизировались с вычислением среднего балла. После вычисления среднего балла ответов проводилось вычисление окончательного результата (1 – (Бср – 1)/3) х 100. Результирующие показатели функциональной шкалы характеризовались сочетанием высокого уровня функционального благополучия с высоким баллом.
Результаты и обсуждение
Непосредственные результаты оперативных вмешательств.
Ближайший послеоперационный период у всей совокупности из 133 пациентов сопровождался развитием экстра-абдоминальных осложнений (острый коронарный синдром, пневмония, тромбоэмболические осложнения) в 16,5 % случаев, интраабдоминальных инфекционных осложнений – в 6,8 % случаев. При этом основная причина интраабдоминального инфекционного процесса – несостоятельность швов в зоне ЭЭА – определила развитие распространенного перитонита всего у 1,5 % пациентов, интраабдоминальных абсцессов и наружных свищей пищеварительной трубки по ходу дренажных каналов у 5,3 % пациентов. Послеоперационная летальность составила 2,3 % (табл. 2).
Таблица 2
Непосредственные результаты оперативных вмешательств
|
1 группа/1 group |
2 груп-па/2 group |
3 груп-па/3 group |
4 груп-па/4 group |
|
|
Число пациентов, n/ Number of patients, n |
48 |
12 |
38 |
35 |
|
Несостоятельность ЭЭА/ EEA failure |
6,2 % |
8,3 |
2,6 % |
11,4 % |
|
Распространенный перитонит/ Common peritonitis |
2,1 % |
– |
– |
2,9 % |
|
Абсцесс Наружный кишечный свищ/ Abscess External intestinal fistula |
3,1 % |
8,3 % |
2,6 % |
8,5 % |
|
Релапаротомии/ релапароскопии/ Relaparotomy/relapa-roscopy |
8,3 % |
16,7 % |
– |
8,6 % |
|
Экстраабдоминальные осложнения/ Extra-abdominal complications |
20,8 % |
16,7 % |
13,2 % |
14,3 % |
|
Летальность/ Lethality |
6,2 % |
8,3 % |
– |
– |
При сопоставлении непосредственных результатов операций, проведенных открытым или лапароскопическим доступом, от- мечено достоверное превышение частоты несостоятельности ЭЭА и связанных с ней интраабдоминальных инфекционных осложнений (11,4 % vs. 5,1 %, p<0,05) при операциях лапароскопическим доступом. Достоверное превышение частоты именно экстраабдоминальных осложнений (17,4 % vs. 11,4 %, p<0,05) может объяснить наличие летальных исходов при лапаротомном доступе (6,1 %) и их отсутствие при лапароскопическом доступе. Представленные данные подтверждают доминирующее в современной литературе мнение о том, что ГЭ-Ру в любом варианте реконструкции, лапаротомным или лапароскопическим доступом, характеризуется минимальным уровнем экстра- и интраабдоминальных осложнений. При этом интраабдоминальные инфекционные осложнения после реконструкции по Ру имеют в подавляющем большинстве случаев отграниченный характер и практически полностью исключают развитие распространенного перитонита. Следует отметить, что наилучшими непосредственными результатами и полным отсутствием летальных исходов характеризовалась ГЭ-Ру с формированием проксимального кишечного резервуара.
Общеизвестно, что фактором, в наибольшей степени влияющим на непосредственные результаты гастрэктомии является надежность ЭЭА. Минимальная частота развития несостоятельности ЭЭА при ГЭ-Ру с инвагинационным поперечным эзофаго-энтероанастомозом «конец в бок» и формированием проксимального кишечного резервуара объясняется сочетанием двух созданных de novo анатомических элементов, оказывающих независимое протективное действие в отношении ЭЭА. Первым протективным элементом является циркулярное укрепление внутреннего ряда швов ЭЭА тонкокишечной манжетой, формирующейся при создании резервуара и определяющей условия для полной физической, а затем и биологической герметичности анастомоза. Вторым фактором служит гидродинамическая демпфирующая функция расположенного непосредственно за ЭЭА кишечного резервуара. Площадь поперечного сечения и, соответственно, объем резервуара в два раза большей площади сечения отводящей кишки и самого пищевода, что по законам гидродинамики (теорема Борда-Карно) определяет закономерное снижение внутрипросветного гидростатического давления на стенку пищевода и тонкокишечного резервуара в зоне ЭЭА при прохождении по ним пищевого комка (теорема Борда). Очевидно, что снижение внутрипросветного давления в зоне ЭЭА при формировании резервуара предупреждает растяжение линии швов и их прорезывание, а также является профилактикой нарушения гемоперфузии и возникновения ишемии пищевода и кишки в зоне ЭЭА – основного патогенетического элемента несостоятельности любых анастомозов пищеварительной трубки.
При оценке электрической активности кишечника методом электрогастроэнтерографии на селективном полиграфе желудочно-кишечного тракта (рис. 2) у всех пациентов на сроках с 1-х по 3-и сутки послеоперационного периода отмечалась низкоамплитудная активность, не превышавшая в максималь- ных пиках 8–9 мкВ, что соответствовало положению кривой практически на изолинии с канала регистрации тонкокишечной моторики. Также прослеживалась дискоординированная, т.н. асинхронная деятельность отделов пищеварительного тракта. У пациентов 1, 2 и 4 клинических групп низкоамплитудная электрическая активность отмечалась вплоть до 5 суток послеоперационного периода и в последующем имела тенденцию к приросту амплитуды до субнормальных значений (35–40 мкВ) на 7–8 сутки послеоперационного периода. Вместе с тем у данных групп пациентов были отмечены парадоксальные эпизоды прироста амплитуды электрической активности тонкой кишки до 40–45 мкВ с выраженной пропульсивной асинхронностью. У пациентов 3 клинической группы (формирование проксимального кишечного резервуара), начиная с 3 суток послеоперационного периода, наблюдался достоверный прирост вольтажа перистальтической активности всех отделов пищеварительного тракта с синхронизацией пропульсивности и приростом амплитуды электрической активности до 45–49 мкВ. Также у пациентов 3ей клинической группы отмечалась регистрация мигрирующих моторных комплексов и эпизодов биений, что являлось иллюстрацией восстановления моторно-эвакуаторной активности кишечника.
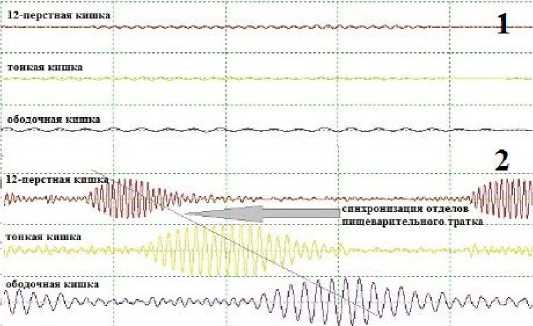
Рис. 2. Электрическая активность тонкой кишки в послеоперационном периоде: 1 – низкоамплитудная активность, асинхрония моторики пищеварительного тракта; 2 – прирост вольтажа перистальтической активности всех отделов пищеварительного тракта с синхронизацией пропульсивности (объяснения в тексте) Fig. 2. Electrical activity of the small intestine in the postoperative period: 1 – low-amplitude activity, asynchronous motility of the digestive tract; 2 – increase in voltage of peristaltic activity of all parts of the digestive tract with synchronization of propulsivity (explanations in the text)
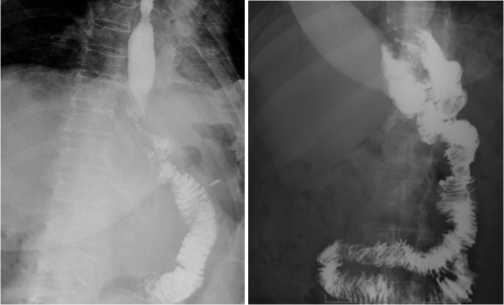
При рентгеноскопии верхних отделов пищеварительного тракта с пероральным контрастированием (рис. 3) на 4 сутки послеоперационного периода у пациентов 1, 2 и 4 клинических групп отмечалось одновременное поступление всего объема перорально принятого контраста в алиментарную петлю с ее дилатацией и депонирование большей части контраста в 20–30
см дистальнее ЭЭА с последующей замедленной эвакуацией в нижележащие отделы тонкой кишки. Для пациентов 2 и 4 групп было характерно сохранение на стенках пищевода следов контраста спустя 5–7 минут после перорального его приема. У пациентов 3 клинической группы (формирование проксимального кишечного резервуара) отмечалось депонирование большей части контраста в резервуаре и медленное и непрерывное его поступление в алиментарную петлю и нижлежащие отделы тонкой кишки без депонирования в ней. Остатки контрастного вещества сохранялись на стенках резервуара более 10 минут.
1 2
Рис. 3. Рентгеноскопия с пероральным контрастированием:
1 – гастрэктомия с ЭЭА «бок в бок» на Ру-петле линейным сшивающим аппаратом; 2 – гастрэктомия с формированием проксимального кишечного резервуара на Ру-петле Fig. 3. X-ray with oral contrast: 1 – gastrectomy with side–to-side EEA on the loop with a linear stapler; 2 – gastrectomy with the formation of a proximal intestinal reservoir on the loop
Отдаленные функциональные результаты оперативных вмешательств.
Оценка качества жизни пациентов, перенесших различные варианты реконструкции после ГЭ-Ру через 7–12 месяцев после вмешательства по функциональной шкале EORTC QLQ С3О/3.0. ST0 продемонстрировала максимальный уровень качества жизни у пациентов после ГЭ-Ру с формированием проксимального кишечного резервуара (88,7±6,3 баллов). Достоверно меньшим (80,1±4,2 балла, p<0,05) был показатель качества жизни у пациентов после ГЭ-Ру с инвагинационным поперечным анастомозом. Минимальными показателями качества жизни, достоверно отличающимися от показателей двух предшествующих групп (p<0,05) характеризовались пациенты после ГЭ-Ру с формированием ЭЭА линейным и циркулярным сшивающими аппаратами (72±5,1 и 68,3±5,8 балла соответственно, различия между группами недостоверно, р>0,05).
При эндоскопическом обследовании пациентов в сроки 7 – 12 месяцев после ГЭ-Ру явления рефлюкс-эзофагита были выявлены у 14,7 % пациентов, в том числе у 1,5 % - с выражен- ностью воспалительных изменений степени С. С минимальной частотой (8,0 % и 13,1 %) явления рефлюкс-эзофагита были отмечены у пациентов после ГЭ-Ру с формированием кишечного резервуара и ГЭ-Ру с инвагинационным ЭЭА. Наиболее часто явления рефлюкс-эзофагита были выражены у пациентов после реконструкции с использованием аппаратных ЭЭА: с формированием анастомоза линейным аппаратом и циркулярным аппаратом – 28,6 % и 19,1 % соответственно. Явления тяжелого рефлюкс-эзофагита были отмечены лишь у одного пациента после реконструкции с формированием ЭЭА линейным аппаратом. Очевидно, что само по себе формирование на Ру-петле инвагинационного поперечного анастомоза весьма эффективно для достижения антирефлюксного эффекта [2, 3]. Однако, как следует из представленных данных, Ру-петли и полуклапанного характера анастомоза оказывается недостаточно доля полного исключения рефлюкса и возникновения послеоперационного рефлюкс-эзофагита. Приведенные данные указывают также и на то, что даже при известных антирефлюксных свойствах Ру-петли формирование ЭЭА механическим швом с помощью циркулярного или линейного сшивающего аппарата отнюдь не гарантирует исключение пищеводного рефлюкса и развитие (в том числе и тяжелого) рефлюкс-эзофагита. При этом единственным вариантом реконструкции, минимизирующим до 8,0 % уровень кишечно-рефлюкса, является ГЭ-Ру с формированием проксимального кишечного резервуара.
Таблица 3
Оценка отдаленных результатов оперативных вмешательств: послеоперационный рефлюкс-эзофагит и качество жизни
|
1 группа/1 group |
2 группа/2 group |
3 груп-па/3 group |
4 груп-па/4 group |
|
|
Число обследованных пациентов, n/ Number of examined patients, n |
23 |
7 |
25 |
21 |
|
Нормальная слизистая пищевода/ Normal esophageal mucosa |
86,9 % |
71,4 % |
92,0 % |
80,9 % |
|
Эзофагит/ Esophagitis |
13,1 % |
28,6 % |
8,0 % |
19,1 % |
|
Степень А и В/ Degree A and B |
13,1 % |
28,6 % |
8,0 % |
14,3 % |
|
Степень С/ Degree C |
– |
– |
– |
4,8 % |
Продолжение Таблицы 3
|
Показатель качества жизни EORTC QLQ С3О/3,0, баллы (M±m)/ Quality of life indicator EORTC QLQ C3O/3.0, points (M±m) |
80,1±4,2 |
68,3±5,8 |
88,7±6,3 |
72±5,1 |
Комментируя полученные данные по антирефлюксным свойствам различных вариантов ГЭ-Ру, следует заметить, что нередко приводимые в литературе указания на различные варианты тонкокишечных резервуаров или так называемые гастропластические операции как на один из способов улучшения функциональных результатов эзофаго-энтеростомии, в том числе и в плане профилактики рефлюкса, не совсем корректны. Действительно, само по себе формирование резервуара из тонкой кишки даже теоретически не способно предотвратить пищеводный рефлюкс. Напротив, депонирование непосредственно за пищеводом некоего объема пищи, преследующее задачу ее замедленной эвакуации, в отсутствии клапанного механизма создает очевидные предпосылки к регургитации содержимого резервуара в пищевод. Тонкокишечные резервуары лишь отчасти решили проблему рефлюкса: Ру-петля, предотвращая рефлюкс кишечного содержимого, никоим образом не влияла на регургитацию в пищевод содержимого резервуара [6–7].
Существуют два принципиально различных подхода к предотвращению рефлюкса из резервуара в пищевод. Первым вариантом решения данной проблемы стали методики, предложенные F. Paulino (1973) и L. Nadrowski (2002) и заключавшиеся в перемещении тонкокишечного резервуара в дистальном направлении – от зоны пищеводно-кишечного анастомоза в зону межкишечного соустья. По замыслу авторов отключенный по Ру алиментарный сегмент тонкой кишки между пищеводнокишечным и межкишечным анастомозами играет роль клапана, препятствующего рефлюксу в пищевод и из резервуара, и из нижележащих отделов тонкой кишки. Тем не менее, при дистальном перемещении кишечного резервуара теряется его про-тективная роль в отношении к ЭЭА – манжеты, прикрывающей зону анастомоза, и гидродинамического демпфера, снижающего внутрипросветное давление в зоне пищеводно-кишечного соустья. Другим вариантом эффективного предотвращения рефлюкса из резервуара в пищевод и одновременного увеличения надежности ЭЭА является формирование инвагинационного анастомоза с клапанной функцией одновременно с проксимальным кишечным резервуаром, что продемонстрировало данное исследование. Сопоставление данных эндоскопического обследования с анализом балльных показателей функциональной шкалы у пациентов, перенесших ГЭ-Ру позволяет подтвердить наличие корреляции между выраженностью послеоперацион- ного рефлюкс-эзофагита и худшим качеством жизни [12, 13]. Принимая во внимание данные факты, а также сопоставление отличий в течении раннего послеоперационного периода при разных вариантах ГЭ-Ру, вполне правомочным станет выделение характерных преимуществ реконструкции с инвагинационным поперечным ЭЭА и формированием проксимального кишечного резервуара на Ру-петле, а именно – их влияние на адаптацию пищеварительного тракта в условиях постгастрэктомических морфофункциональных нарушений.
Первичная аккумуляция поступающего из пищевода пищевого комка в резервуаре предупреждает поступление проглоченного пищевого субстрата сразу непосредственно в отводящую от эзофаго-энтероанастомоза петлю тонкой кишки. При этом отсутствует перерастяжение проксимального отдела алиментарной кишечной петли и возникающие вследствие этого нарушения ее моторики (ретроградная перистальтика) с замедлением эвакуации пищевого комка. Таким образом резервуар осуществляет функцию демфи-рования пищевого удара в алиментарной кишечной петле и предупреждает возникновение моторно-эвакуаторных нарушений в ней.
Поступившее в резервуар содержимое пищевода первично аккумулируется и затем эвакуируется в алиментарную петлю порционно, в ритме нормальных перистальтических сокращений тонкой кишки, сформировавшей резервуар, и перистальтических сокращений самой алиментарной кишечной петли. Таким образом кишечный резервуар осуществляет функцию накопления пищевого содержимого и его последующей порционной эвакуации в алиментарную кишечную петлю.
При возникновении условий для рефлюкса кишечного содержимого из общей кишечной петли по алиментарной петле в пищевод (ретроградная перистальтика, недостаточная длина алиментарной петли, повышение внутрибрюшного давления) камера резервуара аккумулирует ретроградно поступившее содержимое алиментарной петли (рефлюктант), препятствуя, таким образом, развитию энтеро-эзофагеального рефлюкса. Указанный механизм находится в основе функции предупреждения кишечным резервуаром рефлюкса кишечного содержимого в пищевод.
Наличие непосредственно за эзофаго-энтероанастомозом кишечного резервуара с площадью поперечного сечения в два раза большим площади сечения отводящей кишки и самого пищевода определяет закономерное снижение внутрипросветного гидростатического давления на стенку тонкой кишки резервуара в зоне формирования эзофаго-энтероанастомоза при прохождении пищевого комка. Очевидно, что снижение внутрипросветного давления в зоне эзофаго-энтероанастомоза при формировании резервуара предупреждает растяжение линии анастомотических швов и является профилактикой нарушений гемоперфузии в анастомозированных стенках пищевода и кишки и развития несостоятельности анастомоза.
Заключение


