Гастроинтестинальные стромальные опухоли
Автор: Никулин М.П., Архири П.П., Мещеряков А.А., Носов Д.А., Стилиди И.С., Филоненко Д.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Практические рекомендации
Статья в выпуске: 3S2-1 т.13, 2023 года.
Бесплатный доступ
Гастроинтестинальные стромальные опухоли, мутация kit, мутация pdgfra, дикий тип, ингибиторы тирозинкиназ
Короткий адрес: https://sciup.org/140302398
IDR: 140302398 | DOI: 10.18027/2224-5057-2023-13-3s2-1-580-588
Текст статьи Гастроинтестинальные стромальные опухоли
1. КЛАССИФИКАЦИЯ И ОПРЕДЕЛЕНИЕ СТАДИИ
Стадирование ГИСО с 2019 г. проводится по системе TNM 8-го издания. Основными прогностическими факторами являются митотический индекс, размер и локализация опухоли. В основу стадирования ГИСО положены размер опухоли и митотический индекс. Т — первичная опухоль
ТХ — первичная опухоль не может быть оценена
Т0-первичная опухоль отсутствует
Т1-опухоль не более 2 см наибольшем измерении
Т2-опухоль более 2 см, но не более 5 см в наибольшем измерении
Т3-опухоль более 5 см, но не более 10 см в наибольшем измерении
Т4-опухоль более 10 см в наибольшем измерении
N — регионарные лимфатические узлы
NX — регионарные лимфоузлы не могут быть оценены 1
N0-нет метастазов в регионарных лимфатических узлах
N1-есть метастазы в регионарных лимфатических узлах.
М — отдаленные метастазы
М0-нет отдаленных метастазов
М1-есть отдаленные метастазы.
Митотический индекс
Низкий митотический индекс — не более 5 митозов в 50 полях зрения
Высокий митотический индекс — более 5 митозов в 50 полях зрения.
Митотический индекс для ГИСО определяют по количеству митозов в 50 полях зрения (на общей площади 5 мм 2 ) при большом увеличении микроскопа, используя объектив×40.
|
Стадия |
T |
N |
M |
Митотический индекс |
|
Стадия IA |
T1, T2 |
N0 |
M0 |
Низкий |
|
Стадия IB |
Т3 |
N0 |
M0 |
Низкий |
|
Стадия II |
T1, T2 |
N0 |
M0 |
Высокий |
|
Т4 |
N0 |
M0 |
Низкий |
|
|
Стадия IIIA |
Т3 |
N0 |
M0 |
Высокий |
|
Стадия IIIB |
Т4 |
N0 |
M0 |
Высокий |
|
Стадия IV |
Любая Т |
N1 |
M0 |
Любой |
|
Любая Т |
Любая N |
М1 |
Любой |
Таблица 2. Распределение по стадиям гастроинтестинальных стромальных опухолей внежелудочной локализации 1
|
Стадия |
T |
N |
M |
Митотический индекс |
|
Стадия I |
T1, T2 |
N0 |
M0 |
Низкий |
|
Стадия II |
Т3 |
N0 |
M0 |
Низкий |
|
Стадия |
T |
N |
M |
Митотический индекс |
|
Стадия IIIA |
T1 |
N0 |
M0 |
Высокий |
|
Т4 |
N0 |
M0 |
Низкий |
|
|
Стадия IIIB |
Т2, T3, T4 |
N0 |
M0 |
Высокий |
|
Стадия IV |
Любая Т |
N1 |
M0 |
Любой |
|
Любая Т |
Любая N |
М1 |
Любой |
1 Критерии стадирования опухолей тонкой кишки применяются для первичных ГИСО остальных внежелудочных локализаций.
2. ДИАГНОСТИКА
Диагноз устанавливается на основании данных осмотра, результатов инструментальных методов обследования и патоморфологического заключения. Первичное обследование должно быть проведено до всех видов лечебных воздействий и включает в себя:
В сложных случаях (трудности в установке морфологического или молекулярногенетического диагноза, больные с триадой Карнея, синдромом Карнея-Стратакиса или с диким типом) уточняющую диагностику и лечение целесообразно проводить в специализированных онкологических учреждениях.
Деление ГИСО на прогностические группы в зависимости от размера, локализации, митотического индекса и факта разрыва капсулы представлено в табл. 3.
Таблица 3. Прогностические группы гастроинтестинальных стромальных опухолей (по H. Joensuu, 2008 г.).
Мутационный статус также обладает прогностическим значением: пациенты с точечными мутациями, дупликациями в 11 экзоне гена KIT и гене PDGFRA (кроме D842V) лучше отвечают на лечение и обладают благоприятным прогнозом.
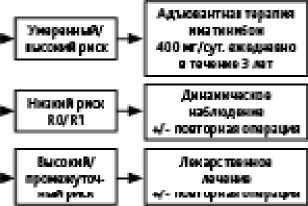
Основным методом лечения локализованных и местнораспространенных форм ГИСО является хирургическое лечение, а при рецидиве или метастатической болезни — тар-гетная терапия иматинибом.
-
• при низком риске прогрессирования показано динамическое наблюдение;
-
• при промежуточном и высоком риске прогрессирования показана адъювантная терапия иматинибом в течение 3 лет.
-
3.2. Нерезектабельные опухоли, рецидивы, метастазы
-
3.2.1. I линия терапии
-
При назначении адъювантной терапии или лечении неоперабельных и метастатических опухолей целесообразно проводить молекулярно-генетическое исследование для исклю- чения ГИСО, резистентных к таргетной терапии (мутация D842V в гене тромбоцитарного фактора роста, встречающаяся менее чем в 5%случаев). При выявлении потери экспрессии SDHB в опухоли при ИГХ исследовании адъювантная терапия иматинибом нецелесообразна.
При рецидиве болезни после адъювантной терапии показано возобновление приема иматиниба. Алгоритм лечения локализованных ГИСО представлен на рис. 1.
-
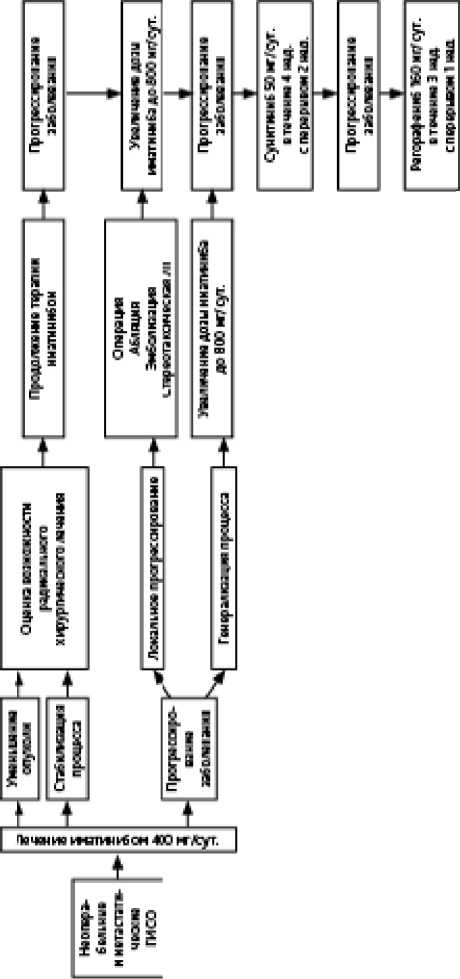
• При нерезектабельных опухолях, рецидиве или метастазах основной метод лечения — таргетная терапия иматинибом 400 мг/сут. до прогрессирования или неприемлемой токсичности.
-
• При мутации в 9-м экзоне гена KIT рекомендован иматиниб 800 мг/сут. (статистически значимо увеличивает время до прогрессирования без существенного улучшения общей выживаемости по сравнению с дозой иматиниба 400 мг/сут.).
-
• При диком типе ГИСО с дефицитом SDH (в том числе при ГИСО в составе триады Карнея и синдрома Карнея-Стратакиса) приём иматиниба не рекомендуется; в I линии рекомендуется прием сунитиниба 50 мг/сут. в течение 4 нед., 2 нед. — перерыв (либо 37,5 мг/сут. ежедневно) или регорафениба 160 мг/сут. в течение 3 нед., 1 неделя — перерыв.
-
• При мутации гена D842V в 18 экзоне гена PDGFRA в I линии лечения возможно применение дазатиниба 140 мг/сут. ежедневно.
-
• При исходно не резектабельных опухолях у больных с эффектом в результате терапии целесообразна оценка возможности радикального хирургического лечения через 6–12 мес. после начала терапии.
-
• При изолированном поражении печени возможны РЧА, резекция печени, эмболизация, либо стереотаксическая ЛТ через 6–12 мес. после начала терапии.
-
• При мультифокальном прогрессировании хирургическое лечение не улучшает выживаемость по сравнению с лекарственным лечением.
-
• При локальном прогрессировании (увеличение отдельных метастазов при сохраняющемся эффекте со стороны других метастазов) консилиумом может быть рассмотрен вопрос о хирургическом удалении отдельных очагов либо использовании различных методов локального воздействия (эмболизация, стереотаксическая ЛТ).
-
• ХТ, ГТ, а также другие виды лекарственного лечения неэффективны.
-
• ЛТ может быть назначена при метастазах в костях с паллиативной целью.
-
• При хирургических осложнениях течения болезни (разрыве опухоли, кишечной непроходимости, кровотечении) выполняются общепринятые хирургические мероприятия с продолжением таргетной терапии.
-
3.2.2. II линия терапии
-
• При прогрессировании на фоне приема иматиниба в дозе 400 мг /сут. показана эскалация дозы препарата до 800 мг/сут., лечение — до прогрессирования или неприемлемой токсичности.
-
• При непереносимости иматиниба или первичной резистентности показана терапия сунитинибом 50 мг/сут. ежедневно в течение 4 недель, 2 недели перерыв, альтернативный режим приёма — 37,5 мг/сут. ежедневно без перерыва, лечение — до прогрессирования или неприемлемой токсичности. При выраженных побочных эффектах допустимо снижение дозы сунитиниба до 37,5 мг/сут. ежедневно в течение 4 недель, 2 недели перерыв, следующий дозовый уровень — 25 мг/сут. ежедневно в течение 4 недель, 2 недели перерыв. Медиана времени до прогрессирования при таком варианте лечения составляет 6 мес.
-
• При локальном прогрессировании (увеличение отдельных метастазов при сохраняющемся эффекте со стороны других метастазов) консилиумом может быть рассмотрен вопрос о хирургическом удалении отдельных очагов либо использовании различных методов локального воздействия (эмболизация, стереотаксическая ЛТ).
-
3.2.3. III линия терапии
• При прогрессировании болезни на фоне приема иматиниба и сунитиниба либо их непереносимости показана терапия регорафенибом 160 мг/сут. ежедневно в течение 3 недель, перерыв — 1 неделя, лечение — до прогрессирования или неприемлемой токсичности. Медиана времени до прогрессирования составляет 5 мес.
• При локальном прогрессировании (увеличение отдельных метастазов при сохраняющемся эффекте со стороны других метастазов) консилиумом может быть рассмотрен вопрос о хирургическом удалении отдельных очагов либо использовании различных методов локального воздействия (эмболизация, стереотаксическая ЛТ).
• Рекомендуется тестирование опухоли для выявления MSI-H, dMMR; в случае их выявления необходимо рассмотреть назначение пембролизумаба.
• Рекомендуется тестирование опухоли для выявления транслокаций генов NTRK. В случае выявления транслокаций NTRK необходимо рассмотреть вопрос о назначении ларотректиниба 100 мг два раза в сутки ежедневно либо энтректиниба 600 мг в сутки ежедневно.
• При неэффективности/непереносимости терапии сунитинибом/регорафенибом возможно рассмотреть повторное назначение иматиниба в дозе 400 мг/сут.
3.2.4. Дополнительные лекарственные препараты для лечения метастатической формы ГИСО
4. НАБЛЮДЕНИЕ И ОЦЕНКА ЭФФЕКТА
Возникновение резистентности к стандартным противоопухолевым лекарственным препаратам обусловлено появлением вторичных мутаций, в свою очередь чувствительных к другим таргетным препаратам (сорафениб, дазатиниб, нилотиниб, понатиниб, кабозантиниб).
После прогрессирования на трёх линиях лечения возможно применение комбинации иматиниба 600 мг/сут. и эверолимуса 2,5 мг/сут.
При выявлении мутации V600E в гене BRAF возможно назначение комбинации ВRAF ингибиторов (вемурафениба или дабрафениба) с ингибиторами MEK (кобиметинибом или траметинибом).
При метастазах в костях рекомендуется применение остеомодифицирующих препаратов: золедроновая кислота 4 мг в/в или деносумаб 120 мг п/к один раз в 28 дней.
Алгоритм лечения неоперабельных и метастатических форм ГИСО представлен на рис. 2.
После радикальных операций с целью раннего выявления метастазов и оценки эффективности терапии метастатической болезни необходимо выполнение УЗИ брюшной полости/малого таза. Оптимальным является использование КТ/МРТ органов брюшной полости и малого таза с в/в контрастированием. УЗИ может применяться для оценки появления новых очагов при невозможности выполнения КТ, но не является надежным методом мониторинга эффективности терапии метастатической болезни. При КТ должны быть оценены не только размеры опухолевых очагов, но и их плотность: формальное увеличение размеров опухоли без оценки плотности не всегда означает прогрессирование.
ГИСО крайне редко метастазируют в легкие, поэтому КТ грудной клетки нецелесообразна, обзорная R-графия в прямой и боковой проекциях является достаточным методом.
Частота обследования (КТ) после радикальных операций зависит от группы риска:
• при низком риске прогрессирования — 1 раз в 6–12 мес. в течение 5 лет;
• при промежуточном и высоком риске прогрессирования — каждые 6 мес. на протяжении 5 лет, далее — 1 раз в год.
5. ПРОФИЛАКТИКАИ ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
ПЭТ выполняется для оценки метаболической активности первичной опухоли или метастазов, но не является рутинным методом.
С учетом редкой встречаемости ГИСО не проводятся.
I D
=
E
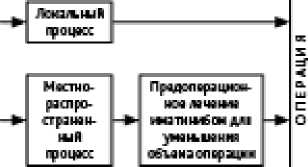
Рисунок 1. Алгоритм лечения операбельных форм гастроинтестинальных стромальных опухолей.