Гастроинтестинальные стромальные опухоли: понятие, распространённость в Российской Федерации и Республике Мордовия
Бесплатный доступ
В статье рассматриваются вопросы этиологии и диагностики гастроинтестинальных стромальных опухолей (ГИСО). Представлен подробный статистический отчет за пятилетний период, отражающий особенности эпидемиологии ГИСО в Республике Мордовия. Цифры, полученные в ходе исследования, даны в сравнении с показателями по Российской Федерации в целом. Эти результаты могут послужить основой для дальнейшего изучения данной патологии.
Гастроинтестинальная стромальная опухоль, диагностика, желудочно кишечный тракт, метастаз, эпидемиология
Короткий адрес: https://sciup.org/147249590
IDR: 147249590 | УДК: 616-091:616-006:616.34
Текст научной статьи Гастроинтестинальные стромальные опухоли: понятие, распространённость в Российской Федерации и Республике Мордовия
В качестве диагностического термина ГИСО были предложены в 1983 году профессорами М. Т. Мазуром и Х. Б. Кларком. До конца 1990-х годов гастроинтестинальными стромальными опухолями называли многие гладкомышечные опухоли желудочно-кишечного тракта (ЖКТ) – лейомиомы, лейомиосаркомы, фибромы, невриномы и др. Ранее патогистологически было невозможно отличить ГИСО от других опухолей. В настоящее время доказано, что подобные опухоли резко отличаются от других неоплазий своим молекулярным строением [3].
Считается, что ГИСО возникают из интерстициальных клеток Кахаля. Данные клетки задают ритм сокращений полых органов ЖКТ. Некоторые особенности клеток Кахаля представлены в таблице 1.
Таблица 1
Особенности строения и локализации клеток Кахаля в организме
Генетические особенности данных опухолей заключаются в том, что 85–90% ГИСО несут онкогенные мутации c-kit или PDGFRA [4]. В норме эти гены являются мембранными рецепторами факторов роста. Активация мутаций данных рецепторов стимулирует пролиферацию клеток опухоли. В 85% случаев ГИСО обнаружены нарушения работы сигнального пути c-kit. При этом с-kit присутствует на поверхности интерстициальных клеток Кахаля и других клеток организма. Молекула c-kit содержит длинный внеклеточный домен, трансмембранный сегмент и внутриклеточную часть. 90% всех мутаций с-kit происходит в ДНК, кодирующей внутриклеточный домен, который работает как активатор других ферментов. Мутантные формы c-kit могут функционировать независимо от активации фактором стволовых клеток, что приводит к высокой частоте деления клеток и их геномной нестабильности, является первым звеном патогенеза ГИСО. Известно [4], что при ГИСО наблюдаются мутации в 9, 11 и редко в 13 и 17 экзонах гена с-kit. Определение места локализации мутаций позволяет прогнозировать течение заболевания и определять тактику лечения. Около 30% ГИСО имеют мутацию в другом кодирующем тирозинкиназу гене PDGFRA [4]. Большинство мутаций PDGFRA представлено заменой нуклеотида во втором тирозинкиназном домене, что придает клеткам опухоли первичную устойчивость к иматинибу и создает трудности при выборе лекарственной терапии.
Около 85% ГИСО у детей и 10-15% ГИСО у взрослых не несут мутаций в экзонах гена с-kit и гена PDGFRA. Подобные новообразования называют опухолями дикого типа. Постепенно накапливаются данные о том, что ГИСО дикого типа представляют собой разнородную группу опухолей, различающихся по движущим мутациям. Примерно половина таких опухолей синтезирует повышенное количество рецептора инсулиноподобного фактора роста. Описано [4] несколько мутаций, характерных для ГИСО дикого типа, однако их значение на сегодняшний день не определенно.
Большинство ГИСО являются не наследуемыми. Характерно, что менее чем 5% развиваются в рамках наследственных семейных или идиопатических мультиопухолевых синдромов, таких как: нейрофиброматоз I типа, триада Карни, эмбриональные мутации в с-kit/PDGFRA, диада Карни-Стратакиса [5].
Наиболее достоверным методом диагностики ГИСО является иммуногистохимический метод исследования. В частности, выявление CD117 или с-kit протеина: экспрессия рецептора с-kit отмечается в 95% случаев. В таблице 2 представлены иммуногистохимические маркеры, используемые для дифференциальной диагностики мезенхимальных опухолей ЖКТ.
Таблица 2
Иммуногистохимические маркеры мезенхимальных опухолей ЖКТ (цит. по [5])
|
Тип опухоли |
с-kit |
CD34 |
SMA |
Десмин |
S-100 |
|
ГИСО |
+ |
+ (60-70 %) |
+ (30-40 %) |
+ (1-2 %) |
+ (5%) |
|
Гладкомышечные опухоли |
- |
+ (10-15%) |
+ |
+ |
- |
|
Шваннома |
- |
+ |
- |
- |
+ |
|
Фиброматоз |
? |
- |
+ |
+ |
- |
Больные предъявляют жалобы на затруднение глотания, желудочно-кишечные кровотечения (50%), боли в животе без четкой локализации (20–50%), непроходимость в 10– 30% случаев, а также на увеличение живота в объеме, анемию, слабость, потерю массы тела, тошноту, рвоту, пальпируемые опухолевые массы. В клинической картине ГИСО не существует специфических симптомов, т.к. все перечисленные выше признаки могут быть присущи опухолям ЖКТ любого гистогенеза.
С 2008 года риск прогрессирования ГИСО стратифицируется по Джоенсуу (табл. 3).
Таблица 3
Стратификация риска прогрессирования ГИСО [2]
Частота встречаемости первичной локализации ГИСО представлена в таблице 4.
Таблица 4
Частота встречаемости первичной локализации ГИСО, в %
|
Локализация |
Данные НИИ нейрохирургии им. Н.Н. Бурденко (%) |
Данные зарубежных авторов (%) |
|
Желудок |
50 |
70 |
|
Тонкая кишка |
33,3 |
20 |
|
Внеорганная опухоль |
5,6 |
Редко |
|
Толстая и прямая кишка |
1,1 |
5 |
|
Пищевод |
0 |
Меньше 5 |
ГИСО могут метастазировать в печень (60%), сальник (30%), кости (6%), легкие (2%), регионарные лимфоузлы (6–8%). Однако метастазирование для ГИСО не является показателем злокачественности, все определяет размер опухоли и место ее расположения в ЖКТ (табл. 5).
Самая высокая частота ГИСО в России отмечена в возрасте 50–65 лет. Соотношение мужчин и женщин составляет 39 к 61%. При этом 69% людей с ГИСО обратились за помощью в лечебные учреждения из-за нарастающих клинических симптомов, у 10% пациентов ГИСО выявлены на аутопсии, а у 21% выявляются случайно (микроГИСО) [7].
Таблица 5
Определения риска злокачественности в зависимости от размера опухоли
|
Риск агрессивности |
Размер опухоли, см |
Митотическая активность (на 50 ПЗ) |
|
Очень низкий |
< 2 |
< 5/50 ПЗ |
|
Низкий |
2–5 |
< 5 |
|
Умеренный |
< 5 |
6–10 |
|
5–10 |
< 5 |
|
|
Высокий |
> 5 |
> 5 |
|
> 10 |
Любая |
|
|
Любой |
> 10 |
Примечание: ПЗ – поле зрения при сильном увеличении.
Данные по выявляемости ГИСО в России и отдельных ее федеральных округах (ФО) представлены в таблице 6.
Таблица 6
Выявленные случаи ГИСО на территории Российской Федерации
|
Регион/год |
1998–2004 |
2008 |
2009 |
2010 |
Всего |
|
РФ |
48 |
483 |
602 |
454 |
1587 |
|
Приволжский ФО |
453 |
||||
|
Москва |
358 |
||||
|
Южный ФО |
166 |
При анализе данных с 2011 г. по 2016 г., всего в Республике Мордовия (РМ) было первично выявлено с подозрением на ГИСО 11 пациентов (рис. 1). Диагноз был подтвержден морфологически в 10 клинических случаях.
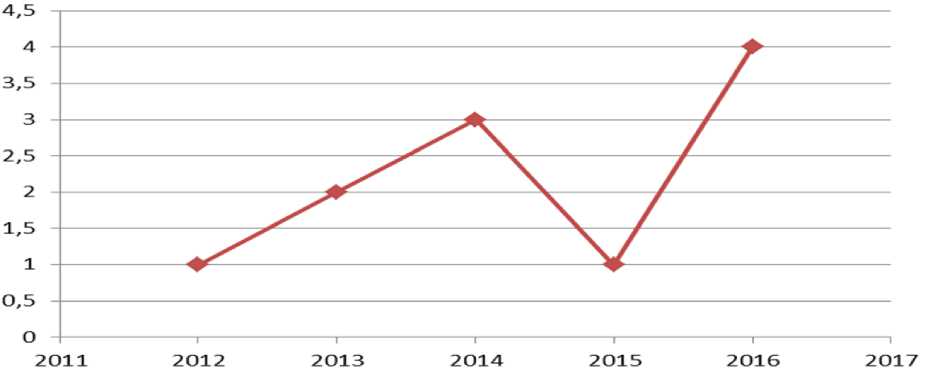
Рис. 1. Выявленные случаи ГИСО в Республике Мордовия в 2011–2016 гг.
Соотношение мужчин и женщин составило 20 к 80% соответственно. Все пациенты вне зависимости от пола были старше 55 лет.
Выводы .
-
1. В Республике Мордовия ГИСО выявляются у лиц старше 55 лет, что совпадает с данными РФ (50–65 лет).
-
2. В Республике Мордовия ГИСО чаще болеют женщины, соотношение женщин к мужчинам составляет 80 : 20% (в России это соотношение равно 61 : 39%).
-
3. В Республике Мордовия наиболее частая первичная локализация ГИСО – желудок (40%), как и по России в целом (50%), так и в зарубежных странах (70%).
-
4. Выживаемость в Республике Мордовия в течение первых пяти лет после проведенного радикального течения составляет 90%. Данные по РФ не
представлены.
Список литературы Гастроинтестинальные стромальные опухоли: понятие, распространённость в Российской Федерации и Республике Мордовия
- Всемирная организация здравоохранения. Рак. [Электронный ресурс]. - Режим доступа: http://www.who.int/mediacentre/factsheets/fs297/ru.
- Клинические рекомендации по лечению ГИСО [Электронный ресурс] // Министерство здравоохранения РФ. - 2015. - Пересмотр от 2017 года. - Режим доступа: http://oncology-association.ru/files/clinical-guidelines_adults/giso.pdf.
- Носов Д. А. Гастроинтерстенальные стромальные опухоли: новая нозологическая единица и современные возможности лечения [Электронный ресурс] // VII Российская онкологическая конференция: RosOncoWeb-2017. - Режим доступа: https://rosoncoweb.ru/library/congress/ru/07/13.php.
- Мещеряков А. А. Гастроинтестинальные стромальные опухоли - современные возможности лекарственного контроля [Электронный ресурс] // Трудный пациент. - 2007. - Режим доступа: http://t-pacient.ru/articles/6063/.
- Гастроинтестинальная стромальная опухоль [Электронный ресурс]. - Режим доступа: http://novoston.com/news/gastrointestinalnaya-stromalnaya-opuhol-40832.
- Fletcher С.D.M. Clinicopathologic correlations in gastrointestinal stromal tumors // Human Pathology. - 2002. - Vol. 33, Issue 5. - Р. 455.
- Сложные случаи в абдоминальной хирургии [Электронный ресурс] // Управление делами президента РФ. Федеральное государственное бюджетное учреждение «Объединенная больница с поликлиникой». - 2015. - Режим доступа: http://fgu-obp.ru/stat/hirur/full/Slozhnye-sluchai-v-abdominalnoj-hirurgii/Gastrointestinalnaya-stromalnaya-opuhol-zheludka-oslozhnyonnaya/.


