Гелеобразование в низкоконцентрированных растворах глицирама и аминокислот в присутствии нитрата серебра
Автор: Матаипова А. К., Джуманазарова A. З., Абдуллаева Ж. Д.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Химические науки
Статья в выпуске: 11 т.7, 2021 года.
Бесплатный доступ
Актуальность: низкомолекулярные супрамолекулярные гидрогели представляют собой уникальные объекты, которые способны решить многие актуальные проблемы в медицине, пищевой промышленности и других отраслях народного хозяйства. Цели исследования: в недавнем прошлом было обнаружено, что низко концентрированные растворы L-цистеина и нитрата серебра (ЦСР) могут образовать, при добавлении к ним растворов электролитов, гидрогели. Перед нами стояла задача получения гидрогелей из разбавленных растворов глицирама (GC) добавлением ЦСР, поскольку GC, из-за плохой растворимости, обладает низкой биодоступностью. Материалы и методы исследования: методом изомолярных серий проведено сравнительное изучение образования гидрогелей разбавленными растворами GC при добавлении ЦСР и GCР. Было обнаружено, что наиболее прочные гидрогели получаются при использовании ЦСР. Результаты исследования: были получены гидрогели глицирама при его концентрации, равной 10−3 М при смешении его с серебряными растворами аминокислот — L-цистеина (ЦСР) и L-глутаминовой кислоты (GCP) в таких же низких концентрациях. Выводы: гидрогели с глицирамом образуют серебряные растворы тех аминокислот, которые способны при соотношении аминокислота : нитрат серебра 1,25 давать структуры каркасного строения.
Глицирам, гидрогель, цистеин, глутаминовая кислота, антибактериальные свойства, супрамолекулярные системы.
Короткий адрес: https://sciup.org/14121218
IDR: 14121218 | УДК: 577.1:5443.422 | DOI: 10.33619/2414-2948/72/01
Текст научной статьи Гелеобразование в низкоконцентрированных растворах глицирама и аминокислот в присутствии нитрата серебра
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 577.1:5443.422
Уникальность гидрогелей состоит в том, что они могут содержать большое количество воды, намного превышающее количество растворенного вещества. Кроме этого, гидрогели могут содержать несколько компонентов, каждый из которых проявляет свою уникальную биологическую активность.
Исследования, посвященные супрамолекулярным гидрогелям (СМГ) являются неотъемлемой частью современной прикладной и фундаментальной химической науки последних трех десятилетий, благодаря их уникальным свойствам. К ним относится особенность гидрогелей [1] связывать большое количество воды при относительно малых концентрациях реагентов (~3ммоль/л). Благодаря высокому содержанию воды СМГ идеально подходят для биологического применения в качестве покрытий ран, контактных линз, суперсорбентов, биосенсоров, пищевых добавок [2].
Кроме этого, наличие биоактивных веществ делает СМГ привлекательными для использования в качестве основы противовоспалительных, обволакивающих препаратов [3]. СМГ [4] на основе олигомерных и полимерных СМС, могут использоваться для неинвазивного способа доставки медицинских препаратов в организм, также они могут служить антисептической матрицей для создания новых лекарственных препаратов.
СМГ получаются [5] из соединений с небольшой молекулярной массой (<3000). На микроуровне эти гели представляют собой вытянутые волокно подобные структуры, связанные между собой множественными взаимодействиями (водородными связями, ван-дер-ваальсовыми взаимодействиями и т. д.). Главные свойства СМГ, дающие им особые функции, это их динамичность и обратимость [1].
Одним из перспективных представителей СМГ [6] является впервые синтезированный в 2001 г. низкоконцентрированный тиксотропный гидрогель на основе водных растворов аминокислоты L-цистеина и нитрата серебра, названный авторами цистеин-серебряным раствором (ЦСР). Были также изучены особенности процессов образования гидрогелей на основе L-цистеина при применении других солей серебра - нитрита серебра [7], а также ацетата серебра [8].
Материал и методы исследования
В работе был использован метод изомолярных серий, проведено сравнительное изучение образования гидрогелей разбавленными растворами GC при добавлении ЦСР и GCР. Было обнаружено, что наиболее прочные гидрогели получаются при использовании ЦСР. Таким образом, были получены гидрогели GC при концентрации 10-3 М после добавления ЦСР и GСР, имеющие супрамолекулярный характер и сочетающие в себе свойства GC, аминокислоты и ионов серебра.
Результаты и обсуждение
В начальный момент при сливании водных растворов L- цистеина и AgNO 3 образуется мутный раствор. Однако в процессе стояния он постепенно становится прозрачным и только после добавления в раствор определенных анионов, играющих роль линкеров (скрепок) между положительно заряженными фрагментами, образуется гидрогель [3]. ЦСР может быть переведен в гелеобразное состояние и другими способами [7, 8] изменением диэлектрической постоянной среды с помощью водорастворимых органических растворителей, а также изменением заряда фрагментов, добавляя в раствор щелочи. Таким образом, гель в системах на основе ЦСР формируется в две стадии: сначала синтезируется ЦСР, а затем в него добавляется определенный компонент, стимулирующий гелеобразование.
Интересно, что гелеобразующая композиция получается на основе оксациллина и нитрата серебра, которая была получена и изучена в работе [9]. Оксациллин-серебряный гель – удобная комбинированная лекарственная форма серебра и антибиотика, имеющая коагуляционную структуру, и которая обладает антимикробными, ранозаживляющими и антисептическими свойствами.
Известны также гели [10], полученные на основе нитрата серебра (I) с ампициллином, оксациллином, цефазолином и цефетаксимом в водных растворах.
В работе [11] изучен гель ЦСР и природного полимера – хитозана, проявляющий выраженные антисептические свойства. Перед нами стояла задача получить гидрогель глицирама (GC) при его низких концентрациях с помощью серебряных растворов аминокислот, поскольку известно [12], что глицирам, наряду с глицирризиновой кислотой, обладает крайне низкой биодоступностью из-за недостаточной растворимости в воде. Композиции низко концентрированных растворов GC с серебряными растворами аминокислот с образованием гидрогелей могут представить значительный практический интерес, сочетающие в себе уникальные свойства GC в доступной форме, аминокислоты и иона серебра. Ранее, в нашей публикации [13], мы расширили круг аминокислот для получения СМС и изучили серебряные растворы на основе L-глутаминовой кислоты (GСР) и L- лизина (LСР) сравнительно с ЦСР с помощью метода динамического светорассеяния. В данной работе мы изучили процесс гелеобразования в разбавленных растворах GC при добавлении ЦСР, GСР без применения растворов электролитов и строение гидрогелей с помощью сканирующего электронного микроскопа (СЭМ).
Мольные соотношения исходных продуктов, при которых наблюдается гелеобразование, были установлены методом изомолярных серий. Для этого были приготовлены растворы глицирама, глутаминовой кислоты, цистеина, лизина и нитрата серебра в концентрациях 10-3М. Из этих растворов подготовлены: Cys+AgNO 3 =цистеин серебряный раствор (ЦСР), Glu+AgNO 3 =глутамин серебряный раствор (GCР). Причем соотношение аминокислоты и нитрата серебра равнялось 1,25. Затем GC был смешан с
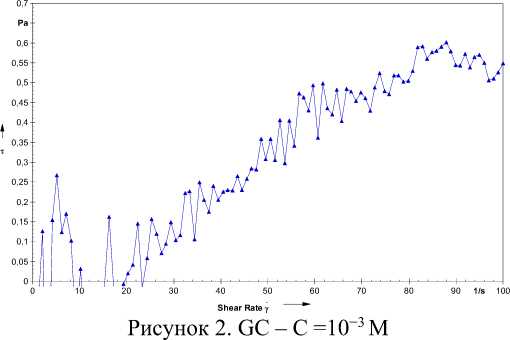
Бюллетень науки и практики / Bulletin of Science and Practice Т. 7. №11. 2021 полученными растворами в соотношениях 9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9. При соотношениях GC: ЦСР 6:4, 5:5, 4:6, 3:7, а для GC:GСР – при соотношениях 4:6, 7:3 – были получены прочные гели, при соотношениях 8:2, 9:1 наблюдалось образование менее прочных гелей. При смешении GC и LСР наблюдалось образование гелей, которые отличались большей текучестью, чем с ЦСР и GСР. Поэтому эти системы в дальнейшем нами не рассматривались. Также, смешение ЦСР, GСР и LСР с GC, концентрация которого составляла 10-4 М, образование гелей не наблюдалось. Стадии образования гидрогелей GC+ЦСР и GC+GСР приведены на Рисунках 1, 2.





Рисунок 1. 1 — Цистеин-серебряный раствор. 2 — Созревший цистеин-серебряный раствор (ЦСР). 3 — Водный раствор глицирама (концентрация 10-3 М). 4 — Гидрогель после смешения ЦСР и раствора глицирама. 5 —Гидрогель после смешения GСР и раствора глицирама
Твердость полученных гелей была оценена в работе [14] согласно [2, 15]. Полученные гели обладали тиксотропными свойствами [16].
Для определения кинематической и динамической вязкости полученных гидрогелей был использован реовискозиметр Rheolab QC, Anton Paar (Австрия), 2013. Полученные результаты приведены на Рисунках 3–7.
Из этих графиков можно видеть, что при концентрации 10-3 M GC показывает достаточную текучесть, Рисунок 2 (GC - С= 10-3M). Более прочными оказались гидрогели GC c ЦCP в соотношениях, указанных на Рисунке 3. ЦСР + GC 1:0,5 и Рисунок 4. ЦСР + GC 1:1. Менее прочными являются гели GC c GCP, Рисунок 5. GСР + GC 1:0,5 и Рисунок 6. GСР + GC 1:1.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 7. №11. 2021
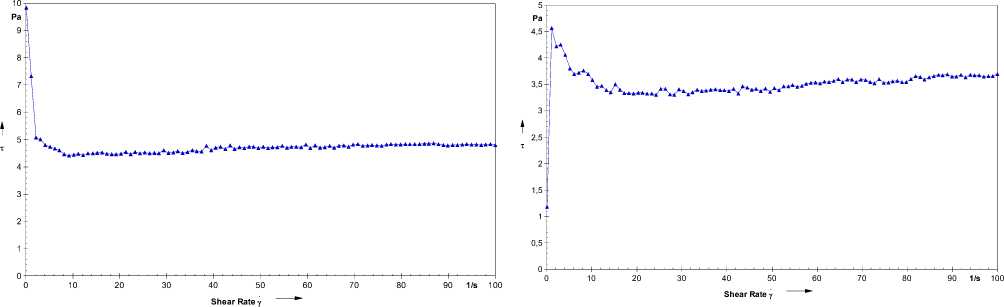
Рисунок 4. GСР + GC 1:1
Pa
Рисунок 3. ЦСР + GC 1:0,5
0,65
0,55
0,25
0,15
0,1
0,05
I 0,45
0,4
0,35
Shear Rate у
Рисунок 6. LСР + GC 1:1
Shear Rate .
Рисунок 5. GСР + GC 1:0,5
Одной из важных характеристик гидрогелей является морфология поверхности, которая позволяет охарактеризовать не только свойства системы, но также перспективы их дальнейших исследований и применения.
Для исследования морфологии поверхности гидрогелей нами был использован метод сканирующей электронной микроскопии, для этого образцы были предварительно лиофилизированы из замерзшего состояния, затем покрыты тонким слоем проводящего металла. Полученные результаты приведены на Рисунках 7–8.
Образование гидрогелей GC и ЦСР, вероятно, можно объяснить взаимодействием мицелл GC с ЦСР. В работе T. V. Romanko, Y. I. Murinov по изучению изменений вязкости растворов глицирризиновой кислоты была оценена критическая концентрация мицеллообразования — 0,004 вес. % (0,05 мМ) [17].
Образование мицелл GC, как установлено в работе А. В. Душкина, Е. С. Метелевой, Ю. С. Чистяченко, С. С. Халиковой, происходит при концентрации, равной 0,0001 вес.% или 0,001 мМ, т.е. при той концентрации, при которой нами получены гидрогели [18].
Образование мицелл молекулами GC объясняется присутствием гидрофильного (два глюкуронидных остатка) и гидрофобного (тритерпеновый фрагментов) в GC. Наиболее вероятно, что в мицелле молекулы GC ориентированы гидрофобными фрагментами внутрь, а гидрофильными частями на внешнюю поверхность самоассоциата, который взаимодействует с сетчатым каркасом ЦСР, образованный цепочками фрактальных кластеров и, который является поликатионом [4].
Вероятно, по такому же механизму происходит взаимодействие мицелл GC с серебряными растворами глутаминовой кислоты с образованием гидрогелей. В комплексах серебра с L-глутаминовой кислотой [19], выделенными при низких значениях рН, обнаружена координация по типу. При этом атомы серебра координируются приблизительно линейно с цис-конфигурациией относительно карбоксилатной группы. Найдено цепочечно-разветвленное полимерное строение комплекса с глутаминат-ионом [Ag2Glu]n [19]. Вероятно, цепочечно-разветвленные полимерные глутамат-ионы образуют также сетчатый каркас, несущий положительные заряды.

Рисунок 7. Морфологическое строение гидрогеля GC+ЦСР на СЭМ (1 – растущий гидрогель; 2 – гель)

Рисунок 8. Морфологическое строение гидрогеля GC+ГСР на СЭМ
Выводы о том, что при взаимодействии L-цистеина и L-глутаминовой кислоты с нитратом серебра (в соотношении 1,25) образуются цепочечно-разветвленные структуры каркасного типа можно сделать из их УФ-спектров, представленных на рис. 9, 10. Вероятно, имеющиеся полосы поглощения при 217 нм, 227 нм, 233 нм, 304 нм в ЦСР, и полосы поглощения при 218 нм, 229 нм, 300 нм в ГЦР ответственны за перенос электронов с σ→σ * в этих структурах.
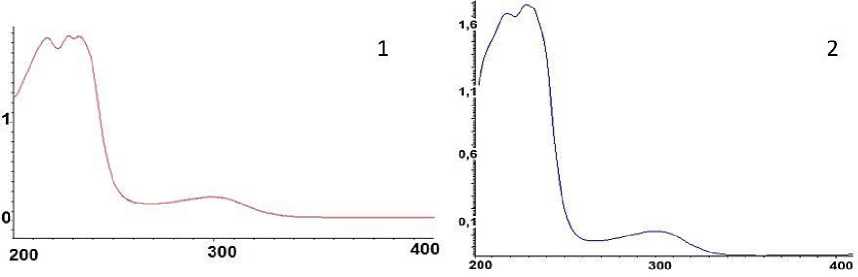
Рисунок 9. 1- УФ-спектры ЦСР. 2- УФ-спектры ГСР
Подобно оксацаллин-серебряному гелю [11], вероятно, гель-структуру глицирам-серебряных растворов аминокислот можно отнести к коагуляционной структуре. Для коагуляционных структур характерно старение во времени, которое проявляется в постепенном упрочении структуры, ее сжатии и высвобождению части жидкости из структурной сетки. Это может привести к разделению системы на две фазы: более концентрированный студень и растворитель, содержащий некоторое количеству дисперсной фазы (явление синерезиса), что можно видеть из Рисунка 7, после 6-месяцев стояния гидрогелей GC и GСР в разных соотношениях (Рисунок 10).

Рисунок 10. Соотношение GC: GCP– 1 (6:4), 2 (7:3), 3 (8:2), 4 (9:1)
Гидрогели, полученные на основе GC и серебряных растворов L-цистеина и L-глутаминовой кислоты были высушены и изучены их ИК-спектры. ИК-спектры были сняты на приборе Nicolet Avatar 370 GDTSот 4000 см-1 до 400 см-1 в KBr.
ИК-спектр GC (KBr, ν, cм-1): 3196,7 (OH, NH), 2836,9 (CH), 1716,9 (C=O), 1699,8 (C=O), 1647,7 (С 11 =О, C=C), 1589 (СОО-), 1541,5 (CH), 1507 (CH), 1456 (СН 2 , СН 3 ), 1418 ( NH 4 + ), 1387,6 (CH), 1362 (CH), 1260 (CH), 1212 (CH), 1165 (С-О-С, С-ОН), 1040,6 (С-О-С, СОН), 981 (=CH), 919 (CH).
ИК-спектр Cys (KBr, ν, cм-1): 2995 (NH 3 +), 2543 (S-H); 2104,8 (NH 3 +), 1611(аминокислотная полоса I - NH 3 +), 1513 (COO-), 1427 (аминокислотная полоса II - NH 3 +), 1397 (COO-), 1360 (СН 2 ), 1345 (СН 2 ), 1327 (СН 2 ), 1291 (COO-), 1204 (CH), 1159 (CH), 1139 (CH), 1066 (C-OH), 1044 (C-OH), 985 (NH 3 +), 942 (S-H), 824 (COO-), 660 (CS).
ИК-спектры GC+Cys + AgNO 3 (KBr, ν, cм-1) : 3450 (О-Н, NH), 3026 (NH 3 +), 2922 (CH), 2852 (CH), 2360 (CH), 2342 (CH), 2272 (CH), 1631 (СО), 1601 (аминокислотная полоса I -NH 3 +), 1512 (COO-), 1492 (аминокислотная полоса II - NH 3 +), 1384 (СН 2 ), 1353 (СН 2 ), 1156 (СН 2 ), 1080 (С-О-С, С-ОН), 1043 (С-О-С, С-ОН), 879 (COO-).
Из анализа спектров исходных GC, Cys и их гидрогели можно видеть, что в гидрогеле исчезает полоса 2543 cм-1, характерная для S-H L-цистеина, что свидетельствует о замещении водорода серебром [10], и что является началом образования пространственной сетки ЦСР. Имеют место достаточно заметные смещения аминокислотных полос I и II L-цистеина, 1611 > 1601,3 см-1 и 142 7 > 1492,3 см-1, соответственно. Смещение полосы поглощения 2995 см-1, которая характеризует (NH 3 +) в область низких частот 3450,1 см-1, свидетельствует о разрушении цвиттер ионной формы в аминокислоте и об участии этой группы в образовании водородных связей, в которых принимают участие функциональные группы молекулы GC.
ИК-спектр GC (KBr, ν, cм-1) : 3196,7 (OH, NH), 2836,9 (CH), 1716,9 (C=O), 1699,8 (C=O), 1647,7 (С 11 =О, C=C), 1589 (СОО-), 1541,5 (CH), 1507 (CH), 1456 (СН 2 , СН 3 ), 1418 (NH 4 +), 1387,6 (CH), 1362 (CH), 1260 (CH), 1212 (CH), 1165 (С-О-С, С-ОН), 1040,6 (С-О-С, СОН), 981 (=CH), 919 (CH).
ИК-спектр Glu (KBr, ν, cм-1): 3011 (NH 4 +), 2741 (OH, NH, CH), 1699 (COOH не ионизованная), 1636 (аминокислотная полоса I -NH 3 +), 1559 (COO-), 1506 (аминокислотная полоса II — NH 3 +), 1419 (COO-), 1349,6 (CH), 1310 (CH), 1256 (CH), 1232 (CH), 1212 (CH), 1149 (C-OH), 1126(NH 4 +), 1073 (CCN, NH 4 +), 1051 (C-OH), 945 (CC), 911 (CC).
ИК-спектры GC+Glu+AgNO 3 (KBr, ν, cм-1) : 3428 (ОН, NН), 3236 (OH, NH), 3083 (OH, NH), 2926 (CH), 2856 (CH), 2360 (CH), 2342 (CH), 2077 (CH), 1722 (C=O), 1632 (аминокислотная полоса I — NH 4 +), 1619 (COO-), 1513 (аминокислотная полоса II - NH 3 +), 1384 (CH), 1355 (CH), 1260 (CH), 1229 (CH), 1214 (CH), 1174 (CH), 1155 (CH), 1126 (CH), 1080 (С-О-С, С-OH), 1041 (С-О-С, С-OH), 982 (=CH), 946 (CC), 880 (COO-).
Из анализа спектров исходных GC, Glu и их гидрогели можно видеть, что в гидрогеле имеют место смещения аминокислотных полос I и II L-глутаминовой кислоты, 1636 → 1632 см-1 и 1506 → 1513 см-1, соответственно. Смещение полосы поглощения 3011 см-1, которая характеризует (NH 3 +) в область низких частот 3428 см-1, свидетельствует о разрушении цвиттер ионной формы в аминокислоте и об участии этой группы в образовании водородных связей, в которых принимают участие функциональные группы молекулы GC.
Следует отметить, что рассматриваемые гидрогели GC и серебряных растворов аминокислот интересны не только с точки зрения изучения процессов самосборки и гелеобразования в разбавленных растворах, но и в практическом отношении. Так, в [14, 16] проведены тесты на микробиологическую активность GC в концентрации 10-3 М и его разведенных образцов (1:10, 1:20, 1:50, 1:100), а также гелей GC : ЦСР, GC : GCР при тех же разведениях, по отношению к тест-культурам патогенных и условно-патогенных микроорганизмов. Образцы глицирама при разведении не обнаружили чувствительность к изученным микроорганизмам; гидрогели показали более высокую чувствительность к микроорганизмам при разведении 1:10, по сравнению с серебряными растворами аминокислот; при более высоких разведениях чувствительность была намного ниже. Высокую активность при разведении 1:10 гидрогели проявили по отношению к Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus. Механизм действия гидрогелей подобного типа была объяснена в [1].
Выводы
Таким образом, были получены гидрогели глицирама при его концентрации, равной 10-3 М при смешении его с серебряными растворами аминокислот — L-цистеина (ЦСР) и L-глутаминовой кислоты (GCP) в таких же низких концентрациях. Методом изомолярных серий были установлены соотношения между GC c ЦСР и GCP, при которых образуются наиболее прочные гели, и которые проявили большую биологическую активность по отношению к микроорганизмам, по сравнению с GC. Из ИК-спектров можно сделать вывод, что при образовании гидрогелей наибольшие изменения при взаимодействии с глицирамом претерпевают цвиттер-ионная форма аминокислот. Следует отметить, что гидрогели с глицирамом образуют серебряные растворы тех аминокислот, которые способны при соотношении аминокислота: нитрат серебра 1,25 давать структуры каркасного строения.
Список литературы Гелеобразование в низкоконцентрированных растворах глицирама и аминокислот в присутствии нитрата серебра
- Баранова О. А. Физико химические аспекты самоорганизации супрамолекулярной системы на основе водного раствора L цистеина и нитрата серебра: автореф. … канд. хим. наук: Тверь, 2013. 22 с.
- Пахомов П. М., Хижняк С. Д., Овчинников М. М., Комаров П. В. Супрамолекулярные гели. Тверь. 2011. 269 с.
- Пахомов П. М., Овчинников М. М., Хижняк С. Д., Рощина О. А., Комаров П. В. Супрамолекулярный гидрогель медицинского назначения на основе L цистеина и ионов серебра // Высокомолекулярные соединения. Серия А. 2011. Т. 53. №9. С. 1574 1581.
- Овчинников М. М., Червинец В. М., Червинец Ю. В., Михайлова Е. С., Хижняк С. Д., Пахомов П. М. Новые катионные антисептики на основе композиций L цистеин серебряного раствора и хитозана // Вестник Тверского государственного университета. Серия: Химия. 2016. №1. С. 140 151.
- Draper E. R., Adams D. J. Low molecular weight gels: the state of the art // Chem. 2017. V. 3. №3. P. 390 410. https://doi.org/10.1016/j.chempr.2017.07.012
- Пахомов П. М., Овчинников М. М., Хижняк С. Д., Лавриенко М. В. Изучение процесса гелеобразования в водных растворах цистеина и нитрата серебра // Коллоидный журнал. 2004. Т. 66. №1. С. 73 79.
- Перевозова Т. В., Хижняк С. Д., Арутюнян Л. Р., Арутюнян Р. С., Овчинников М. М., Пахомов П. М. Гелеобразование в водном растворе L цистеина и нитрита серебра // Вестник Тверского государственного университета. Серия: Химия. 2016. №2. С. 135 143.
- Адамян А. Н., Аверкин Д. В., Мехтиев А. Р., Хижняк С. Д., Пахомов П. М. Процессы самоорганизации в водном растворе L цистеина и ацетата серебра под воздействием сульфата натрия // Вестник Тверского государственного университета. Серия: Химия. 2018. №2. С. 64 77.
- Алексеева Е. П. Процесс гелеобразования в оксациллин серебряном гидрогеле // Вестник Тверского государственного университета. Серия: Химия. 2012. №14. С. 180 189.
- Снесарев С. В., Кулапина Е. Г. Комплексообразование серебра (i) с ампициллином, оксациллином, цефазолином и цефотаксимом в водных растворах // Известия Саратовского университета. Новая серия. Серия Химия. Биология. Экология. 2012. Т. 12. №1. С. 17 21.
- Спиридонова В. М., Савельева В. С., Червинец В. М., Червинец Л. Ф., Пахомов П. М. Микробиологическая активность низкоконцентрированных растворов и гидрогелей на основе L цистеина и нитрата серебра // Физико химия полимеров: синтез, свойства и применение. 2009. №15. С. 99 103.
- Воскресенская А. А., Медведева Н. В., Прозоровский В. Н., Москалева Н. Е., Ипатова О. М. Особенности всасывания глицирризиновой кислоты в составе лекарственного препарата" фосфоглив" // Биомедицинская химия. 2012. Т. 58. №5. С. 564 572.
- Матаипова А. К., Джуманазарова А. З. Изучение разбавленных растворов аминокислот и нитрата серебра методом динамического светорассеяния // Scientific research in the Kyrgyz Republic. 2021. №1. P. 38 46.
- Матаипова А. К., Джуманазарова А. З., Маметова А. С., Сариева Ж. К. Механизм формирования и микробиологическая активность супрамолекулярного гидрогеля на основе низкоконцентрированного глицирама и цистеин серебряного раствора // Наука, новые технологии и инновации Кыргызстана. 2019. №9. С. 25 29.
- Pakhomov P. M., Ovchinnikov M. M., Khizhnyak S. D., Roshchina O. A., Komarov P. V. A supramolecular medical hydrogel based on L cysteine and silver ions // Polymer Science Series A. 2011. V. 53. №9. P. 820 826. https://doi.org/10.1134/S0965545X11090094
- Матаипова А. К., Джуманазарова А. З., Маметова А. С., Сариева Ж. К. Структурные особенности и микробиологическая активность гидрогеля на основе низкоконцентрированного глицирама и глутамат серебряного раствора // Наука, новые технологии и инновации Кыргызстана. 2019. №12. С. 118 122.
- Romanko T. V., Murinov Y. I. Some features of a flow of dilute solutions of glycyrrhizic acid // Russian Journal of Physical Chemistry A. 2001. V. 75. №9. P. 1459 1462.
- Душкин А. В., Метелева Е. С., Чистяченко Ю. С., Халиков С. С. Механохимическое получение и свойства твердых дисперсий, образующих водорастворимые супрамолекулярные системы // Фундаментальные исследования. Фармацевтические науки. 2013. №1. С. 741 749.
- Леглер Е. В. Исследование комплексообразования серебра (I) с трифункциональными аминокислотами: дисс. … канд. хим. наук. Красноярск, 2001. 173 с.


