Гематологические нежелательные лекарственные реакции при использовании ингибиторов фактора роста эндотелия сосудов и цитостатических препаратов в лечении глиобластомы: систематический обзор
Автор: Степанов Иван Андреевич, Шамеева Мария Анатольевна, Кручинин Денис Борисович, Бывальцев Вадим Анатольевич, Шагдурова Инесса Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 5 т.19, 2020 года.
Бесплатный доступ
Эффективность использования ингибиторов фактора роста эндотелия сосудов (Vascular Endothelial Gowth Factor, VEGF) в терапии глиобластомы за счет достоверного увеличения показателя выживаемости без прогрессирования наглядно продемонстрирована в ряде исследований. Применение анти-VEGF агентов ассоциировано с развитием ряда нежелательных лекарственных реакций (НЛР), среди которых наибольшую распространенность имеют гематологические. Цель исследования -выполнить систематический обзор, основанный на результатах рандомизированных контролируемых клинических исследований, которые изучают виды и частоту встречаемости гематологических НЛР при использовании анти-VEGF и химиотерапевтических агентов в терапии глиобластомы. Материал и методы. Выполнен поиск рандомизированных контролируемых клинических исследований в базах данных Pubmed, EMBASE, Cohrane Library и eLibrary, опубликованных в период с января 2008 г. по август 2019 г., касающихся безопасности применения анти-VEGF лекарственных средств в качестве основного/вспомогательного способа лечения пациентов с глиобластомой. Сформированы основные критерии соответствия включения исследований в настоящий систематический обзор. Результаты. В объединенный анализ данных включены 13 рандомизированных контролируемых клинических исследований. Средняя частота гематологических НЛР при использовании анти-VEGF агентов в качестве монотерапии глиобластомы составила 27,7 %, основными видами НЛР являлись нейтропения и тромбоцитопения. Средняя частота гематологических НЛР при применении цитотостатиков равнялась 48,1 %, при этом чаще всего наблюдались лимфопения и тромбоцитопения. Средняя частота гематологических НЛР при комбинированном использовании анти-VEGF и химиотерапевтических препаратов составила 46,2 %, в основном возникали тромбоцитопения, нейтропения и анемия. При сочетанном применении анти-VEGF, химиотерапевтических препаратов и лучевой терапии гематологических НЛР в среднем возникали в 12,3 % случаев, чаще всего наблюдалась тромбоцитопения тяжелой степени. Заключение. Применение анти-VEGF препаратов в виде монотерапии глиобластомы ассоциировано с меньшей частотой гематологических НЛР При этом наиболее безопасным анти-VEGF агентом является бевацизумаб. Наибольшая частота гематологических НЛР характерна для комбинации анти-VEGF и цитостатических препаратов, таких как цедираниб с ломустином и бевацизумаб с карбоплатином.
Глиобластома, антиангиогенная терапия, цитостатические препараты, нежелательные лекарственные реакции, гематологическая токсичность
Короткий адрес: https://sciup.org/140254374
IDR: 140254374 | УДК: 616-006.484-08-06:616.15 | DOI: 10.21294/1814-4861-2020-19-5-121-130
Текст обзорной статьи Гематологические нежелательные лекарственные реакции при использовании ингибиторов фактора роста эндотелия сосудов и цитостатических препаратов в лечении глиобластомы: систематический обзор
Глиобластома является наиболее распространенной первичной злокачественной опухолью головного мозга, имеющей неблагоприятный прогноз [1, 2]. При данной патологии показатели 2-летней выживаемости составляют менее 30 %, 5-летней выживаемости – менее 10 % [3]. Стандартный про- токол лечения впервые выявленной глиобластомы включает в себя микронейрохирургическую резекцию опухоли с последующим курсом лучевой терапии и химиотерапии темозоломидом [4]. Несмотря на совершенствование данных методов лечения, глиобластома неизбежно рецидивирует, а медиана общей выживаемости не превышает 15 мес [5].
Низкая эффективность цитостатических препаратов в лечении глиобластомы привела к разработке и внедрению в клиническую практику новой группы лекарственных средств – антиангиогенных таргетных препаратов [6]. Ряд исследований доказывают, что глиобластома представляет собой опухолевую ткань с развитой микроваскулярной сетью, которая участвует в росте и прогрессировании новообразования [7–9]. Ускоренное развитие микроваскулярной сети в глиобластоме происходит благодаря синтезу опухолевыми клетками большого количества фактора роста эндотелия сосудов (Vascular Endothelial Gowth Factor, VEGF) [10]. По этой причине разработка анти-VEGF агентов представляется одним из наиболее перспективных способов таргетного лечения глиобластомы за счет ингибирования процессов неоваскулогенеза и опосредованного снижения поступления питательных веществ в опухолевую ткань [11, 12].
Действие антиангиогенных препаратов направлено на различные механизмы формирования микрососудистой сети (рис. 1), что взято за основу их фармакологической классификации на прямые, непрямые и смешанные ингибиторы неоваску-логенеза [11]. Широкое применение в терапии глиобластомы получили следующие анти-VEGF агенты: бевацизумаб (химерное человеческое рекомбинантное антитело к рецепторам VEGF), ранибизумаб (моноклональное гуманизированное антитело к рецептору VEGF-A), афлиберцепт (рекомбинантное антитело к рецепторам VEGF-A, VEGF-В и плацентарному фактору роста (Placental Growth Factor, PLGF)), цедираниб (ингибитор тиро-зинкиназ рецептора VEGF2, рецепторов α и β тромбоцитарного фактора роста (Platelet-derived Growth Factor PDGF), рецепторов фактора роста стволовых клеток (Stem Cell Factor, SCF)) и циленгитид (высокоселективный ингибитор трансмембранного клеточного рецептора интегрина) [11, 12].
Эффективность использования анти-VEGF препаратов в терапии глиобластомы в виде достоверного увеличения выживаемости без прогрессирования наглядно продемонстрирована в ряде рандомизированных контролируемых клинических исследований, а также подтверждена в некоторых систематических обзорах и метаанализах [13–16]. Необходимо отметить, что применение анти-VEGF агентов ассоциировано с развитием ряда нежелательных лекарственных реакций (НЛР), среди которых наибольшую распространенность имеют гематологические реакции [17]. Поиск литературных источников в отечественных и зарубежных базах данных продемонстрировал отсутствие исследований, посвященных изучению видов и частоты гематологических НЛР при использовании анти-VEGF и цитостатических препаратов в терапии глиобластомы.
Цель исследования – выполнить систематический обзор, основанный на результатах рандомизированных контролируемых клинических исследований, которые изучают виды и частоту гематологических НЛР при использовании анти-VEGF и химиотерапевтических агентов в терапии глиобластомы.
Материал и методы
Выполнен поиск рандомизированных контролируемых клинических исследований в базах данных Pubmed, EMBASE, Cohrane Library и eLibrary, опубликованных в период с января 2008 г. по август 2019 г., касающихся безопасности применения анти-VEGF препаратов при лечении
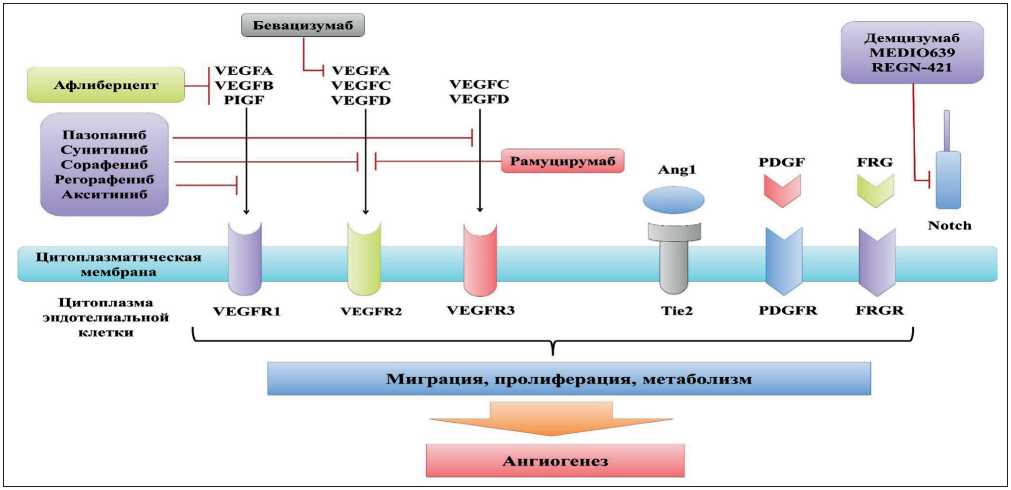
Рис. 1. Фармакодинамические особенности различных анти-VEGF препаратов Fig. 1. Pharmacodynamic features of various anti-VEGF drugs
больных глиобластомой. Анализ литературных источников осуществлен 3 исследователями. При возникновении разногласий относительно включения литературного источника в систематический обзор решение принималось коллегиально при участии всего авторского коллектива.
На первом этапе проводился поиск литературных источников с использованием ключевых слов «randomized controlled trial», «controlled clinical trial», «glioblastoma», «glioma», «anti-vascular endothelial growth factor», «anti-VEGF», «bevacizumab», «ranibizumab», «onartuzumab», «dazatinib», «aflibercept», «cilengitide», «cediranib», «adverse drug reactions», «hematotoxity» для англоязычных систем, «рандомизированное контролируемое исследование», «глиобластома», «глиома», «анти-фактор роста эндотелия сосудов», «анти-VEGF», «бевацизумаб», «ранибизумаб», «онартузумаб», «дазатиниб», «афлиберцепт», «циленгитид» и «цедираниб», «нежелательные лекарственные реакции», «гематотоксичность» – для системы eLibrary и ручной отбор статей по названиям на соответствие критериям исследования. На 2-м этапе просматривали аннотации статей и исключали публикации, не соответствующие критериям исследования. На 3-м этапе просматривали полный текст отобранных статей на соответствие критериям включения и список литературы на наличие релевантных исследований (рис. 2).
При планирования исследования определены следующие критерии соответствия литературных источников: включенные исследования – изучающие эффективность и безопасность применения анти-VEGF препаратов при лечении пациентов с глиобластомой; участники исследования – пациенты с впервые выявленной и рецидивной глиобластомой; применяемые анти-VEGF препараты – прямые анти-VEGF и непрямые анти-VEGF агенты; изучаемые НЛР – гематологические НЛР различной тяжести; дизайн исследований – рандомизированные контролируемые клинические исследования II–III фазы.
Исследование выполнено в соответствии с международными рекомендациями по написанию систематических обзоров и метаанализов PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) [18]. Исследователями изучены виды и частота встречаемости гематологических
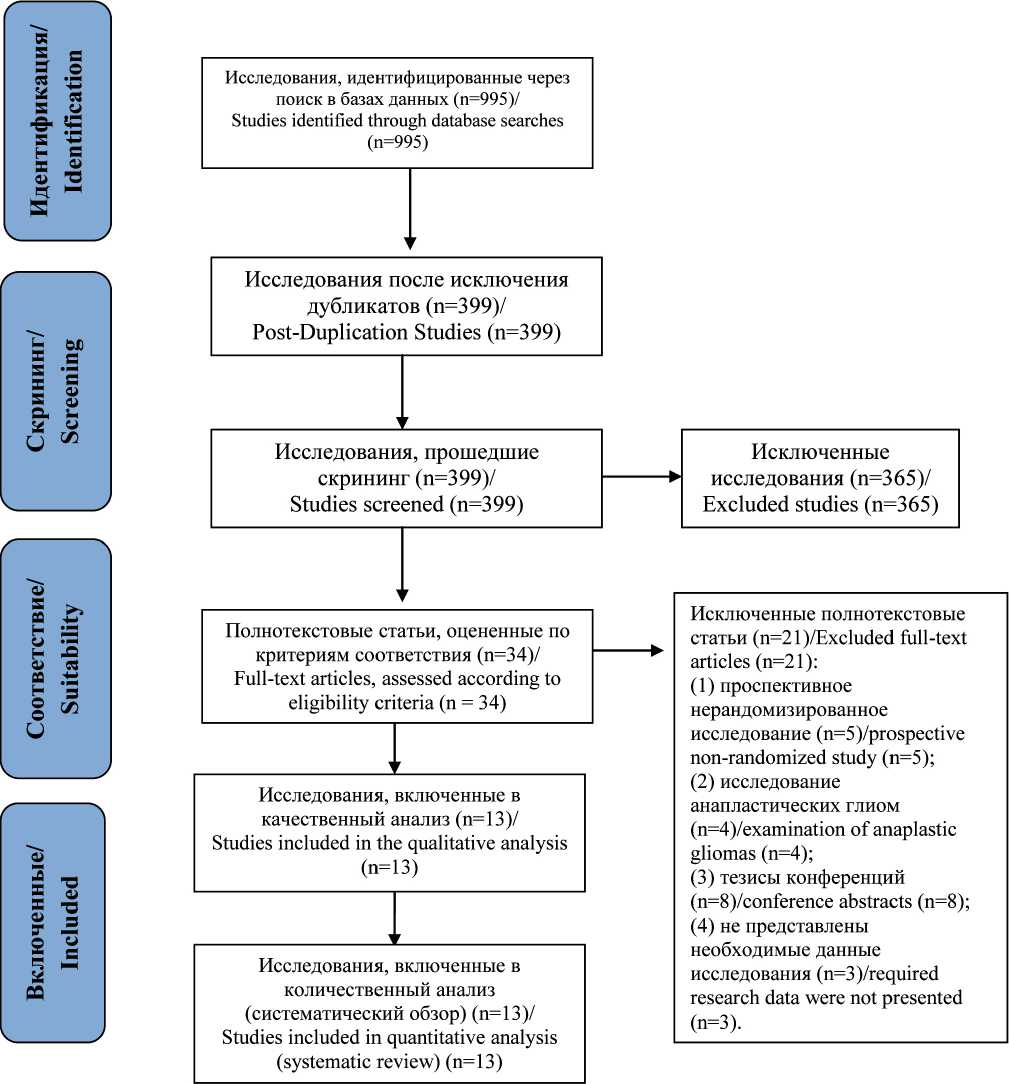
Рис. 2. Стратегия поиска и отбора литературных данных для включения в систематический обзор Fig. 2. Strategy for searching and selecting literature data for inclusion in a systematic review
Таблица/table
Общая характеристика исследований, включенных в систематический обзор general characteristics of the studies included in the systematic review
|
Дизайн Авторы/ исследования/ Authors Study design |
Лечение/ Частота гематологических НЛР/ Treatment Frequency of hematotoxic ADR |
|
РКИ, II фаза, паци-H. Fried- енты с рецидивом man et al., ГБМ (n=167)/ 2009 [26] RCT, phase II, Patients with recurrent GBM (n=167) |
Исследуемая группа (n=82): бевацизумаб (10 мг/ Исследуемая группа: 3,57 % (лимфопения, кг) + иринотекан (125 мг/м2 или 340 мг/м2). Кон- лейкопения, нейтропения). Контрольная группа: трольная группа (n=85): бевацизумаб (10 мг/кг)/ 22,7 % (лимфопения, нейтропения)/ Study group (n=82): bevacizumab (10 mg/kg) + Study group: 3.57 % (lymphopenia, leukopenia, irinotecan (125 mg/m2 or 340 mg/m2). Control group neutropenia). Control group: 22.7 % (lymphopenia, (n=85): bevacizumab (10 mg/kg) neutropenia) Исследуемая группа (n=241): (1) ежедневный пе- Исследуемая группа: (1) 5,4 % (лимфопения, |
|
РКИ, III фаза, пациенты с рецидивом T. Batch- ГБМ (n=325)/ elor et al., 2013 [13] RCT, phase III, Patients with recurrent GBM (n=325) |
роральный прием цедираниба (30 мг) (n=131); (2) лейкопения, нейтропения, анемия), (2) 94,3 % ежедневный пероральный прием цедираниба (30 (лимфопения, лейкопения, нейтропения, ане-мг) + ломустин (110 мг/м2) (n=129). Контрольная мия). Контрольная группа: 40,6 % (лимфопения, группа (n=84): ломустин (110 мг/м2) (n=84)/ лейкопения, нейтропения)/ Study group (n=241): (1) daily oral intake of Study group: (1) 5.4% (lymphopenia, leukopenia, cediranib (30 mg) (n=131); (2) daily oral cediranib neutropenia, anemia), (2) 94.3% (lymphopenia, (30 mg) + lomustine (110 mg/m2) (n=129). Control leukopenia, neutropenia, anemia). Control group: group (n=84): lomustine (110 mg/m2) (n=84) 40.6% (lymphopenia, leukopenia, neutropenia) |
|
РКИ, III фаза, пациенты с супра-O. Chinot тенториальной et al., 2014 локализацией ГБМ [20] (n=921)/ RCT, phase III Patients with supratentorial GBM localization (n=921) |
Исследуемая группа (n=458): темозоломид Исследуемая группа: 14,9 % (тромбоцитопе-+ радиотерапия + бевацизумаб. Контрольная ния). группа (n=463): темозоломид + радиотерапия + Контрольная группа: 9,7 % (тромбоцитопе-плацебо/ ния)/ Study group (n=458): temozolomide + radiotherapy Study group: 14.9% (thrombocytopenia). Control + bevacizumab. Control group (n=463): temozolo- group: 9.7 % (thrombocytopenia) mide + radiotherapy + placebo |
|
РКИ, III фаза, пациенты с впервые M. Gilbert диагностированной et al., 2014 ГБМ (n=629)/ [15] RCT, phase III Patients with recurrent GBM (n=629) |
Исследуемая группа (n=312): химиолучевая Исследуемая группа: 33,9 % (лимфопения, терапия + бевацизумаб (10 мг/кг) каждые 2 нед. нейтропения, тромбоцитопения, анемия). Кон-Контрольная группа (n=317): химиолучевая трольная группа: 59,6 % (лимфопения, нейтро-терапия/ пения, тромбоцитопения, анемия)/ Study group (n=312): chemoradiotherapy + beva- Study group: 33.9 % (lymphopenia, neutropenia, cizumab (10 mg/kg) every 2 weeks. Control group thrombocytopenia, anemia). Control group: 59.6 % (n=317): chemoradiotherapy (lymphopenia, neutropenia, thrombocytopenia, anemia) |
|
РКИ, II фаза, пациенты с рецидивом W. Taal et al., 2014 ГБМ (n=153)/ [21] RCT, phase II, Pa tients with recurrent GBM (n=153) |
Исследуемая группа (n=106): (1) бевацизумаб Исследуемая группа: (1) 100 % (тромбоцитопе-(n=51); (2) бевацизумаб + ломустин (n=55). Кон- ния, лейкопения), (2) 75 % (тромбоцитопения, трольная группа (n=47): ломустин/ лейкопения). Контрольная группа: 100 % (тром- Study group (n=106): (1) bevacizumab (n=51); (2) боцитопения, лейкопения)/ bevacizumab + lomustine (n=55). Control group Study group: (1) 100 % (thrombocytopenia, (n=47): lomustine leukopenia), (2) 75 % (thrombocytopenia, leuko penia). Control group: 100 % (thrombocytopenia, leukopenia) Исследуемая группа (n=176): (1) стандартная Исследуемая группа: (1) 30,3 % (лимфопения, |
|
РКИ, II фаза, пациенты с супра-L. Nabors тенториальной et al., 2015 локализацией ГБМ [14] (n=265)/ RCT, phase II, Patients with supratentorial GBM localization (n=265) |
терапия циленгитидом (n=88); (2) интенсивная те- нейтропения, тромбоцитопения, анемия), рапия циленгитидом (n=88). Контрольная группа (2) 38,2 % (лимфопения, нейтропения, тромбо- (n=89): химиолучевая терапия/ цитопения, анемия). Контрольная группа: Study group (n=176): (1) standard therapy with cilen- 32,9 % (лимфопения, нейтропения, тромбоци-gitide (n=88); (2) intensive therapy with cilengitide топения, анемия)/ (n=88). Control group (n=89): chemoradiotherapy Study group: (1) 30.3 % (lymphopenia, neutropenia, thrombocytopenia, anemia), (2) 38.2 % (lymphopenia, neutropenia, thrombocytopenia, anemia). Control group: 32.9 % (lymphopenia, neutropenia, thrombocytopenia, anemia) |
Окончание таблицы/end of table
N. Laack et al., 2015 [23]
РКИ, II фаза, пациенты с впервые диагностированной ГБМ (n=196)/ RCT, phase II, Newly diagnosed GBM patients (n=196)
Исследуемая группа (n=133): дазатиниб + темозоломид + радиотерапия. Контрольная группа (n=63): темозоломид + радиотерапия/
Study group (n=133): dasatinib + temozolomide + radiotherapy. Control group (n=63): temozolomide + radiotherapy
Исследуемая группа: 43,6 % (лимфопения, нейтропения, тромбоцитопения). Контрольная группа: 68,2 % (лимфопения, нейтропения, тромбоцитопения, анемия)/
Study group: 43.6 % (lymphopenia, neutropenia, thrombocytopenia). Control group: 68.2 % (lymphopenia, neutropenia, thrombocytopenia, anemia
K. Field et al., 2015 [27]
РКИ, II фаза, пациенты с впервые диагностированной ГБМ (n=122)/ RCT, phase II, Newly diagnosed GBM patients (n=122)
Исследуемая группа (n=60): бевацизумаб (10 мг/кг) + карбоплатин каждые 4 нед. Контрольная группа (n=62): бевацизумаб (10 мг/кг) каждые 2 нед/
Study group (n=60): bevacizumab (10 mg/kg) + carboplatin every 4 weeks. Control group (n=62): bevacizumab (10 mg / kg) every 2 weeks
Исследуемая группа: 89,6 % (анемия, нейтропения, тромбоцитопения). Контрольная группа: 22,7 % (анемия, нейтропения, тромбоцитопения)/
Study group: 89.6 % (anemia, neutropenia, thrombocytopenia). Control group: 22.7 % (anemia, neutropenia, thrombocytopenia)
J. Duerinck et al., 2016 [25]
РКИ, II фаза, пациенты с впервые диагностированной ГБМ (n=44)/ RCT, phase II, Newly diagnosed GBM patients (n=44)
Исследуемая группа (n=22): ежедневный прием акситиниба (10 мг). Контрольная группа (n=22): (1) 20 пациентов – бевацизумаб (10 мг/кг) каждые 2 нед; (2) 2 пациента – ломустин (110 мг/м2) каждые 6 нед /
Study group (n=22): daily axitinib (10 mg). Control group (n=22): (1) 20 of 22 patients took bevacizumab (10 mg/kg) every two weeks; (2) 2 of 22 patients took lomustine (110 mg/m2) every 6 weeks
Исследуемая группа: 0 %. Контрольная группа: (1) 0 %, (2) 0 %/
Study group: 0 %. Control group: (1) 0 %, (2) 0 %
C. Balana et al., 2016 [19]
РКИ, II фаза, пациенты с нерезе-цированной ГБМ (n=93)/
RCT, phase II, Patients with unresected GBM (n=93)
|
U. Her-rlinger et al., 2016 [22] |
РКИ, II фаза, пациенты с впервые диагностированной ГБМ (n=170)/ RCT, phase II, Newly diagnosed GBM patients (n=170) |
|
T. Clou- |
РКИ, II фаза, пациенты с рецидивом ГБМ (n=129)/ |
|
ghesy et al., |
RCT, phase II, Pa- |
|
2017 [28] |
tients with recurrent |
|
GBM (n=129) |
Исследуемая группа (n=48): темозоломид + бева-цизумаб (10 мг/кг), в 1-е и 15-е сут каждого цикла неоадъювантной терапии и в 1-е, 15-е и 30-е сут консолидирующей терапии. Контрольная группа (n=45): неоадъювантная терапия темозоломидом (85 мг/м2)/
Study group (n=48): temozolomide + bevacizumab (10 mg/kg) added on the 1st and 15th days of each neoadjuvant therapy cycle and on the 1st, 15th and 30th days of concomitant therapy. Control group (n=45): neoadjuvant therapy with temozolomide (85 mg/m2)
Исследуемая группа (n=116): бевацизумаб + иринотекан + радиотерапия. Контрольная группа (n=54): темозоломид + радиотерапия/
Study group (n=116): bevacizumab + irinotecan + radiotherapy. Control group (n=54): temozolomide + radiotherapy
Исследуемая группа: 14,5 % (лимфопения, нейтропения, тромбоцитопения, анемия). Контрольная группа: 31,1 % (лимфопения, нейтропения, тромбоцитопения, анемия, медуллярная аплазия)
Study group: 14.5 % (lymphopenia, neutropenia, thrombocytopenia, anemia). Control group: 31.1 % (lymphopenia, neutropenia, thrombocytopenia, anemia, medullary aplasia)
W. Wick et al., 2017 [24]
РКИ, III фаза, пациенты с рецидивом ГБМ (n=437)/ RCT, phase II, Patients with recurrent GBM (n=437)
Исследуемая группа (n=64): онартузумаб (15 мг/кг) + бевацизумаб (15 мг/кг). Контрольная группа (n=65): 3-недельный цикла плацебо + бевацизумаб в 1-е сут/
Study group (n=64): onartuzumab (15 mg/kg) + bevacizumab (15 mg/kg). Control group (n=65): placebo + bevacizumab for a 3-week cycle (for every 1st day of the cycle)
Исследуемая группа (n=288): бевацизумаб (10 мг/кг) + ломустин (90 мг/м2). Контрольная группа (n=149): ломустин (110 мг/м2)/
Study group (n=288): bevacizumab (10 mg / kg) + lomustine (90 mg/m2). Control group (n=149): lomustine (110 mg/m2)
Исследуемая группа: 12,6 % (данные о видах НЛР не представлены). Контрольная группа: 60 % (данные о видах НЛР не представлены)/ Study group: 12.6 % (data on the types of hema-totoxic ADR are not presented). Control group: 60 % (data on the types of hematotoxic ADR not shown)
Исследуемая группа: 0 %. Контрольная группа: 0 %/
Study group: 0 %. Control group: 0 %
Исследуемая группа: 53,7 % (данные о видах НЛР не представлены). Контрольная группа: 49,6 % (данные о видах НЛР не представлены)/
Study group: 53.7 % (data on types of ADR not presented).
Control group: 49.6 % (data on the types of ADR not presented)
Примечание: ГБМ – глиобластома, РКИ – рандомизированное контролируемое исследование, НЛР – нежелательные лекарственные реакции.
Note: GBM – glioblastoma multiforme, RCT – randomized controlled trial, ADR – adverse drug reactions.
НЛР при изолированном использовании анти-VEGF и цитостатических агентов при использовании комбинации анти-VEGF и цитостатиков, а также при использовании комбинации анти-VEGF и цитостатических препаратов с лучевой терапией. Необходимо отметить, что в настоящем систематическом обзоре не учитывались степени тяжести гематологических НЛР.
Согласно критериям соответствия в настоящий систематический обзор включены 13 рандомизированных контролируемых клинических исследований (таблица), посвященных гематологическим НЛР при использовании анти-VEGF и цитостатических препаратов у 4253 пациентов с впервые выявленной или рецидивом глиобластомы [13–15, 19–28]. При анализе указанных литературных источников установлено, что средняя частота гематологических НЛР при использовании анти-VEGF агентов в качестве монотерапии глиобластомы составила 27,7 %. Необходимо отметить, что наибольшее количество гематологических НЛР наблюдалось при использовании дазатиниба (43,6 %) и циленгитида (34,2 %), основными видами НЛР были нейтропения и тромбоцитопения. Средняя частота гематологических НЛР при моно-терапевтическом применении цитостатических препаратов составила 48,1 %. Наиболее часто указанные НЛР встречались при использовании темозоломида (45,5 %) и ломустина (49,8 %), в основном в виде лимфопении и тромбоцитопении. Средняя частота гематологических НЛР при комбинированном использовании анти-VEGF и химиотерапевтических препаратов равнялась 46,2 %, чаще всего они наблюдались при использовании цедираниба с ломустином (94,6 %) и бевацизумаба с карбоплатином (89,6 %) в виде тромбоцитопении, нейтропении и анемии. Анализ результатов рандомизированных контролируемых клинических исследований показал, что при сочетанном применении анти-VEGF агентов, химиопрепаратов и лучевой терапии частота гематологических НЛР в среднем составляет 12,3 %. Наиболее частой НЛР являлась тромбоцитопения тяжелой степени при использовании комбинации бевацизумаба, темозоломида и лучевой терапии – 14,9 %.
Анти-VEGF препараты, в особенности в сочетании с цитостатиками, прочно вошли в клиническую практику нейроонкологов [29]. Наиболее часто применяемыми анти-VEGF агентами в терапии глиобластомы являются бевацизумаб, дазатиниб, онартузумаб и цедираниб. Среди цитостатических препаратов, используемых в комбинации с анти-VEGF агентами, чаще всего назначаются темозоломид, ломустин, карбоплатин и иринотекан. Несмотря на клиническую эффективность, применение этого метода лечения ассоциировано с возникновением НЛР, из которых наиболее грозными являются гематологические реакции [30].
Гематотоксичность анти-VEGF агентов связана с ингибированием активности тирозинкиназы и торможением активности ряда внутриклеточных сигнальных путей. Анти-VEGF препараты подавляют работу KIT-внутриклеточной сигнальной системы путем ингибирования рецепторов данного сигнального пути на поверхности гемопоэтических клеток-предшественников [17]. Доказано, что анти-VEGF агенты препятствуют фосфорилированию рецепторов KIT-сигнальной системы и тем самым тормозят пролиферацию клеток [31]. Другим механизмом гематотоксичности анти-VEGF агентов является участие VEGF и его рецепторов в процессе гемопоэза. Показано, что рецепторы VEGF (VEGFR1 и VEGFR2) ответственны за пролиферацию стволовых клеток крови [32]. Более того, рецепторы VEGF участвуют в пролиферации клеток-предшественников миелоцито- и лимфоцитопоэза [33]. Ингибирование FLT-3 в стволовых клетках крови и нарушение работы внутриклеточных сигнальных путей, активируемых рецепторами PDGF (PDGFR), выступает одним из основных патофизиологических механизмов миелотоксических НЛР при использовании анти-VEGF препаратов [34]. Возможной причиной тромбоцитопении как НЛР при терапии анти-VEGF препаратами может являться артериальная гипертензия [35], не исключается и аутоиммунный механизм развития лекарственно индуцированной тромбоцитопении [36].
Гематотоксичность цитостатических препаратов связана с их фармакологическими свойствами. Так, темозоломид относится к производным тетразина и обладает алкилирующим действием. В системном кровотоке при референсных значениях pH препарат подвергается химическому превращению в монометилтриазеноимидазолкарбоксамид, действие которого связано с алкилированием гуанина в положении О6 и N7 c последующим запуском механизма аберрантного восстановления метилового остатка. Следствием данного взаимодействия является нарушение структуры и синтеза ДНК, а также торможение клеточного цикла [37]. Схожими фармакологическими свойствами обладают производные платины (карбоплатин, цисплатин) и нитрозомочевины (ломустин) [38, 39]. Механизм действия иринотекана, который относится к группе камптотецинов и участвует в ингибировании фермента топоизомеразы I, отличается от фармакодинамики алкилирующих агентов. Препарат связывается с биохимическим комплексом топоизомераза I-дезоксирибонуклеиновая кислота, что приводит к нарушению повторного сшивания нитей ДНК [40].
Гематологические НЛР при использовании анти-VEGF агентов в европейской популяции являются редкими осложнениями [41], напротив, в азиатской популяции миелотоксические НЛР тяжелой степени наблюдаются достаточно часто [42]. Гема- тологические НЛР легкой и средней степени, как правило, не требуют коррекции дозы анти-VEGF препаратов. При тяжелых миелотоксических НЛР необходимо временное прерывание антиангиоген-ной терапии (ААТ). Так, при использовании суни-тиниба коррекция дозы зависит от дня развития гематологических НЛР, при их возникновении на 28-е сут ААТ снижение дозы препарата не является строго обязательным, поскольку развивающиеся нейтро- и тромбоцитопения, как правило, кратковременны и регрессируют в течение 2 нед от момента прекращения антиангиогенной терапии. Начало следующего курса терапии возможно лишь при нормализации показателей периферической крови (ПК). При повторных гематологических НЛР лечение временно прекращается до снижения степени их тяжести. При многократно повторяющихся гематологических НЛР тяжелой степени рекомендуется снижение дозы анти-VEGF агентов до полного восстановления показателей ПК [43].
Настоящее исследование имеет ряд ограничений, которые необходимо обозначить. В настоящем систематическом обзоре не представлены данные
Список литературы Гематологические нежелательные лекарственные реакции при использовании ингибиторов фактора роста эндотелия сосудов и цитостатических препаратов в лечении глиобластомы: систематический обзор
- Porter K.R., McCarthy B.J., Freels S., Kim Y, Davis F.G. Prevalence estimates for primary brain tumors in the United States by age, gender, behavior, and histology. Neuro Oncol. 2010 Jun; 12(6): 520-7. doi: 10.1093/neuonc/nop066.
- Louis D.N., Perry A., Reifenberger G., von Deimling A., Figarella-Branger D., Cavenee W.K., Ohgaki H., Wiestler O.D., Kleihues P., Ellison D.W. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: a summary. Acta Neuropathol. 2016 Jun; 131(6): 803-20. doi: 10.1007/s00401-016-1545-1.
- TouatM., Idbaih A., Sanson M., Ligon K.L. Glioblastoma targeted therapy: updated approaches from recent biological insights. Ann Oncol. 2017 Jul 1; 28(7): 1457-1472. doi: 10.1093/annonc/mdx106.
- Kast R.E., Boockvar J A., BrüningA, CappelloF., Chang W. W., CvekB., Dou Q.P., Duenas-Gonzalez A., Efferth T., Focosi D., Ghaffari S.H., Karpel-Massler G., Ketola K., Khoshnevisan A., Keizman D., Magné N., Marosi C., McDonald K., Muñoz M., Paranjpe A., Pourgholami M.H., Sardi I., Sella A., Srivenugopal K.S., Tuccori M., Wang W., Wirtz C.R., Halatsch M.E. A conceptually new treatment approach for relapsed glio-blastoma: coordinated undermining of survival paths with nine repurposed drugs (CUSP9) by the International Initiative for Accelerated Improvement of Glioblastoma Care. Oncotarget. 2013 Apr; 4(4): 502-30. doi: 10.18632/ oncotarget.969.
- WinogradE.K., CiesielskiM.J., FenstermakerR.A. Novel vaccines for glioblastoma: clinical update and perspective. Immunotherapy. 2016 Nov; 8(11): 1293-1308. doi: 10.2217/imt-2016-0059.
- Wang N., Jain R.K., Batchelor T.T. New Directions in Anti-An-giogenic Therapy for Glioblastoma. Neurotherapeutics. 2017 Apr; 14(2): 321-332. doi: 10.1007/s13311-016-0510-y.
- Бывальцев В.А., Степанов И.А., Белых Е.Г., Яруллина А.И. Молекулярные аспекты ангиогенеза в глиобластомах головного мозга. Вопросы онкологии. 2017; 1: 19-27. [Byvaltsev V.A., Stepanov I.A., Belykh E.G., Yarullina A.I. Molecular aspects of angiogenesis in brain glioblastomas. Problems in Oncology. 2017; 1: 19-27. (in Russian)].
- Kim K.J., Li B., Winer J., Armanini M., Gillett N., Phillips H.S., Ferrara N. Inhibition of vascular endothelial growth factor-induced angiogenesis suppresses tumour growth in vivo. Nature. 1993 Apr 29; 362(6423): 841-4. doi: 10.1038/362841a0.
- Ricci-Vitiani L., Pallini R., Biffoni M., Todaro M., Invernici G., Cenci T., Maira G., Parati E.A., Stassi G., Larocca L.M., De Maria R. Tumour vascularization via endothelial differentiation of glioblastoma stem-like cells. Nature. 2010 Dec 9; 468(7325): 824-8. doi: 10.1038/ nature09557.
- Lee C.G., Heijn M., di Tomaso E., Griffon-Etienne G., Ancuki-ewiczM., Koike C., ParkK.R., Ferrara N., JainR.K., SuitH.D., Boucher Y. Anti-Vascular endothelial growth factor treatment augments tumor radiation response under normoxic or hypoxic conditions. Cancer Res. 2000 Oct 1; 60(19): 5565-70.
- Ghiaseddin A., Peters K.B. Use of bevacizumab in recurrent glioblastoma. CNS Oncol. 2015; 4(3): 157-69. doi: 10.2217/cns.15.8.
- Niyazi M., Harter P.N., Hattingen E., Rottler M., von Baumgar-tenL., Proescholdt M., Belka C., LauberK., MittelbronnM. Bevacizumab and radiotherapy for the treatment of glioblastoma: brothers in arms or unholy alliance? Oncotarget. 2016 Jan; 7(3): 2313-28. doi: 10.18632/ oncotarget.6320.
- Batchelor T.T., Mulholland P., NeynsB., NaborsL.B., CamponeM., Wick A., Mason W., Mikkelsen T., Phuphanich S., Ashby L.S., Degroot J., Gattamaneni R., Cher L., Rosenthal M., Payer F., Jürgensmeier J.M., Jain R.K., Sorensen A.G., Xu J., Liu Q., van den Bent M. Phase III randomized trial comparing the efficacy of cediranib as monotherapy, and in combination with lomustine, versus lomustine alone in patients with recurrent glioblastoma. J Clin Oncol. 2013 Sep 10; 31(26): 3212-8. doi: 10.1200/Jc0.2012.47.2464.
- Nabors L.B., FinkK.L., Mikkelsen T., Grujicic D., Tarnawski R., Nam D.H., MazurkiewiczM., SalaczM., Ashby L., Zagonel V., DepenniR., Perry J.R., Hicking C., PicardM., Hegi M.E., Lhermitte B., ReardonD.A. Two cilengitide regimens in combination with standard treatment for patients with newly diagnosed glioblastoma and unmethylated MGMT gene promoter: results of the open-label, controlled, randomized phase II CORE study. Neuro Oncol. 2015 May; 17(5): 708-17. doi: 10.1093/ neuonc/nou356.
- Gilbert M.R., Dignam J.J., Armstrong T.S., Wefel J.S., Blumenthal D.T., VogelbaumM.A., ColmanH., Chakravarti A., Pugh S., WonM., Jeraj R., Brown P.D., Jaeckle K.A., SchiffD., Stieber V.W., Brachman D.G., Werner-Wasik M., Tremont-Lukats I.W., Sulman E.P., Aldape K.D., Curran W.J.Jr., MehtaM.P. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014; 370(8): 699-708. doi: 10.1056/NEJMoa1308573.
- 16.Xiao Q., Yang S., Ding G., LuoM. Anti-vascular endothelial growth factor in glioblastoma: a systematic review and meta-analysis. Neurol Sci. 2018 Dec; 39(12): 2021-2031. doi: 10.1007/s10072-018-3568-y.
- Schmidinger M. Understanding and managing toxicities of vascular endothelial growth factor (VEGF) inhibitors. EJC Suppl. 2013; 11(2): 172-191. doi: 10.1016/j.ejcsup.2013.07.016.
- Liberati A., Altman D.G., Tetzlaff J., Mulrow C., G0tzsche P.C., Ioannidis J.P., Clarke M., Devereaux P.J., Kleijnen J., Moher D. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. J Clin Epidemiol. 2009 Oct; 62(10): e1-34. doi: 10.1016/j. jclinepi.2009.06.006.
- Balana C., De Las Penas R., Sepúlveda J.M., Gil-Gil M.J., Luque R., Gallego O., Carrato C., Sanz C., Reynes G., Herrero A., Ramirez J.L., Pérez-Segura P., Berrocal A., Vieitez J.M., Garcia A., Vazquez-Estevez S., Peralta S., Fernandez I., Henriquez I., Martinez-Garcia M., De la Cruz J.J., Capellades J., GinerP., Villa S. Bevacizumab and temozolomide versus temozolomide alone as neoadjuvant treatment in unresected glioblastoma: the GENOM 009 randomized phase II trial. J Neurooncol. 2016 May; 127(3): 569-79. doi: 10.1007/s11060-016-2065-5.
- Chinot O.L., Wick W, Mason W., Henriksson R., Saran F., Ni-shikawaR., CarpentierA.F, Hoang-XuanK., KavanP., CerneaD., Brandes A.A., HiltonM., AbreyL., Cloughesy T. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014 Feb 20; 370(8): 709-22. doi: 10.1056/NEJMoa1308345.
- Taal W., OosterkampH.M., WalenkampA.M., DubbinkH.J., Beer-epootL.V., HanseM.C., Buter J., Honkoop A.H., BoermanD., de VosF.Y., Dinjens W.N., Enting R.H., Taphoorn M.J., van den Berkmortel F.W., Jansen R.L., Brandsma D., Bromberg J.E., van Heuvel I., VernhoutR.M., van der Holt B., van den BentM.J. Single-agent bevacizumab or lomustine versus a combination of bevacizumab plus lomustine in patients with recurrent glioblastoma (BELOB trial): a randomised controlled phase 2 trial. Lancet Oncol. 2014 Aug; 15(9): 943-53. doi: 10.1016/S1470-2045(14)70314-6.
- Herrlinger U., Schäfer N., Steinbach J.P., Weyerbrock A., Hau P., Goldbrunner R., Friedrich F., Rohde V., Ringel F., Schlegel U., SabelM., RonellenfitschM. W., UhlM., Maciaczyk J., Grau S., Schnell O., HänelM., KrexD., Vajkoczy P., GerlachR., KortmannR.D., MehdornM., Tüttenberg J., Mayer-Steinacker R., Fietkau R., Brehmer S., Mack F., Stuplich M., Kebir S., Kohnen R., Dunkl E., Leutgeb B., Proescholdt M., Pietsch T., Urbach H., Belka C., Stummer W., Glas M. Bevacizumab Plus Irinotecan Versus Temozolomide in Newly Diagnosed O6-Methylguanine-DNA Methyltransferase Nonmethylated Glioblastoma: The Randomized GLARIUS Trial. J Clin Oncol. 2016 May 10; 34(14): 1611-9. doi: 10.1200/ JC0.2015.63.4691.
- LaackN.N., GalanisE., Anderson S.K., Leinweber C., Buckner J.C., Giannini C., Sarkaria J.N. Randomized, placebo-controlled, phase II study of dasatinib with standard chemo-radiotherapy for newly diagnosed glioblastoma (GBM), NCCTG N0877 (Alliance). J Clin Oncol. 2015; 33(15): 2013-20. doi: 10.1200/jco.2015.33.15_suppl.2013.
- Wick W., Gorlia T., BendszusM., TaphoornM., Sahm F., Harting I., Brandes A.A., Taal W., Domont J., Idbaih A., Campone M., Clement P.M., Stupp R., Fabbro M., Le Rhun E., Dubois F., Weller M., von Deimling A., Golfinopoulos V., Bromberg J.C., Platten M., Klein M., van den Bent M.J. Lomustine and Bevacizumab in Progressive Glioblastoma. N Engl J Med. 2017; 377(20): 1954-63. doi: 10.1056/NEJMoa1707358.
- Duerinck J., Du Four S., Vandervorst F., D 'HaeneN., LeMercierM., Michotte A., Van Binst A.M., Everaert H., Salmon I., Bouttens F., Ver-schaeve V., Neyns B. Randomized phase II study of axitinib versus physicians best alternative choice of therapy in patients with recurrent glioblastoma. J Neurooncol. 2016 May; 128(1): 147-155. doi: 10.1007/ s11060-016-2092-2.
- Friedman H.S., Prados M.D., Wen P.Y., Mikkelsen T., Schiff D., Abrey L.E., Yung W.K., PaleologosN., NicholasM.K., Jensen R., Vreden-burgh J., Huang J., Zheng M., Cloughesy T. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009 Oct 1; 27(28): 4733-40. doi: 10.1200/JCO.2008.19.8721.
- Field K.M., Simes J., Nowak A.K., CherL., WheelerH., HoveyE.J., Brown C.S., Barnes E.H., Sawkins K., Livingstone A., Freilich R., Phal P.M., Fitt G.; CABARET/COGNO investigators, RosenthalM.A. Randomized phase 2 study of carboplatin and bevacizumab in recurrent glioblas-toma. Neuro Oncol. 2015 Nov; 17(11): 1504-13. doi: 10.1093/neuonc/ nov104.
- Cloughesy T., Finocchiaro G., Belda-Iniesta C., Recht L., Brandes A.A., PinedaE., Mikkelsen T., Chinot O.L., Balana C., MacdonaldD.R., Westphal M., Hopkins K., Weller M., Bais C., Sandmann T., Bruey J.M., Koeppen H., Liu B., Verret W., Phan S.C., Shames D.S. Randomized, Double-Blind, Placebo-Controlled, Multicenter Phase II Study of Onartuzumab Plus Bevacizumab Versus Placebo Plus Bevacizumab in Patients With Recurrent Glioblastoma: Efficacy, Safety, and Hepatocyte Growth Factor and O6-Methylguanine-DNA Methyltransferase Biomarker Analyses. J Clin Oncol. 2017; 35(3): 343-51. doi: 10.1200/jc0.2015.64.7685.
- Meadows K.L., Hurwitz H.I. Anti-VEGF therapies in the clinic. Cold Spring Harb Perspect Med. 2012; 2(10): a006577. doi: 10.1101/ cshperspect.a006577.
- HoukB.E., Bello C.L., PolandB. Relationship between exposure to sunitinib and efficacy and tolerability endpoints in patients with cancer: results of a pharmacokinetic/pharmacodynamic meta-analysis. Cancer Chemother Pharmacol. 2010; 66: 357-371. doi: 10.1007/s00280-009-1170-y.
- Brandt J., Briddell R.A., Srour E.F., Leemhuis T.B., Hoffman R. Role of c-kit ligand in the expansion of human hematopoietic progenitor cells. Blood. 1992; 79: 634-641.
- Gerber H.P., Malik A.K., Solar G.P. VEGF regulates haematopoietic stem cell survival by an internal autocrine loop mechanism. Nature. 2002; 417: 954-958. doi: 10.1038/nature00821.
- GabrilovichD., Ishida T., Oyama T. Vascular endothelial growth factor inhibits the development of dendritic cells and dramatically affects the differentiation of multiple hematopoietic lineages in vivo. Blood. 1998; 92: 4150-4166.
- Mendel D.B., Laird A.D., Xin X. In vivo antitumor activity of SU11248, a novel tyrosine kinase inhibitor targeting vascular endothelial growth factor and platelet-derived growth factor receptors: determination of a pharmacokinetic/pharmacodynamic relationship. Clin Cancer Res. 2003; 9: 327-337.
- Kapiteijn E., Brand A., Kroep J., Gelderblom H. Sunitinib induced hypertension, thrombotic microangiopathy and reversible posterior leukencephalopathy syndrome. Ann Oncol. 2007; 18: 1745-1747. doi: 10.1093/annonc/mdm454.
- Trinkaus M., Trudeau M., Callum J. Drug-induced immune thrombocytopenic purpura secondary to sunitinib. Curr Oncol. 2008; 15(3): 152-154. doi:10.3747/co.v15i3.233.
- HartM.G., GarsideR., Rogers G., SteinK., GrantR. Temozolomide for high grade glioma. Cochrane Database Syst Rev. 2013; 2013(4): CD007415. doi: 10.1002/14651858.CD007415.pub2.
- Brandes A.A., Carpentier A.F, Kesari S., Sepulveda-Sanchez J.M., WheelerH.R., Chinot O., CherL., Steinbach J.P., CapperD., SpecenierP., Rodon J., Cleverly A., Smith C., Gueorguieva I., Miles C., Guba S.C., De-saiah D., LahnM.M., Wick W. A Phase II randomized study of galunisertib monotherapy or galunisertib plus lomustine compared with lomustine monotherapy in patients with recurrent glioblastoma. Neuro Oncol. 2016; 18(8): 1146-56. doi: 10.1093/neuonc/now009.
- de Groot J.F., Gilbert M.R., Aldape K., Hess K.R., Hanna T.A., Ictech S., Groves M.D., Conrad C., Colman H., Puduvalli V.K., Levin V., Yung W.K. Phase II study of carboplatin and erlotinib (Tarceva, OSI-774) in patients with recurrent glioblastoma. J Neurooncol. 2008; 90(1): 89-97. doi: 10.1007/s11060-008-9637-y.
- de Man F.M., Goey A.K.L., van SchaikR.H.N., Mathijssen R.H.J., Bins S. Individualization of Irinotecan Treatment: A Review of Pharmacoki-netics, Pharmacodynamics, and Pharmacogenetics. Clin Pharmacokinet. 2018; 57(10): 1229-54. doi: 10.1007/s40262-018-0644-7.
- Yoo C., Kim J.E., Lee J.L. The efficacy and safety of sunitinib in korean patients with advanced renal cell carcinoma: high incidence of toxicity leads to frequent dose reduction. Jpn J Clin Oncol. 2010; 40: 980-5. doi: 10.1093/jjco/hyq073.
- Schmidinger M., Bellmunt J. Plethora of agents, plethora of targets, plethora of side effects in metastatic renal cell carcinoma. Cancer Treat Rev. 2010; 36: 416-424. doi: 10.1016/j.ctrv.2010.01.003.
- Schmidinger M., Arnold D., Szczylik C., Wagstaff J., Ravaud A. Optimizing the use of sunitinib in metastatic renal cell carcinoma: an update from clinical practice. Cancer Invest. 2010; 28: 856-864. doi: 10.3109/07357901003631080.


