Гемостаз и когнитивный мозг: 5П-медицина и хронотерапия артериальной гипертонии
Автор: Пятин Василий Федорович, Маслова Ольга Александровна, Романчук Наталья Петровна, Булгакова Светлана Викторовна, Волобуев Андрей Николаевич
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 5 т.7, 2021 года.
Бесплатный доступ
Нейрофизиологические и кардионеврологические полифункциональные исследования системы «мозг-сердце» при реабилитации неврологических больных с использованием высоких медицинских технологий помогут ответить на многие вопросы, связанные с оптимизацией ведения пациентов при сочетанной церебральной и кардиальной патологии в восстановительном периоде. Поздний хронотип и более поздние сроки сна связаны с большей заболеваемостью, включая более высокие показатели метаболической дисфункции и сердечно-сосудистых заболеваний (ССЗ). Многочисленные исследования были скорректированы с учетом возраста, пола, этнической принадлежности, курения, индекса массы тела, продолжительности сна, социально-экономического статуса и сопутствующих заболеваний. Возрастные группы, особенно будучи определенным вечерним типом, были значительно связаны с более высокой распространенностью всех сопутствующих заболеваний. Результаты свидетельствуют о повышенной смертности в вечерних типах и увеличении уровней кардиометаболических факторов риска в этих группах. Риск смертности в вечерних типах может быть обусловлен поведенческими, психологическими и физиологическими факторами риска, многие из которых могут быть связаны с хроническим несоответствием между внутренними физиологическими сроками и внешними сроками работы и общественной деятельностью. Многоуровневые и межнейронные взаимодействия - ведущий фактор формирования высших психических функций и саморазвития личности. Циркадианный гомеостаз регулирует и синхронизирует функции взрослых стволовых клеток и их изменения во время старения, а также модулирует их внешние и внутренние механизмы. Циркадные часы синхронизируют клеточную физиологию с ежедневными изменениями окружающей среды, и могут как положительно, так и отрицательно, влиять на физиологические процессы. Циркадианное начало ССЗ часто показывает изменение времени суток, и связано с системой молекулярных часов. Острый инфаркт миокарда или желудочковая аритмия (желудочковая тахикардия), возникает в основном рано утром. Многочисленные биохимические и физиологические параметры показывают циркадный ритм, который может объяснить суточные вариации сердечно-сосудистых событий. К ним относятся колебания артериального давления, активность вегетативной нервной системы и ренин-ангиотензиновой оси, каскад свертывания крови, сосудистый тонус и внутриклеточный метаболизм кардиомиоцитов. Новое понимание молекулярных и клеточных путей, по которым сердечно-сосудистые события происходят в суточном колебательном паттерне, поможет создать новый терапевтический подход к лечению ССЗ. Продолжаются исследования актуализированной современной проблемы циркадианных нейрокоммуникаций «мозга и сердца» в период электромагнитной и информационной нагрузки/перегрузки, влияния новой генетики и эпигенетики, изменения гемостаза и гомеостаза, формирование нового иммунитета и микробиоты, во взаимосвязи с современным нейробытом и нейромаркетингом, с 5П медициной и 5G технологиями нейрокоммуникаций.
Антиагреганты, антикоагулянты, артериальная гипертония, гемостаз, десинхроноз, нейропластичность, кардионеврология, хронобиология, 5п медицина
Короткий адрес: https://sciup.org/14120964
IDR: 14120964 | УДК: 616.83/.85:616.89: | DOI: 10.33619/2414-2948/66/16
Текст обзорной статьи Гемостаз и когнитивный мозг: 5П-медицина и хронотерапия артериальной гипертонии
Бюллетень науки и практики / Bulletin of Science and Practice
Мозг человека — это биологические, биофизические, нейрофизиологические и медикосоциальные парадигмы обмена информацией. Современные коммуникации — это многоуровневые, мультипарадигмальные и междисциплинарные модели обмена информацией. Новые компетенции психонейроиммуноэндокринология и психонейроиммунология играют стратегическую роль в междисциплинарной науке и межведомственном планировании и принятии решений. Внедрение многовекторных нейротехнологий искусственного интеллекта и принципов цифрового здравоохранения, будут способствовать развитию современного нейробыта и нейромаркетинга.
Нейрогенетика является центром мультидисциплинарных и межведомственных исследований, использующих передовые методы, с участием 5П-медицины и 5G-технологии. Нейрогенетика изменила наше понимание механизмов, опосредующих расстройства мозга. Новых три десятилетия принесли огромный прогресс с точки зрения точной молекулярной диагностики и знания генов и путей, которые участвуют в большом количестве неврологических и психиатрических расстройств. Секвенирование генома человека стало важной научной вехой, которая произвела революцию в биологии и медицине. Проект «Геном человека» — это нейрогенетическая маршрутизация с XX в XXI в., многочисленные открытия благодаря сотрудничеству между проницательными клиницистами и технически инновационными фундаментальными учеными. Геномная инженерия, редактирование генома и редактирование генов относятся к модификациям (вставкам, делециям, заменам) в геноме живого организма. Современное редактирование генома основано на кластеризованных регулярно чередующихся коротких палиндромных повторах и ассоциированном белке 9 (CRISPR-Cas9). У прокариот CRISPR-Cas9 — это адаптивная иммунная система, которая естественным образом защищает клетки от вирусных инфекций ДНК. CRISPR-Cas9 был модифицирован для создания универсальной технологии редактирования генома, которая имеет широкий спектр применений в медицине, сельском хозяйстве и фундаментальных исследованиях функций генов [1].
Когнитивное здоровье и долголетие Homo sapiens — это расширение информационного пространства духовного и нравственного развития человека. Взаимодействие новых коммуникационных технологий и категорий «Здоровье» и «Долголетие» достигаются при обмене целевой и стратегической информацией через всю жизнь. Современная наука рассматривает человека, человечество и биосферу как единую систему, с растущими демографическими, продовольственными и медицинскими проблемами [2].
Компартментализированная регуляция метаболических процессов обеспечивает взаимодействие нервной, иммунной и эндокринной систем для осуществления единого организованного ответа на патологические воздействия, в том числе на острую церебральную ишемию. Нейрональная пластичность, определяет, с каких компартментов нейрона информацию следует усилить, а с каких подавить. Это позволят нейрону определить, какой информационный поток в локальной нейрональной сети получит приоритет. Новое понимание управления эпигенетической регуляцией является ключевым для объяснения и модификации процесса старения и активного долголетия как организма человека в целом, так и головного мозга в частности. Мозг регулирует кишечник и его микробиоту посредством нейроанатомических, иммунологических и нейроэндокринных нейросетевых путей, сообщающихся с помощью нейромедиаторов, нейропептидов или продуктов микробного происхождения, влияющих на микробиоту кишечника. Соответственно, микробиота кишечника влияет на мозг. Эти два способа формируют двунаправленную связь и взаимодействие между кишечником и мозгом. Дисбактериоз кишечника может быть вызван различными факторами окружающей среды, в том числе, такими как диета, стресс, воздействие антибиотиков, токсинов, лекарств и патогенов.
Циркадианный многофункциональный сон является главным инструментом и механизмом в формировании когнитивной памяти, ее количественном и качественном объеме, интеграции перехода на качественно новый уровень саморазвития и самосовершенствования, позволяющий создавать новый интеллектуальный «квалификационный разум». H. sapiens 21 века имеет возможность понимать физиологические и нейрофизиологические паттерны сна, управлять и изменять свои привычки сна. Оцифровка сна — настоящее и будущее для развития промышленности, здравоохранения, науки и персонализированного здоровья.
В новой 5П-медицине здоровье человека становится личным результатом, следствием работы со своим организмом, правильной и своевременной диагностики и профилактических мероприятий. Новая 5П-медицина основана, на глубоком индивидуализированном подходе к пациенту и стремлении профилактировать заболевания. Функционирование интегрированных нейронных систем путем интеграции и анализа динамической гибридной мультимодальной нейронной информации ЭЭГ и фМРТ, в сочетании с нейропсихологическим тестированием, позволит клиническому врачу гериатру управлять здоровым старением H. sapiens . Современная трансформация 4П в 5П-медицину — это новый подход — прецизионность (точность) — основан на глубоком понимании природы заболеваний и использования новейших достижений в диагностике, и объединяет опыт классической медицины и современные технологии. Модель 5П-медицины совместно с новейшими достижениями в медицине — важный шаг в улучшении состояния организма и продлении жизни не только у человека, но и у человечества в целом. 5П-медицина и 5G-технологии нейрокоммуникаций — новый уровень нейросетевого взаимодействия гиппокампа и когнитивного здоровья человека. Мозг H. sapiens 21 века объединяет внутреннюю и внешнюю многоуровневую информацию в единый алгоритм структурирования, маршрутизации, хранения, а также извлечения информации в настоящем и будущем периоде времени [3].
Здоровая микробиота — это качественное и количественное соотношение разнообразных микробов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека [4].
Новая управляемая здоровая биомикробиота и персонализированное функциональное и сбалансированное питание «мозга и микробиоты» — это долговременная медицинская программа пациента, которая позволяет комбинированному применению питательной эпигенетики и фармэпигенетики, а главное проведению профилактики полипрагмазии. Функциональный продукт питания с помощью биомаркеров и технологий искусственного интеллекта является целевой питательной средой как для организма в целом, так и для биомикробиоты в частности [4].
Современные инструменты и методики эпигенетической, диетической и биомикробиотической защиты здорового старения – это междисциплинарные, межвузовские и межведомственные направления, которые фокусируются на изучении нервной системы и влияния мозга на поведение и мыслительную способность людей [5–6].
Генетический и эпигенетический вклад в старение и долголетие человека огромен. В то время как факторы окружающей среды и образа жизни важны в более молодом возрасте, вклад генетики проявляется более доминантно в достижении долголетия и здоровой старости. Эпигеномные изменения во время старения глубоко влияют на клеточную функцию и стрессоустойчивость. Дисрегуляция транскрипционных и хроматиновых сетей, вероятно, является важнейшим компонентом старения. В ближайшем будущем искусственный интеллект и крупномасштабная биоинформационная система анализа сможет выявить вовлеченность многочисленных сетей взаимодействия.
Новая эпигенетика H. sapiens управляет взаимодействием эпигенетических механизмов старения и долголетия с биологией, биофизикой, физиологией и факторами окружающей среды в регуляции транскрипции. Старение — это структурно-функциональная перестройка (перепрограммирование) и постепенное снижение физиологических функций организма, которые приводят к возрастной потере профессиональной пригодности, болезням, и к смерти. Понимание причин здорового старения составляет одно из самых проблемных междисциплинарных направлений [5].
Продолжительность жизни человека в значительной степени определяется эпигенетически. Эпигенетическая информация — обратима, наши исследования дают возможность терапевтического вмешательства при здоровом старении, и связанных с возрастом заболеваниях [5].
Авторские разработки позволяют управлять острым и хроническим стрессом, снижают аллостатическую перегрузку, повышают нейропластичность мозга, включают гибридные и комбинированные инструменты и методики нейрореабилитации и психонейроиммунореабилитации [5].
В исследовании установлены основные современные инструменты и методики эпигенетической защиты здорового старения и долголетия человека разумного [6].
Функциональные продукты питания различные по составу, оказывают системное воздействие как на гуморальные и гормональные циркадианные колебания, так и на персонифицированное состояние здоровья, и его полиморбидность [7]. Включение в комбинированную схему лечения и профилактики заболеваний — функционального продукта питания обусловлено его сбалансированностью по содержанию микро- и макроэлементов, витаминов и минералов, клетчатки и др., необходимых мужскому и женскому организму человека как для профилактики гормональных нарушений в репродуктивной системе, так и для диетического, профилактического и функционального питания при диссомнии, десинхронозе [7].
Концентрация мелатонина в желудочно–кишечных тканях превосходит его уровень в крови в 10–100 раз, а в желудочно–кишечном тракте, по крайней мере, в 400 раз больше мелатонина, чем в шишковидной железе [8]. Организм человека представляет собой симбиотическое сообщество многочисленных эукариотических, прокариотических клеток, вирусов и архебактерий. Общее число соматических и зародышевых клеток достигает 1 трлн, а микробных клеток — свыше 100 трлн. В системно-интегративной деятельности головного мозга человека насчитывается огромное количество – примерно 10 млрд связанных между собой и постоянно взаимодействующих клеток.
В исследованиях Н. П. Романчук показано, что оптимизация нейробиологических и хрономедицинских процессов, возможна при циркадианной выработке мелатонина и обеспечении его длительной концентрации в организме человека. Установлено, что системно–локальное и индивидуальное сочетанное (медикаментозное и немедикаментозное) вмешательство в циркадианную ось «микробиота–кишечник–мозг» с помощью ежедневного употребления функциональных продуктов питания, положительно влияет на когнитивное и психическое здоровье человека [9]. Висцеральный и когнитивный мозг регулируя уровни мелатонина изменяют флору кишечника и улучшают антимикробные действия. Функциональное и сбалансированное питание обеспечивают циркадианное функционирование нейрооси «мозг–кишечник» с одновременным питанием «мозга» и «микробиоты». Новая концепция, рассматривающая микрофлору кишечника как ключевой регулятор поведения и функционирования головного мозга, представляет собой смену парадигмы в нейронауке и клинической гериатрии [8].
Внедрение результатов исследования Н. П. Романчук [7, 9], позволяет восстановить функционирование циркадианной системы человека, нормализовать уровень и концентрацию мелатонина в организме, осуществлять регуляцию процессов сна и бодрствования, управлять нейропластичностью, проводить профилактику когнитивных нарушений, активировать собственные циркадианные ритмы и их синхронизацию с окружающей средой, через использование мультимодальной схемы повышения циркадианного уровня гормона мелатонина в крови человека: циркадианные очки, функциональное питание и физическая активность [10].
Нейродегенеративные и возраст — ассоциированные хронические заболевания, при которых имеют место такие патофизиологические проявления как нестабильность генома и эпигенома, окислительный стресс, хроническое воспаление, укорочение теломер, утрата протеостазиса, митохондриальные дисфункции, клеточное старение, истощение стволовых клеток и нарушение межклеточной коммуникации преимущественно инициируются несбалансированным питанием и дисбалансом симбиотической кишечной микробиоты.
Суммарный геном нормальной микробиоты содержит в 100 раз больше генов, чем геном человека. В микробных сообществах, относящихся к нормальной микрофлоре человека, эволюционно сформировались межклеточные сети, представляющие систему трофических и энергетических взаимосвязей внутри кишечного микробиоценоза. Учитывая, что 90% энергии для клеток пищеварительного тракта производится кишечными бактериями и именно микроорганизмы являются ключевым звеном, стартерами возникновения, а затем эволюции и эпигенетики биологической жизни, включая человека, на нашей планете — необходимо соответствующее управление биоэнергией.
Молекулярными, клеточными и средовыми основами здоровья и долголетия являются метагеном и эпигеном человека, а полноценность их реализации в конкретных условиях жизнедеятельности H. sapiens — являются многомасштабные методы моделирования и прогнозирования.
Влияние пищевых привычек на микробиоту кишечника. Поскольку наши пищевые привычки являются результатом специфической смеси микро- и макроэлементов, непрерывно и бесконечно поступающих в нашу кишечную экосистему, огромное влияние инновационных и современных пищевых привычек на микробиоту кишечника, связанную с барьерными и иммунными функциями слизистой оболочки хозяина [11].
Функциональное питание, актуализированное по содержанию макро- и микроэлементов, клетчатки — является одним из ключевых модуляторов состава микробиоты кишечника, которая непосредственно влияет на гомеостаз хозяина и биологические процессы, а также через метаболиты, полученные из микробной ферментации питательных веществ [11].
Геномика циркадных ритмов: здоровье и болезни
Циркадные часы — это эндогенные осцилляторы, управляющие 24-часовыми физиологическими и поведенческими процессами. Центральные циркадные часы контролируют множество аспектов физиологии млекопитающих, включая регуляцию сна, метаболизма и иммунной системы. Актуально, понимание генетической регуляции сна через циркадную систему, а также влияние дисрегуляции экспрессии генов на метаболические функции. Исследования [12], начали раскрывать роль циркадных часов в управлении сердечно-сосудистой и нервной системами, микробиотой кишечника, раком и старением. Циркадный контроль этих систем частично зависит от транскрипционной регуляции, а последние данные свидетельствуют о том, что геномная регуляция часов осуществляется через циркадную хромосомную организацию. Новые открытия в области геномной регуляции физиологии человека открывают возможности для разработки более совершенных стратегий лечения и нового понимания биологических основ болезней человека. Циркадные ритмы управляются внутренней системой синхронизации, регулируемой на транскрипционном уровне, что приводит к возникновению генных сетей, которые колеблются с 24-часовым циклом. Внутри этих сетей находятся часовые гены, управляющие ритмами в физиологии и поведении. Благодаря циркадным функциям, есть возможность вмешательства с использованием временного введения лекарств (хронофармакология) или нацеливания на компоненты часов (Рисунок 1) [12].
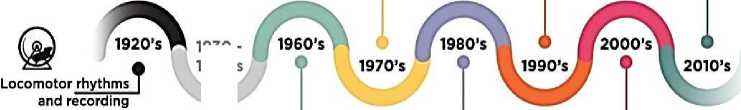
1920-е годы: первые долгосрочные записи локомоторных ритмов у крыс.
1960 г.: симпозиум по биологическим часам в Колд-Спринг-Харбор. Первые наблюдения показывают, что время суток определяет восприимчивость к эндотоксинам.
1972 г.: исследования поражения показывают, что супрахиазматическое ядро (СКН) гипоталамуса регулирует кортикостерон надпочечников и ритмы питьевого поведения.
1970-х и 1980-х гг. были проведены первые ENU-скрининги для идентификации новых генов у млекопитающих .
1984–1990 гг.: идентификация SCN как главного регулятора с помощью экспериментов по трансплантации.
1988 г.: естественная циркадная мутация Tau была идентифицирована у хомяков.
1990-е гг.: первые экраны ENU млекопитающих для поведения, приводящие к идентификации первого гена часов млекопитающих, Clock.
1995 г.: циркадные ритмы были показаны клеточно–автономными у млекопитающих, сохраняясь в изолированных нейронах SCN.
cc ) ® I
1997 г.: клонирование Гена часов, который, как было показано, принадлежит к семейству транскрипционных факторов bHLH-PAS-да. В том же году был также клонирован ген Per1 млекопитающих, оба из которых обеспечивают точки входа для идентификации механизма циркадной ритмичности у млекопитающих.
1998–2000 гг.: Открытие BMAL1/MOP3 в качестве партнера часов, репрессия CRY и петля обратной связи Per1/2-Cry1/2 на часах: BMAL1. Первые описания циркадных часов на периферии. Клонирование Тау - мутанта хомяка идентифицировало CK1e как важную киназу, регулирующую основные циркадные часы.
2000-е гг.: меланопсин был идентифицирован как циркадный фоторецептор в сетчатке.
2001: первая мутация в часовом гене, связанная с заболеванием человека.
2002 г: первые циркадные транскриптомы выявили значительное подмножество генов, имеющих циклическую экспрессию генов с 24-часовым периодом.
2004–2005 гг.: ассоциация мутаций в часовых генах с нарушением метаболизма.
2011 г.: циклы пероксиредоксина, как сообщается, не зависят от транскрипции.
2011–2012 гг.: подробные описания общегеномной регуляции часами.
2012–2013 гг.: основные достижения в нашем понимании часового контроля иммунитета.
MAMMALIAN CIRCADIAN RESEARCH TIMELINE
Fi rst ENU screens for behavior 1994: Identification of

mouse Clock mutant 1995: SCN cell-autonomous FiralENU 1997:
20 11-2012:
Genome-wide regulation by the clock
201 2-2013:
screens in mammals
Cloning 1st clock genes
Clock control of immunity
2013-P RESENT:
Chromosome conformation rhythms
199 8-2000:
Peripheral clocks
1972:
Discovery of the SCN
1930 -1950’s
Susceptibility rhythm to endotoxins
19 84-1987:
SCN transplantation
1988:
The naturally occurring Tau mutation
200 0-2002:
Melanopsin circadian photoreceptor
2001:
Association of clock genes to human diseases
2002:
Circadian transcriptome Clock genes and cancer 200 4-2005:
Clock disruption and impaired metabolism
Рисунок 1. Хронология основных открытий в исследовании циркадных часов [12]
Циркадные нарушения сна человека и их генетические причины. Циркадная геномика и регуляция сна (Рисунок 2) [12].
Управляемый циркадными часами, регулярный ежедневный режим питания и голодания поддерживает нормальную циркадную физиологию. Однако рецидивирующее нарушение суточных ритмов активности–отдыха и, следовательно, паттернов питания связано с метаболическим синдромом. Генетическое нарушение циркадных часов также предрасполагает грызунов к метаболическим заболеваниям. Часы непосредственно управляют метаболизмом, управляя транскрипционными программами для определенных метаболических путей (Рисунок 3) [12].
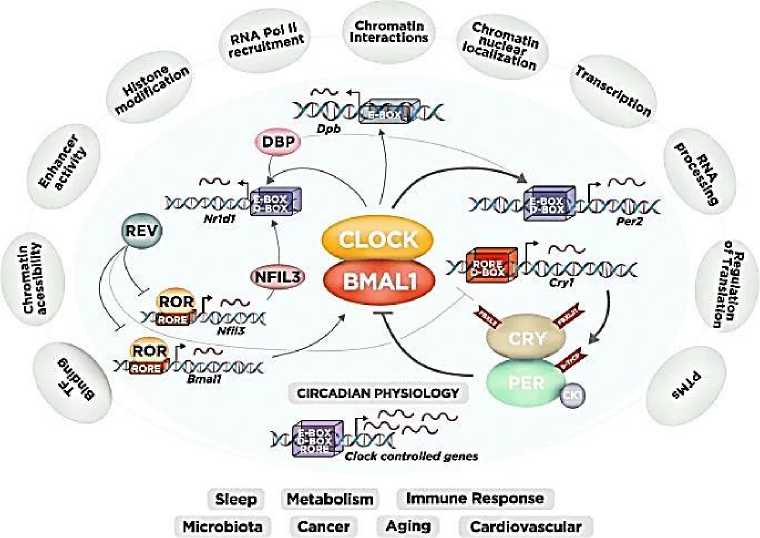
Рисунок 2. Циркадная генная сеть и слои общегеномной регуляции у млекопитающих [12]
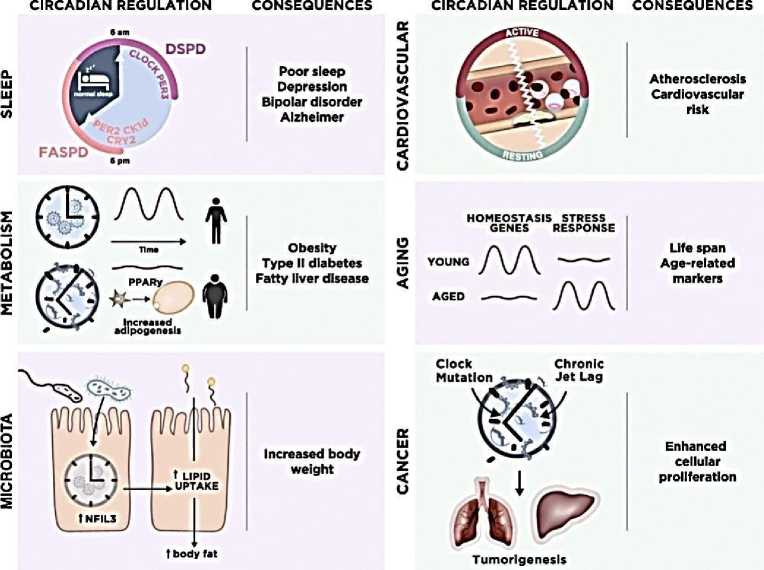
Рисунок 3. Основные аспекты циркадной регуляции в различных физиологических системах [12]
Влияние света на настроение и обучение. Свет является сильным внешним сигналом для циркадной системы. Его обнаружение включает в себя три класса фоторецепторов в сетчатке: классические палочки и колбочки, а также подмножество ганглиозных клеток сетчатки (RGCs), которые экспрессируют фотопигмент меланопсин (Opn4), что делает их внутренне фоточувствительными (ipRGCs). Когда ipRGCs теряются, SCN больше не получает световую информацию. Неожиданно абляция этих фоторецепторов у мышей влияет на настроение и обучение, указывая на то, что ipRGCs являются сенсорными клетками, которые управляют этими поведенческими эффектами. Показано, что эти нейроны передают световую информацию, которая влияет на когнитивные функции независимым от SCN образом. Вместо этого SCN-независимое подмножество ipRGCs соединяется с ядром таламуса [12].
Циркадианный гемостаз
Взаимодействие между циркадной и поведенческой системами влияет на тяжесть заболевания, в частности, на дневную/ночную картину неблагоприятных сердечнососудистых событий, судорог и обострений астмы; и как болезнь может влиять на циркадную ритмичность, в частности на циркадное нарушение болезни Альцгеймера; и неблагоприятные последствия для здоровья циркадного рассогласования, типичного для хронической сменной работы. В каждом случае излагаются хронотерапевтические соображения. Хронотерапия, в настоящее время недостаточно используется в большинстве областей медицины, учитывая очень заметные дневные/ночные вариации тяжести заболевания. Такая сдержанность может быть вызвана необходимостью повышения уровня образования врачей, наличием подходящих лекарств с соответствующей фармакодинамикой и более глубоким пониманием того, вызваны ли уязвимые периоды специфическим поведением и/или циркадной фазой. Этот последний момент важен при определении терапевтической цели, что становится особенно актуальным, когда циркадные ритмы и поведение становятся по-разному выровненными, как при лишении сна, сменной работе, смене часовых поясов и некоторых нарушениях сна. Хотя существуют многочисленные варианты улучшения нейрокогнитивной функции и сна в условиях циркадного рассогласования, меньше известно о терапевтических контрмерах на многие физиологические изменения, сопровождающие циркадное рассогласование, которые могут лежать в основе артериальной гипертонии (АГ), ССЗ, диабета, ожирения, рака, гастроэзофагеальных и репродуктивных проблем человека. Однако растет признание этих проблем. Кроме того, в настоящее время исследователи начинают изучать, как функционируют циркадные часы во многих периферических тканях (например, сердце, печень, легкие, циркулирующая кровь), которые потенциально могут десинхронизироваться от центрального циркадного кардиостимулятора. Последствия периферической-центральной десинхронизации не вполне понятны, но могут иметь последствия для физиологических функций, метаболизма, сна, нейрокогнитивной функции и здоровья. Молекулярногенетические основы этой ритмичности в настоящее время изучаются на многочисленных моделях животных, Закладывая основу для будущих трансляционных исследований. Практическое применение хронотерапии при многих заболеваниях требует дальнейшего изучения. Определение полезных биомаркеров или генетических анализов, которые могут быть надежно использованы для идентификации лиц, подвергающихся особому риску неблагоприятных циркадианных эффектов, связанных с заболеваниями, или неблагоприятных последствий циркадианного рассогласования, будет иметь многочисленные далеко идущие последствия [13].
Факторы риска развития церебральных инсультов и их патогенетические механизмы непостоянны во времени: их значение зависит от возраста и определенных периодов времени — часов, суток, времени года и т. д. Установлены циркадианные (суточные), сезонные и иные физиологические ритмы артериального давления, частоты сердечных сокращений, сократительной способности миокарда, уровня гормонов, большинства других биохимических и иных показателей жизнедеятельности организма. Рассогласование внутренних ритмов (десинхронизация) может быть причиной преждевременного старения, способствовать нарушению обмена веществ, развитию онкологических заболеваний, утяжелять течение сопутствующих заболеваний. Показана суточная и сезонная динамика развития таких сердечно-сосудистых заболеваний, как инфаркт миокарда. Суточные изменения вязкости крови, плазмы и гематокрита с акрофазой в утренние часы создают определенный фон, который в сочетании с другими факторами риска — колебаниями артериального давления, изменением уровня глюкозы — способствует развитию острой ишемии головного мозга, а в определенных случаях утренние изменения гемостаза могут быть решающим фактором возникновения ишемического инсульта [14].
По медико-социальной значимости сердечно-сосудистая патология стоит на первом месте среди неинфекционных заболеваний. Несмотря на то, что с момента проведения первого чрескожного коронарного вмешательства прошло более 50 лет, оптимальный режим антикоагулянтной терапии представляет собой серьезную проблему для клиницистов.
Антикоагулянтная терапия является стандартом оказания медицинской помощи пациентам с ишемической болезнью сердца при чрескожном коронарном вмешательстве. Сохраняется значительная неопределенность в отношении данной терапии у пациентов с высоким риском кровотечений, особенно у лиц пожилого и старческого возраста. Как правило, большинство проведенных исследований не оценивало риск кровотечения, а фокусировалось на ишемическом риске. Однако в последние годы кровотечение было признано значимым фактором заболеваемости и смертности у пациентов, перенесших чрескожное коронарное вмешательство. В тоже время, в данный момент отсутствует единая классификация кровотечений, а наличие множества ее вариантов затрудняет интерпретацию клинических данных и выбор тактики ведения пациента.
В настоящее время большое значение отводится решению проблемы высокой сердечнососудистой смертности. Важную роль в развитии серьезных сердечно-сосудистых осложнений играет тромбообразование. Атеротромбоз признан основой патогенеза большинства сердечно-сосудистых заболеваний. Более глубокое понимание роли молекулярных механизмов тромбообразования в развитии сосудистых катастроф послужили тому, что антитромбоцитарные препараты стали основой лечения многих болезней сердечнососудистых системы [15]. По результатам крупных многоцентровых исследований, именно антиагреганты наряду с гиполипидемическими препаратами оказывают существенное влияние на частоту развития и исход острых сосудистых ситуаций, повышают качество и продолжительность жизни пациентов [16]. До настоящего времени ацетилсалициловая кислота (АСК) является самым доступным и широко используемым антитромбоцитарным препаратом. В определенных клинических ситуациях для больных, относящихся к группе очень высокого риска, терапия АСК может быть усилена за счет препаратов других групп, например ингибиторов рецепторов АДФ (P2Y12 рецепторов): клопидогрела, прасугрела, тикагрелора) [15–17]. Таким образом, антиагрегантная терапия остается одной из наиболее широко исследуемых областей медицины с момента применения аспирина в 60-х годах [15– 16].
На замену монотерапии антитромбоцитарными препаратами пришла двойная антиагрегантная терапия (ДААТ). Несмотря на более чем 30-летний опыт использования двойной антиагрегантной терапии, сохраняется нерешенный вопрос: как наилучшим образом управлять различными клиническими ситуациями [18]. Важной проблемой остается профилактика кровотечений на фоне антитромботической терапии у больных ИБС пожилого и старческого возраста с острым коронарным синдромом (ОКС) и чрескожными коронарными вмешательствами (ЧКВ) [18]. В связи с этим, изучение данного вопроса является актуальным.
Частота геморрагических осложнений при ОКС значительно отличается в зависимости от типа проводимого исследования и может варьировать от 1до 19,5% [19–20].
Значительный диапазон частоты кровотечений у пациентов с ОКС можно объяснить отсутствием унифицированной методики классификации кровотечений. Практически в каждом исследовании, в котором изучались показатели кровотечений, использовались самые разные классификации кровотечений и их тяжести [21 –22] .
Систематический обзор, в котором участвовало более полумиллиона участников после ЧКВ, показал, что сильное кровотечение увеличивало общую смертность в 3 раза, а также и риск нежелательных серьезных сердечно-сосудистых событий (НССС) в аналогичной степени.
В настоящее время представлено достаточное количество работ по ведению пациентов с ОКС, однако рандомизированных исследований по проблеме диагностики геморрагических осложнений у лиц старших возрастных групп недостаточно.
В ряде проведенных исследований указывалось, что у пожилых пациентов имеется множество факторов риска кровотечений: ХБП, анемический синдром, эрозивные поражения желудочно-кишечного тракта, эндокринные нарушения и другие [23, 25–27]. Возраст является значимым фактором риска как тромбозов, в частности, неблагоприятного течения ишемической болезни сердца, так и частоты геморрагических осложнений [26–27]. Геморрагические осложнения, возникшие после или во время хирургического вмешательства, можно отнести к ятрогенным заболеванием. По современным представлениям, ятрогенией следует считать любое качественно новое состояние, патогенетически не связанное с исходным заболеванием, которое возникает в результате профилактических, диагностических, лечебных и других мероприятий, независимо от ошибочности или правильности врачебной деятельности. Совершенно очевидно, что ятрогенные заболевания чаще встречаются у пожилых пациентов [28].
В связи с постарением населения, увеличилось число пациентов с фибрилляцией предсердия, требующих оперативных вмешательств. В данном случае вопрос ЧКВ остается сложным и спорным, и он становится еще более сложным, если рассматривать расширенный список новых антикоагулянтных препаратов, помимо варфарина, которые получают больные. Кроме того, каждый из этих новых антикоагулянтов требует индивидуального подхода с учетом таких показателей, как почечная функция, возраст и вес пациента.
Нерешенными вопросами и проблемами в лечении ОКС у пожилых пациентов остаются вопросы, связанные с геморрагическими осложнениями, возникающими при ЧКВ. В значительной степени именно опасения по поводу риска кровотечений определяют тактику антиагрегантной терапии. До настоящего времени отсутствует единая стандартизация и классификация кровотечений, не учтены вопросы о частоте кровотечений в определенных группах, особенно у пожилых пациентов.
Пожилые пациенты с высоким риском кровотечения, которым после ЧКВ назначается ДААТ, требуют со стороны врача принятия сложных решений. С одной стороны, назначение адекватной ДААТ связано с опасностью развития кровотечений, с другой модификация ДААТ, направленная на снижение этих рисков, повышает риск тромбоза, увеличивая тем самым риск развития серьезных нежелательных кардиальных событий [28].
Это трудная дилемма, «кошмар» для каждого кардиолога. Сложность, с которой сталкиваются клиницисты, заключается в том, что для безопасного ведения пациента на антиагрегантной или антикоагулянтной терапии постоянно требуется осуществлять баланс между предупреждением кровотечений и профилактикой тромбозов. Пожилые пациенты, находящиеся на длительной ДААТ, требуют постоянного наблюдения и контроля у терапевтов и врачей гериатров.
Лишь в последние годы кровотечения после ЧКВ были полностью признаны клиницистами, как важный вопрос, требующий обсуждения и решения. Фактически, ранние исследования, посвященные ЧКВ, по-видимому, не в полной мере оценили эту проблему. Некоторые врачи, возможно, предполагали, что, если у пациента произошло кровотечение, то это легко исправимая гемотрансфузией ситуация. Однако теперь известно, что это не так, поскольку кровотечение приводит к худшему исходу, а даже однократная гемотрансфузионная терапия сама по себе тоже связана с более плохим прогнозом. С другой стороны, незначительное кровотечение может привести к прерыванию ДААТ, с последующим неблагоприятным прогнозом, учитывая тот факт, что у пациентов после преждевременного прекращения антиагрегантного лечения риск тромбоза увеличивается во много раз [28].
В связи с этим, прежде чем рассматривать показания к ЧКВ, врачу важно детально изучить клиническую картину заболевания пожилого пациента, чтобы убедиться, что имеющиеся симптомы, действительно, обусловлены ишемией миокарда, являются симптомами ИБС и что ему, действительно, необходимо стентирование с последующей ДААТ. Последняя, несомненно, увеличивает риск кровотечения в течение 1, 6, 12 месяцев или даже 3-х лет в зависимости от выбранной продолжительности ДААТ. Клиницистам важно тщательно оценивать риск кровотечения в каждом случае, и, если риск слишком высок, то необходимо отказаться от ЧКВ.
Понимание того, что кровотечение опасно, обязывает врачей четко знать особенности, которые увеличивают его риск [29]. Особое внимание следует уделять стареющему населению, так как оно относится к категории высокого риска, а доля пациентов старше 75 лет, перенесших ЧКВ, неуклонно растет и будет увеличиваться [30–31]. Эта категория пациентов недостаточно изучена в контексте стратегий ДААТ и требует дальнейших исследований [31–32].
В настоящее время в связи с широким применением препаратов, влияющих на гемостаз, с целью предупреждения тромбозов, повышается риск возникновения кровотечений. Для их оценки создано множество алгоритмов и шкал риска тромбоза и кровотечений, а также классификаций тяжести кровотечений. К таким шкалам относится шкала TIMI (шкала оценки 2-х недельного риска при ОКС без подъема сегмента ST), GUSTO (классификация тяжести кровотечений согласно критериям группы CUSTO), ISTH (шкала оценки риска развития кровотечений), PLATO (сравнение тикагрелора и клопидогрела у больных с ОКС с подъемом сегмента ST), BARC (Bleeding Academy Research Consortium), классификация кровотечений для пациентов с острым коронарным синдромом или со стабилизацией стенокардии у больных с ИБС после оперативного вмешательства на коронарных артериях [33]. В данной классификации учитывают не только большие и клинически значимые кровотечения, но и малые геморрагии, являющиеся причиной преждевременной отмены ДАТТ. Существуют и другие шкалы для оценки тяжести геморрагических осложнений при ОКС: REPLACE-2, ACUTY, HORIZONS-AMI. Данные классификаторы разработаны для изучения действия и частоты возникновения нежелательных явлений антитромбоцитарных препаратов при ОКС [30–31].
Для оценки тяжести геморрагических событий при проведении клинических исследований, а также для анализа использования антитромбоцитарных препаратов в реальной клинической практике используются шкалы TIMI и GUSTO, основанные на контроле клинико-лабораторных показателей. В шкале TIMI выделяют большие, умеренные и незначительные кровотечения. К «большим» кровотечениями относятся интракраниальные, а также геморрагии, обуславливающие падение показателей гемоглобина на 50 г/л и более от исходного значения. Надо отметить, что во всех шкалах к тяжелым кровотечениям относятся интракраниальные кровотечения, которые сложно предвидеть. Шкале CUSTO включает тяжелые, умеренные и легкие кровотечения. Шкала CRUSDE включает оценку риска кровотечений и тяжести кровотечений (I, II, III и IV степень тяжести в период госпитализаций у пациентов с ОКС без подъема сегмента ST). В шкале BLEEDSCORE кровотечения классифицируют на угрожающие или тревожные, внутренние и поверхностные [34–35]. Угрожающие кровотечения носят ургентный характер, требуют оперативного вмешательства или гемотрансфузии. Кровохарканье, носовые, маточные кровотечения, кровоточивость десен, кровоизлияние в стекловидное тело, гематурия составляют внутренние кровотечения. Поверхностные геморрагии чаще не требуют врачебного вмешательства, к ним относятся мелкие гематомы, экхимозы кровотечения при порезах.
В классификации, предложенной Европейской ассоциацией кардиальной хирургии (ЕАК) 2017 г. тяжесть кровотечений на фоне ДААТ подразделяется на следующие варианты: незначительные, легкие, умеренные, тяжелые и жизнеугрожающие. Российский геронтологический научно-клинический центр, с учетом классификации ЕАК подразделяет кровотечения на незначительные, легкие, тяжелые и жизнеугрожающие .
Разница оценки степени тяжести кровотечений у больных с ОКС и ЧКВ в предложенных классификациях делает трудным для клиницистов сравнение исследований и выбор тактики ведения пациентов. Кроме того, в своей работе врачи сталкиваются с тяжелыми психологическими реакциями со стороны пациентов при возникновении даже незначительных геморрагических проявлений с отказом от дальнейшего проведения ДААТ, что требует подробных разъяснений, а также психологической поддержки.
Таким образом, кровотечения у пожилых больных, перенесших ЧКВ, являются серьезной ятрогенной проблемой. До сих пор остаются нерешенными вопросы единой классификации кровотечений, что затрудняет выбор тактики ведения пациента. Кроме того, в большинстве исследований нет самостоятельной группы пациентов пожилого и старческого возраста с полиморбидностью, с высокими рисками развития и тромбоза, и кровотечения, что также затрудняет интерпретацию результатов. В идеале, все будущие исследования должны использовать единую классификацию кровотечений, включать группу пациентов гериатрического возраста для обеспечения сравнимых результатов и разработки единых клинических рекомендаций.
В исследовании [36], протестировали группу из 66 здоровых добровольцев с точки зрения влияния циркадного ритма на выбранные параметры системы свертывания крови и фибринолитической системы. Кровь брали с интервалом в 6 часов, в 8 часов утра, в 2 часа дня, в 8 часов вечера и в 2 часа ночи. Циркадная изменчивость наблюдалась как в параметрах системы свертывания крови, так и в фибринолитической системе. В образцах крови, собранных утром (8 часов утра), наблюдали повышенную агрегацию тромбоцитов, пролонгацию АПТТ, а также повышенные уровни факторов (фибриногена, PAI-1) и комплексов пап и ТАТ, влияющих на системы свертывания и фибринолиза. Отмечен циркадный ритм в количестве циркулирующих тромбоцитов (PLT), с пиком во второй половине дня (2 часа дня), сопровождающимся повышением концентрации Т-ПА, Д-димеров и пролонгированием PT. На основании полученных результатов можно сделать вывод, что циркадный ритм оказывает влияние на активацию процессов свертывания крови в утренние часы с прогрессирующей активацией фибринолиза вплоть до полудня. Определении транзиторного риска сердечно-сосудистых событий, включая инфаркт миокарда и ишемический инсульт, и, следовательно, могут способствовать эффективной профилактике таких событий. Такие наблюдения также могут стать отправной точкой для дальнейших исследований, направленных на определение циркадного влияния параметров секреции в системе гемостаза на другие системы и параметры в организме человека [36].
Молекулярные механизмы и физиологическое значение циркадных ритмов
Новые циркадианные десинхронозы циклов: «сон-бодрствование» и «бодрствование-сон». Нарушения цикла «сон–бодрствование» остаются актуальной проблемой и до настоящего времени. Они охватывают от 28 до 45% популяции, являясь для половины из этого числа людей существенной клинической проблемой, требующей специальной диагностики и лечения. С циклом «сон–бодрствование» тесно связывают клинику мозгового инсульта. В 75% случаев инсульты развиваются в дневное время, а в 25% – в период ночного сна. Нарушение ритмов, например расстройства сна, может привести к психическим заболеваниям. Отмечено, что при различных депрессивных расстройствах в 83–100% случаев отмечают нарушения ночного сна. Причинами развития депрессии при органических заболеваниях ЦНС являются патологические изменения в мозге, связанные с определенными нейрохимическими дефектами. Наиболее частой формой органической депрессии в неврологической клинике является паркинсонизм (депрессия встречается у 30–90% больных паркинсонизмом).
Под влиянием факторов изменяющейся окружающей среды, а именно, появления циклических изменений ее условий, ритмы организмов затягиваются этими изменениями и становятся околосуточными. В обычных условиях наблюдаются определенные соотношения между фазами отдельных циркадианных ритмов. Поддержание постоянства этих соотношений обеспечивает согласование функций организма во времени. Динамика околосуточных физиологических ритмов у человека и высших животных обусловлена не только врожденными механизмами, но и выработанным в течение жизни суточным стереотипом деятельности.
Всего к настоящему времени у человека и животных выявлено более чем 300 функций и процессов, имеющих околосуточную ритмику. Установлено наличие циркадианных ритмов двигательной активности, температуры тела и кожи, частоты пульса и дыхания, кровяного давления, диуреза. Суточным колебаниям подвержены содержания различных веществ в тканях и органах тела, в крови, моче, поте, слюне, интенсивность обменных процессов, энергетическое и пластическое обеспечение клеток, тканей и органов. По существу, в околосуточном ритме колеблются все эндокринные и гематологические показатели, показатели нервной, мышечной, сердечно-сосудистой, дыхательной и пищеварительной систем. Чувствительность организма к разнообразным факторам внешней среды, переносимость функциональных нагрузок, лекарственных препаратов, хирургических вмешательств также имеет циркадианную ритмику.
Каждая функция имеет суточные пики и спады. Показано, что масса тела достигает максимальных значений в 18.00–19.00 ч, уровень эритроцитов в крови — в 11.00–12.00 ч, лейкоцитов — в 21.00–23.00 ч, гормонов в плазме крови — в 10.00–12.00 ч, инсулина — в
18.00 ч, общего белка крови — в 17.00–19.00 ч, физическая выносливость человека достигает максимума в 21.00–24.0 ч, но в то же время в ночные часы быстрее наступает кислородное голодание мышц, что обусловлено падением в это время скорости кровотока. У человека наибольший диапазон колебаний АД регистрируется в утренние часы. Данный факт связывают с повышением физической и умственной активности после пробуждения, а наименьший — с периодом сна или минимальной активности. Постепенное повышение АД в утренние часы связано с активирующей деятельностью нейрогуморальных систем (повышением в крови концентрации кортизола, адреналина, норадреналина (НА), ренина). Повышение и понижение концентрации кортизола у большинства людей обратно пропорционально суточному уровню мелатонина – основного гормона пинеальной железы. Так, уровень кортизола в крови начинает нарастать с полуночи и достигает максимума к 06.00–08.00 ч утра, к этому времени практически прекращается выработка мелатонина. Приблизительно через 12 ч концентрация кортизола начинает снижаться, а спустя еще 2 ч запускается синтез мелатонина. В ночное время снижается активность симпатоадреналовой и ренин-ангиотензиновой систем, уменьшается общее периферическое сосудистое сопротивление, минутный объем кровообращения [37].
Ведущую роль в центральной регуляции АД отводят вентролатеральной области продолговатого мозга, в которой выделяют зону С1-клеток – группа адреналинсодержащих нейронов, контролирующих активность симпатических преганглионарных нейронов спинного мозга. Установлено, что при электрическом раздражении этой области продолговатого мозга можно наблюдать выраженный подъем АД.
Температура тела также имеет бифазную периодичность в течение суток, которую связывают с изменением секреции мелатонина. Отмечают видовые различия суточных изменений температуры тела. У человека температура тела максимальна в 18.00–19.00 ч, а в 04.00 ч — минимальна. Температура тела человека во время сна понижается (в 3 ч ночи у женщин до 35,6 °С, а у мужчин до 34,9 °С). Подобные суточные колебания температуры — снижение ночью и повышение днем — наблюдаются также и в отсутствие сна или при дневном сне и ночном бодрствовании [37].
Выделяют иерархически построенную мозговую систему, регулирующую циклы сна и бодрствования. Смена фаз сна и бодрствования связана с вегетативной, соматической, психической системами, лимбико-ретикулярным комплексом. На сегодняшний день выделяют около десятка систем тонической деполяризации, или активации коры мозга, которые условно называют «центрами бодрствования». Последние располагаются на всех уровнях мозговой оси: в продолговатом мозге, в ретикулярной формации моста, среднего и промежуточного мозга, в области n. coeruleus и n. subcoeruleus (регулируют смену «быстрой» и «медленной» фаз сна) и дорзальных ядер шва, в заднем гипоталамусе и базальных ядрах переднего мозга. В качестве медиаторов нейроны этих отделов мозга выделяют глутаминовую кислоту, ацетилхолин, НА, серотонин и гистамин. У человека нарушение деятельности любой из этих систем не компенсируется за счет других, что несовместимо с сознанием и приводит к коме. В конце 80-х гг. XX века был найден центр медленного сна. Показано, что нейроны, активность которых незначительна в бодрствовании, но резко возрастает в период обычного сна и прекращается во время парадоксального, расположены в переднем гипоталамусе, в так называемом вентролатеральном преоптическом ядре (медиатор — гамма-аминомасляная кислота — ГАМК) [37].
Чтобы приспособиться к ежедневным повторяющимся изменениям окружающей среды, животные демонстрируют циклические изменения в поведении и физиологии, которые включают в себя заметные поведенческие состояния, такие как циклы сна и бодрствования, но также множество менее заметных колебаний в неврологических, метаболических, эндокринных, сердечно–сосудистых и иммунных функциях. Циркадная ритмичность создается эндогенно генетически закодированными молекулярными часами, компоненты которых взаимодействуют, чтобы генерировать циклические изменения в их собственном изобилии и активности с периодичностью около суток. По всему телу такие молекулярные часы передают временной контроль функции органов и тканей, регулируя соответствующие последующие программы. Синхронизация между различными циркадными осцилляторами и резонанс с солнечным днем в значительной степени обеспечивается нейронным пейсмейкером, который непосредственно реагирует на определенные сигналы окружающей среды и способен передавать внутренние представления о времени суток всему организму.
Циркадные осцилляторы — это сети биохимических петель обратной связи, которые генерируют 24-часовые ритмы в организмах от бактерий до животных. Эти периодические ритмы являются результатом сложного взаимодействия между компонентами часов, которые специфичны для организма, но имеют общие молекулярные механизмы в разных сообществах (королевствах, царствах). Полное понимание этих процессов требует детального знания не только биохимических свойств белков часов и их взаимодействий, но и трехмерной структуры компонентов часового механизма. В последнее время особое внимание уделяется посттрансляционным модификациям и межбелковым взаимодействиям, в частности сложным взаимодействиям, опосредованным фосфорилированием часовых белков и образованием мультимерных белковых комплексов, регулирующих часовые гены на транскрипционном и трансляционном уровнях [38].
Циркадные часы — это эндогенная, самоподдерживающаяся система учета времени. Циркадные часы существуют у большинства исследованных биологических форм жизни, начиная от одноклеточных бактерий и заканчивая высокосложными высшими организмами, включая человека. Эти часы предсказывают суточные изменения окружающей среды и регулируют различные физиологические и метаболические процессы. Часовые гены по всем сообществам показывают ограниченную сохранность; тем не менее, основной регуляторный и хронометражный механизм, по-видимому, сходен. Циркадные часы имеют внутреннюю продолжительность периода приблизительно 24 ч при постоянных условиях. Внешние сигналы, такие как свет и температура, действуют как цейтгеберы (дающие время), которые могут сбросить часы, а также влияют на ритмическую амплитуду тактовых выходов. Процесс, с помощью которого часы сбрасываются в ответ на дневные и ночные изменения окружающей среды, называется захватом. Такая синхронизация необходима из-за вариаций восхода и захода солнца, а также постепенного замедления периодичности вращения Земли, что требует реагирования как на сезонные, так и на эволюционные временные рамки. Циркадные ритмы также компенсируются температурой таким образом, что они могут возникать в течение аналогичного периода в широком диапазоне биологически значимых температур Часы в различных организмах могут быть клеточно автономными. Например, устойчивые циркадные ритмы транскрипции наблюдались в одиночных клетках цианобактерий и изолированных фибробластах млекопитающих при минимальной синхронизации между соседними клетками. Чрезмерно упрощенная базовая циркадная сеть может быть определена как состоящая из трех элементов: входных путей, которые воспринимают и передают сигналы, синхронизирующие часы с окружающей средой, центрального осциллятора и выходных путей, которые связывают осциллятор с различными биологическими процессами. Однако с добавлением новых компонентов в тактовую сеть наши модели циркадной системы становятся все более сложными (Рисунок 4) [39]. Данный циркадный осциллятор состоит из ауторегуляторной сети множественных транскрипционных и трансляционных петель обратной связи, где тактовые гены активируются или подавляются ритмическим циклом кодируемых ими белков. Сами входные пути также могут ритмически регулироваться выходами циркадных часов. Вместе линейная концепция от входа до тактовых выходов фактически представляет собой переплетенную систему обратных связей [39].
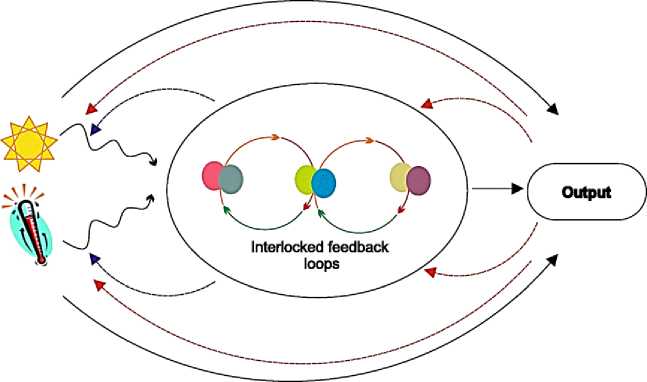
Рисунок 4. Сложная модель циркадных часов с множественной обратной связью [39–40]
Модифицированная сеть связанных генераторов множественной обратной связи представлена сплошными цветными линиями и овалами. Тактовые гены, образующие функциональный осциллятор, регулируют входные и выходные пути (синие пунктирные линии). Обратная связь с выходными путями также может регулировать работу генератора и входных путей (красные пунктирные линии). В дополнение к внешнему преобразованию входного сигнала для тактового захвата, входные пути также могут непосредственно влиять на тактовый выход и наоборот (сплошная черная линия) [39–40].
Множество физиологических процессов показывают стабильные и синхронизированные суточные колебания, которые либо управляются, либо модулируются биологическими часами. Циркадный кардиостимулятор, расположенный в супрахиазматическом ядре вентрального гипоталамуса, координирует 24-часовые колебания Центральной и периферической физиологии с окружающей средой. Циркадный часовой механизм, участвующий в управлении ритмической физиологией, состоит из различных часовых генов, которые взаимосвязаны через сложную петлю обратной связи, чтобы генерировать точные, но пластичные колебания длительностью 24 часа [41].
Исследована новая специфическая роль основного гена часового механизма Period1 и его паралоги на внутри-осцилляторные и экстрагентаторные функции, включая, но не ограничиваясь, гиппокамп-зависимые процессы, сердечно-сосудистую функцию, контроль аппетита, а также гомеостаз глюкозы и липидов. Изменения в функции генов периода были вовлечены в широкий спектр физических и психических расстройств. В то же время различные состояния, включая метаболические нарушения, также влияют на экспрессию часовых генов, приводя к циркадным нарушениям, что, в свою очередь, часто усугубляет состояние болезни [41]. Новые выводы:
–Циркадная система интегрирована во все формы жизни, о чем свидетельствует ее роль в управлении физиологическими ритмами и синхронизации их с циклами окружающей среды, а также в поддержании биологической стабильности.
–Часовые гены являются интерфейсом в двунаправленной связи между циркадными часами и центральными/периферическими физиологическими процессами.
–Физиологические процессы тесно связаны с циркадными часами; сменная работа и смена часовых поясов ухудшают циркадные часы и явно повышают риск метаболических нарушений и других болезненных состояний.
–Кроме того, часовые гены участвуют во множестве экстраклорных функций; период действия часового гена, в частности, был вовлечен во множество центральных и периферических процессов, от беспозвоночных до человека.
–Экспрессия генов циклического периода по существу подразумевает тканеспецифическую и органоспецифическую регуляцию ритмической экспрессии BMAL1-зависимого гена.
–Исследования на животных остаются бесценными для доказательства концепции и механизма действия исследований, связанных с хронобиологическими вопросами здоровья человека.
Центральная внечасовая функция периода в лимбической системе. Лимбическая система, анатомическая сущность и физиологическая концепция, представляет собой совокупность функционально и анатомически взаимосвязанных ядер и корковых структур, обнаруженных в телеэнцефалоне и диэнцефалоне. Хотя эти ядра имеют различные общие роли, они обычно функционируют в направлении управления самосохранением и сохранением видов. Области мозга, обычно входящие в лимбическую систему, состоят из подкорковых структур и коры головного мозга. Примером последнего является гиппокамп, который (1) паракринной и аутокринной функции, такие как синтеза эстрогенов и дифференциального регулирования гиппокампа рецепторов эстрогена и (2) эндокринной функции, включая контроль над гипоталамо–гипофизарно–надпочечниковой (HPA) оси, и широко известен за его роль в (3) обработки (сбор, консолидация и извлечение) информации [41].
Многие биохимические процессы в гиппокампе, такие как синтез белков и нейромедиаторов, синаптическая возбудимость и высвобождение нейрогормонов, демонстрируют циркадные колебания. Таким образом, циркадная регуляция локальных биохимических процессов в гиппокампе, вероятно, является механизмом, посредством которого циркадная система накладывает временную регуляцию на различные биологические функции. Важно отметить, что способность организма обрабатывать долговременные воспоминания варьируется в течение 24-часового дня, причем пики производительности памяти ограничены определенными временными окнами в активной фазе организма. Чтобы определить механизм, с помощью которого временная информация о дневном времени влияет на эффективность обработки памяти или любой из многих других функций гиппокампа, необходимо глубокое понимание того, как циркадные часы интегрируются в обработку гиппокампозависимых событий. Хотя кажется очевидным, что гиппокамп является ритмической структурой, особенно на уровне клеточной сигнализации, механизм, с помощью которого циркадные часы распространяют временную информацию, чтобы управлять молекулярными ритмами гиппокампа, остается под исследованием.
Предполагается, что гиппокамп работает параллельно с миндалиной, чтобы модулировать физиологию тела в ответ на когнитивные стимулы, процесс, известный как когнитивное восприятие. Гиппокампальные выходы преимущественно ингибируют нисходящую нейроэндокринную активность; увеличение синаптической эффективности в гиппокампе (например, долгосрочная потенциация (LTP)) может способствовать ингибированию пропускной способности. Одним из многих примеров является его ингибирующее действие на ось HPA. Это особенно интересно, потому что предыдущее исследование сообщает в Per1-дефицитные мыши, у которых уровень глюкокортикоидов надпочечников (ГК) аритмичен и повышен. Следовательно, изменения в контролируемых часами сигнальных событиях гиппокампа могут влиять на нижестоящий нейроэндокринный код. Последний, как известно, отвечает за обратную связь с гиппокампом и модулирует активность гиппокампа, в частности обработку памяти. В этом аспекте мы далее обсудим последние данные о Пер-зависимой регуляции сигналов и функций гиппокампа [41].
Актуально предположить, что механизм, посредством которого темпоральная информация интегрируется в обработку LTM, включает ритмическую интерференцию циклических тактовых белков, таких как PER1, с соответствующими памяти молекулярными сигнальными событиями. Заводные компоненты могут иметь не связанные с часами функции. Per2, например, конститутивно выражен в зубчатой извилине гиппокампа, и поэтому он не может передавать временную информацию, ритмически вмешиваясь в местные события.
Описанная роль Per-генов в сигналах гиппокампа и то, как они преобразуются в процессы LTM, является одним из примеров и поддерживает дальнейшие исследования более нисходящих эндокринных функций, регулируемых гиппокампом.
Есть убедительные доказательства того, что гормоны, а также метаболические сигналы могут модулировать циркадные колебания экспрессии часового гена в мозге и периферии. Пинеальный гормон мелатонин, например, модулирует ритм экспрессии Per1 в гипофизе, стриатуме и коре надпочечников. Кроме того, было показано, что ГХ надпочечников модулируют ритм экспрессии PER2 в овальном ядре ложа ядра stria terminalis и центральном ядре миндалины. Это позволяет предположить, что гены часов, являясь неотъемлемым компонентом обработки памяти и лимбической функции, также служат для передачи периферических эндокринных функций центральным процессам.
Стратегически представлено, что циркадная система состоит из двух категорий циркадных часов: центрального кардиостимулятора в супрахиазматических ядрах гипоталамуса (СХЯ, SCN) и периферийных осцилляторов, распределенных по всему телу. Ритмическая экспрессия тканеспецифичных и органоспецифических генов, подчеркивает важность временной координации различных биологических процессов. Колебания физиологических процессов в периферических тканях показаны на Рисунке 5 [41]. Например, дневные ответы инсулина (приводящие к удалению глюкозы) наиболее высоки в дневное время, когда пик поглощения углеводов обусловлен регулируемой SCN дневной активностью и потреблением пищи. Аналогично, пик секреции глюкагона ночью, так что хранящийся гликоген может эффективно превращаться в глюкозу, чтобы противодействовать снижению уровня глюкозы в сыворотке во время голодания. Эта координация центральных и периферических ритмов жизненно важна для эффективного поддержания ресурсов и метаболического гомеостаза. Циклы дня и ночи, возникающие в результате вращения Земли вокруг своей оси, синхронизируют центральные часы SCN. Часы SCN распространяют временную информацию о дневном времени на периферические часы через нервные и гормональные пути для синхронизации и координации физиологических ритмов на периферии, таким образом, выравнивая периферические физиологические ритмы с геофизическим временем. Все периферические органы содержат циркадные осцилляторы, на многие из которых также может влиять время приема пищи. Хотя дневные (синие) и ночные
(оранжевые) виды обычно имеют одни и те же компоненты часового механизма, их физиологические и поведенческие ритмы являются антифазными [41].
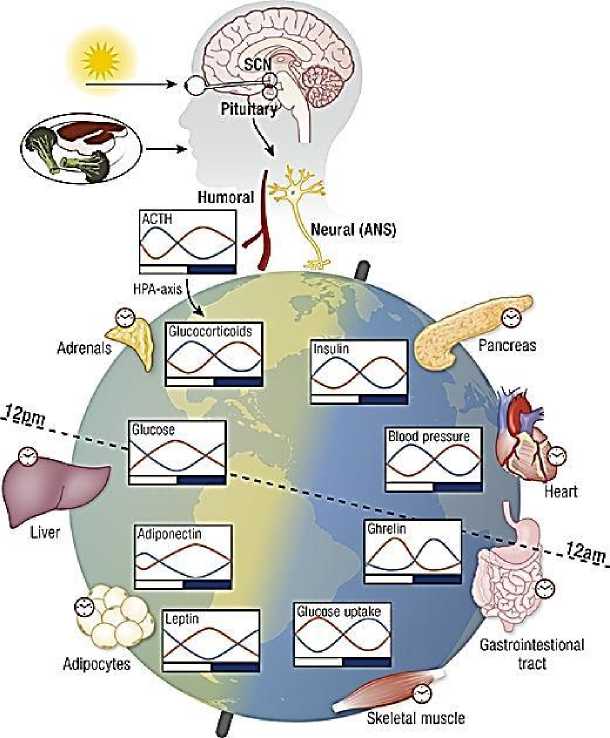
Рисунок 5. Связь между центральными и периферическими циркадными часами [41]
Кардионеврология XXI века
Циркадная система связывает внешнюю среду, мозг и организм человека. Нобелевская премия по физиологии и медицине 2017 года была присуждена трем хронобиологам за открытие основных компонентов циркадного часового механизма. Этот механизм закодирован в нашей ДНК, присутствует практически во всех наших клетках и важен, потому что мы живые организмы на планете с 24-часовым циклом дня/ночи. Циркадный механизм позволяет нам адаптироваться к дневной среде, оптимизируя физиологические процессы нашего организма для ежедневной активности и ночного отдыха.
Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности [42].
Три области головного мозга наиболее подвержены патологическим изменениям при стрессе: гиппокамп, префронтальная часть коры головного мозга и мозжечковая миндалина. Эти области отвечают за интерпретацию стрессовых переживаний и соответствующую ответную реакцию. Гиппокамп — наиболее стресс-чувствительная область мозга вследствие того, что в ней находится большое количество рецепторов к глюкокортикоидам (Рисунок 6).
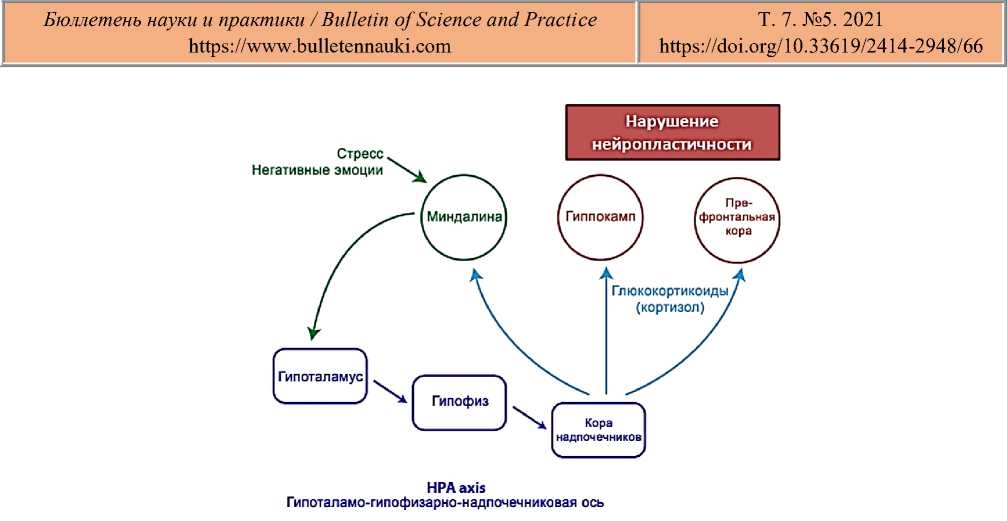
Рисунок 6. Перепрограммирование HPA оси при воздействии стресса [42]
Дефицит всех моноаминов в комплексе говорит о подавленном настроении, психомоторной дисфункции и нарушении сна. На Рисунке 6 показаны отделы головного мозга, где нарушения функции представленных моноаминов приводит к развитию депрессивной симптоматики.
Новые математические и вычислительные методы имеют решающее значение для проведения исследований во многих областях медицины, биофизики и биологии, таких как геномика, молекулярная биология, клеточная биология, биология развития, нейробиология, экология и эволюция. Современное цифровое здравоохранение, ядерная медицина, биофизика, биология, медицинская иммунология создают новые проблемы, которые стимулируют развитие нового биофизического контура и математических моделей геномноклеточного организменного ядерного синтеза. При этом эффективно используются: детерминированные, стохастические, гибридные, многомасштабные методы моделирования, а также аналитические и вычислительные методы.
АД было самым высоким в середине утра, а затем постепенно падало в течение всего оставшегося дня. Кровяное давление было самым низким в 3 часа ночи и снова начало повышаться в ранние утренние часы перед пробуждением. Эти результаты могут иметь важные последствия в отношении терапевтического лечения гипертонической болезни [43].
В современном обществе, где нарушение циркадного ритма и ССЗ часто сочетаются, например, в контексте сменной работы, нарушения сна или социальной смены часовых поясов. Сменная работа является глубокой причиной циркадной десинхронии, и ВОЗ называет сменную работу фактором риска развития ишемической болезни сердца, внезапной сердечной смерти, а также другие основные заболевания, включая рак молочной железы, ожирение и диабет 2 типа. С точки зрения сердечно-сосудистой системы, нарушение ритма связано с повышенным риском ССЗ, неблагоприятных сердечно-сосудистых событий и отрицательных исходов [44].
Циркадианная физиология опосредуется сложным взаимодействием между экстракардиальными (например, поведением и связанными с ними нейронными и гуморальными колебаниями) и внутрисердечными воздействиями (Рисунок 7) [45]. В течение дня внутренние свойства миокарда варьируются на уровнях экспрессии генов и белков, метаболизма, чувствительности к внеклеточным стимулам/стрессам и гомеостазу ионов, все из которых влияют на сократительную способность. За последнее десятилетие циркадные часы в кардиомиоците стали важным механизмом, ответственным за модуляцию внутренних свойств сердца. Кроме того, критическая роль этого механизма подчеркивается сообщениями о том, что нарушение, посредством генетических манипуляций, приводит к развитию сердечных заболеваний и преждевременной смертности [45].
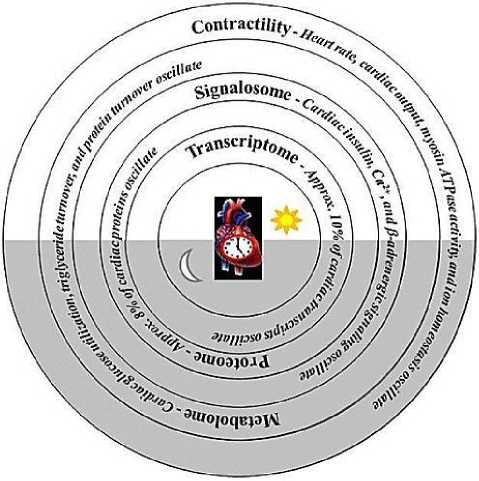
Рисунок 7. Влияние циркадных часов кардиомиоцитов на физиологию и патофизиологию сердца [45]
В начале XXI века полифункциональная кардионеврология поднялась на новый этап развития благодаря внедрению современных методов изучения сложных взаимоотношений «мозг–сердце» и «сердце–мозг» при острых и хронических цереброваскулярных заболеваниях (ЦВЗ). Накопление клинических данных о взаимоотношениях сердечнососудистой и центральной нервной системы послужило дальнейшему расширению современных представлений о целях и задачах кардионеврологии [46–47].
Современная кардионеврология — это, постоянно развивающееся интегративное научное направление в медицине, основной целью которого является исследование сердца при различных формах сосудистых поражений головного мозга, включая операции на артериях головы, а также исследование мозга при заболеваниях сердца, нарушениях центральной гемодинамики и кардиохирургических вмешательствах. В рамках кардионеврологии в настоящее время решается ряд актуальных клинических проблем, которые требуют консолидации усилий кардиологов, неврологов, сердечно-сосудистых хирургов, специалистов по интервенционной медицине, а также представителей лучевой и функциональной диагностики [48]. Хорошо известно, что патогенез ишемического инсульта неразрывно связан с сердечными заболеваниями, выявляющимися у большинства пациентов с ЦВЗ. Так, у 90% больных ишемическим инсультом обнаруживается АГ, у 75% — разнообразная кардиальная патология, включающая хроническую сердечную недостаточность (ХСН), ишемическую болезнь сердца (ИБС), кардиальные аритмии, пороки сердца, кардиомиопатии, врожденные аномалии, опухоли [49].
На сегодняшний день описано более 20 кардиальных источников церебральных эмболий, наиболее значимыми из которых являются неревматическая ФП, приобретенные пороки сердца и постинфарктные изменения миокарда [50]. Кроме этого, по данным наблюдений, более чем у 50% больных удается обнаружить изменения, ассоциирующиеся с риском парадоксальной эмболии, в основном открытое овальное окно и артериальновенозные легочные шунты [51]. Данные состояния, по существу, представляют собой норму, за исключением таких вариантов развития, как массивный праволевый шунт, большой анатомический размер открытого овального окна, клапанный или окончатый тип его строения. Не менее актуальной проблемой являются нарушения церебральной перфузии, составляющие основу гемодинамического инсульта. Колебания системного АД, приводящие к редукции мозгового кровотока, могут быть обусловлены различными причинами, в том числе и кардиологическими, включая ряд аритмий и транзиторную ишемию миокарда (ТИА) [52]. Объединяющим звеном двух «кардиогенных» подтипов ишемического инсульта является «скрытность» течения патогенетически значимых кардиальных нарушений и непостоянство симптомов, указывающих на вовлечение сердца в патологический процесс.
В качестве будущих направлений можно выделить изучение возрастных аспектов кардиальной составляющей ишемического инсульта, исследование новых факторов риска кардиогенного церебрального поражения и анализ кардиальных причин ТИА. Для улучшения прогноза больных после инсульта необходимо продолжать изыскания в следующих направлениях: определение прогностических факторов сердечно-сосудистых осложнений в отдаленном постинсультном периоде, включая ВСР; выделение пациентов наиболее высокого риска повторных сердечно-сосудистых нарушений и повышение приверженности к лечению; изучение эффективности и внедрение новых классов лекарственных препаратов (антигипертензивных, антитромботических, гиполипидемических и т. д.), либо дозировок или схем лечения для профилактики сердечно-сосудистых осложнений в постинсультном периоде; выбор оптимального «кардионеврологического» долгосрочного медикаментозного режима терапии, позволяющей увеличить продолжительность и качество жизни. Так, по расчетным данным, показано, что адекватное использование современных знаний по профилактике сердечно-сосудистых осложнений в постинсультном периоде может снизить относительный 5-летний риск осложнений на 94% [53].
Хронодиагностика и хронотерапия
Периферические часы синхронизируются тремя основными способами: 1) напрямую посредством нервных и гормональных сигналов (контролируемых СХЯ) — здесь ключевая роль принадлежит свету; 2) пищей; и 3) температурой тела [54]. Кроме того, циркадная координация температуры посредством изменения метаболизма и тонуса сосудов тесно взаимосвязана с регуляцией сна [55–56].
Основной причиной различий в степени выраженности ритма (амплитуда) и стабильности структуры ритма (фазы ЦР) является разная доля эндогенного и экзогенного компонентов в формировании их ЦФТ. Кроме того, разные показатели могут иметь разную зависимость ото сна и уровня активности. Так, примером трех высокоамплитудных ЦФТ с разной степенью зависимости ото сна могут служить ритмы кортизола, тиреотропного гормона (ТТГ) и пролактина. Все эти показатели имеют настолько выраженный ЦР, что значения, полученные в разное время суток, различаются не менее чем на 200–300% (в 2–3 раза). Однако, кортизол имеет стабильную среднюю величину и стабильное положение фазы, которые практически не зависят ото сна (sleep independent circadian phenotype CPT, or «sleep impact grade 0» S0-CPT), ЦФТ типа 0 (независим от режима сна). Ритм ТТГ сохраняет фазовое положение, но его средний уровень существенно модулируется сном (снижается во время сна) и, напротив, повышается на фоне депривации сна (sleep dependent CPT, sleep impact grade 1; S1-CPT), ЦФТ тип 1 (умеренная зависимость от режима сна) — уровневая, в большей мере, чем фазовая зависимость. Наконец, пролактин имеет как уровневую, так и фазовую зависимость от режима сна (sleep dependent CPT; grade2, S2-CPT), ЦФТ тип 2 (уровневая и фазовая зависимость от режима сна). Целесообразно также выделить еще один вариант – ЦФТ тип D (ритмы, находящиеся в первостепенной зависимости от режима питания); Diet dependent CPT, Dd-CPT [54].
Среди биохимических показателей другими примерами ЦФТ типа 0 являются мелатонин, АКТГ; ЦФТ типа 1 — лептин, триглицериды, а также ключевой гормон, регулирующий метаболизм железа, гепцидин, имеющий выраженный ЦР дневного типа с минимальными значениями ранним утром и максимальным уровнем вечером [57]; примерами ЦФТ типа 2 служат гонадотропный гормон, гормон роста и др. Следует предполагать, что большинство ЦФТ, характеризующих липидый обмен, могут быть отнесены к ЦФТ типа 0 или 1. Так, с помощью метаболического подхода [58] было продемонстрировано, что у человека около 15% всех метаболитов с малой молекулярной массой имеют циркадные колебания и среди них более 75% составляют липиды, в основном жирные кислоты. Из этой работы выяснилось, что эндогенные циркадные часы являются основным регулятором колебаний липидного профиля плазмы, так как изменения в графике сна или питания не повлияли существенно на их динамику [58]. Из сказанного выше следует важнейший практический вывод: выход клинического показателя за пределы нормативного коридора не всегда отражает патологический процесс. Прежде всего следует исключить возможность фазового сдвига ЦФТ, связанную с особенностями режима сна, либо хронотипа. Чем выше амплитуда ЦФТ присущего данному клиническому показателю, тем менее выраженные фазовые сдвиги радикально меняют положение вещей. Выход же показателя за пределы норматива в рамках статистической погрешности 5–10% во многих случаях может объясняться лишь изменениями режима сна в пределах 60–90 минут.
Хронотип человека является наследуемым признаком, примерно на 50% зависящим от генетических факторов [59]. Эндогенный компонент хронотипа тесно взаимосвязан с понятием внутреннего периода суточного ритма, τ. Внутренний, или эндогенный период биологических часов, τ как правило, отличен от 24 часов, и как уже было отмечено, является видоспецифическим признаком, варьируя в диапазоне 24±4 часа. Именно эта особенность и явилась основанием для появления термина «циркадианный» (циркадный, circadian) или околосуточный, предложенного Францем Халбергом в 1959 г. У каждого представителя данного вида τ также различается, что может быть обусловлено генетическим полиморфизмом ключевых генов биологических часов (Core clock genes, CG) и некоторых вспомогательных для них генов-партнеров. Некоторые данные указывают на то, что наиболее тесная связь может существовать между хронотипом и полиморфизмом гена Per3 [60], продукты ключевых генов CG (Bmal, Clock, Per, Cry) и их партнеров (REV-ERBα, RORα и др.), посредством механизма обратной связи координируют собственную транскрипцию и транскрипцию других генов, известных как clock-controlled genes (ccg, или «управляемые часами гены»). Ритмичная суточная динамика экспрессии этих генов на разных уровнях (транскрипционном, пост-транскрипционном, трансляционном и пост-трансляционном), а также фазовые отношения между этими процессами модулируют параметры ЦР, в т. ч. циркадианный. Имеются весомые данные о сопряженности вечерних хронотипов с повышенным риском заболеваемости и смертности, в частности полученные при анализе данных биобанка почти полумиллиона англичан [61]. Вечерние хронотипы также более склонны к нездоровому характеру питания — в более позднее время, реже, но более крупными порциями, имеют сниженный уровень липопротеидов высокой плотности, ЛПВП, более высокую распространенность апноэ сна и более высокий уровень стрессовых гормонов. Остается вопрос, в какой степени данная взаимосвязь обусловлена биологическими предпосылками. Например, можно предполагать существование более высокой устойчивости к неблагоприятным десихронизирующим факторам обладателей средних (точных) периодов (что, в частности, наблюдается у животных . Или же, данная взаимосвязь является лишь следствием сложившейся «социальной дискриминации» вечерних хронотипов, вынужденных подстраиваться под прокрустово ложе стандартных социальных режимов труда. Так или иначе, в существующих условиях лица с вечерним хронотипом являются потенциально подверженными внешнему десинхронозу – в частности, социальному джет-лагу (десинхронизации между фазой эндогенных БЧ и социальными факторами). Выраженность социального джет-лага коррелирует со снижением ЛПВП, повышением триглицеридов, инсулина натощак, резистентности к инсулину, риском метаболического синдрома, предрасположенностью к сахарному диабету 2 типа и атеросклерозу. Во многих исследованиях прослеживается взаимосвязь между нарушениями / дефицитом сна и изменениями ли-период, τ.
Имеются весомые данные о сопряженности вечерних хронотипов с повышенным риском заболеваемости и смертности, в частности полученные при анализе данных биобанка почти полумиллиона англичан [61]. Более поздний хронотип (то есть вечернее предпочтение) и более поздние сроки сна были связаны с большей заболеваемостью, включая более высокие показатели метаболической дисфункции и ССЗ. Тем не менее, никто не исследовал, связан ли хронотип с риском смертности на сегодняшний день. Нашей целью было проверить гипотезу о том, что вечерний тип связан с повышенной смертностью в большом когортном исследовании, британском биобанке. Наш анализ включал 433 268 взрослых в возрасте 38–73 лет на момент зачисления и в среднем 6,5-летнее наблюдение. Первичное воздействие было хронотипным, что оценивалось с помощью одного самооценки, определяющей вопросы участников как определенные утренние типы, умеренные утренние типы, умеренные вечерние типы или определенные вечерние типы. Первичными результатами были смертность от всех причин и смертность от сердечно-сосудистых заболеваний. Распространенное заболевание также сравнивалось среди групп хронотипов. Анализы были скорректированы с учетом возраста, пола, этнической принадлежности, курения, индекса массы тела, продолжительности сна, социально-экономического статуса и сопутствующих заболеваний. Возрастные группы, особенно будучи определенным вечерним типом, были значительно связаны с более высокой распространенностью всех сопутствующих заболеваний. Сравнивая определенный тип вечера с определенным типом утра, ассоциации были сильнейшими при психологических расстройствах (OR 1,94, 95% CI 1,86-2,02, р = < 0,001), с последующим диабетом (OR 1,30, 95% CI 1,24-1,36, р = < 0,001), неврологические расстройства (OR 1,25, 95% CI 1,20–1,30, р = < 0,001), желудочно-кишечные/абдоминальные расстройства (OR 1,23, 95% CI 1,19–1,27, p = < 0,001) и респираторные заболевания (OR 1,22, 95% CI 1,18-1,26, p = < 0,001). Общее число смертей составило 10 534, из которых 2127 были из-за ССЗ. Большая вечность, основанная на хронотипе как порядковой переменной, была связана с небольшим повышенным риском смертности от всех причин (ЧСС 1,02, 95% CI 1,004–1,050, р = 0,017) и смертности от ССЗ (ЧСС 1,04, 95% CI 1,00–1,09, р = 0,06). По сравнению с определенными утренними типами определенные вечерние типы имели значительно повышенный риск смертности от всех причин (ЧСС 1,10, 95% CI 1,02–1,18, p = 0,012). Результаты свидетельствуют о повышенной смертности в вечерних типах согласуются с предыдущими сообщениями о повышенных уровнях кардиометаболических факторов риска в этой группе. Риск смертности в вечерних типах может быть обусловлен поведенческими, психологическими и физиологическими факторами риска, многие из которых могут быть связаны с хроническим несоответствием между внутренними физиологическими сроками и внешними сроками работы и общественной деятельностью. Эти результаты свидетельствуют о необходимости исследования возможных вмешательств, направленных либо на изменение циркадных ритмов у людей, либо на обеспечение большей гибкости вечерних часов [61].
Вечерние хронотипы также более склонны к нездоровому характеру питания — в более позднее время, реже, но более крупными порциями, имеют сниженный уровень липопротеидов высокой плотности, ЛПВП, более высокую распространенность апноэ сна и более высокий уровень стрессовых гормонов. Остается вопрос, в какой степени данная взаимосвязь обусловлена биологическими предпосылками. Например, можно предполагать существование более высокой устойчивости к неблагоприятным десихронизирующим факторам обладателей средних (точных) периодов (что, в частности, наблюдается у животных. Или же, данная взаимосвязь является лишь следствием сложившейся «социальной дискриминации» вечерних хронотипов, вынужденных подстраиваться под прокрустово ложе стандартных социальных режимов труда. Так или иначе, в существующих условиях лица с вечерним хронотипом являются потенциально подверженными внешнему десинхронозу – в частности, социальному джет-лагу (десинхронизации между фазой эндогенных биологических часов (БЧ) и социальными факторами). Выраженность социального джет-лага коррелирует со снижением ЛПВП, повышением триглицеридов, инсулина натощак, резистентности к инсулину, риском метаболического синдрома, предрасположенностью к сахарному диабету 2 типа и атеросклерозу. Во многих исследованиях прослеживается взаимосвязь между нарушениями / дефицитом сна и изменениями липидного и углеводного метаболизма, а хронический десинхроноз даже провоцирует развитие карцином печени [62]. С другой стороны, механизмы данных нарушений стоит искать в утрате временной согласованности молекулярно-генетических факторов метаболизма. Действительно, депривация и нарушения сна влекут за собой уменьшение амплитуды наряду со снижением числа выявляемых на уровне транскриптома и метаболома циркадианного ритма ЦР, а также внутренним фазовым разлучением эндогенных центральных ритмов с ритмами метаболома органов и тканей [63].
Увеличение времени сна и количества REM – сна связано с меньшей смертностью от всех причин в когорте лиц среднего и старшего возраста. В частности, в работе [64] показано, что сочетание продолжительности сна и доли в нем REM-сна могут служить прогностическими факторами смертности от всех причин. Авторы работы также предполагают, что поскольку архитектура сна регулируется циркадным ритмом, доля REM-сна может отражать функционирование СХЯ (центральных биологических часов в гипоталамусе). В отдельных исследованиях было показано, что качество сна может быть взаимосвязано с кишечным микробиомом, в частности, дефицит определенных бактерий может служить фактором уменьшения количества и качества сна [64].
Хрононутрициология
Суммарный геном нормальной микробиоты содержит в 100 раз больше генов, чем геном человека. Масса нормальной микробиоты составляет от 2 до 8 кг. 99,9% составляет микробиота толстого кишечника. Филогенетически древние отношения в биотопах человеческого организма жизненно важны как для организма, так и для самой микробиоты.
В микробиоценозе представлены постоянно обитающие виды бактерий (главная, автохтонная, индигенная, резидентная микрофлора), составляющие 90% от всех микроорганизмов, а также добавочные (сопутствующие, факультативные), на которые приходится 10%, и транзиторные (случайные виды, аллохтонная, остаточная микрофлора) – 0,01%. Облигатная (нормальная, дружественная — friendly) микробиота представлена анаэробными бактериями родов Bacterioides, Bifidobacterium, непатогенными штаммами клостридий (Bifidobacterium, Lactobacillus, нормальная E. coli, Peptostreptococcus spp., Streptococcus faecium и др.).
Факультативная микрофлора кишечника представлена пептококками, стафилококками, стрептококками, бациллами, дрожжевыми и дрожжеподобными грибами.
В микробных сообществах, относящихся к нормальной микрофлоре человека, эволюционно сформировались межклеточные сети, представляющие систему трофических и энергетических взаимосвязей внутри кишечного микробиоценоза. Практически ни один доступный биосубстрат не используется только в интересах одной видовой популяции микроорганизмов. 95–99% всех микроорганизмов в естественной среде существует в виде биопленки.
Рисунок 8. Иммунный гомеостаз [65]
Взаимодействия хозяин — микробиота лежат в основе гомеостаза и воспаления в кишечнике и внетестинальных тканях. При гомеостазе кишечные бактерии компартментализированы в просвете посредством исключения слизью, нейтрализации антимикробными пептидами, продуцируемыми IEC, и высвобождения секреторного IgA (sIgA) из кишечно-резидентных В-клеток. В ответ на различные сигналы ILC3s и Th17 клетки в кишечнике вырабатывают IL-22, который действует на IEC, чтобы способствовать компартментализации микробиоты. Tregs продуцируют IL-10 и индуцируются микробно полученными SCFA и PSA или бактериальными видами B. fragilis и Clostridium. Кишечная активация Tregs может защитить от нейровоспаления в ЦНС во время EAE. Во время хронического воспаления кишечника потеря функция кишечного барьера приводит к бактериальной транслокации через эпителий, высвобождению соразмерно полученных MAMPs, провоспалительного цитокина и активация хемокинов и ответы Th17 и В-клеток. Специфические бактерии усугубляют воспаление кишечника, включая Prevotellaceae, Imageobacteriaceae и Th17-inducing SFB. Потеря толерантности к self-Ags может произойти из-за пониженных порогов для автоактивации (эффект Байандера), которые могут опосредовать аутоиммунитет во внетестинальные ткани. Побочные эффекты инициируют и усугубляют воспаление Th17-mediated на мышиных моделях EAE и RA. При РА, Th17 и фолликулярном помощнике Т-клеточные ответы способствуют выработке аутоантитела во вторичных лимфатических узлах. Лицензирование кросс-реактивных ответов Т-клеток, которые распознают микробно полученные пептиды и реакция на самопептиды может также инициировать аутоиммунитет во внетестинальных тканях, как показано на мышиной модели экспериментального аутоиммунного увеита (EAU) (Рисунок 8) [65].
Нормальная микробиота представляет собой большое количество чужеродных молекул (антигенов и паттернов), которые способна распознавать иммунная система. Однако иммунная система слизистых не осуществляет привычные защитные функции в отношении нормальной микробиоты и не элиминирует ее. Современные исследования о взаимоотношениях нормальной микробиоты кишечника и иммунной системы, демонстрируют обеспечение возможности проживания большого количества видов симбионтных бактерий на слизистых рассматривается как отдельная и независимая функция иммунной системы — акцептивная. Акцептивный иммунитет — это взаимодействие иммунной системы с нормальной микробиотой в отличие от «протективного иммунитета», направленного на уничтожение патогенов. Защитная (протективная) реакция обеспечивает агрессию против патогенов, их повреждение, уничтожение, формирует противоинфекционный иммунитет, аллергию, аутоиммунные реакции. В то время как акцептивная обеспечивает мирное сосуществование, сохранение, химеризм, симбиоз с нормальной микробиотой, толерантность к пищевым антигенам, нормальное течение беременности, противоопухолевый иммунитет.
Взаимодействия между симбиотическими микробами и их хозяином изменяют реакцию иммунной системы хозяина на другие микроорганизмы, включая патогенные, и необходимые для поддержания надлежащего иммунного гомеостаза.
Новые достижения в понимании того, как функционально взаимодействуют иммунная система млекопитающих и кишечная микробиота, дали новые представления о здоровье и болезнях человека. Современные технологии количественного измерения специфических и функциональных характеристик микробиоты желудочно-кишечного тракта, наряду с фундаментальными и новыми концепциями в области иммунологии, выявили многочисленные пути, по которым взаимодействие хозяина и микробиоты протекает благоприятно, нейтрально или неблагоприятно для хозяев млекопитающих. Очевидно, что микробиота кишечника оказывает сильное влияние на форму и качество иммунной системы; соответственно, иммунная система определяет состав и локализацию микробиоты. Эти взаимодействия охватывают гомеостаз и воспаление в кишечнике и, в некоторых случаях, внекишечных тканях. Трансляционные методы лечения, основанные на исследованиях взаимодействия хозяина и микробиоты, могут быть использованы для лечения хронических воспалительных заболеваний [65].
Понимание механизмов функционирования генома, эпигенома, их взаимоотношений с факторами окружающей среды повышает точность диагностики заболеваний, позволяет разрабатывать персонифицированные функциональные диеты и выявлять среди известных или вновь созданных лекарственных средств те, которые имеют эпигеномную направленность.
Нейроось «микробиота-кишечник-мозг» представляет собой динамическую матрицу тканей и органов, включая желудочно-кишечную микробиоту, иммунные клетки, ткани кишечника, железы, вегетативную нервную систему и головной мозг, которые взаимодействуют сложным разнонаправленным образом через ряд анатомически и физиологически различных систем. Долгосрочные возмущения этой гомеостатической среды могут способствовать прогрессированию ряда нарушений путем изменения физиологических процессов, включая активацию HPA оси, нейромедиаторных систем, иммунной функции и воспалительной реакции.
Продолжаются исследования [4] того, что триллионы микробов, населяющих наш кишечник, являются существенным фактором, способствующим психическому здоровью и, в равной степени, прогрессированию нервно-психических расстройств. Экстраординарная сложность экосистемы кишечника и ее взаимодействие с кишечным эпителием для проявления физиологических изменений в головном мозге, влияющих на настроение и поведение. H. sapiens имеет уникальное сообщество микробиоты и здоровой биомикробиоты, которая меняется под воздействием ряда факторов, включая диету, физические упражнения, стресс, состояние здоровья, генетику, «свою полипрагмазию» и т. д.
Микробиом-иммунный вклад в метаболический синдром. Кишечный микробиом является ключевым регулятором иммунных и метаболических функций хозяина и считается центральным фактором, способствующим воспалению в контексте метаболического синдрома (Рисунок 9) [66].
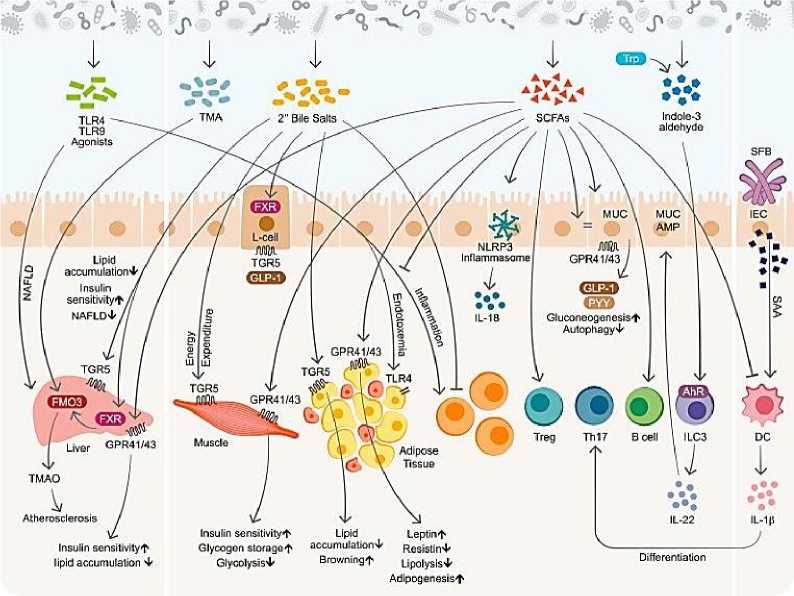
Рисунок 9. Микробиом и иммунно-метаболические взаимодействия [66]
Микробиом взаимодействует с иммунной системой хозяина, регулируя обмен веществ различными механизмами: непосредственным физическим контактом, выработкой метаболитов и сбросом структурных компонентов. Они влияют на метаболический гомеостаз путем местной иммунной модуляции слизистой оболочки и путем отдаленных изменений метаболических органов, таких как жировая ткань, мышцы и печень (Рисунок 7) [66].
Традиционная и новая современная роль иммунной системы в обеспечении противоинфекционной и противоопухолевой защиты, заключается в участии в регуляции системного метаболического гомеостаза. Перекрестная связь между иммунной и метаболической системами играет ключевую роль в поддержании «метаболического здоровья» на протяжении всей жизни организма и играет фундаментальную роль в его адаптации к постоянно меняющимся условиям окружающей среды и доступности питания. Современное понимание взаимодействий иммунитета и метаболизма, между отдельными людьми и между популяциями, указывает на будущие направления исследований, которые, возможно, позволят использовать иммунитет как средство персонализированного лечения общих метаболических нарушений [66].
Актуальность иммуно-метаболического взаимодействия при метаболических нарушениях, заключается в сложных взаимодействиях между иммунной и метаболической системами, и лучше всего проявляется в нескольких определенных состояниях метаболических нарушений, начиная от чрезмерного или недостаточного питания и заканчивая явными проявлениями метаболического синдрома. В большинстве случаев нарушенного метаболизма воспаление является способствующим или регулирующим фактором и включает иммунную сигнализацию либо в истинных гемопоэтических иммунных клетках, либо в тканевых резидентных клетках.
Метаболическое здоровье и вклад иммунитета в метаболические риски, определяемые на различных физиологических этапах жизни и доступности питания, огромное. Несмотря на значительный скачок в нашем понимании связей между иммунной и метаболической системами и выявление ключевых новых алгоритмов и инструментов, которые модифицируют эти взаимодействия, демонстрируют еще более сложные отношения. Будущие перспективы будут сосредоточены на углублении нашего молекулярного понимания иммуно-метаболических перекрестных связей, влияний окружающей среды и микробиома на эти взаимодействия, а также на изучении их значимости для человека в гомеостатических или болезненных условиях.
Использование этих знаний поможет нам во всех аспектах поддержания здоровья и профилактики заболеваний. Детальное профилирование иммунных маркеров, генетики хозяина, эпигенетики и конфигураций микробиома может быть полезно для профилактики и ранней диагностики у лиц, подверженных метаболическим заболеваниям. Аналогичным образом, вмешательства, нацеленные на ключевые центры иммунно-метаболических взаимодействий, могут быть использованы для изменения иммунного вклада в метаболические заболевания. Понимание на молекулярном уровне перекрестных иммуннометаболических взаимодействий, а также связанных с окружающей средой и микробиомом модификаций этой коммуникационной сети может позволить лучше понять формирующие силы, определяющие иммунный и метаболический гомеостаз и патогенез иммунноопосредованных или ассоциированных метаболических заболеваний [66–67].
В дополнение к этой пространственной зональности метаболических функций циркадные часы накладывают временной ритм на экспрессию генов гепатоцитов, который синхронизирует метаболизм гепатоцитов с суточными ритмами питания и голодания [68].
Основная функциональная единица метаболических органов состоит из паренхиматозных, иммунных и стромальных клеток, которые непрерывно взаимодействуют друг с другом и с окружающей средой. В жировой ткани, это координированное восприятие метаболитов опосредуется датчиком жирных кислот PPARy, тогда как в печени оно может быть организовано рецептором оксистерола LXRa. На основную функциональную единицу накладываются нейрональные, гормональные и циркадные входы, которые устанавливают координацию между метаболическими органами, необходимыми для адаптации к вызовам окружающей среды (Рисунок 10) [68].
A
Spatial
Zone-specific gene program
Blood flow
Pericentral
Wnt
P-catenin/Tcf
Periportal HRas
Oxygen |
Gluconeogenesis (PEPCK, G6PC, FBP1)
Glycolysis (GK)
Fatty acid oxidation (CPT1)
De novo lipogenesis (FAS, ACC, ACL)
Cholesterol synthesis (HMG-CoA-reductase)
Bile acid synthesis (CYP7A1)
Oxidative energy metabolism (mitochondria)
Glycolysis
Xenobiotic detoxification (sulfation)
Ureagenesis (CPS)
Xenobiotic biotransformation (P450 enzymes, gtuouronidation)
Glutamine synthesis (GS)
Рисунок 10. Метаболическая и иммунная зональность печени [68]. А) модель того, как метаболические и иммунные функции могут быть зонированы в печени. B) метаболическая зональность печени
Мозг регулирует кишечник и его микробиоту посредством нейроанатомических, иммунологических и нейроэндокринных нейросетевых путей, сообщающихся с помощью нейромедиаторов, нейропептидов или продуктов микробного происхождения, влияющих на микробиоту кишечника. Соответственно, микробиота кишечника влияет на мозг. Эти два способа формируют двунаправленную связь и взаимодействие между кишечником и мозгом (Рисунок 11) [69–70].
Дисбактериоз кишечника может быть вызван различными факторами окружающей среды, в том числе, такими как диета, стресс, воздействие антибиотиков, токсинов, лекарств и патогенов.
В исследовании [71], установлено, что микробиом играет ключевую роль в сохранении здоровья и профилактике заболеваний, и существует значительный интерес к терапевтическому таргетированию микробиома, а также к разработке этого богатого ресурса в усилиях по открытию лекарств. Однако все больше данных свидетельствует о том, что микробиота кишечника сама может влиять на действие целого ряда ксенобиотиков, как благотворно, так и потенциально вредно. Традиционно клинические исследования, оценивающие фармакокинетику новых лекарственных средств, в основном игнорируют важное прямое и косвенное влияние микробиома кишечника на метаболизм и эффективность лекарственных средств. Несмотря на некоторые важные наблюдения за метаболизмом ксенобиотиков в целом, существует лишь неполное представление о масштабах влияния микробиома конкретно на метаболизм и абсорбцию лекарственных средств, а также о том, как это может влиять на системные концентрации исходных соединений и токсичных метаболитов.
Значение как микробного метаболизма ксенобиотиков, так и влияния микробиома кишечника на ферментные системы печени хозяина, тем не менее, набирает обороты и представляет собой дополнительную проблему в усилиях по открытию лекарственных средств, имеющих последствия для улучшения результатов лечения или противодействия неблагоприятным лекарственным реакциям. В настоящее время микробные факторы должны учитываться при определении фармакокинетики лекарственных средств и влияния, которое эволюционирующий и динамичный микробиом может оказывать в этом отношении. Интегрировав вклад микробиома кишечника в сохранение здоровья и патогенез болезней к метаболизму ксенобиотиков, сосредоточив внимание на терапевтических вмешательствах, фармакологическом действии лекарственных средств и химических биотрансформациях, которые в совокупности являются стратегическими в доказательной медицине (Рисунок 12) [71].
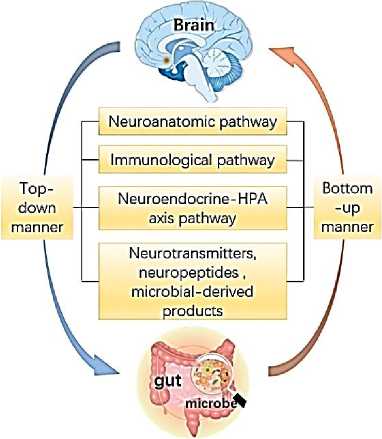
Рисунок 11. Взаимодействие мозга и микробиоты. Общая концепция двунаправленной оси: кишечник-мозг-микробиота [69–70]
-
А) метаболические ниши в микробиоме кишечника. Локализация и пространственная организация кишечной микробиоты неоднородны по всему желудочно-кишечному тракту. Эта динамическая экосистема кишечника состоит из многих уникальных особенностей, таких как микрониши, градиенты рН и динамические микробно-тканевые взаимодействия, имеющие отношение к микробной биотрансформации. Самая высокая плотность бактерий присутствует в толстой кишке, причем последние оценки 1013 бактериальных клеток в толстой кишке связаны с микробными генами, кодирующими широкий спектр ферментов, необходимых для биотрансформации ксенобиотиков. Эти бактерии, вероятно, наиболее важны для фармакомикробиомики и обитают в реакционной камере со средним рН 6,4–7,0 и более низким окислительно-восстановительным потенциалом, чем другие желудочнокишечные ниши. Парциальное давление кислорода по желудочно-кишечному тракту также вносит свой вклад в эти метаболические ниши.
-
B) факторы, влияющие на состав и функционирование метаболической ниши толстой кишки. На композиционные характеристики микробиома кишечника оказывает влияние целый ряд факторов, при этом начальный посев и траектория движения к здоровому подобию взрослому разнообразию и стабильности определяются способом доставки (естественный или кесарево сечение) и ранними схемами кормления (грудное вскармливание против искусственного вскармливания). Генетика хозяина также играет определенную роль, как и географическое положение, в то время как стресс на протяжении всей жизни может рассматриваться как угроза для разнообразия микробиома кишечника. Считается также, что «западная» диета нарушает целостность микробиома кишечника, в то время как повышенное
потребление клетчатки связано с повышенным разнообразием. Физические упражнения могут также способствовать стабильности микробиома здоровья, хотя процесс старения связан с сужением разнообразия, как и многие болезненные состояния и чрезмерное/ нецелесообразное использование антибиотиков (Рисунок 12) [71].
104- 1t)’CFU/ml pOj 33 mm Hg
Bifidobacterium, Bacteroides, Lactobacillus, Streptococcus, Enterobacteriaceae
■Stomach pH 1-3
10’-1 Лги'Til pC?77mmHg
Lactobacillus, Streptococcus,
Staphyfococcus,Enterobactenoceae
F Colon pH 7 lO’ffiJ’cRJ/Ml pO2<33mmHg Bacteroides, Eubacteruim, Clostridium, Peptostreptocossus, Streptococcus, Bifidobacterium, Fusobacterium, Lactobacillus, Enterobacteriaceae
enum rCFU/ml pO233 mmHg
Lactobacillus, Streptococcus, Staphylococcus, Enterobacteriaceae
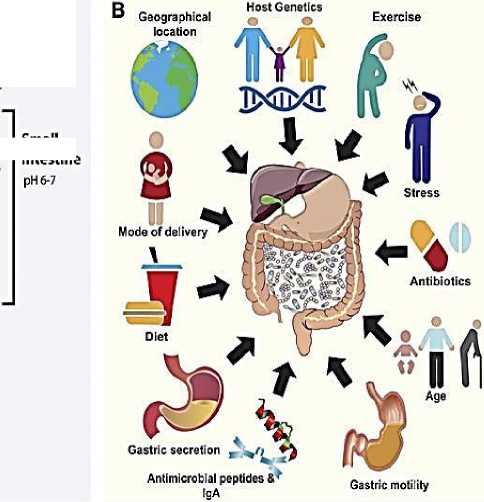
Рисунок 12. Метаболические ниши в микробиоме пищеварительного тракта, их локализация и пространственная организация [71]
-Small
Intestine
Научные данные, касающиеся микробиоты кишечника, позволяют объяснить связь между питательными веществами и чертами человека. Микробиота кишечника не только непосредственно взаимодействует с соматическими клетками своего хозяина, влияя на особенности человека, как в случае тренировки иммунологических сетей, но и вырабатывает различные химические вещества, которые могут непосредственно модифицировать биохимические пути человека.
Состав микробиоты кишечника колеблется в зависимости от поглощения питательных веществ его хозяином, и состав микробиоты кишечника влияет на различные человеческие черты так же сильно, как и наши гены. Поэтому вполне разумно предположить, что воздействие питательных веществ на человеческие черты будет представлять собой комбинированные результаты как микробиоты кишечника, модифицированной поглощением питательных веществ, так и самих питательных веществ. Исследовано, что микробиота кишечника является недостающим звеном между питательными веществами и модификациями человеческих черт [72].
Научные данные, касающиеся микробиоты кишечника, позволяют объяснить связь между питательными веществами и чертами человека. Микробиота кишечника не только непосредственно взаимодействует с соматическими клетками своего хозяина, влияя на особенности человека, как в случае тренировки иммунологических сетей, но и вырабатывает различные химические вещества, которые могут непосредственно модифицировать биохимические пути человека.
Состав микробиоты кишечника колеблется в зависимости от поглощения питательных веществ его хозяином, и состав микробиоты кишечника влияет на различные человеческие черты так же сильно, как и наши гены. Поэтому вполне разумно предположить, что воздействие питательных веществ на человеческие черты будет представлять собой комбинированные результаты как микробиоты кишечника, модифицированной поглощением питательных веществ, так и самих питательных веществ. Исследовано, что микробиота кишечника является недостающим звеном между питательными веществами и модификациями человеческих черт. Влияние микробиоты кишечника на фенотипы человека стало бурно развивающейся областью исследований и представляет собой новую парадигму возможностей для применения в медицине и пищевой промышленности [72].
Многочисленные современные исследования, установили следующие функции кишечной микробиоты:
-
1. Защитная функция (колонизационная резистентность) заключается в предотвращении колонизации желудочно-кишечного тракта условно-патогенными и патогенными микроорганизмами. Микробный антагонизм реализуется посредством конкуренции за питательные вещества и рецепторы адгезии, а также за счет выработки органических кислот, перекиси водорода, антибиотикоподобных веществ — бактерицинов, препятствующих росту патогенных микроорганизмов.
-
2. Пищеварительная функция реализуется за счет, как регуляции функций кишечника, так и непосредственной утилизации питательных субстратов. Облигатная микрофлора толстой кишки в норме обеспечивает конечный гидролиз белков, омыление жиров, сбраживание высокомолекулярных углеводов, которые не абсорбировались в тонкой кишке. Протеолитические микроорганизмы (бактероиды, нормальная кишечная палочка) ферментируют протеины. Некоторые поступающие с пищей вещества могут метаболизироваться только кишечной микрофлорой. Так, сахаролитическая микрофлора расщепляет целлюлозу и гемицеллюлозу до короткоцепочечных жирных кислот.
-
3. Детоксикационная и антиканцерогенная функция. Нормальная микрофлора способна нейтрализовать многие токсические субстраты и метаболиты (нитраты, ксенобиотики, гистамин, мутагенные стероиды), предохраняя энтероциты и отдаленные органы от воздействия повреждающих факторов и канцерогенов.
-
4. Синтетическая функция. Нормальная микрофлора обеспечивает синтез многих макро- и микронутриентов: витаминов группы В, С, К, фолиевой, никотиновой кислоты. Только кишечная палочка синтезирует 9 витаминов. Синтез гормонов и биологически активных веществ лежит в основе регуляторного действия микрофлоры на функции внутренних органов и ЦНС.
-
5. Иммунная функция. Как известно, слизистая оболочка кишечника обладает собственной лимфоидной тканью, известной как GALT (gut-associated lymphoid tissue), которая является одним из значимых компонентов иммунной системы макроорганизма. В слизистой оболочке кишечника локализовано около 80% иммунокомпетентных клеток, 25% слизистой оболочки кишечника состоит из иммунологически активной ткани. Таким образом, кишечник можно рассматривать как самый большой иммунный орган человека. Микрофлора участвует в формировании как местного (активация продукции IgА, фагоцитарной активности), так и системного иммунитета. Само наличие бактерий оказывает постоянное антигенное тренирующее действие.
-
6. Генетическая функция. Микробиота является своего рода «генетическим банком», обмениваясь генетическим материалом с клетками человека путем фагоцитоза. В результате этого микробиота приобретает рецепторы и другие антигены, присущие хозяину и делающие ее «своей» для иммунной системы. Эпителиальные ткани в результате такого обмена
-
7. «Суперорганизменная». Кишечная микрофлора — сложнейший «суперорганизм», не уступающий любому другому жизненно важному органу.
приобретают бактериальные антигены. Известно также, что микроорганизмы влияют на экспрессию генов макроорганизма.
Хронотерапия
Хронотерапия сегодня рассматривается как перспективный метод повышения эффективности лечения, для обоснованной реализации которого требуется оценка индивидуальных особенностей фазы ЦР. Целесообразно выделить два принципа хронотерапии:
-
1) результативный (стратегия оптимизации времени воздействия фактора (лечебного, или профилактического) для достижения наилучшего результата. Основана на обоснованном выборе нужного времени и оптимальном балансе между фазами эффективности (ритма чувствительности) и снижения возможных побочных эффектов (ритма токсичности);
-
2) превентивный (стратегия упреждения фактора в пиковые часы его риска). Данный принцип основан на знании хроноэпидемиологии заболевания.
Примером первой, «результативной» стратегии, является научно обоснованное управление временем приема пищи, что самостоятельно, без приема препаратов, снижает уровень сахара и артериального давления, повышая чувствительность к инсулину, модулируя иммунитет, не оказывая при этом влияния на массу тела [73–74]. В свою очередь, управление временем приема препаратов способно существенно увеличивать их действенность, без повышения дозировки [75–78]. Примером второй, «превентивной» стратегии является назначение антикоагулянтов, статинов и гипотензивных препаратов для обеспечения их максимального эффекта в утренние часы, когда риск сердечно-сосудистых катастроф максимален [78–79].
Новые разработки в области хронофармакологии — это создание формул «ретард» препаратов, высвобождающих действующее вещество постепенно. Примером также может служить мелатонин, который при приеме на ночь дает максимально выраженный гипотензивный эффект в ранние утренние часы [80–85].
Другой пример — модуляция физиологической динамики при заместительной терапии гормональными препаратами. В таких случаях может быть необходимо учитывать и модулировать не только параметры циркадного, но и ультрадианных ритмов, иначе целевого эффекта лечения не удается достичь [86–87].
Альтернативный пример — ритм артериального давления, имеющий в своей суточной динамике как эндогенный, так и стохастический компоненты [88–89].
Соответственно, хронотерапия артериальной гипертензии может быть основана как на результативном подходе (например, для достижения должного снижения ночного АД), так и на превентивном — например для предотвращения резкого утреннего подъема, являющегося одним из кофакторов утреннего пика сердечно-сосудистых катастроф. Причем, для достижение наилучших результатов хронотерапии следует учитывать этно-популяционные и индивидуальные особенности генетического полиморфизма ряда генов, которые могут оказывать влияние на ее эффективность [90].
Также хронотерапия может быть основана на
-
1) хроностандартизованном подходе (время назначения, дозировка и кратность воздействия одинаковы для всех, вне зависимости от индивидуальных особенностей ЦФТ, подлежащего коррекции), либо
-
2) хроноселективном подходе (время назначения, дозировка и кратность применения
воздействия подбираются индивидуально и зависят от особенностей параметров ЦФТ, подлежащего коррекции.
Примером хроностандартизованного подхода является, обоснование более высокой результативности лечения артериальной гипертензии при приеме препаратов в вечернее время для достижения должного снижения ночного АД [91–92] или коррекция возрастных проявлений ДС (нарушений сна, температуры и ритма артериального давления) или светового ДС с помощью малых доз мелатонина, назначаемых в 22:30 [93].
Настоящее и будущее уже очевидно, что применение хронобиологического подходя является неотъемлемым условием современной диагностики заболеваний. Хронотерапия, в свою очередь, на ряду с фармакогеномикой представляют собой два главных принципа персонализированной стратегии лечения и профилактики. Важнейшими условиями для прорыва и трансляции фундаментальных знаний хронобиологии в практическое здравоохранение (хрономедицину) являются:
-
1) Разработка универсальных критериев методологии сбора, анализа и интерпретации результатов динамических наблюдений, и создание банков данных динамических наблюдений (БДДН) в системе создаваемых медбиобанков и
-
2) Разработка простого, но точного метода оценки фазы биологических часов (фазы эндогенного циркадного ритма).
Персонализированная хронофармакология АГ
Разработка лекарственных препаратов, способных к нормализации патологически измененных биологических ритмов — перспективное направление фармакологии ХХI в [94].
Хронофармакология — наука, предметом изучения которой является изменчивость фармакодинамических и фармакокинетических показателей лекарственных средств (ЛС) в зависимости от временных факторов его введения (периода суток, месяца, сезона года), а также оценка влияния лекарственных препаратов на биологические ритмы.
Использование полученных знаний для оптимизации лечебного процесса путем увеличения эффективности терапии и уменьшения риска побочных эффектов за счет учитывания временного фактора составляет сущность хронофармакотерапии .
Хронофармакология и хронотерапия сформировались на основе знаний о регуляции биологических ритмов человека, а также новых данных, свидетельствующих о временной зависимости чувствительности организма к внешним, в том числе фармакологическим, воздействиям.
Хронофармакокинетика. Влияние циркадианных ритмов на фармакокинетику, в первую очередь опосредованное через гормональные системы организма, связано с влиянием на всасывание, распределение, метаболизм и выведение лекарственных препаратов.
В течение суток изменяются: интенсивность всасывание лекарственных препаратов в тонком кишечнике; pH желудочного сока (которая могут быть обусловлена как естественным околосуточными колебаниями секреции, так и ритмом приема пищи); связывающая способность белков крови; активность ферментов, метаболизирующих лекарственные вещества; интенсивность почечного и печеночного кровотока.
К примеру, установлен суточный ритм метаболизма пропранолола, определяемого в большей степени скоростью печеночного кровотока, с максимальным значением к 16–19 часам. Среднесуточный уровень кортизола повышается на 20–50% между 20 и 80 годами жизни, преимущественно за счет повышения минимального уровня гормона в вечерние часы, что приводит к снижению амплитуды циркадианного ритма кортизола и может являться одной из причин нарушений сна у пожилых людей.
В норме изменение АД у человека подвержено циркадианным ритмам. В ночные часы снижается активность симпатоадреналовой системы, что обуславливает уменьшение периферического сопротивления сосудов и сердечного выброса. Наибольшее снижение АД наблюдается примерно в 3 ч, затем к 6–7 часам утра АД постепенно повышается.
До 70% пациентов с артериальной гипертензией также имеют циркадные ритмы изменения АД, которые хорошо обнаруживаются при его суточном мониторировании.
Однако у больных АГ происходит смещение нормальных циркадных ритмов, из-за чего наиболее часто подъем артериального давления (вплоть до развития гипертонического криза) наблюдается в 16–24 часов. Поэтому с позиции хронопатологии, более эффективной считается превентивная схема хронотерапии АГ, когда тот или иной гипотензивный препарат назначается до наступления акрофазы АД. Для лечения ССЗ был также предложен метод совпадения акрофаз (времени максимального значения показателей — АД и ЧСС). Предполагается, что совпадение акрофаз АД и ЧСС может служить дополнительнымм аргументом в пользу назначения бета-адреноблокаторов, а несовпадение акрофаз является поводом для назначения других антигипертензивных препаратов, в частности ингибиторов АПФ.
Превентивный метод хронотерапии в клинической практике [94]: отказ от приема нитратов ночью, когда риск приступов стенокардии минимален, для уменьшения вероятности развития толерантности; прием аспирина утром, когда вязкость крови повышена, для усиления антиагрегантного эффекта; вторичный превентивный прием β1-адреноблокаторов, эффект которых максимален в утренние часы; новые лекарственные формы верапамила, соданные для контроля АД и ЧСС, принимаемые на ночь, около 22 часов; пролонгированные таблетированные формы теофиллина, назначаемые в вечерние часы для предупреждения ночных приступов бронхиальной астмы; прием статинов в утренние часы, когда синтез холестерина печенью наиболее интенсивен; однократный прием антагонистов H2-рецепторов гистамина в вечерние часы, прием ингибиторов протонной помпы в утренние часы;
Второй способ использования лекарственных препаратов по принципам хронотерапии основывается на уже установленных закономерностях изменений концентрации определенных веществ в крови и тканях в соответствии с характерных для здорового индивидуума биоритмом. В этой связи этот способ обозначается как имитационный метод хронотерапии. Он успешно используется при заместительной гормональной терапии, в частности назначении в утренние часы метилпреднизолона, тестостерона [94].
Третий метод хронотерапии [94] основан на использовании лекарственных и нелекарственных воздействий для навязывания организму больного определенных ритмов, приближающихся к нормальным ритмам здоровых людей. Этот метод является не только способом оптимизации введения препарата, но и принципиально новой формой лечения, способом нормализации нарушенных функций биосистем воздействиями, применяемыми с учетом закономерностей их временной организации. Метод лежит в основе пульс-терапии (введение через определенные интервалы времени высоких доз глюкокортикоидов, цитостатиков).
Время приема лекарств от артериального давления имеет значение. Современные рекомендации по лечению АГ не определяют предпочтительного времени для лечения препаратами, снижающими АД, но наиболее распространенной рекомендацией клиницистов является утреннее лечение. Однако новые результаты исследования Hygia Chronotherapy показывают, что прием антигипертензивных препаратов перед сном связан с лучшим контролем АД и снижением риска ССЗ на 45% по сравнению с приемом лекарств утром после пробуждения [95]. Это многоцентровое контролируемое проспективное исследование проводилось в условиях первичной медико-санитарной помощи и включало 19 084 пациента с артериальной гипертензией (10 614 мужчин и 8470 женщин), которым было назначено более одного препарата, снижающего ад. Пациенты были рандомизированы, чтобы принять всю свою суточную дозу антигипертензивных препаратов либо перед сном, либо после пробуждения. Амбулаторный мониторинг АД в течение 48 ч проводился исходно и при каждом плановом посещении клиники. После медианы в 6,3 года группа лечения перед сном улучшила контроль АД с более низким систолическим АД во сне (САД) и большим относительным снижением сад во время сна (то есть снижением АД) по сравнению с группой утреннего лечения. Кроме того, первичный исход ССЗ (сочетание смерти от ССЗ, инфаркта миокарда, коронарной реваскуляризации, сердечной недостаточности или инсульта) произошел у меньшего числа пациентов в группе лечения на ночь, чем в группе лечения утром (ОР 0,55, 95% Ди 0,50–0,61). Анализ отдельных компонентов первичного результата показал сходные результаты. Таким образом, время лечения, по-видимому, важно для контроля АД и защиты от ССЗ. Тем не менее, механизм для преимущества дозирования перед сном неясен. Текущие крупномасштабные испытания, оценивающие сроки антигипертензивного лечения, могут дать дополнительное представление о роли циркадных схем (картин) лечения [95].
Дозировка препарата в ночное время при АГ может снизить риск развития ССЗ [96]. Прием назначенных препаратов для лечения АГ перед сном может позволить циркадному ритму организма усилить их действие, что приводит как к лучшему контролю АД, так и к большему снижению риска серьезных сердечно-сосудистых событий, предполагает крупное испанское исследование «Это новое исследование на сегодняшний день является самым крупным из когда-либо проводившихся в области хронотерапии гипертонии и с самой длительной продолжительностью наблюдения» [96]. В ходе исследования Chronotherapy было рандомизировано более 19 000 пациентов с АГ, которые принимали свои лекарства -блокаторы рецепторов ангиотензина (БРА), ингибиторы АПФ, блокаторы кальциевых каналов, бета-блокаторы и/или диуретики-утром или непосредственно перед сном. В среднем через 6,3 года у людей, принимавших лекарства ночью, а не утром, наблюдалось большее снижение среднего систолического и диастолического давления во время сна. Кроме того, меньшее количество пациентов в ночной группе были классифицированы как «недипперы», термин, используемый для обозначения пациентов, которые не достигают среднего снижения на 10% или более во время сна (37% против 50%). Наиболее значимо, что в группе ночного приема лекарств наблюдалось 45%-ное снижение комбинированной первичной конечной точки им, коронарной реваскуляризации, сердечной недостаточности, ишемического инсульта, геморрагического инсульта и смерти от ССЗ. Результаты были аналогичны для вторичных индивидуальных конечных точек инсульта, коронарных событий и сердечных событий [96].
АД во сне является прогностическим фактором риска ССЗ . Пациентов были рандомизировали на дневные или ночные стратегии в период с 2008 по 2018 год, причем врачи первичной медико-санитарной помощи назначали им терапию без ограничений. Наиболее частыми монотерапевтическими препаратами были валсартан или телмисартан, Эналаприл или Рамиприл и Амлодипин. Распространенными стратегиями двойного комбинирования были ингибиторы БРА/АПФ плюс мочегонное средство, которым в большинстве случаев был гидрохлоротиазид в дозах до 25 мг/сут.
В течение всего периода исследования пациентам измеряли офисное артериальное давление при каждом посещении и давали амбулаторные мониторы для ношения в течение 48 часов. Эти визиты проводились ежегодно или чаще, если АГ была неконтролируемой или если пациенты имели сопутствующие заболевания, такие как диабет, хроническая болезнь почек или в прошлом имели ССЗ [97].
Хронотерапия для лечения АГ у пациентов с обструктивным апноэ сна. Обструктивное апноэ сна (СОАС) и АГ поражают более 100 миллионов человек в США и за рубежом [97– 99]. АГ и обструктивное апноэ сна (СОАС) связаны с повышенным риском неблагоприятных сердечно-сосудистых событий. Коморбидная АГ с СОАС часто резистентна к фармакологическому лечению. Хронотерапия, выбор времени лечения, основанный на циркадных ритмах, может оказаться ценным и экономически эффективным инструментом для улучшения контроля артериального давления (АД) у пациентов с СОАС. Были изучены различные исходы. Из всех исследований, в которых изучалось среднее дневное и среднее ночное АД, все, кроме одного, обнаружили значительное снижение по сравнению с исходным уровнем в обеих переменных независимо от используемого лекарства или времени лечения. Из четырех исследований, в которых изучался паттерн снижения АД, в двух было обнаружено значительное увеличение процента участников с нормальным паттерном снижения, в одном-незначительное увеличение, а в одном-отсутствие увеличения. Одно исследование и тематическое исследование сообщают о влиянии на скачок АД во сне вторичного по отношению к гипоксемии и естественному раннему утреннему скачку АД. Исследование показало, что β-блокатор Карведилол был более эффективен в снижении вызванного гипоксией скачка АД во сне, в то время как блокатор кальциевых каналов Нифедипин был более эффективен в снижении естественного утреннего скачка АД, а селективный конкурентный блокатор постсинаптических α1-адренорецепторов — Доксазозин был эффективен в снижении обоих показателей у одного пациента. Полученные данные свидетельствуют о том, что ночное и дневное введение антигипертензивных препаратов может оказывать большее влияние на улучшение показателей АД у взрослых. Современная литература недостаточна для того, чтобы сделать надежные выводы относительно эффективности хронотерапии в целевой популяции. Успех, отмеченный в некоторых исследованиях, подтверждает необходимость изучения этого вмешательства в будущих исследованиях [99].
Хронотерапия АГ. С появлением новых знаний о том, что циркадный ритм существует в каждой клетке и во всех системах органов, растет интерес к возможным преимуществам хронотерапии при многих заболеваниях. Существует [100], хорошо документированная 24часовая картина артериального давления с утренним всплеском, которая может способствовать наблюдаемому утреннему увеличению неблагоприятных сердечнососудистых событий. Исторически сложилось, что антигипертензивная терапия включает утренние дозы, обычно направленные на снижение дневных скачков артериального давления, но отсутствие ночного снижения артериального давления также связано с повышенным сердечно-сосудистым риском. К большему эффективно снижая ночное артериальное давление и все еще противодействуя утреннему скачку артериального давления, в ряде исследований рассматривалось перемещение одного или нескольких антигипертензивных средств с утреннего приема на ночь. Совсем недавно такие исследования хронотерапии изучали популяции коморбидных заболеваний, включая обструктивное апноэ сна, хронические заболевания почек или диабет. Суммируя [100], основные выводы последних исследований в этой области (2013–2017 гг.). В целом ночное введение антигипертензивных средств улучшало общее 24-часовое АД профили вне зависимости от сопутствующей патологии заболевания. Однако несоответствия между исследованиями указывают на необходимость проведения более перспективных рандомизированных контролируемых исследований с достаточной статистической силой. Кроме того, экспериментальные исследования по определению механизмов, с помощью которых хронотерапия является полезной, могут помочь в разработке лекарственных препаратов и руководящих принципов для своевременного введения [100].
В целом ночное введение антигипертензивных препаратов улучшало общий 24-часовой профиль АД независимо от сопутствующей патологии и не вызывало повышенного риска, поэтому его следует серьезно рассматривать для лечения АГ в общей популяции, а также при АГ с определенными сопутствующими заболеваниями.
Диабетическая ассоциация сделала такую рекомендацию, что потенциально отражает дальнейшую необходимость проведения проспективных рандомизированных исследований в больших и разнообразных популяциях с уже существующими сопутствующими заболеваниями, позволяющими получить достаточную статистическую мощность для проведения анализа подгрупп. Кроме того, доклинические исследования для выяснения механизмов, с помощью которых хронотерапия является полезной, могут помочь в разработке антигипертензивных препаратов и рекомендаций по их своевременному введению. Эта область может продвинуться дальше, сосредоточившись на механистической основе использования лекарств перед сном, а не просто перемещая лекарство с утра на ночь дозирование. Например, механизмы, лежащие в основе повышенного риска ССЗ из-за отсутствия снижения АД, пока неясны. Кроме того, эти механизмы, которые могут быть связаны со временем приема пищи, режимом сна или эндогенными циркадными ритмами, могут по-разному влиять на регуляторы ад (например, на сердце, почки или сосудистую систему). Последнее может потребовать персонифицированной медицины для отдельных лиц, таких как вахтовые рабочие, которые часто следуют нетипичным схемам сна и питания или разработке лекарств, которые оптимизируют биодоступность и натуралистические ритмы лекарственных мишеней [100].
Исследовано, что доля и продолжительность БДГ-сна отрицательно связаны со смертностью от всех причин. Это открытие подчеркивает важность персонализированного управления сном в общинных популяциях. Процесс сна можно разделить на две основные фазы: сон без быстрого движения глаз (NREM) и сон с быстрым движением глаз (REM). Первая состоит из трех стадий (N1, N2, N3) и составляет от 75% до 80% общего сна, в то время как на вторую приходится примерно от 20% до 25% общего сна. Быстрый сон характеризуется низковольтным высокочастотным паттерном в бета-или тета-диапазоне на электроэнцефалографе (ЭЭГ), а также ослаблением мышечного тонуса и быстрым сном. Подобно бодрствованию, БДГ-сон — это высокоактивное психическое состояние, связанное со сновидениями, приостановленной терморегуляцией и вегетативными нарушениями [101]. Кроме того, БДГ-сон играет важную роль в раннем развитии сенсорных систем (зрительных, слуховых и т. д.), а также функции обучения и памяти путем избирательного поддержания вновь образованных синапсов [102].
За последнее десятилетие накопились доказательства связи быстрого сна с неврологическими и сердечно-сосудистыми заболеваниями. Более того, предыдущие исследования показали, что меньшая доля быстрого сна связана с повышенным соотношением АД во сне и бодрствовании, что может увеличить риск ССЗ и смертности. Установлено, что более длительная фаза REM ускоряет выздоровление после инсульта [102].
Стратегический аспект, циркадные ритмы важны для сердечно-сосудистой физиологии и патофизиологии. Ведущим фронтиром для исследований циркадной биологии является трансляционное применение в клинической медицине, и особенно в сердечно-сосудистом здоровье и болезнях. Интересно, что недавние клинические и экспериментальные исследования выявили глубокие различия в сердечно-сосудистых заболеваниях у мужчин и женщин. Учет пола и/или гендера повышает эффективность исследований и может принести пользу результатам инноваций в области здравоохранения для мужчин и женщин. Более того, учет биологического пола является важным фактором для перевода циркадной биологии в клиническую кардиологию.
Таким образом, разработка лекарственных препаратов, способных к нормализации патологически измененных биологических ритмов — перспективное направление фармакологии XXI века.
Выводы
Нейропластичность — это внутреннее свойство и перепрограммирование мозга на протяжении всей его жизнедеятельности.
Нейрогенетика является центром мультидисциплинарных и межведомственных исследований, использующих передовые методы, с участием 5П-медицины и 5G-технологии.
Генетическая регуляции сна через циркадную систему, влияние дисрегуляции экспрессии генов на метаболические функции, актуализировали роль циркадных часов в управлении сердечно-сосудистой и нервной системами, микробиотой кишечника, онкологией и старением.
Многие биохимические процессы в гиппокампе, такие как синтез белков и нейромедиаторов, синаптическая возбудимость и высвобождение нейрогормонов, демонстрируют циркадные колебания. Циркадная регуляция локальных биохимических процессов в гиппокампе, вероятно, является механизмом, посредством которого циркадная система накладывает временную регуляцию на различные биологические функции.
БДГ-сон — это высокоактивное психическое состояние, связанное со сновидениями, приостановленной терморегуляцией и вегетативными нарушениями. Продолжительность БДГ-сна отрицательно связаны, со смертностью от всех причин. Это открытие подчеркивает важность персонализированного управления сном в общинных популяциях.
Биологический пол является важным фактором для перевода циркадной биологии в клиническую кардиологию.
Циркадианная вариабельность реактивности кровеносных сосудов и активности факторов свертывания крови способствует развитию утренней гиперкоагуляции.
Циркадный ритм оказывает влияние на активацию процессов свертывания крови в утренние часы с прогрессирующей активацией фибринолиза вплоть до полудня.
Суточные изменения вязкости крови, плазмы и гематокрита с акрофазой в утренние часы создают определенный фон, который в сочетании с другими факторами риска — колебаниями артериального давления, изменением уровня глюкозы — способствует развитию острой ишемии головного мозга, а в определенных случаях утренние изменения гемостаза могут быть решающим фактором возникновения ишемического инсульта.
Современная хронотерапия — перспективный метод повышения эффективности лечения, для обоснованной реализации которого требуется оценка индивидуальных особенностей фазы циркадианных ритмов.
Новое понимание молекулярных и клеточных путей, по которым сердечно-сосудистые события происходят в суточном колебательном паттерне, поможет создать новый терапевтический подход к лечению сердечно-сосудистых заболеваний.
Циркадианная дозировка лекарственного препарата в ночное время при артериальной гипертонии может снизить риск развития сердечно-сосудистых заболеваний.
Список литературы Гемостаз и когнитивный мозг: 5П-медицина и хронотерапия артериальной гипертонии
- Волобуев А. Н., Романчук Н. П., Булгакова С. В. Нейрогенетика мозга: сон и долголетие человека // Бюллетень науки и практики. 2021. Т. 7. №3. С. 93-135. https://doi.org/10.33619/2414-2948/64/12
- Волобуев А. Н., Романов Д. В., Романчук П. И. Природа и мозг человека: парадигмы обмена информацией // Бюллетень науки и практики. 2021. Т. 7. №1. С. 59-76. https://doi .0^/10.33619/2414-2948/62/06
- Сиротко И. И., Волобуев А. Н., Романчук П. И. Генетика и эпигенетика болезни Альцгеймера: новые когнитивные технологии и нейрокоммуникации // Бюллетень науки и практики. 2021. Т. 7. №2. С. 89-111. https://doi.org/10.33619/2414-2948/63/09
- Романчук Н. П. Здоровая микробиота и натуральное функциональное питание: гуморальный и клеточный иммунитет// Бюллетень науки и практики. 2020. Т. 6. №9, С. 127166. https://doi.org/10.33619/2414-2948/58/14
- Романчук П. И. Возраст и микробиота: эпигенетическая и диетическая защита, эндотелиальная и сосудистая реабилитация, новая управляемая здоровая биомикробиота // Бюллетень науки и практики. 2020. Т. 6. №2. С. 67-110. https://doi.org/10.33619/2414-2948/51/07
- Романчук П. И., Волобуев А. Н. Современные инструменты и методики эпигенетической защиты здорового старения и долголетия Homo sapiens // Бюллетень науки и практики. 2020. Т. 6. №1. С. 43-70. https://doi.org/10.33619/2414-2948/50/06
- Романчук Н. П. Способ производства зернового компонента для пищевого продукта быстрого приготовления и способ производства функционального пищевого продукта быстрого приготовления. Патент РФ на изобретение №2423873.
- Романчук Н. П., Романчук П. И., Малышев В. К. Продукт диетического, профилактического и функционального питания при хронической ишемии головного мозга// Патент РФ на изобретение № 2489038.
- Романчук Н. П., Пятин В. Ф. Мелатонин: нейрофизиологические и нейроэндокринные аспекты // Бюллетень науки и практики. 2019. Т. 5. №7. С. 71-85. https://doi.org/10.33619/2414-2948/44/08
- Пятин В. Ф., Романчук Н. П., Романчук П. И. Способ нормализации циркадианных ритмов человека. Патент РФ на изобретение 2533965.
- Булгакова С. В., Романчук Н. П. Иммунный гомеостаз: новая роль микро- и макроэлементов, здоровой микробиоты // Бюллетень науки и практики. 2020. Т. 6. №10. С. 206-233. https://doi.org/10.33619/2414-2948/59/22
- Rijo-Ferreira F., Takahashi J. S. Genomics of circadian rhythms in health and disease // Genome medicine. 2019. V. 11. №1. P. 1-16. https://doi.org/10.1186/s13073-019-0704-0
- Litinski M., Scheer F. A. J. L., Shea S. A. Influence of the circadian system on disease severity // Sleep medicine clinics. 2009. V. 4. №2. P. 143-163. https://doi.org/10.1016/jjsmc.2009.02.005
- Макаров А. Н., Мартынов М. Ю., Петухов В. Б., Колесникова Т. И., Ясаманова А. Н., Гусев Е. И. Циркадианные изменения вязкости крови, плазмы и гематокрита и связь с развитием ишемических инсультов полушарной локализации // Лечебное дело. 2014. №4. С. 50-57.
- Esmonde S., Sharma D., Peace A. Antiplatelet agents in uncertain clinical scenarios—a bleeding nightmare // Cardiovascular diagnosis and therapy. 2018. V. 8. №5. P. 647. https://dx.doi.org/10.21037%2Fcdt.2018.06.09
- Кашталап В. В. Кочергина А. М., Кочергин Н. А. Кровотечения при инвазивной тактике ведения пациентов с острым коронарным синдромом: распространенность, современные подходы к оценке риска и профилактике (обзор литературы) // Русский медицинский журнал. 2016. №12. C. 739-743.
- Ducrocq G., Schulte P. J., Becker R. C., Cannon C. P., Harrington R. A., Held C., ... Steg P. G. Association of spontaneous and procedure-related bleeds with short-and long-term mortality after acute coronary syndromes: an analysis from the PLATO trial // Eurolntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. 2015. V. 11. №7. P. 737-745. https://doi.org/10.4244/eijy14m09_11
- Webster E., Gil M. Advances in anticoagulation therapy //Journal of the American Academy of PAs. 2018. V. 31. №2. P. 30-35. https://doi.org/10.1097/01.JAA.0000529772.90897.d6
- Wallentin L., Becker R. C., Budaj A., Cannon C. P., Emanuelsson H., Held C., Harrington R. A. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // New England Journal of Medicine. 2009. V. 361. №11. P. 1045-1057. 10.1056/NEJMoa0904327
- Stone G. W., Ellis S. G., Cannon L., Mann J. T., Greenberg J. D., Spriggs D. Comparison of a polymer-based paclitaxel-eluting stent with a bare metal stent in patients with complex coronary artery disease: a randomized controlled trial // Jama. 2005. V. 294. №10. P. 1215-1223. https://doi.org/10.1001/jama.294.10.1215
- Doyle B. J., Rihal C. S., Gastineau D. A., Holmes D. R. Bleeding, blood transfusion, and increased mortality after percutaneous coronary intervention: implications for contemporary practice // Journal of the American College of Cardiology. 2009. V. 53. №22. P. 2019-2027. https://doi.org/10.1016/jjacc.2008.12.073
- Lee S. Y., Hong M. K., Palmerini T., Kim H. S., Valgimigli M., Feres F., Stone G. W. Short-term versus long-term dual antiplatelet therapy after drug-eluting stent implantation in elderly patients: a meta-analysis of individual participant data from 6 randomized trials // JACC: Cardiovascular Interventions. 2018. V. 11. №5. P. 435-443. https://doi.org/10.1016/jjcin.2017.10.015
- Palmerini T., Della Riva D., Benedetto U., Bacchi Reggiani L., Feres F., Abizaid A., Stone G. W. Three, six, or twelve months of dual antiplatelet therapy after DES implantation in patients with or without acute coronary syndromes: an individual patient data pairwise and network meta-analysis of six randomized trials and 11 473 patients // European heart journal. 2017. V. 38. №14. P. 1034-1043. https://doi .org/10.1093/eurheartj/ehw627
- Mehran R., Rao S. V., Bhatt D. L., Gibson C. M., Caixeta A., Eikelboom J., ... White H. Standardized bleeding definitions for cardiovascular clinical trials: a consensus report from the Bleeding Academic Research Consortium // Circulation. 2011. V. 123. №23. P. 2736-2747. https://doi.org/10.1161/CIRCULATIONAHA.110.009449
- Захарова Н. О., Булгакова С. В., Тренева Е. В., Николаева А. В., Романчук П. И., Нестеренко С. А. Особенности определения и прогностическое значение скорости клубочковой фильтрации у лиц старших возрастных групп с сердечно-сосудистой патологией // Клиническая лабораторная диагностика. 2020. Т. 65. №2. C. 77-83.
- Захарова Н. О., Булгакова С. В., Тренева Е. В., Гусева В. М. Особенности анемического синдрома у гериатрических пациентов с хронической болезнью почек // Клиническая лабораторная диагностика. 2020. Т. 65. №5. C. 275-280.
- Булгакова С. В., Овчинникова Е. А., Захарова Н. О., Тренева Е. В. Состояние микроциркуляторного русла при сочетанном течении ишемической болезни сердца и хронической обструктивной болезни легких у пациентов старческого возраста // Современные проблемы здравоохранения и медицинской статистики. 2020. №1. C. 1-16.
- Дворецкий Л. И. Ятрогения в практике врача. М.: Медицинское информационное агентство. 2018. 328 с.
- Choi J. H., Seo J. M., Lee D. H., Park K., Kim Y. D. Clinical utility of new bleeding criteria: a prospective study of evaluation for the Bleeding Academic Research Consortium definition of bleeding in patients undergoing percutaneous coronary intervention // Journal of cardiology. 2015. V. 65. №4. P. 324-329. https://doi.org/10.1016/jjjcc.2014.06.011
- Angiolillo D. J., Goodman S. G., Bhatt D. L., Eikelboom J. W., Price M. J., Moliterno D. J., Faxon D. P. Antithrombotic therapy in patients with atrial fibrillation treated with oral anticoagulation undergoing percutaneous coronary intervention: a North American perspective-2018 update // Circulation. 2018. V. 138. №5. P. 527-536. https://doi.org/10.1161/CIRCULATI0NAHA.118.034722
- Varenne O., Cook S., Sideris G., Kedev S., Cuisset T., Carrie D., .Sinnaeve P. R. Drug-eluting stents in elderly patients with coronary artery disease (SENIOR): a randomised single-blind trial // The Lancet. 2018. V. 391. №10115. P. 41-50. https://doi.org/10.1016/S0140-6736(17)32713-7
- Alnasser S. M., Bagai A., Jolly S. S., Cantor W. J., Dehghani P., Rao S. V., Cheema A. N. Transradial approach for coronary angiography and intervention in the elderly: a meta-analysis of 777,841 patients // International journal of cardiology. 2017. V. 228. P. 45-51. https://doi.org/10.1016/j.ijcard.2016.11.207
- Serruys P. W., Morice M. C., Kappetein A. P., Colombo A., Holmes D. R., Mack M. J., Mohr F. W. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease // New England journal of medicine. 2009. V. 360. №10. P. 961-972. https://doi.org/10.1056/NEJMoa0804626
- Ndrepepa G., Schuster T., Hadamitzky M., Byrne R. A., Mehilli J., Neumann F. J., Kastrati A. Validation of the Bleeding Academic Research Consortium definition of bleeding in patients with coronary artery disease undergoing percutaneous coronary intervention // Circulation. 2012. V. 125. №11. P. 1424-1431. https://doi.org/10.1161/CIRCULATI0NAHA.111.060871
- Schulman S., Angeras U., Bergqvist D., Eriksson B., Lassen M. R., Fisher W.. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients // Journal of Thrombosis and Haemostasis. 2010. V. 8. №1. P. 202-204. https://doi.org/10.1111/j. 1538-7836.2009.03678.x
- Budkowska M., Lebiecka A., Marcinowska Z., Wozniak J., Jastrz^bska M., Dol^gowska B. The circadian rhythm of selected parameters of the hemostasis system in healthy people // Thrombosis research. 2019. V. 182. P. 79-88. https://doi.org/10.1016/j.thromres.2019.08.015
- Семак И. В., Кульчицкий В. А. Физиологические и биохимические механизмы регуляции циркадных ритмов // Тр. Белорус. гос. ун-та. Сер.: Физиол., биохим. и молекуляр. основы функционирования биосистем. 2007. Т. 2. Ч. 1. С. 17-37.
- Patke A., Young M. W., Axelrod S. Molecular mechanisms and physiological importance of circadian rhythms // Nature reviews Molecular cell biology. 2020. V. 21. №2. P. 67-84. https://doi .org/10.1038/s41580-019-0179-2
- Saini R., Jaskolski M., Davis S. J. Circadian oscillator proteins across the kingdoms of life: structural aspects // BMC biology. 2019. V. 17. №1. P. 1-39. https://doi.org/10.1186/s12915-018-0623-3
- Harmer S. L. The circadian system in higher plants // Annual review of plant biology. 2009. V. 60. P. 357-377. https://doi.org/10.1146/annurev.arplant.043008.092054
- Kim P., Oster H., Lehnert H., Schmid S. M., Salamat N., Barclay J. L., Rawashdeh O. Coupling the circadian clock to homeostasis: the role of period in timing physiology // Endocrine reviews. 2019. V. 40. №1. P. 66-95. https://doi.org/10.1210/er.2018-00049
- Романчук Н. П., Романчук П. И. Нейрофизиология и нейрореабилитация когнитивных нарушений и расстройств // Бюллетень науки и практики. 2019. Т. 5. №11. С. 176-196. https://doi.org/10.33619/2414-2948/48/19
- Millar-Craig M. W., Bishop C. N., Raftery E. B. Circadian variation of blood-pressure // The Lancet. 1978. V. 311. №8068. P. 795-797. https://doi.org/10.1016/S0140-6736(78)92998-7
- Pyle W. G., Martino T. A. Circadian rhythms influence cardiovascular disease differently in males and females: role of sex and gender // Current Opinion in Physiology. 2018. V. 5. P. 30-37. https://doi.org/10.1016/j.cophys.2018.05.003
- He L. et al. Influence of the cardiomyocyte circadian clock on autophagy in the heart // The FASEB Journal. 2016. V. 30. P. 1279.8-1279.8. https://doi.org/10.1096/fasebj .30.1_supplement.1279.8
- Суслина З. А., Фонякин А. В., Гераскина Л. А. Кардионеврология: современное состояние и перспективные направления // Вестник Российской академии медицинских наук. 2012. Т. 67. №2. С. 4-10.
- Hackam D. G., Spence J. D. Combining multiple approaches for the secondary prevention of vascular events after stroke: a quantitative modeling study // Stroke. 2007. V. 38. №6. P. 18811885. https://doi.org/10.1161/STROKEAHA.106.475525
- Суслина З. А., Фонякин А. В., Пирадов М. А. Современное состояние и перспективы кардионеврологии (аналитический обзор трудов i Национального конгресса «Кардионеврология») // Анналы клинической и экспериментальной неврологии. 2009. Т. 3. №1. С. 51-57.
- Суслина З. А., Фонякин А. В. Практическая кардионеврология. М.: ИМА-ПРЕСС. 2010. 304 с.
- Hanna J. P., Furlan A. J. Cardiac disease and embolic sources // Brain Ischemia. Springer, London, 1995. P. 299-315. https://doi.org/10.1007/978-1-4471-2073-5_31
- Суслина З. А., Фонякин А. В., Чечеткин А. О., Глебов М. В., Гераскина Л. А., Никитин Ю. М., Кравченко М. А. Патогенетическая гетерогенность ишемического инсульта и открытое овальное отверстие // Анналы клинической и экспериментальной неврологии. 2008. Т. 2. №3. С. 4-8.
- Симоненко В. Б., Широков Е. А. Гемодинамический инсульт // Клиническая медицина. 1999. Т. 77. №6. С. 4-9.
- Суслина З. А., Фонякин А. В., Гераскина Л. А. Кардионеврология: современное состояние и перспективные направления // Вестник Российской академии медицинских наук. 2012. Т. 67. №2. С. 7-13.
- Губин Д. Хронодиагностика и хронотерапия-основа персонализированной медицины // Тюменский медицинский журнал. 2019. Т. 21. №1. С. 20-40. https://doi.org/10.36361/2307-4698-2019-21-1-20-40
- Weinert D., Gubin D. G. The circadian body temperature rhythm-Origin and implications for health and wellbeing // Тюменский медицинский журнал. 2018. Т. 20. №2. С. 6-14.
- Harding E. C., Franks N. P., Wisden W. The temperature dependence of sleep // Frontiers in neuroscience. 2019. V. 13. P. 336. https://doi.org/10.3389/fnins.2019.00336
- Troutt J. S., Rudling M., Persson L., Stâhle L., Angelin B., Butterfield A. M., Konrad R. J. Circulating human hepcidin-25 concentrations display a diurnal rhythm, increase with prolonged fasting, and are reduced by growth hormone administration // Clinical chemistry. 2012. V. 58. №8. P. 1225-1232. https://doi.org/10.1373/clinchem.2012.186866
- Dallmann R., Viola A. U., Tarokh L., Cajochen C., Brown S. A. The human circadian metabolome // Proceedings of the National Academy of Sciences. 2012. V. 109. №7. P. 2625-2629. https://doi.org/10.1073/pnas.1114410109
- Kalmbach D. A., Schneider L. D., Cheung J., Bertrand S. J., Kariharan T., Pack A. I., Gehrman P. R. Genetic basis of chronotype in humans: insights from three landmark GWAS // Sleep. 2017. V. 40. №2. https://doi.org/10.1093/sleep/zsw048
- Turco M., Biscontin A., Corrias M., Caccin L., Bano M., Chiaromanni F., Costa R. Diurnal preference, mood and the response to morning light in relation to polymorphisms in the human clock gene PER3 // Scientific reports. 2017. V. 7. №1. P. 1-10. https://doi.org/10.1038/s41598-017-06769-w
- Knutson K. L., Von Schantz M. Associations between chronotype, morbidity and mortality in the UK Biobank cohort // Chronobiology international. 2018. https://doi.org/10.1080/07420528.2018.1454458
- Kettner N. M., Voicu H., Finegold M. J., Coarfa C., Sreekumar A., Putluri N., Fu L. Circadian homeostasis of liver metabolism suppresses hepatocarcinogenesis // Cancer cell. 2016. V. 30. №6. P. 909-924. https://doi.Org/10.1016/j.ccell.2016.10.007
- Skene D. J., Skornyakov E., Chowdhury N. R., Gajula R. P., Middleton B., Satterfield B. C., Gaddameedhi S. Separation of circadian-and behavior-driven metabolite rhythms in humans provides a window on peripheral oscillators and metabolism // Proceedings of the National Academy of Sciences. 2018. V. 115. №30. P. 7825-7830. https://doi.org/10.1073/pnas.1801183115
- Zhang J., Jin X., Li R., Gao Y., Li J., Wang G. Influence of rapid eye movement sleep on all-cause mortality: a community-based cohort study // Aging (Albany NY). 2019. V. 11. №5. P. 1580. https://doi.org/10.18632/aging.101858
- Grigg J. B., Sonnenberg G. F. Host-microbiota interactions shape local and systemic inflammatory diseases // The Journal of Immunology. 2017. V. 198. №2. P. 564-571. https://doi.org/10.4049/jimmunol.1601621
- Zmora N., Bashiardes S., Levy M., Elinav E. The role of the immune system in metabolic health and disease // Cell metabolism. 2017. V. 25. №3. P. 506-521. https://doi.org/10.1016/jxmet.2017.02.006
- Bass J., Takahashi J. S. Circadian integration of metabolism and energetics // Science. 2010. V. 330. №6009. P. 1349-1354. https://doi.org/10.1126/science.1195027
- Man K., Kutyavin V. I., Chawla A. Tissue immunometabolism: development, physiology, and pathobiology // Cell metabolism. 2017. V. 25. №1. P. 11-26. https://doi.org/10.1016/jxmet.2016.08.016
- Singh P. B., Newman A. G. Age reprogramming and epigenetic rejuvenation // Epigenetics & chromatin. 2018. V. 11. №1. P. 1-7. https://doi.org/10.1186/s13072-018-0244-7
- Wang H. X., Wang Y. P. Gut microbiota-brain axis // Chinese medical journal. 2016. V. 129. №19. P. 2373. https://doi.org/10.4103/0366-6999.190667
- Clarke G., Sandhu K. V., Griffin B. T., Dinan T. G., Cryan J. F., Hyland N. P. Gut reactions: breaking down xenobiotic-microbiome interactions // Pharmacological reviews. 2019. V. 71. №2. P. 198-224. https://doi.org/10.1124/pr.118.015768
- Chung H. J., Nguyen T. T., Kim H. J., Hong S. T. Gut Microbiota as a missing link between nutrients and traits of human // Frontiers in microbiology. 2018. V. 9. P. 1510. https://doi .org/10.3389/fmicb.2018.01510
- Sutton E. F., Beyl R., Early K. S., Cefalu W. T., Ravussin E., Peterson C. M. Early time-restricted feeding improves insulin sensitivity, blood pressure, and oxidative stress even without weight loss in men with prediabetes // Cell metabolism. 2018. V. 27. №6. P. 1212-1221. e3. https://doi.org/10.1016/jxmet.2018.04.010
- Masri S., Sassone-Corsi P. The emerging link between cancer, metabolism, and circadian rhythms // Nature medicine. 2018. V. 24. №12. P. 1795-1803. https://doi.org/10.1038/s41591-018-0271-8
- Sulli G., Rommel A., Wang X., Kolar M. J., Puca F., Saghatelian A., Panda S. Pharmacological activation of REV-ERBs is lethal in cancer and oncogene-induced senescence // Nature. 2018. V. 553. №7688. P. 351-355. https://doi.org/10.1038/nature25170
- Van Der Vorst E. P., Peters L. J., Müller M., Gencer S., Yan Y., Weber C., Döring Y. G-protein coupled receptor targeting on myeloid cells in atherosclerosis // Frontiers in pharmacology. 2019. V. 10. P. 531. https://doi.org/10.3389/fphar.2019.00531
- Winter C., Silvestre-Roig C., Ortega-Gomez A., Lemnitzer P., Poelman H., Schumski A., Soehnlein O. Chrono-pharmacological targeting of the CCL2-CCR2 axis ameliorates atherosclerosis // Cell metabolism. 2018. V. 28. №1. P. 175-182. e5. https://doi.org/10.1016/jxmet.2018.05.002
- Scheer F. A. J. L., Shea S. A. Human circadian system causes a morning peak in prothrombotic plasminogen activator inhibitor-1 (PAI-1) independent of the sleep/wake cycle // Blood, The Journal of the American Society of Hematology. 2014. V. 123. №4. P. 590-593. https://doi .org/10.1182/blood-2013 -07-517060
- Crnko S., Du Pré B. C., Sluijter J. P., Van Laake L. W. Circadian rhythms and the molecular clock in cardiovascular biology and disease // Nature Reviews Cardiology. 2019. V. 16. №7. P. 437-447. https://doi.org/10.1038/s41569-019-0167-4
- Губин Д. Г. Молекулярные механизмы циркадианных ритмов и принципы развития десинхроноза // Успехи физиологических наук. 2013. Т. 44. №4. С. 65-87.
- Губин Д. Г. Околонедельные (циркасептанные) ритмы в физиологии (обзор) // Успехи современного естествознания. 2015. №1-8. С. 1268-1272.
- Губин Д. Г., Ветошкин А. С., Болотнова Т. В. Взаимосвязь суточного профиля, вариабельности и структуры циркадианных ритмов артериального давления и частоты сердечных сокращений с хронотипом у вахтовиков Арктики // Медицинская наука и образование Урала. 2015. Т. 16. №2-1 (82). С. 108-113.
- Губин Д. Г. Околонедельные (циркасептанные) ритмы в физиологии (обзор) // Успехи современного естествознания. 2015. №1-8. С. 1268-1272.
- Губин Д. Г., Вайнерт Д. Динамика временной организации в процессе старения: I. Центральные и периферические механизмы // Успехи геронтологии. 2015. Т. 28. №2. С. 257268.
- Губин Д. Г., Вайнерт Д. Динамика временной организации в процессе старения: 2. Системные механизмы и способы коррекции возрастного десинхроноза // Успехи геронтологии. 2015. Т. 28. №3. С. 423-434.
- Kalafatakis K., Russell G. M., Harmer C. J., Munafo M. R., Marchant N., Wilson A., Lightman S. L. Ultradian rhythmicity of plasma cortisol is necessary for normal emotional and cognitive responses in man // Proceedings of the National Academy of Sciences. 2018. V. 115. №17. P. E4091-E4100. https://doi.org/10.1073/pnas.1714239115
- Vargas I., Vgontzas A. N., Abelson J. L., Faghih R. T., Morales K. H., Perlis M. L. Altered ultradian cortisol rhythmicity as a potential neurobiologic substrate for chronic insomnia // Sleep medicine reviews. 2018. V. 41. P. 234-243. https://doi.org/10.1016/j.smrv.2018.03.003
- Губин Д. Г., Вайнерт Д., Соловьева С. В. Эндогенный суточный ритм артериального давления в норме. Как он выглядит и его отличия от результатов амбулаторного мониторинга // Тюменский медицинский журнал. 2018. Т. 20. №1. С. 3-6.
- Губин Д. Г., Вайнерт Д., Соловьева С. В., Дуров А. М. Роль активности, сна и внешней освещенности в суточной динамике артериального давления // Медицинский алфавит. 2018. Т. 1. №3. С. 20-23.
- Douma L. G., Gumz M. L. Circadian clock-mediated regulation of blood pressure // Free radical biology and medicine. 2018. V. 119. P. 108-114. https://doi.org/10.1016/j.freeradbiomed.2017.11.024
- Hermida R. C., Ayala D. E., Mojón A., Fernández J. R. Blunted sleep-time relative blood pressure decline increases cardiovascular risk independent of blood pressure level—the "normotensive non-dipper" paradox // Chronobiology international. 2013. V. 30. №1-2. P. 87-98. https://doi.org/10.3109/07420528.2012.701127
- Hermida R. C., Ayala D. E., Smolensky M. H., Fernández J. R., Mojón A., Portaluppi F. Sleep-time blood pressure: unique sensitive prognostic marker of vascular risk and therapeutic target for prevention // Sleep medicine reviews. 2017. V. 33. P. 17-27. https://doi.org/10.1016/j.smrv.2016.04.001
- Губин Д. Хронодиагностика и хронотерапия-основа персонализированной медицины // Тюменский медицинский журнал. 2019. Т. 21. №1. С. 20-40. https://doi .org/10.36361/2307-4698-2019-21-1-20-40
- Петров В. И. Хронофармакология и хронотерапия // Вестник ВолГМУ. 2012. Вып. 4(44).
- Fernândez-Ruiz I. Blood-pressure medication timing matters // Nature Reviews Cardiology. 2020. V. 17. №1. P. 8-8. https://doi.org/10.1038/s41569-019-0306-y
- Hermida R. C., Crespo J. J., Dominguez-Sardina M., Otero A., Moyâ A., Rios M. T. Bedtime hypertension treatment improves cardiovascular risk reduction: the Hygia Chronotherapy Trial // European heart journal. 2020. V. 41. №48. P. 4565-4576. https://doi.org/10.1093/eurheartj/ehz754
- Kirkland E. B. et al. Trends in healthcare expenditures among US adults with hypertension: national estimates, 2003-2014 // Journal of the American Heart Association. 2018. V. 7. №11. P. e008731. https://doi.org/10.1161/JAHA.118.008731
- Benjamin E. J., Muntner P., Alonso A., Bittencourt M. S., Callaway C. W., Carson A. P. A report from the American Heart Association // Circulation. 2019. V. 139. №10. P. e56-e528. https://doi.org/10.1161/CIR.0000000000000659
- Deaton M., Ruff J. C., Boss L. Chronotherapy for the Treatment of HTN among Patients with OSA: A Systematic Review // Research in Social and Administrative Pharmacy. 2019. V. 15. №10. P. e39.
- 100. Bowles N. P., Thosar S. S., Herzig M. X., Shea S. A. Chronotherapy for hypertension // Current hypertension reports. 2018. V. 20. №11. P. 1-24. https://doi.org/10.1007/s11906-018-0897-4
- 101. Zhang J., Jin X., Li R., Gao Y., Li J., Wang G. Influence of rapid eye movement sleep on all-cause mortality: a community-based cohort study // Aging (Albany NY). 2019. V. 11. №5. P. 1580. https://doi.org/10.18632/aging.101858
- 102. Li W., Ma L., Yang G., Gan W. B. REM sleep selectively prunes and maintains new synapses in development and learning // Nature neuroscience. 2017. V. 20. №3. P. 427-437. https://doi.org/10.1038/nn.4479


