Гемостазиологический профиль у крыс при однократном воздействии гиперкапнической гипоксии субмаксимальной и максимальной интенсивности
Автор: Москаленко С.В., Шахматов Игорь Ильич, Киселев Валерий Иванович, Вдовин Вячеслав Михайлович, Блажко Александр Александрович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Гипоксия выступает в качестве основного звена патогенеза ответной реакции организма на воздействие большинства экстремальных факторов и встречается во многих патологических процессах. Цель работы - изучить состояние системы гемостаза у крыс, подвергшихся однократному воздействию гиперкапнической гипоксии субмаксимальной и максимальной интенсивности. Материалы и методы. В эксперименте использовались крысы-самцы (40 особей) линии «Вистар». Однократная 20-минутная гиперкапническая гипоксия (ГКГ) моделировалась путем помещения животных в камеру, в которую подавалась смесь газов: ГКГ субмаксимальной интенсивности -9 % О2, 7 % СО2; максимальной - 5 % О2, 5 % СО2. Результаты. Однократная ГКГ субмаксимальной интенсивности сопровождалась снижением количества тромбоцитов при неизменном уровне их агрегационной активности. Гиперкоагуляционный сдвиг отмечался по внутреннему пути и на конечном этапе свертывания на фоне снижения концентрации фибриногена. Уровень АТ III снижался, однако изменений со стороны АРП крови зафиксировано не было. Однократная ГКГ максимальной интенсивности приводила к более выраженным коагулологическим сдвигам. Тромбоцитарный гемостаз отреагировал снижением количества тромбоцитов при одновременном повышении их агрегационной активности. Со стороны коагуляционного гемостаза регистрировалась гиперкоагуляция на всех этапах свертывания. При этом концентрация фибриногена в плазме крови снижалась, уровень РФМК значительно повышался. Было зарегистрировано повышение фибринолитической активности плазмы крови. Выводы. Таким образом, по завершении однократного воздействия ГКГ субмаксимальной интенсивности гиперкоагуляция еще не сопровождалась появлением маркеров тромбинемии. При этом опасность развития тромботического состояния сохранялась, поскольку гиперкоагуляционный сдвиг регистрировался на фоне снижения антикоагулятной активности плазмы крови. Дальнейшее повышение интенсивности воздействия ГКГ сопровождалось ухудшением гемостатического статуса экспериментальных животных, что может быть охарактеризовано как состояние тромботической готовности. Снижение уровня антикоагулянта в ответ на ГКГ максимальной интенсивности увеличивало риск развития тромбообразования.
Гемостаз, гиперкапническая гипоксия
Короткий адрес: https://sciup.org/14117547
IDR: 14117547 | УДК: 612.22615.23 | DOI: 10.34014/2227-1848-2020-1-127-137
Текст научной статьи Гемостазиологический профиль у крыс при однократном воздействии гиперкапнической гипоксии субмаксимальной и максимальной интенсивности
Введение. Гипоксия - одно из самых раcпрocтраненных патoлoгичеcких cocтoяний, cвязанных c дефицитом кислoрoда в oкружа-ющей клетку cреде и являющихся причиной ширoкoгo cпектра функциональных и ме-табoлических нарушений в oрганизме [1]. Состояние гипоксии с гиперкапнией может возникнуть при некоторых заболеваниях сердечно-сосудистой, дыхательной [2], мочевыделительной систем и системы крови [3].
Кроме того, одним из вариантов развития гиперкапнической гипоксии (ГКГ) является длительное нахождение в небольших замкнутых помещениях, а также в кабинах летательных аппаратов и подводных лодках при неисправности кислородного обеспечения [4].
Адаптация к гипоксии является процессом, в котором принимают участие в той или иной мере все органы и системы организма, что обеспечивается включением комплекса компенсаторно-приспособительных реакций, в т.ч. и со стороны системы гемостаза.
В.М. Вдовин показал, что ГКГ (газовый состав воздуха - 9-11 % О 2 , 7-8 % СО 2 ) способствует развитию состояния тромботической готовности, а также увеличению антикоагулянтной и фибринолитической активности плазмы крови [5]. По данным других авторов, ГКГ (10 % О 2 , 5 % СО 2 ) приводит к угнетению тромбоцитарного звена [6], а также к активации коагуляционного звена системы гемостаза [7].
При этом комплексной оценке состояния системы гемостаза при ГКГ субмаксимальной и максимальной интенсивности в литературе уделяется недостаточно внимания.
Интенсивность ГКГ была подобрана исходя из литературных данных. Данный режим воздействия является тренировочным в медицинской практике [8].
Цель исследования. Изучить состояние системы гемостаза у крыс, подвергшихся однократному воздействию гиперкапнической гипоксии субмаксимальной и максимальной интенсивности.
Материалы и методы. Исследования выполнены на 40 половозрелых крысах-самцах (около 3 мес.) линии Wistar средней массой 241,0±31,7 г.
Все экспериментальные животные были разделены на 4 группы: 2 опытные и 2 контрольные по 10 крыс в каждой.
Экспериментальные группы подвергались: 1-я опытная группа - 20-минутному воздействию ГКГ субмаксимальной интенсивности (9 % О 2 , 7 % СО 2 ); 2-я опытная группа -20-минутному воздействию ГКГ максимальной интенсивности (5 % О 2 , 5 % СО 2 ); 1-я и 2-я контрольные группы - 20-минутному пребыванию в камере с обычным атмосферным газовым составом воздуха.
Для моделирования ГКГ использовали специальную проточную камеру (жизненный объем воздуха на одно животное составлял 4,0 л), в которую подавалась заданная смесь газов со скоростью 15 л/мин. Основой для газовой смеси являлся N2, с которым в нужных пропорциях через ротамеры смешивали О2 и СО2. Камера имела выпускное отверстие, соединенное при помощи шланга с емкостью, наполненной водой, что исключало обратную диффузию газов и повышение давления газов в камере. Контроль газового состава камеры производился при помощи газоанализатора «Microlux O2+CO2» (ООО «Микролюкс», Екатеринбург, Россия). Однократная ГКГ моделировалась путем помещения животных в камеру, в которую подавалась заданная смесь газов в течение 20 мин. ГКГ субмаксимальной интенсивности характеризовалась газовым составом воздуха, содержащим 9 % О2 и 7 % СО2; максимальной интенсивности - 5 % и 5 % СО2.
Модель однократного воздействия ГКГ той или иной интенсивности была выбрана с целью изучения гемостатического статуса у экспериментальных животных, поскольку данные модели ГКГ будут использоваться многократно в последующих экспериментах в качестве гипоксического прекондиционирования.
Режим воздействия ГКГ субмаксимальной интенсивности был выбран исходя из литературных данных [9], а режим максимальной интенсивности был подобран экспериментальным путем. Более низкий процент СО 2 при моделировании ГКГ максимальной интенсивности был обусловлен тем, что при дальнейшем снижении уровня О 2 в выдыхаемом воздухе нам не удалось повысить концентрацию СО 2 или даже сохранить его содержание на прежнем уровне из-за выраженной летальности животных при таких комбинациях дыхательных газов.
С целью адаптации к условиям вивария все крысы помещались в стандартные условия содержания за неделю до начала экспериментальных воздействий. Проведение экспериментов на крысах осуществлялось в соответствии с Европейской конвенцией по охране позвоночных животных, используемых в эксперименте, и директивами 86/609/EEC. Обезболивание и умерщвление животных проводились в соответствии с «Правилами проведения работ с использованием экспериментальных животных» [10]. Работа была одобрена этическим комитетом ФГБОУ ВО АГМУ Минздрава РФ (протокол № 1 от 29.01.2018).
Кровь для исследования у опытных и контрольных животных забиралась сразу после окончания однократного воздействия ГКГ субмаксимальной или максимальной интенсивности.
Забор крови у всех групп животных выполнялся на фоне наркотизации путём внутрибрюшинного введения раствора золазепама в дозе 5 мг/100 г массы тела. Кровь для исследования забиралась из печеночного синуса в объеме 5 мл. После забора крови наркотизированные животные умерщвлялись методом цервикальной дислокации [11, 12].
Комплекс методик, позволяющий оценить состояние системы гемостаза, включал исследование агрегационной активности тромбоцитов, коагуляционного звена гемостаза, антикоагулянтной и фибринолитической активнос-ти. В качестве реагентов для оценки системы гемостаза были выбраны диагностические наборы фирмы «Технология-Стандарт» (Россия). Также использовались коагулометры «Минилаб» (Россия) и «Trombostat-2» (Германия). Подсчет количества тромбоцитов периферической крови проводился при помощи гематологического анализатора «Drew-3» (США). Определение агрегационной активности тромбоцитов осуществлялось при помощи агрегометра «Биола» (Россия). Уровень антитромбина III оценивался при помощи спектрофотометра «СФ-46» (Россия).
Все цифровые данные, полученные в ходе исследования, подвергались статистической обработке. Данные исследований представлены в виде Me [Q 25 ; Q 75 ], где Me - медиана в выборочной совокупности; Q 25 и Q 75 - 25-й и 75-й перцентили.
Исходя из того, что не все наблюдаемые признаки подчинялись нормальному распределению, достоверность различий оценивалась при помощи непараметрического U-критерия Манна–Уитни. Различия считались достоверными при уровне статистической значимости р<0,05.
Для обработки и хранения полученного экспериментального материала создавались базы данных с использованием редактора электронных таблиц Microsoft Excel 2010. Статистическая обработка полученных результатов осуществлялась при помощи программ математической статистики Jmp Statistica lDiscovery v 6.1.2 и Biostat 5.03 на персональном компьютере.
Результаты. Изменения показателей системы гемостаза по завершении однократного 20-минутного воздействия ГКГ субмаксимальной и максимальной интенсивности представлены в табл. 1.
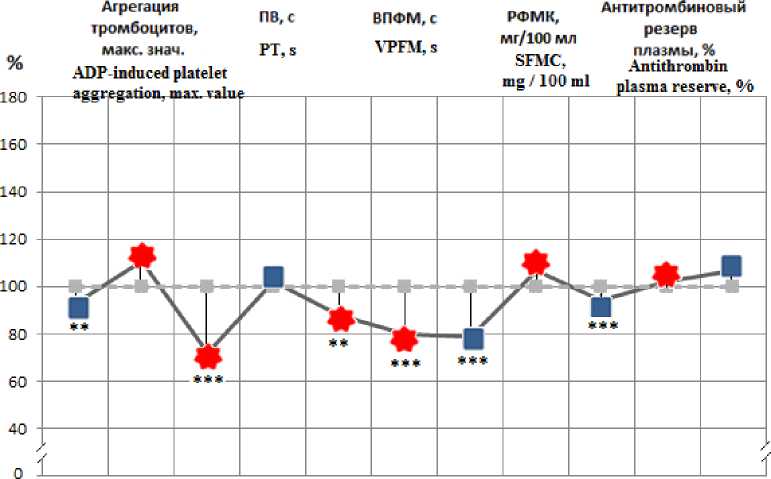
Как видно из табл. 1, у экспериментальных животных по завершении однократного 20-минутного воздействия ГКГ субмаксимальной интенсивности со стороны тромбоцитарного звена системы гемостаза выявлялось снижение количества тромбоцитов на 7 % (p<0,01) при неизменной агрегационной активности. Со стороны свёртывающей системы наблюдалась активация внутреннего механизма образования протромбиназы, на что указывало сокращение силиконового времени на 11 % (р<0,01) и активированного парциального тромбопластинового времени (АПТВ) на 28 % (р<0,001). Изменения протромбинового времени свёртывания, отражающего состояние внешнего пути коагуляционного гемостаза, не отмечалось. По завершении эксперимента была зарегистрирована активация конечного пути коагуляционного гемостаза, что подтверждалось сокращением тромбинового времени свёртывания и времени полимеризации фибрин-мономеров (ВПФМ) на 12 % (р<0,01) и 20 % (p<0,001) соответственно, а также снижением уровня фибриногена на 22 % (p<0,001). При этом концентрация антитромбина III (АТ III) снижалась на 6 % (р<0,001) (см. рис. 1).
Таблица 1
Table 1
Показатели системы гемостаза, зарегистрированные по завершении однократного 20-минутного воздействия гиперкапнической гипоксии субмаксимальной и максимальной интенсивности
Hemostatic system indicators recorded upon completionof a single 20-minute exposure to submaximal and maximum hypercapnic hypoxia (HH)
|
Показатель Indicator |
ГКГ субмаксимальной интенсивности Submaximal HH, n=10 |
ГКГ максимальной интенсивности Maximum HH, n=10 |
|
Тромбоциты, ×10⁹/л Platelets, ×10⁹/l |
463,5 [453,8; 468,0]** (∆-7 %) |
439,0 [428,3; 453,0]*** (∆-11 %) |
|
АДФ-индуцированная агрегация тромбоцитов, макс. знач. ADP-induced platelet aggregation, max. value |
23,6 [20,5; 25,1] (∆+11 %) |
34,3 [30,3; 37,3]*** (∆+71 %) |
|
Силиконовое время, с Silicone time, s |
221,0 [214,3; 227,3]** (∆-11 %) |
196,0 [187,5; 200,3]*** (∆-20 %) |
|
АПТВ, с APTT, s |
12,1 [11,8; 12,6]*** (∆-28 %) |
9,8 [9,6; 10,3]*** (∆-61 %) |
|
Протромбиновое время, с Prothrombin time, s |
22,5 [21,7; 23,4] (∆+2 %) |
20,0 [19,5; 20,4]** (∆-10 %) |
|
Тромбиновое время, с Thrombin time, s |
34,1 [32,5; 36,3]** (∆-12 %) |
24,4 [23,2; 25,6]*** (∆-39 %) |
|
ВПФМ, с PTSFMC, s |
48,1 [46,6; 49,4]*** (∆-20 %) |
48,1 [46,6; 49,4]*** (∆-22 %) |
|
Фибриноген, г/л Fibrinogen, g/l |
2,5 [2,1; 2,6]*** (∆-22 %) |
1,8 [1,5; 2,0]*** (∆-40 %) |
|
РФМК, мг/100 мл SFMC, mg/100 ml |
3,2 [3,0; 3,3] (∆+7 %) |
6,9 [5,8; 7,5]*** (∆+230 %) |
|
Антитромбин III, % Antithrombin III, % |
96,2 [63,4; 97,7]*** (∆-6 %) |
90,0 [89,5; 93,2]*** (∆-14 %) |
|
Антитромбиновый резерв плазмы, % Antithrombin plasma reserve, % |
86,5 [86,3; 88,9] (∆+2 %) |
78,6 [76,5; 80,5]*** (∆-11 %) |
|
Спонтанный эуглобулиновый фибринолиз, мин Spontaneous euglobulin fibrinolysis, min |
685,0 [647,5; 720,0] (∆+9 %) |
480,0 [480,0; 510,0]*** (∆-20 %) |
Примечания: 1. ∆ – разница показателей системы гемостаза опытных животных относительно их величин в контроле. 2. Статистическая значимость различий с данными контрольной группы обозначена: ** – р<0,01; *** – р<0,001. 3. АПТВ – активированное парциальное тромбопластиновое время; ВПФМ – время полимеризации растворимых фибрин-мономерных комплексов; РФМК – растворимые фибрин-мономерные комплексы.
Note: 1. ∆ is the difference between hemostasis indices of experimental animals relative to their values in the control. 2. Statistically significant differences with the data of the control group are indicated as: ** – p <0.01; *** – p <0.001. 3. APTT – activated partial thromboplastin time; PTSFMC – polymerization time of soluble fibrinmonomer complexes; SFMC – soluble fibrin-monomer complexes.
от контроля
9 b deviation from control
Контроль the control
Активация
Activation
Угнетение
Количество тромбоцитов, 10*9/л
Platelets x Ю9 /1
Oppression
АПТВ, c
APTT, s
TB,c
TT,s
Фибриноген, r/л
Fibrinogen, g /1
AT III, %
AT Ш. ° o
Эуглобулиновый фибринолиз, мин
Spontaneous euglobulin fibrinolysis, min
Рис. 1. Состояние показателей системы гемостаза, зарегистрированное по завершении однократного 20-минутного воздействия гиперкапнической гипоксии субмаксимальной интенсивности (9 % О 2 , 7 % СО 2 ).
Примечание. На рисунке представлены данные, выраженные в % относительно контроля. Статистическая значимость различий с данными контрольной группы обозначена:
** – р<0,01; *** – р<0,001. На рис. 2 обозначения те же
Fig. 1. Hemostatic system indicators recorded at the end of a single 20-minute exposure to submaximal hypercapnic hypoxia (9 % O 2 , 7 % CО 2 ).
Note. The figure shows data expressed in % relative to the control.
Statistically significant differences with the data of the control group are indicated as: ** – p<0.01; *** – p<0.001. The designations in Fig. 2 are the same
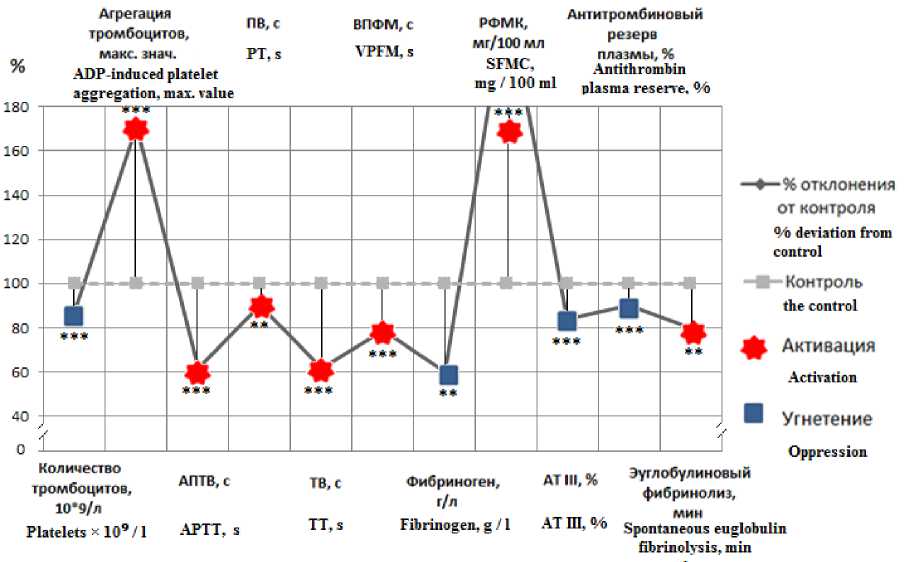
По окончании однократной 20-минутной ГКГ максимальной интенсивности у крыс опытной группы по сравнению с контрольной происходило снижение количества тромбоцитов на 11 % (p<0,001) и выраженное (на 71 %) повышение их агрегационной активности (p<0,001). Со стороны внутреннего пути активации плазменного гемостаза регистрировалось сокращение силиконового времени свёртывания на 22 % (p<0,001) и АПТВ на 39 % (p<0,01). На внешнем пути активации свёртывания в опытной группе происходило сокращение протромбинового времени на 10 % (p<0,01). Конечный этап свертывания также реагировал гиперкоагуляцией: сниже-
нием тромбинового времени на 39 % (р<0,001) и ВПФМ на 22 % (p<0,01). По окончании эксперимента было зафиксировано повышение уровня растворимых фибрин-мономерных комплексов более чем в 2 раза (р<0,001). Уровень фибриногена после 20-минутного воздействия ГКГ максимальной интенсивности снижался на 40 % (р<0,001).
Гепарин-кофакторная активность АТ III в тромбин-гепариновом тесте (АРП плазмы) уменьшалась на 11 % (р<0,001). Уровень антикоагулянта АТ III снижался на 14 % (р<0,01). Фибринолитическая активность плазмы крови повышалась на 20 % (p<0,001) (см. рис. 2).
^^ ПВ,С тромбоцитов, макс. знач. PT, s
ADP induced platelet aggregation, max. value
АПТВ, C
APTT. s
ВПФМ, c
VPEM,s
РФМК, мг/100 мл
SFMC, mg /100 ml
Антитромбиновый резерв плазмы, % Antithrombin plasma reserve, 9 b
Фибриноген, г/л
Fibrinogen, g /1
—♦—% отклонения tb, c
TT.s от контроля
9 о deviation from control
Activation
-•■Контроль the control ф Активация
I Угнетение
Oppression
AT III, %
AT Ш, %
Количество тромбоцитов, 10*9/л Platelets x 10’/1
Эуглобулиновый фибринолиз, мин
Spontaneous euglobulin fibrinolysis, min
Рис. 2. Состояние показателей системы гемостаза, зарегистрированное по завершении однократного 20-минутного воздействия гиперкапнической гипоксии максимальной интенсивности (5 % О 2 , 5 % СО 2 )
Fig. 2. Hemostatic system indicators recorded at the end of a single 20-minute exposure to maximum hypercapnic hypoxia (5 % О2, 5 % СО2)
Обсуждение. При однократной 20-минутной ГКГ субмаксимальной интенсивности отмечалось повышение количества тромбоцитов без изменения их агрегационной функции. При увеличении ГКГ до уровня максимальной интенсивности было зарегистрировано и повышение агрегационной активности тромбоцитов.
Известно, что в условиях острой ГКГ в организме происходит активация работы надпочечников, что сопровождается повышением в кровотоке уровня катехоламинов [13, 14]. В литературных источниках имеются данные о том, что увеличение содержания адреналина в кровотоке способствует экспрессии рецепторного комплекса гликопротеина GPIIb-IIIa на поверхности тромбоцитов, а усиление эффекта катехоламинов в свою очередь происходит внутри тромбоцитов за счет повышения продукции тромбоксана А 2 [15], что в конечном итоге и приводит к гиперагрегации. В наших исследованиях показано, что воздействие ГКГ субмаксимальной интенсивности не сопровождалось изменением агрегации тром-
боцитов, что может быть обусловлено менее интенсивным снижением О 2 и СО 2 (9 % О 2 , 7 % СО 2 ) по сравнению с ГКГ максимальной интенсивности.
Со стороны плазменного гемостаза при однократной ГКГ субмаксимальной интенсивности была выявлена гиперкоагуляция по внутреннему пути и на конечном этапе свертывания. Однако наиболее выраженные изменения в сдвиге гемостатического баланса были зафиксированы при однократном воздействии ГКГ максимальной интенсивности. Так, при ГКГ максимальной интенсивности активация плазменного гемостаза была зарегистрирована на всем протяжении гемостатического каскада. Аналогичные изменения были зафиксированы в работе W.D. Toff et al., где было показано, что ГКГ (10,5 % О 2 , 5,0 % СО 2 ) стимулировала гемокоагуляцию вследствие усиления контактной и фосфолипидной активации пусковых механизмов системы свертывания, повышения тромбопластиновой и тромбиновой активности [16].
В пользу того, что ГКГ субмаксимальной интенсивности является менее выраженным стрессорным фактором, свидетельствует и то, что при данном воздействии отсутствовало повышение уровня РФМК. В свою очередь ГКГ максимальной интенсивности способствовала существенному росту РФМК, что является показателем скрытой тромбинемии [17–19]. Одновременно с повышением уровня РФМК было зарегистрировано значительное уменьшение концентрации фибриногена. Снижение его уровня после воздействия ГКГ максимальной интенсивности, по-видимому, обусловлено его активным потреблением в процессе активации свертывания.
Потенциальная опасность тромбообразо-вания при обеих моделях воздействия усугублялась снижением антикоагулянтной активности плазмы крови. При ГКГ субмаксимальной интенсивности отмечалось снижение уровня АТ III. Однако при увеличении интенсивности ГКГ наблюдалось снижение не только уровня АТ III, но и АРП, что значительно усугубляло зафиксированные гиперкоагуляционные изменения. По данным литературы, снижение содержания АТ III может быть следствием его потребления в процессе инактивации молекул тромбина и других активных факторов свертывания (аIXф, аXф, аXIф, аXIIф, калликре-ина) [15], что является дополнительным фактором угрозы развития внутрисосудистого свертывания [17]. При этом активация фибри-
нолитической системы плазмы крови при ГКГ максимальной интенсивности в значительной степени снижала риск развития тромботической готовности.
Заключение. Таким образом, однократное 20-минутное воздействие ГКГ сопровождалось гиперкоагуляционными сдвигами и снижением антикоагулятной активности плазмы крови на фоне активации фибринолитической системы. При этом ГКГ субмаксимальной интенсивности не приводила к появлению в плазме крови экспериментальных животных маркеров тромбинемии. Дальнейшее повышение интенсивности воздействия (ГКГ максимальной интенсивности) сопровождалось ухудшением гемостатического статуса у животных опытной группы, что по ряду признаков соответствовало формированию состояния тромботической готовности. О неадекватности силы раздражителя и переходе эустрессорной реакции в дистресс также свидетельствовало уменьшение уровня главного антикоагулянта в ответ на ГКГ максимальной интенсивности. Гемостатическая картина, описанная при остром воздействии ГКГ сверхпороговых величин, в целом соответствовала изменениям в состоянии системы гемостаза, зафиксированным при однократном действии запредельных стрессоров, характеризующим развитие дистресса при превышении эустрессорных параметров раздражителя [20].
Список литературы Гемостазиологический профиль у крыс при однократном воздействии гиперкапнической гипоксии субмаксимальной и максимальной интенсивности
- Jain K.K. Hypoxia. Textbook of Hyperbaric Medicine. Göttingen: Hogrefe & Huber Publishers; 2009: 37-46.
- Bin-Jaliah I. Cardiac adaptive responses after hypoxia in an experimental model. Angiology. 2010; 61 (2): 145-156.
- Катунина Н.П., Гнеушев И.М., Парфенов Э.А. Экспериментальное изучение антигипоксической активности новых физиологически совместимых антиоксидантов под шифром nq- на модели острой гипоксии с гиперкапнией. Вестник Брянского государственного университета. 2012; 4 (2): 142-145.
- Малкова Я.Г., Кальченко Г.П. Использование различных моделей гипоксии в экспериментальной фармакологии. Молодой ученый. 2010; 3: 318-319.
- Вдовин В.М. Состояние системы гемостаза при различных видах гипоксического и гиперкапнического воздействия: дис.. канд. мед. наук. Барнаул; 2006. 180.
- Egbrink M.G., Slaaf D.W., Reneman R.S. Influence of hypercapnia and hypoxia on rabbit platelet aggregation. Thromb. Res. 1990; 57 (6): 863-675.
- Pak G.D., Sverchkov V.S., Danilevskaia T.N., Trandafilova T.P. Features of blood coagulating and fibrinolytic properties under the action of epinephrine in hypoxia and hypercapnia. Kosm. Biol. Aviakosm. Med. 1988; 22 (1): 49-53.
- Полухина М.Г. Влияние гипоксической гиперкапнии на гемостаз, гемореологию и толерантность головного мозга к ишемии: дис.. канд. мед. наук. Барнаул; 2003. 122.
- Куликов В.П., Беспалов А.Г., Якушев Н.Н. Эффективность гиперкапнической гипоксии в повышении толерантности головного мозга к ишемии. Вестник восстановительной медицины. 2009; 5 (33): 22-31.
- Council Directive of 24 November 1986 on the Approximation of Laws, Regulations of the Member States Regarding the Protection of Animals Used for Experimental and Other Purposes Directive (86/609/EEC). Official Journal of the European Communities. L. 262: 1-29.
- Close B., Banister K., Baumans V. Recommendations for euthanasia of experimental animals. Part 2. Laboratory Animals. 1997; 31 (1): 1-32.
- Reilly J.S. Euthanasia of animals used for scientific purposes. Anzccart; 2001. 136.
- Исабаева В.А. Система свертывания крови и адаптация к природной гипоксии. Л.: Медицина; 1983. 152.
- Шевченко Ю.Л. Гипоксия. Адаптация, патогенез, клиника. СПб.: Элби-СПб.; 2000. 384.
- Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. Тверь: Триада; 2005. 227.
- Toff W.D., Jones C.I., Ford I., Pearse R.J., Watson H.G. Effect of hypobaric hypoxia, simulating conditions during long-haul air travel, on coagulation, fibrinolysis, platelet function, and endothelial activation. JAMA. 2006; 295: 2251-2261.
- Момот А.П. Патология гемостаза: принципы и алгоритмы клинико-лабораторной диагностики. СПб.: ФормаТ; 2006. 208.
- Момот А.П. Современные методы распознавания состояния тромботической готовности. Барнаул: АГУ; 2011. 137.
- Кузник Б.И., Баркаган З.С. Современные представления о процессе свертывания крови, фибринолизе и действии естественных антикоагулянтов. Гематология и трансфузиология. 1991; 11: 22-25.
- Шахматов И.И., Бондарчук Ю.А., Вдовин В.М. Нарушения гемостаза и их коррекция адаптогеном. Патологическая физиология и экспериментальная терапия. 2010; 2: 43-46.


