Генетическая структура региональных популяций Mycosphaerella graminicola (Septoria tritici) - возбудителя септориоза пшеницы (Triticum aestivum L.)
Автор: Пахолкова Е.В., Сальникова Н.Н., Куркова Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фитопатология. Иммунитет и защита растений
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Возбудитель септориозной листовой пятнистости (STB) Mycosphaerella graminicola (анаморфа Septoria tritici ) - доминирующий вид в септориозном комплексе на посевах пшеницы в основных зернопроизводящих районах России. Устойчивость к данному заболеванию может быть как количественной (горизонтальной), так и изолят-специфичной (вертикальной). В настоящее время у пшеницы идентифицировано 17 генов устойчивости к STB ( Stb1 - Stb17 ). Благодаря генетическому анализу в патосистеме «пшеница- M. graminicola » было доказано взаимодействие «ген-на-ген», следовательно, наличие генов устойчивости у хозяина предполагает существование специфических генов вирулентности у патогена. Относительная частота генов вирулентности внутри географического региона может быть вычислена как доля изолятов, выражающих эти гены, от общего числа изолятов, используемых в исследовании. Целью нашей работы было, допуская связь «ген-на-ген», определить гены вирулентности в популяциях M. graminicola из разных географических регионов России, используя сорта с известными генами устойчивости - Bulgaria 88 ( Stb1 ), Oasis ( Stb1 ), Veranopolis ( Stb2 ), Israel 493 ( Stb3 ), Tadinia ( Stb4 ), CS/Synthetic 7D ( Stb5 ), Flame ( Stb6 ), Estanzuela Federal ( Stb7 ), W7984 ( Stb8 ). В условиях теплицы и камеры искусственного климата были протестированы 47 изолятов из Северо-Кавказского района, 66 изолятов из Центрально-Черноземного района, 29 изолятов из Поволжского района, 64 изолята из Центрального района и 34 изолята из Северо-Западного района. Оценку вирулентности изолятов проводили на всходах в фазу 2 листьев по двум параметрам - степени поражения растений и споруляции гриба in vivo. На основании частоты встречаемости генов вирулентности была выявлена степень эффективности Stb -генов по отношению к каждой региональной популяции гриба. Региональные популяции M. graminicola различались по генотипу вирулентности, спектру и частоте встречаемости генов вирулентности. Популяции из южной зоны (северо-кавказская, центрально-черноземная и поволжская) обладали более высокой вирулентностью по сравнению с центральной и северо-западной популяциями. Так, в северо-кавказской популяции не имели генов вирулентности 19,2 % изолятов, в центрально-черноземной - 6,0 %, тогда как в центральной и северо-западной их доля составляла соответственно 42,2 и 44,1 %. Изоляты из поволжской популяции M. graminicola имели наиболее разнообразные сочетания генов вирулентности. Во всех популяциях выявлена высокая частота вирулентности в отношении сортов с генами Stb1, Stb5 и Stb7. Значительной эффективностью против изолятов из Центрального, Центрально-Черноземного и Северо-Западного районов характеризовались гены Stb2, Stb3, Stb4, однако она заметно снижалась в отношении северо-кавказских изолятов и изолятов из Поволжского района. Гены Stb6 и Stb8 были в высокой степени эффективны ( Stb8 - абсолютно эффективен) против всех региональных популяций M. graminicola и могут быть рекомендованы для селекции на устойчивость к STB.
Популяция, изолят, гены вирулентности, частота встречаемости, эффективность stb-генов
Короткий адрес: https://sciup.org/142213976
IDR: 142213976 | УДК: 633.1:632.4.01/06:575.174 | DOI: 10.15389/agrobiology.2016.5.722rus
Текст научной статьи Генетическая структура региональных популяций Mycosphaerella graminicola (Septoria tritici) - возбудителя септориоза пшеницы (Triticum aestivum L.)
Возбудитель септориозной листовой пятнистости (STB) Mycosphaerel-la graminicola (анаморфа Septoria tritici ) — доминирующий вид в септориоз-ном комплексе на посевах пшеницы в основных зернопроизводящих районах России (Северо-Кавказский, Центрально-Черноземный). Кроме того, он широко распространен в центральной части страны и на юге Поволжья, где его доля в видовой структуре популяций достигает 40-50 %. Отмечается присутствие этого вида в Северо-Западном районе, в Калининградской области, а также на территории Западной и Восточной Сибири.
Знание генетической структуры популяций патогена, частоты встречаемости генов вирулентности, их динамики во времени и пространстве, а также степени эффективности генов устойчивости относят к обязательным
∗ Работа выполнена при финансовой поддержке гранта Международного научно-технического центра (МНТЦ).
условиям успешной селекции на устойчивость к заболеванию. Если сравнивать с другими болезням (ржавчина, мучнистая роса и др.), то в случае септориоза генетика устойчивости растений менее изучена. К тому же в патосистеме «пшеница― M. graminicola » присутствуют два типа взаимодействия, то есть устойчивость может быть как количественной (горизонтальной), так и изолят-специфичной (вертикальной), причем оба эти взаимодействия важны для патосистемы.
Специфичность взаимодействия между M. graminicola и пшеницей впервые доказали Z. Eyal с соавт. (1, 2), которые, проанализировав многие индивидуальные комбинации «сорт ½ изолят», предположили наличие 28 комплементарных генов. Существование взаимодействующих пар генов было подтверждено результатами других исследователей с использованием 80 изолятов и 47 сортов (3). Заключительное свидетельство связи «ген-на-ген» было получено с помощью молекулярно-генетических исследований хозяина и патогена, что устранило любые сомнения в ее существовании в отношении по крайней мере некоторых известных генов устойчивости (4-7).
За недавние годы на основании взаимодействия между сортами пшеницы и изолятами гриба идентифицировано 17 основных генов устойчивости к M. graminicola ( Stb1 - Stb17 ). Эксперименты, проведенные в разных лабораториях мира, позволили определить хромосомную локализацию и молекулярные маркеры этих генов, которые предлагается использовать в маркерной селекции (8-14).
Согласно теории «ген-на-ген», наличие генов устойчивости у хозяина предполагает существование специфических генов вирулентности у патогена, частота встречаемости которых в регионе может быть вычислена как доля изолятов, выражающих эти гены (вирулентности), от числа изо-лятов, используемых в исследовании (2). Это позволяет, в свою очередь, определить степень эффективности Stb -генов, что имеет большое значение для селекции, так как внедрение определенного Stb -гена не обусловит эффективную устойчивость, если часть популяции патогена вирулентна для несущего такой ген сорта. В частности, исследования, проведенные во Франции, показали, что при тестировании 11 сортов с известными генами устойчивости с использованием монопикнидиальных изолятов из пяти областей страны многие из Stb -генов были неэффективными в отношении большинства французских штаммов M. graminicola (15). Тем не менее, эффективность некоторых генов подтверждена мировой практикой. Так, ген Stb1 , введенный в озимые сорта пшеницы Oasis и Sullivan, более чем 25 лет сохранял свою эффективность в Индиане и соседних штатах (8). Сорт яровой пшеницы Tadinia обладает одним доминантным геном устойчивости Stb4 , который в течение 30 лет использовался для контроля S. tritici в Калифорнии (9). Ген Stb6 ― широко распространенный источник устойчивости к STB во всем мире (16). Об эффективности Stb -генов по отношению к российским популяциям патогена известно мало. Есть только данные Ю.В. Зеленевой (17), проводившей исследования на изолированных листьях пшеницы, согласно которым наибольшей эффективностью против изо-лятов M. graminicola из Центрально-Черноземного района обладали гены Stb1 , Stb4 , Stb5 , тогда как гены Stb2 , Stb3 были менее эффективными.
Пока что нет согласованной методологии оценки и определения границы разделения устойчивости и восприимчивости. Известно, что иммунитета (полной устойчивости) к M. graminicola не существует, так как некрозы и (или) пикниды присутствуют всегда (18, 19). Генетическая устойчивость к STB может выражаться в уменьшении размера зоны поражений и в снижении плодовитости гриба. Эти два параметра находятся под разным генетическим контролем и оба важны при оценке заболевания (3). Плодовитость гриба чаще всего принято оценивать по числу пикнид. В этом случае реакция растений группируется в классы от близкой к иммунной с небольшими некрозами без пикнид до очень восприимчивой с большими сливающимися пятнами и многочисленными пикнидами (5, 2022). Однако визуальная оценка числа пикнид, особенно по балльной шкале, довольно субъективна. Кроме того, было установлено, что на восприимчивых сортах число спор в одной пикниде в 2,0-2,5 раза больше, чем на устойчивых (23). В связи с этим некоторые исследователи рекомендуют определять спорулирующую способность гриба in vivo методом подсчета спор в камере Горяева (24).
Целью наших исследований было, допуская связь «ген-на-ген», определить гены вирулентности и частоту их встречаемости в популяциях Mycosphaerella graminicola из разных регионов России, используя набор сортов с известными генами устойчивости. Эта информация позволит выявить эффективность Stb -генов, оценить их функциональность на территории России и целесообразность использования в селекционных программах в качестве потенциальных источников устойчивости к STB.
Методика. Исследования проводили в течение 2009-2015 годов. Образцы пораженных растений собирали во время обследования посевов пшеницы в течение вегетационного периода по стандартной методике (25). При выделении в чистую культуру моноспоровых изолятов Myco-sphaerella graminicola применяли метод штрихов (26). Для этого кусочки пораженной ткани с пикнидами гриба сначала промывали под проточной водой, затем в нескольких порциях стерильной дистиллированной воды и помещали в стерильную чашку Петри на предметное стекло в каплю стерильной воды. Через несколько минут полученную споровую суспензию с помощью проволочной петли высевали на поверхность питательной среды в чашки Петри. В качестве питательной среды использовали картофельноглюкозный агар (КГА). Через 7-8 сут инкубации при температуре 20-25 ° С единичные колонии, произошедшие из одной конидии, отсевали в другие чашки. Стабильность изолятов отслеживали при трех последовательных пересевах 10-суточных колоний на свежую питательную среду. Культурально-морфологические (КМ) признаки изолятов оценивали на 30-е сут после посева, отмечая характер строения, диаметр и окраску колоний. Для исследований отбирали стабильные по КМ признакам изоляты из разных морфологических групп, стараясь как можно полнее отразить внутривидовое разнообразие популяций.
В опытах использовали моногенные сорта пшеницы с известными генами устойчивости — Bulgaria 88 и Oasis ( Stb1 ), Veranopolis ( Stb2 ), Israel 493 ( Stb3 ), Tadinia ( Stb4 ), CS/Synthetic 7D ( Stb5 ), Flame ( Stb6 ), Estanzuela Federal ( Stb7 ) и W7984 ( Stb8 ). Исследования проводили в камерах искусственного климата и в теплице. Растения выращивали в вазонах объемом 400 см3 (по 10 шт. на вазон) до фазы полностью развернутого 2-го листа. Инокулюм гриба культивировали на КГА в чашках Петри в течение 4-5 сут в лабораторных условиях без дополнительного освещения. Растения заражали индивидуальными изолятами, опрыскивая споровой суспензией гриба с помощью пульверизатора. Плотность суспензии ― 1½107 спор/мл, расход суспензии ― 100 мл/м2. Перед нанесением в суспензию добавляли каплю поверхностно-активного вещества Твин 20. После инокуляции растения на 48 ч помещали во влажную камеру при температуре 20-25 ° С, затем переносили в ростовую камеру или бокс, где поддерживались следующие условия: температура 18-20 ° С (ночь) и 22-24 ° С 724
(день), относительная влажность воздуха 70-80 %, фотопериод 16 ч, освещенность ― около 15 тыс. лк.
Оценку пораженности растений проводили через 20 сут после инокуляции. За основу был взят разработанный во Всероссийском НИИ фитопатологии метод, согласно которому в качестве основных параметров использовали степень поражения растений и интенсивность споруляции гриба in vivo (24, 27). Степень поражения определяли визуально по проценту пораженной поверхности 1-го и 2-го листа. Для определения споруляции срезали учетные листья растений и помещали их на 3-4 ч в лабораторные стаканы с точно измеренным количеством воды. Затем с помощью камеры Горяева определяли число спор в суспензии в пересчете на один учетный лист: N = 2500 MV/n, где N — число спор на одном учетном листе; M — число спор в 100 больших квадратах камеры Горяева; V — объем воды в сосуде, мл; n — число листьев в пробе; 2500 — коэффициент, полученный экспериментально.
Степень поражения дифференцировали как низкую (поражено в среднем до 20 % площади листа), среднюю (21-50 %) или высокую (более 50 %). По интенсивности споруляции изоляты относили к слабоспорулиру-ющим (до 100 тыс. спор/лист), среднеспорулирующим (от 100 до 200 тыс. спор/лист) или высокоспорулирующим (более 200 тыс. спор/лист). На основании сочетания двух этих параметров изоляты делили на три группы: I — слабовирулентные, II — средневирулентные, III — высоковирулентные.
По проценту вирулентных изолятов от общего числа исследованных определяли частоту и спектр генов вирулентности в популяции, а также оценивали эффективность Stb -генов. Stb -гены условно разделяли на эффективные (сорт восприимчив к 0-20 % изолятов), среднеэффективные (сорт восприимчив к 21-50 % изолятов) и неэффективные (сорт восприимчив более чем к 50 % изолятов).
Результаты. Группам вирулентности у изученных изолятов соответствовали следующие сочетания интенсивности споруляции гриба и степени поражения растений (табл. 1). Изоляты I группы рассматривались как авирулентные, тогда как II или III группа вирулентности свидетельствовали о наличии у изолята гена вирулентности.
1. Распределение изученных изолятов Mycosphaerella graminicola по группам вирулентности с учетом споруляции и развития поражения у растений пшеницы ( Triticum aestivum L.) в лабораторных тестах
|
Средняя степень поражения растений, % |
Интенсивность споруляции, тыс. спор/лист |
||
|
низкая (до 100) |
средняя (100-200) |
высокая (более 200) |
|
|
Низкая (до 20) |
I |
I |
II |
|
Средняя (21-50) |
I |
II |
III |
|
Высокая (51-100) |
II |
III |
III |
При исследовании генетической структуры популяций M. gramini-cola протестировали 47 изолятов из Северо-Кавказского района (14 — из Северной Осетии, 19 — из Ставропольского края, 13 — из Краснодарского края, 1 — из Чечни); 66 изолятов из Центрально-Черноземного района (26 — из Воронежской, 10 — из Тамбовской, 10 — из Липецкой, 12 — из Курской, 8 — из Белгородской области); 29 изолятов из Поволжья (9 — из Саратовской и 20 — из Волгоградской области); 64 изолята из Центрального района (59 — из Московской, 3 — из Тульской, 1 — из Брянской и 1 — из Рязанской областей); 34 изолята из Северо-Западного района (6 — из Ленинградской, 9 — из Псковской, 19 — из Новгородской областей). Все изоляты тестировали на восьми сортах с моногенной устойчивостью, за исключением представителей северо-кавказской популяции, которые мы испытывали на шести сортах, поскольку на тот период не располагали сортами с генами Stb6 и Stb8.
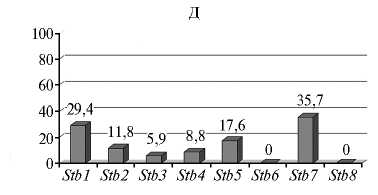
Во всех популяциях M. graminicola была выявлена вирулентность в отношении генов устойчивости Stb1 , Stb2 , Stb3 , Stb4 , Stb5 и Stb7 , значительно варьирующая по частоте (рис.).
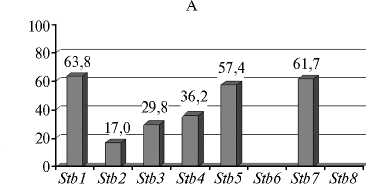
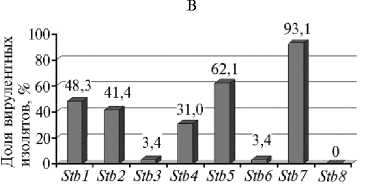
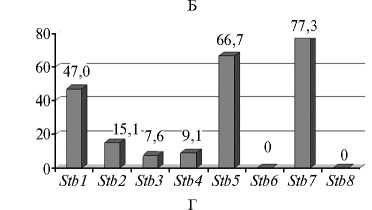
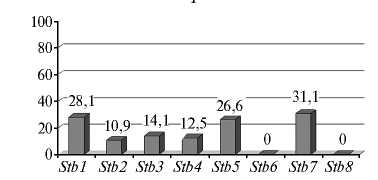
Частота проявления вирулентности в отношении Stb -генов устойчивости пшеницы ( Triticum aestivum L.) в популяциях Mycosphaerella grami-nicola из разных районов России : А — СевероКавказский, Б — Центрально-Черноземный, В — Поволжский, Г — Центральный, Д — Северо-Западный (лабораторные тесты, образцы сборов 2009-2015 годов).
Северо-кавказская популяция была представлена различными генотипами вирулентности, то есть изоляты несли разные комбинации соответствующих генов. При этом 55,3 % изолятов проявляли широкий спектр вирулентности (поражали 3-6 моногенных сортов), 25,5 % изолятов имели по 1-2 гена вирулентности. Изоляты, не обладающие генами вирулентности, составляли 19,2 %. Чаще других поражались сорта c генами устойчивости Stb1 , Stb5 и Stb7 : доля вирулентных для них изолятов составляла 57,4-63,8 %. Сорта с генами Stb2 , Stb3 и Stb4 поражались реже и были восприимчивы к 17,0-36,2 % изолятов.
В центрально-черноземной популяции у 50 % изолятов выявили только по 1-2 гена вирулентности. Доля изолятов с более широким спектром вирулентности составляла 43,9 %. Не имели генов вирулентности 6,0 % изолятов. Чаще других поражались сорта c генами устойчивости Stb1 , Stb5 и Stb7 (47,0-77,3 % вирулентных изолятов). Сорта с генами Stb2 , Stb3 и Stb4 были устойчивы против большинства изолятов (частота вирулентности 7,6-15,1 %). Вирулентность в отношении генов устойчивости Stb6 и Stb8 отсутствовала.
Изоляты из поволжской популяции M. graminicola имели наиболее разнообразные сочетания генов вирулентности. При этом только один изолят (3,4 %) был авирулентным для всех сортов, а 13,8 % изолятов имели по одному гену вирулентности. Большинство изолятов несли по 3-6 генов вирулентности (65,5 %), подавляющее большинство (93,1 %) были вирулентны для сорта с геном Stb7 . Частота вирулентности в отношении сортов с геном Stb5 составляла 62,1 %, с генами Stb1 , Stb2 и Stb4 ― 31,0726
48,3 %. Незначительная вирулентность (3,4 %) наблюдалась в случае Stb3 и Stb6 . Сорт с геном Stb8 был устойчив ко всем изолятам из этой популяции.
В популяции из Центрального района 42,2 % изолятов не имели генов вирулентности. У остальных главным образом выявлялось по 1-2 гена (40,6 % изолятов), реже по 3-5 генов (17,2 % изолятов). В целом, частота вирулентности в отношении Stb -генов была невысокой. Так, для Stb1 , Stb5 и Stb7 она составляла 26,6-31,1 %, для Stb2 , Stb3 и Stb4 — была вдвое ниже (10,9-14,1 %), для Stb6 и Stb8 — равнялась 0 %.
Северо-западная популяция M. graminicola была наименее разнообразной по генотипам вирулентности. Основное число изолятов не имели генов вирулентности (44,1 %) либо имели по одному гену вирулентности (32,3 %). Однако были и изоляты, которые несли по 3-6 генов, но их доля оказалась значительно меньше (14,7 %). Вирулентность наблюдалась чаще всего к генам устойчивости Stb1 и Stb7 (29,4-35,7 %). В отношении сортов с генами Stb2 , Stb3 , Stb4 и Stb5 частота вирулентности была заметно ниже и составляла от 5,9 до 17,6%. Ни у одного из изолятов не зафиксировали вирулентность к генам Stb6 и Stb8 .
Таким образом, региональные популяции M. graminicola различались по генотипам вирулентности, спектру и частоте встречаемости генов вирулентности. Вирулентность популяций из южной зоны (северо-кавказская, центрально-черноземная и поволжская) в целом была выше по сравнению с центральной и северо-западной популяциями, где наблюдалось высокое число авирулентных изолятов. Кроме того, популяции из южной зоны выделялись разнообразием генотипов вирулентности и более высоким числом изолятов с широким спектром вирулентности (3-6 генов). Такое географическое распределение вирулентности M. graminicola на территории России указывает на то, что южные популяции гриба более агрессивны, и это может быть одной из причин доминирования M. graminicola в септориозном комплексе на посевах пшеницы на юге страны.
2. Степень эффективности Stb -генов пшеницы ( Triticum aestivum L.) против региональных российских популяций Mycosphaerella graminicola (лабораторные тесты, образцы сборов 2009-2015 годов)
|
Регион |
Эффективность Stb -генов (по проценту вирулентных изолятов) |
||
|
эффективные (< 20 %) |
среднеэффективные (20-50 %) |
неэффективные (> 50 %) |
|
|
Северо-Кавказский |
Stb2 |
Stb3, Stb4 |
Stb1, Stb5, Stb7 |
|
Центрально-Черноземный Stb2, Stb3, Stb4, Stb6, Stb8 |
Stb1 |
Stb5, Stb7 |
|
|
Поволжский |
Stb3, Stb6, Stb8 |
Stb1, Stb2, Stb4 |
Stb5, Stb7 |
|
Центральный |
Stb2, Stb3, Stb4, Stb6, Stb8 |
Stb1, Stb5, Stb7 |
Отсутствуют |
|
Северо-Западный |
Stb2, Stb3, Stb4, Stb5, Stb6, Stb8 |
Stb1, Stb7 |
Отсутствуют |
Во всех популяциях M. graminicola наблюдалась более высокая частота вирулентности в отношении сортов с генами устойчивости Stb1, Stb5 и Stb7, свидетельствующая о том, что эти Stb-гены наименее эффективны (табл. 2). Реакция растений обычно выражалась в наличии некротических пятен с большой площадью поражения листа и формированием пикнид при средней и высокой интенсивности споруляции. В то же время значительной эффективностью против центральной, центрально-черноземной и северо-западной популяций M. graminicola обладали гены Stb2, Stb3, Stb4, однако отмечалось снижение их эффективности при заражении растений изолятами из северо-кавказской и поволжской популяций. Ген Stb6 был в высокой степени эффективным против всех пяти популяций M. graminicola. Только в поволжской популяции выявили вирулентность для сорта с этим геном, но она встречалась с низкой частотой (3,4 %). Ген Stb8 был абсолютно эффективным против всех протестированных изолятов. Растения редко имели видимые симптомы поражения, споруляция была очень скудной либо отсутствовала.
Итак, наши исследования показали, что 5 из 8 известных генов устойчивости ( Stb1 - Stb5 ) обладают только частичной функциональностью в природных популяциях Mycosphaerella graminicola в России, а эффективность гена Stb7 не подтвердилась в отношении всех изученных популяций. В то же время идентифицированы потенциальные источники устойчивости к септориозной листовой пятнистости — это сорта с генами Stb6 и Stb8 , которые могут быть рекомендованы для использования в селекционно-генетических программах по созданию форм, устойчивых к M. graminicola на территории Российской Федерации.
Авторы благодарят Dr. S.B. Goodwin (USDA-ARS, Crop Production and Pest Control Research Unit, Small Grain Fungal Disease Laboratory, США) за любезно предоставленные семена сортов с известными генами устойчивости Stb1-Stb8.
Список литературы Генетическая структура региональных популяций Mycosphaerella graminicola (Septoria tritici) - возбудителя септориоза пшеницы (Triticum aestivum L.)
- Eyal Z., Amari Z., Whal I. Physiological Specialization of Septoria tritici. Phytopathology, 1973, 63: 1087-1091.
- Eyal Z., Scharen A.L., Huffman M.D., Prescott J.M. Global insights into virulence frequencies of Mycosphaerella graminicola. Phytopathology, 1985, 75: 1456-1462.
- Kema G.H.J., Annone J.G., Sayoud R., Van Silfhout C.H., Van Gincel M., de Bree J. Genetic variation for virulence and resistance in the wheat-Mycosphaerella graminicola pathosystem. I. Interaction between pathogen isolates and host cultivars. Phytopathology, 1996, 86: 200-212.
- Kema G.H.J., Verstappen E.C.P., Waalwijk C. Avirulence in the wheat Septoria tritici leaf blotch fungus Mycosphaerella graminicola is controlled by a single locus. Mol. Plant-Microbe Interact., 2000, 13: 1375-1379 ( ) DOI: 10.1094/MPMI.2000.13.12.1375
- McCartney C.A., Brule-Babel A.L., Lamari L. Inheritance of race-specific resistance to Mycosphaerella graminicola in wheat. Phytopathology, 2002, 92: 138-144 ( ) DOI: 10.1094/PHYTO.2002.92.2.138
- Kema G.H.J., Goodwin S.B., Hamza S., Verstappen E.C.P., Cavaletto J.R., van der Lee T.A.J., Hagenaar-de Weerdt M., Bonants P.J.M., Waalwijk C. A combined AFLP and RAPD genetic linkage map of Mycosphaerella graminicola, the septoria tritici leaf blotch pathogen of wheat. Genetics, 2002, 161: 1497-1505.
- Brading P.A., Verstappen E.C.P., Kema G.H.J., Brown K.M. A gene-for-gene relationship between wheat and Mycosphaerella graminicola, the Septoria tritici blotch pathogen. Phytopathology, 2002, 92: 439-445 ( ) DOI: 10.1094/PHYTO.2002.92.4.439
- Adhikari T.B., Anderson J.M., Goodwin S.B. Identification and molecular mapping of a gene in wheat conferring resistance to Mycosphaerella graminicola. Phytopathology, 2003, 93: 1158-1164 ( ) DOI: 10.1094/PHYTO.2003.93.9.1158
- Adhikari T.B., Cavaletto R., Dubcovsky J., Giego J., Schlatter A., Goodwin S.B. Molecular mapping of the Stb4 gene for resistance to Septoria tritici blotch in wheat. Phytopathology, 2004, 94: 1198-1206 ( ) DOI: 10.1094/PHYTO.2004.94.11.1198
- Adhikari T.B., Wallwork H., Googwin S.B. Microsatellite markers linked to the Stb2 and Stb3 genes for resistance to Septoria tritici blotch in wheat. Crop Sci., 2004, 44: 1403-1411 ( ) DOI: 10.2135/cropsci2004.1403
- Arraiano L.S., Chartrain L., Bossolini E., Slatter H.N., Keller B., Brown J.K.M. A gene in European wheat cultivars for resistance to an African isolate of Mycosphaerella graminicola. Plant Pathol., 2007, 56: 73-78 ( ) DOI: 10.1111/j.1365-3059.2006.01499.x
- Chartrain L., Sourdille P., Bernard M., Brown J.K.M. Identification and location of Stb9, a gene for resistance to Septoria tritici blotch in wheat cultivars Courtot and Tonic. Plant Pathol., 2009, 58: 547-555 ( ) DOI: 10.1111/j.1365-3059.2008.02013.x
- Liu Y., Zhang L., Thompson I.A., Goodwin S.B., Ohm H. Molecular mapping re-locates the Stb2 gene for resistance to Septoria tritici blotch derived from cultivar Veranopolis on wheat chromosome 1BS. Euphytica, 2012, 190: 145-156 ( ) DOI: 10.1007/s10681-012-0796-8
- Goodwin S.B., Cavaletto J.R., Hale I.L., Thompson I., Xu S.S., Adhikari T.B., Dubcovsky J. A new map location of gene Stb3 for resistance to Septoria tritici blotch in wheat. Crop Sci., 2015, 55: 35-43 ( ) DOI: 10.2135/cropsci2013.11.0766
- Tabib Ghaffary M.S., Laurent V., Guerreiro L. et al. Unravelling and exploitation of diversity for resistance to Mycosphaerella graminicola and Fusarium graminearum in wheat and its progenitors. In: Actes de la rencontre scientifique «Synthèse des programmes de recherché FSOV (Fonds de Soutien à l'Obtention Végétale)» (8 janvier 2008, Paris, France). Groupement national interprofessionnel des semences et plants (GNIS), Section Céréales et Protéagineux, Paris, 2009: 31-38 (ISBN 9782952964401).
- Chartrain L., Brading P.A., Brown J.K.M. Presence of the Stb6 gene for resistance to Septoria tritici blotch (Mycosphaerella graminicola) in cultivars used in wheat-breeding programmes worldwide. Plant Pathol., 2005, 54: 134-143 ( ) DOI: 10.1111/j.1365-3059.2005.01164.x
- Зеленева Ю.В., Судникова В.П. Влияние сорта на патогенные свойства возбудителя Septoria tritici Rob. et Desm. в условиях Центрального Черноземья. Вопросы современной науки и практики, 2014, 2(51): 15-20.
- Nelson L.R., Marshall D. Breeding for resistance to Septoria nodorum and Septoria tritici. Adv. Agron., 1990, 44: 257-277.
- Kema G.H.J., Yu D.Z., Rijkenberg F.H.J., Shaw M.W., Baayen R.P. Histology of the pathogenesis of Mycosphaerella graminicola in wheat. Phytopathology, 1996, 86: 777-786.
- Somasco O.A., Quaiset C.O., Gilchrist D.G. Single-gene resistance to Septoria tritici blotch in the spring wheat cultivar ‘Tadinia’. Plant Breeding, 1996, 115: 261-267 ( ) DOI: 10.1111/j.1439-0523.1996.tb00914.x
- Rosielle A.A. Sources of resistance in wheat to speckled leaf blotch caused by Septoria tritici. Euphytica, 1972, 21: 152-161.
- Saadaoui E.M. Physiologic specialization of Septoria tritici in Morocco. Plant Dis., 1987, 71(2): 153-165.
- Gough F.I. Effect of wheat host cultivars on pycnidiospore production by Septoria tritici. Phytopathology, 1978, 68(9): 1343-1345.
- Санина А.А. Физиологическая специализация Septoria tritici Rob. et Desm. Микология и фитопатология, 1991, 25(4): 338-342.
- Пыжикова Г.В., Санина А.А., Курахтанова Т.И., Давыдова Е.П., Породенко В.В., Санин С.С., Васецкая М.Н., Чигирев С.М., Дубынина Т.С., Москвитин Э.В., Катукова Н.П. Септориозы зерновых культур: метод. указ. М., 1988.
- Санина А.А., Анциферова Л.В. Способы выделения и хранения возбудителей септориоза пшеницы. Микология и фитопатология, 1989, 23(2): 172-175.
- Санина А.А., Анциферова Л.В. Определение патогенных свойств изолятов Septoria nodorum (Berk.) Berk. и S. tritici Rob. et Desm. на пшенице. Микология и фитопатология, 1991, 25(2): 155-159.


