Генетическая структура российских и казахстанских популяций возбудителя бурой ржавчины Puccinia triticina Erikss. по вирулентности и SSR маркерам
Автор: Гультяева Е.И., Шайдаюк Е.Л., Шаманин В.П., Ахметова А.К., Тюнин В.А., Шрейдер Е.Р., Кашина И.В., Ерошенко Л.А., Середа Г.А., Моргунов А.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Агробиология зерновых культур
Статья в выпуске: 1 т.53, 2018 года.
Бесплатный доступ
Бурая ржавчина (возбудитель Puccinia triticina Erikss.) - экономически значимое заболевание яровой пшеницы в западно-азиатских регионах России и Северном Казахстане. Для успешной селекции на устойчивость к инфекции необходима информация об эффективности генов Lr пшеницы, влиянии новых сортов на изменчивость патогена по вирулентности, а также о степени изоляции популяций друг от друга. До настоящего времени в популяционных исследованиях P. triticina не использовали единообразный инфекционной материал (его собирали с разного набора сортов в каждом регионе), в связи с чем на результаты оценки вирулентности существенно влияло селективное действие растения-хозяина. Мы впервые сравнили структуру популяций гриба P. triticina на западе азиатской части России и в Северном Казахстане по вирулентности и молекулярным маркерам, использовав в качестве источника инфекционного материала единый набор образцов пшеницы сезона 2016 года, которые испытываются в этих регионах в рамках программы Казахстанско-Сибирской сети улучшения яровой пшеницы (КАСИБ). Для анализа вирулентности использовали 91 монопустульный изолят, в том числе 13 челябинских, 28 омских, 6 курганских, 16 акмолинских, 16 павлодарских и 12 карагандинских. С помощью 20 почти изогенных Lr-линий Thatcher (TcLr) нами описаны 11 фенотипов вирулентности. Сходный фенотипический состав патогена был выявлен на сортах Дуэт, Терция, Омская 35, Памяти Азиева, Са-ратовская 29, Чебаркульская 3 и линии Эритросперум 85-08. На сорте Астана 2 и линиях Лютесценс 1003, Лютесценс 6/04-4 российские изоляты гриба отличались от казахстанских по вирулентности для ТсLr11, а на линиях ГВК 2074/4 и Лютесценс 715 - авирулентностью в отношении ТсLr18. Более существенные различия по спектру вирулентности между региональными популяциями отмечались на менее поражаемой линии Лютесценс 34/08-19 и сорте Родник. Все изученные изоляты P. triticina были авирулентны для TсLr19, TсLr24 и вирулентны для TсLr3а, TсLr3bg, TсLr3ka, TсLr14a, TсLr14b, ТсLr16, ТсLr17, ТсLr30. На линиях Tс с генами Lr1, Lr2a, Lr2b, Lr2c, Lr9, Lr15, Lr18, Lr20, Lr26 наблюдали варьирование по частоте вирулентности. Вирулентность для TсLr9 выявили в популяциях патогена, собранных с образцов пшеницы с этим геном (Дуэт, Терция, Чебаркульская 3, Лютесценс 34/08-19). Индексы генетических расстояний по M. Nei (Nei D) и ΦPT (аналог Fst для бинарных данных в AMOVA) подтвердили различия в дифференциации популяций по вирулентности. Значения Nei D указывали на высокое сходство между большинством североказахстанских и российских популяций, за исключением челябинской и карагандинской. По индексу ΦPT высоким сходством обладали омская, курганская и североказахстанские популяции. Челябинская популяция была близка с курганской и отличалась от других изученных. С использованием 12 SSR маркеров были охарактеризованы 46 изолятов и выяв-лены 9 генотипов. В результате обнаружен 21 полиморфный аллель. Значения индексов Nei D и Fst указывали на умеренные различия между челябинской и карагандинской популяциями и высокое сходство между другими изученными. В целом проведенные исследования свидетельствуют о высоком сходстве популяций бурой ржавчины в западно-азиатских регионах России и Северном Казахстане, что подтверждает предположение о существовании единой популяции гриба в изученных областях. Для предотвращения эпифитотий P. triticina на сопредельной территории России и Казахстана необходимо постоянное обновление сортимента пшеницы, расширение его генетического разнообразия и применение стратегии мозаичного размещения сортов с соблюдением оптимальных площадей, занятых генетически однородными сортами.
Бурая ржавчина, мягкая пшеница, популяции, вирулентность, lr-гены, ssr маркеры
Короткий адрес: https://sciup.org/142214125
IDR: 142214125 | DOI: 10.15389/agrobiology.2018.1.85rus
Текст научной статьи Генетическая структура российских и казахстанских популяций возбудителя бурой ржавчины Puccinia triticina Erikss. по вирулентности и SSR маркерам
Молекулярно-генетические исследования патогена выполнены при финансовой поддержке РНФ, проект ¹ 14-26-00067. Идентификация генов устойчивости у пшеницы с использованием ПЦР маркеров проведена в рамках проекта РНФ ¹ 16-16-10005.
triticina Erikss.) (1-3). При ее эпифитотийном развитии потери урожая пшеницы могут достигать 15-30 % (4).
Большинство производственных сортов, выращиваемых в Западной Сибири, на Урале и в Северном Казахстане, в разной степени восприимчивы к бурой ржавчине (2, 3). Челночная селекция в рамках созданной CIMMYT (International Maize and Wheat Improvement Center) Казахстанско-Сибирской сети по улучшению яровой пшеницы (КАСИБ) позволяет привлекать мировые генетические ресурсы для повышения эффективности реализуемых селекционных программ, в том числе по устойчивости сортов к бурой ржавчине (1, 5).
Стратегии генетической защиты пшеницы основаны на создании и внедрении в производство сортов, иммунных к бурой ржавчине, для чего, в свою очередь, необходимо располагать данными об эффективности генов устойчивости к ее возбудителю ( Lr -генов), изменению вирулентности популяций патогена под влиянием новых сортов, степени изоляции популяций и возможного потока генов между ними. Частота генов вирулентности рассматривается как важнейший критерий при изучении структуры популяции патогена, однако не всегда адекватно характеризует ее (7, 8), поскольку концентрирование генов вирулентности в популяции гриба напрямую обусловлено селективным давлением возделываемых сортов пшеницы. Несмотря на это, большинство популяционных исследований возбудителя бурой ржавчины в России и за рубежом выполнены на инфекционном материале, собранном с разного набора сортов в каждом регионе (9, 10).
Применение селективно нейтральных молекулярных маркеров для сравнения полиморфизмов ДНК патогена позволяет уточнить и дополнить результаты анализа вирулентности. Такие маркеры незаменимы при изучении путей миграции организмов, формирования единых эпидемиологических территорий и возникновения ареалов (7). Молекулярные маркеры (RAPD — random amplification of polymorphic DNA, AFLP — amplified fragment length polymorphism, SSR — simple sequence repeat) привлекаются для исследований Puccinia triticina с середины 1990-х годов (11), при этом наибольшее применение получили микросателлитные маркеры. С их помощью охарактеризована структура популяций P. triticina на Северо- и Южноамериканском континентах, в Западной Европе, в странах Ближнего Востока, Центральной Азии и Северного Кавказа (4, 8, 12).
Нами для анализа впервые был использован инфекционный материал, собранный с единого набора сортов пшеницы в нескольких географических точках, что позволило снизить селективное давление растения-хозяина на результаты оценки вирулентности. При этом было выявлено высокое сходство популяций возбудителя бурой ржавчины на Урале, в Западной Сибири и Северном Казахстане, что подтвердило предположение о существовании единой популяции гриба на этих территориях.
Цель работы — анализ генетической структуры популяций Puccinia triticina в западно-азиатских регионах России и Северном Казахстане по вирулентности и микросателлитным локусам.
Методика . Образцы Puccinia triticina Erikss. отбирали в 2016 году на растениях 15 сортов пшеницы, изучаемых по программе КАСИБ в условиях Челябинской, Омской, Курганской областей (Россия) и Акмолинской. Карагандинской, Павлодарской областей (Казахстан). Во всех этих регионах погодные условия в 2016 году были благоприятными для развития бурой ржавчины, пораженность сортов варьировала от 0 до 100 %.
Изоляты размножали методом лабораторного культивирования со- гласно описанию (13). Вирулентность 91 монопустульного изолята (по 23 с каждого образца пшеницы) анализировали с использованием 20 почти изогенных линий Thatcher с генами Lr (ТсLr). Для этого по 3 зерна каждой TcLr-линии высевали в почву. Проростки (10-14 сут, фаза 1-го листа) инокулировали суспензией спор патогена (106/мл) и помещали в камеру искусственного климата Versatille Environmental Test Chamber MLR-352H («SANYO Electric Co., Ltd.», Япония) при температуре 22 °С и влажности 75 %. Результаты учитывали на 10-е сут по балльной шкале E.B. Mains и H.S. Jackson (14): 0 — отсутствие симптомов, 0; — некрозы без пустул, 1 — очень мелкие пустулы, окруженные некрозом, 2 — пустулы среднего размера, окруженные некрозом или хлорозом, 3 — пустулы среднего размера без некроза, 4 — крупные пустулы без некроза, Х — разные типы пустул на одном листе, присутствуют хлорозы и некрозы (растения с типом реакции Х относили к восприимчивым).
Фенотипы вирулентности классифицировали по североамериканской системе (15). Для этого 20 TcLr-линий разделили на пять наборов: 1-й — TсLr1, TсLr2a, TсLr2c, TсLr3а; 2-й — TсLr9, TсLr16, TсLr24, TсLr26; 3-й — TсLr3ka, TсLr11, TсLr17, TсLr30, 4-й — TсLr2b, TсLr3bg, TсLr14a, TсLr14b; 5-й — TсLr15, TсLr18, TсLr19, TсLr20. Буквенный код фенотипа определяли с помощью пакета программ VAT (Virulence Analysis Tool; . Индексы межпопуляционных различий по M. Nai (Nei D) и ΦPT (аналог Fst для бинарных данных в AMO-VA, аnalysis of molecular variance) вычисляли с помощью пакета программ GenAlEx (Genetic analysis in Excel 6.5; .
SSR-анализ проводили для 46 монопустульных изолятов P. triticina , в том числе 7 челябинских, 5 курганских, 14 омских, 8 акмолинских, 8 павлодарских и 4 карагандинских (1-2 изолята с каждого изученного образца пшеницы). Процедура подготовки коллекции патогена была сходна с описанной J.A. Kolmer с соавт. (4). ДНК гриба выделяли по методике A.F. Justesen и соавт. (16). Определяли полиморфизм 12 микросателлитных локусов: PtSSR50, PtSSR55, PtSSR61, PtSSR91, PtSSR92, PtSSR151, PtSSR152, PtSSR158, PtSSR161, PtSSR164, PtSSR173, RB35. Используемые SSR маркеры подобраны для оценки генетической изменчивости гриба P. triticina (4, 8, 10, 12). Условия ПЦР и последовательности праймеров представлены в оригинальных работах (17, 18). Исследование выполняли на генетическом анализаторе ABI Prism 3500 («Applied Biosystems», США, «Hitachi», Япония). Размеры SSR аллелей определяли в программе GeneMapper 4.1. Для оценки влияния выращиваемых сортов на вирулентность патогена идентифицировали Lr -гены у образцов пшеницы — источников инфекционного материала. Использовали маркеры генов Lr1 (WR003), Lr9 (SCS5), Lr10 (FI.2245/Lr10-6/r2), Lr26 (SCM 9) и Lr34 (L34DIN9/Lr34Plus) (19). Протоколы ПЦР и праймеры при маркировании сортов и линий соответствовали приведенным в оригинальных работах, процитированных A. Serfling с соавт. (19), реакцию проводили на амплификаторе C1000TM Thermal Cycler («Bio-Rad», США).
Статистическую обработку результатов SSR-анализа, включая расчет Р, осуществляли с использованием пакета программ GenAlEx 6.5 (genetic analysis in Excel, 6.5; . Внутрипопу-ляционную генетическую изменчивость гриба по микросателлитным локусам описывали следующими показателями: среднее число аллелей на локус (Na), число эффективных аллелей (Ne), ожидаемая (Hе) и наблюдаемая (Hо) гетерозиготность, индекс фиксации (F) и индекс Шеннона (I). Генетические различия между популяциями оценивали индексами Nei D по M. Nei и Fst, которые рассчитывали с использованием алгоритма AMOVA 87
-
1. Сорта пшеницы — источники инфекционного материала Puccinia triticina Erikss. и идентифицированные на них фенотипы вирулентности и SSR генотипы патогена в разных географических популяциях (2016 год)
|
Образец |
Россия |
Казахстан |
||||||||||
|
Челябинская область |
Омская область |
Курганская область |
Акмолинская область |
Павлодарская область |
Карагандинская область |
|||||||
|
П, % |
1 Ф/SSR |
П, % |
Ф/SSR |
П, % |
Ф/SSR |
П, % |
Ф/SSR |
П, % |
Ф/SSR |
П, % |
1 Ф/SSR |
|
|
Астана 2 |
50S |
– |
40S |
TGTTR/D |
70S |
TGTTR/D |
90S |
TGPTR/D |
50S |
TGPTR/G |
45S |
– |
|
ГВК 2074/4 |
100S |
– |
80S |
THTTM/D |
70S |
– |
50S |
– |
20S |
THTTR/B |
10S |
THTTR/А |
|
Дуэт |
50S |
PQTKH/F |
50S |
PQTKH/F |
– |
– |
– |
– |
– |
– |
– |
– |
|
Лютесценс 1003 |
20MS |
– |
100S |
TGTTR/F |
40S |
– |
90S |
TGPTR |
50S |
TGPTR/G |
30S |
– |
|
Лютесценс 34/08-19 |
10MR |
– |
5MR |
– |
20S |
PQTKH/B |
5S |
TQTTR/B |
20S |
– |
0 |
– |
|
Лютесценс 6/04-4 |
50S |
THTTR/B |
10MR |
THTTR/B |
10S |
– |
5S |
THPTR/B |
20S |
THPTR/B |
0 |
– |
|
Лютесценс 715 |
50S |
– |
100S |
TGTTM/H |
60S |
– |
70MS |
TGTTR/B |
50S |
– |
20S |
TGTTR/С |
|
Омская 35 |
50S |
– |
100S |
TGTTR/F |
70S |
TGTTR/G |
70S |
TGTTR/C |
50S |
– |
– |
– |
|
Памяти Азиева |
50S |
– |
100S |
TGTTR/C |
80S |
TGTTR/C |
90S |
TGTTR/C |
40S |
– |
40S |
– |
|
Родник |
20S |
THTTR/A |
100S |
TGTTR/A |
30S |
– |
50S |
TGTTR/F |
30S |
MGTKH/B |
10S |
– |
|
Саратовская 29 |
50S |
– |
100S |
TGTTR/F |
50S |
– |
100S |
– |
30S |
TGTTR/F |
70S |
– |
|
Степная 53 |
80S |
– |
80S |
TGTTM/B |
60S |
– |
50S |
– |
50S |
TGTTM/B |
5MS |
TGPTR/С |
|
Терция |
20MS |
– |
40S |
– |
60S |
TQPTR/B |
90S |
– |
40S |
TQPTR/D |
– |
– |
|
Чебаркульская 3 |
50S |
CQPKG/E |
5S |
CQPKG/E |
60S |
– |
10S |
CQPKG/E |
20S |
– |
0 |
– |
|
Эритросперум 85-08 |
50S |
THTTR/B |
5MR |
THTTR/B |
0 |
– |
10S |
– |
10S |
– |
0 |
– |
П р и м еч а ни е. П — пораженность, Ф/SSR — фенотип/SSR генотип. S — тип реакции 3-4 балла, MR — тип реакции 1-2 балла, MS — тип реакции X. Прочерки в таблице означают, что образцы не анализировали.
(GenAlЕx) (для 999 пермутаций). Дендрограмму генетического сходства между региональными популяциями по вирулентности и микросателлит-ным локусам строили в пакете программ NTSYSpc 2.21 по индексам Φ PT и Fst. Данные микросателлитного анализа и оценки вирулентности сравнивали с помощью теста Мантеля на основании расстояний между соответствующими матрицами для вирулентности и SSR маркеров (по индексам Fst и Nei D).
Результаты . По программе КАСИБ проводится ежегодное эколого-географическое изучение образцов пшеницы в условиях Западной Сибири, Урала и Казахстана. Это позволяет осуществить популяционные исследования возбудителя бурой ржавчины на обширной территории (свыше 1000 км) и едином наборе сортов, тем самым исключив фактор селективного давления растения-хозяина на результаты анализа вирулентности.
С использованием 20 Tc Lr -линий были выявлены 11 фенотипов вирулентности (табл. 1). Фенотипы, идентичные во всех пунктах изучения, обнаружили на сортах Дуэт (PQTKH, av.: Tc Lr2a , Tc Lr2b , Tc Lr15 , Tc Lr19 , Tc Lr24 , Tc Lr26 ), Терция (TQPTR, av.: Tc Lr18 , Tc Lr19 , Tc Lr24 , Tc Lr26 ), Омская 35 (TGTTR, av.: Tc Lr9 , Tc Lr19 , Tc Lr24 , Tc Lr26 ), Памяти Азиева (TGTTR), Саратовская 29 (TGTTR), Чебаркульская 3 (CQPKG, av.: Tc Lr1 , Tc Lr2a , Tc Lr2b , Tc Lr2с , Tc Lr11 , Tc Lr15 , Tc Lr19 , Tc Lr20 , Tc Lr24 , Tc Lr26 ) и на линии Эритросперум 85-08 (THTTR, av.: Tc Lr9 , Tc Lr19 , Tc Lr24 ). Российские и североказахстанские изоляты, полученные с образцов Астана 2, Лютесценс 1003 (TGPTR, TGTTR) и Лютесценс 6/04-4 (TНPTR, TНTTR), различались по вирулентности для Тс Lr11, а с линий ГВК 2074/4 (THTTM, THРTM) и Лютесценс 715 (TGРTM, TGTTM) — для Тс Lr18. Карагандинские изоляты (TGPTR) с сорта Степная 53 отличались от омских и павлодарских (TGTTM) с того же сорта вирулентностью для Tc Lr18 и ави-рулентностью для Tc Lr11 . Более существенные различия по спектру вирулентности между географическими популяциями наблюдали на линии Лютесценс 34/08-19 (PQTKH и TQTTR) и на сорте Родник (THTTR, MGTKH, TGTTR). Эти образцы существенно слабее поражались патогеном (Лютесценс 34/08-19 — от 0 до 20 %, Родник — от 10 до 50 %), чем другие изученные (см. табл. 1). Несмотря на некоторые различия между российскими и казахстанскими популяциями, собранными с некоторых образцов пшеницы, в целом мы не наблюдали существенных изменений в спектре вирулентности патогена, обнаруженного на изучаемом материале. Фенотип гриба, выявленный на сорте Чебаркульская 3 (CQPKG), характеризовался 10 аллелями вирулентности, что меньше их числа для фенотипов, идентифицированных на других образцах пшеницы, — от 12 (MGTKH) до 17 (ТНТТR).
С помощью ПЦР у образцов — источников инфекционного материала идентифицировали гены Lr26 (ГВК 2074/4, Эритросперум 85-08), Lr9 и Lr10 (Дуэт), Lr9 и Lr34 (Лютесценс 34/08-19), Lr26 и Lr1 (Лютесценс 6/04-4), Lr10 и Lr34 (Омская 35), Lr10 (Памяти Азиева, Саратовская 29, Степная 53), Lr1 и Lr10 (Родник), Lr9 (Терция, Чебаркульская 3). Гены Lr1, Lr9,Lr10, Lr26 и Lr34 характеризуются как неэффективные в условиях Западной Сибири, Урала и Северного Казахстана (4, 6, 12). При этом их определенные сочетания могут способствовать повышению полевой устойчивости пшеницы (19), что в нашем эксперименте наблюдалось у линии Лютесценс 34/08-19 с генами Lr9 и Lr34 (см. табл. 1).
Высокую эффективность в отношении российских и казахстанских популяций патогена (табл. 2) повсеместно имели гены Lr19 и Lr24 , тогда 89
как Lr3а , Lr3bg , Lr3ka , Lr14a , Lr14b , Lr16 , Lr17 и Lr30 были абсолютно неэффективными.
2. Частота (%) изолятов Puccinia triticina Erikss., вирулентных для разных Tс Lr -линий пшеницы, в изученных географических популяциях (2016 год)
|
Линия Thatcher |
Россия |
Казахстан |
||||
|
с Lr -геном |
1 |
] 2 1 |
3 |
4 |
1 5 1 |
6 |
|
Tс Lr19 , Tс Lr24 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Tс Lr1 |
76,9 |
92,9 |
100 |
93,8 |
100 |
100 |
|
Tс Lr2a |
46,2 |
85,7 |
80,0 |
93,8 |
87,5 |
100 |
|
Tс Lr2b |
76,9 |
92,9 |
80,0 |
93,8 |
87,5 |
100 |
|
Tс Lr2c |
76,9 |
92,9 |
100 |
93,8 |
87,5 |
100 |
|
Tс Lr9 |
23,8 |
14,3 |
40,0 |
18,8 |
12,5 |
0 |
|
Tс Lr11 |
76,9 |
92,9 |
80,0 |
50,0 |
50,0 |
62,5 |
|
Tс Lr15 |
46,2 |
85,7 |
80,0 |
93,8 |
87,5 |
100 |
|
Tс Lr18 |
100 |
78,6 |
100 |
100 |
87,5 |
100 |
|
Tс Lr20 |
76,9 |
92,9 |
100 |
93,8 |
100 |
100 |
|
Tс Lr26 |
46,2 |
21,4 |
0 |
12,5 |
25 |
25 |
|
Tс Lr3а, Tс Lr3bg , Tс Lr3ka , Tс Lr14a ,Tс Lr14b , Tс Lr16 , Tс Lr17 , Tс Lr30 |
100 |
100 |
100 |
100 |
100 |
100 |
|
Число изолятов |
13 |
28 |
6 |
16 |
16 |
12 |
П р и м еч а ни е. 1 — Челябинская область, 2 — Омская область, 3 — Курганская область, 4 — Шортан-динская область, 5 — Павлодарская область, 6 — Карагандинская область.
При тестировании на линиях Tс Lr1 , Tc Lr2a , Tc Lr2b , Tc Lr2c , Tc Lr9 , Tc Lr15 , Tc Lr18 , Tc Lr20 , Tc Lr26 частота вирулентности у изолятов варьировала. Вирулентность для линии с Lr9 выявили в субпопуляциях, собранных на образцах пшеницы с этим геном — Дуэт, Терция, Чебаркульская 3, Лютесценс 34/08-19, с Lr26 — в субпопуляциях с линий ГВК 2074/4, Лю-тесценс 6/04-4 и Эритроспермум 85-08, несущих ген Lr26 . В целом различия между региональными популяциями по частоте проявления вирулентности в отношении линий Тс Lr9 и Тс Lr26 определялись представленностью инфекционного материала с растений пшеницы, несущих эти гены . Все изоляты, вирулентные для линий с Lr9 , характеризовались авирулент-ностью для линий с Lr26 . Это позволяет предположить, что сочетание генов Lr9 и Lr26 может обеспечить эффективную защиту растений пшеницы от бурой ржавчины, как это наблюдается для комбинации генов Lr19 + Lr26 , Lr19 + Lr37 и Lr19 + Lr25 (20). Авирулентность для Tc Lr20 выявили только у образцов, собранных с сорта Чебаркульская 3. Определенные различия между российскими и казахстанскими популяциями наблюдали по вирулентности для Тс Lr11 : в случае Lr11 вирулентность существенно чаще проявлялась в российских популяциях.
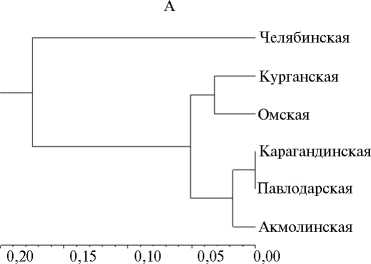
Рис. 1. UPGMA-дендрограмма генетических расстояний между популяциями Puccinia triticina Erikss. по вирулентности (А) и SSR маркерам (Б) (по индексу Fst).
По индексу Nei D большинство российских и казахстанских популяций характеризовалось высоким сходством (Nei D = 0,02-0,7). Исклю-90
чение составили челябинская и карагандинская (Nei D = 0,12). Индекс Φ PT указывал на высокое родство между омскими, курганскими и казахстанскими популяциями. Челябинские популяции были сходны с курганскими и отличались от других изученных (рис. 1, А).
По результатам анализа полиморфизма 12 микросателлитных локусов всего описали 9 генотипов (4 — в челябинской популяции, 4 — в курганской, 7 — в омской, 4 — в павлодарской, 5 — в акмолинской, 2 — в карагандинской) (см. табл. 1). Большинство генотипов встречались в двух популяциях и более, и только два были уникальными (один идентифицировали на линии Лютесценс 715 в омской популяции, другой — на сорте Омская 35 в курганской). Всего обнаружили 21 полиморфный аллель. Для большинства локусов выявили по 2 полиморфных аллеля, за исключением локусов PtSSR55, PtSSR91 и PtSSR164, которые оказались мономорфными (рис. 2, см. online версию статьи на сайте . Мы не обнаружили аллелей, специфичных для определенной популяции. Отметим, что наше исследование выполнено на генетическом анализаторе ABI Prism 3500, у которого, в отличие от приборов 4200 DNA Analyzer или 4300 DNA Analyzer («LI-COR», США), использовавшихся с подобной целью другими научными группами (3, 12, 17, 18), пробоподготовка и анализ полностью автоматизированы, что повышает точность определения и сопоставимость результатов (при той же разрешающей способности).
Показатели генетической изменчивости изолятов P. triticina по микросателлитным локусам были сходными для всех изученных популяций, за исключением карагандинской, что могло быть обусловлено ее малой представленностью в анализе (4 изолята). Среднее число аллелей на локус (Na) варьировало от 1,2 в карагандинской популяции до 1,6-1,7 в других изученных, число эффективных аллелей (Ne) — соответственно от 1,1 до 1,3-1,4. Наблюдаемая гетерозиготность (Но) была выше ожидаемой (Не) для челябинской, курганской, павлодарской и омской популяций, что подтверждалось отрицательными значениями индекса фиксации (F). Для карагандинской и акмолинской популяций наблюдали близкие значения Но и Не (соответственно 0,06 и 0,07; 0,16 и 0,19). Индекс Шеннона (I) был идентичным для всех популяций (0,3), кроме карагандинской (0,1).
Согласно индексу генетических различий Fst, по SSR маркерам не было различий между большинством изученных популяций, за исключением челябинской и карагандинской (Fst = 0,21 Р = 0,003) (см. рис. 1, Б). Аналогичные результаты получили с использованием Nei D (соответственно 0,01-0,03 и 0,07). Выявленная дифференциация между челябинскими и карагандинскими популяциями может быть обусловлена контрастностью сортов пшеницы, возделываемых в этих двух областях, по Lr -генам, географической отдаленностью регионов (свыше 1000 км) и региональными различиями климатических условий. В Карагандинской области бурую ржавчину отмечают спорадически в годы, благоприятные для развития патогена. В Челябинской области заболевание встречается практически ежегодно и относится к группе потенциально опасных.
В целом при сравнении российских и казахстанских популяций индексы генетических расстояний указывали на высокое сходство между ними (Nei D = 0,007; Fst = 0,003; P = 0,31), что согласуется с результатами ранее проведенного анализа вирулентности (10, 20). Низкое значение коэффициента генетической дивергенции (Fst) позволяет предположить существование генного потока между изученными популяциями.
Для всех популяций, кроме челябинской, наблюдали близкий характер дифференциации по вирулентности и микросателлитным локусам: со- гласно тесту Мантеля, при сравнении по Nei D r = 0,88 (Р < 0,001), по индексу Fst — r = 0,43 (Р < 0,001). Сходство челябинской популяции с акмолинской и павлодарской по микросателлитным локусам было существенно выше, чем по вирулентности.
Высокое родство между западноазиатскими российскими и североказахстанскими популяциями указывает на существование единой популяции гриба в этих регионах. Такие результаты согласуются с сообщениями других исследователей и данными, полученными нами ранее (4, 10, 12, 21). Имеется несколько предположений о заносе инфекции на запад азиатской России и в Казахстан. В качестве географического препятствия для распространения спор из Европы в Азию рассматриваются Уральские горы, физического — направления воздушных потоков (21). Показано (22), что вероятность миграции спор с территории Северного Кавказа в Казахстан крайне мала, поскольку проникновению воздушных потоков препятствует циклон, действующий между Каспийским и Аральским морями, и антициклон, спускающийся с севера по Западной Сибири. Подтверждением могут служить эпифитотии болезни в Западной Сибири и на Урале на фоне ее депрессии на Северном Кавказе (21, 22), а также отсутствие изолятов с вирулентностью для форм с Lr9 в северокавказских популяциях (23) при высокой представленности в азиатских.
Согласно мнению других исследователей, эпифитотийное развитие бурой ржавчины в Западной Сибири и Северном Казахстане происходит только при заносе инфекции из южных или юго-западных районов европейской части России (24). Не исключен перенос патогена с посевов Среднего Поволжья и западных районов Казахстана (24, 25). При этом наряду с экзогенной инфекцией в Западной Сибири имеются ее собственные, независимые от европейских источники (21, 22, 24). Произрастание в регионе промежуточного растения-хозяина Isopyrum fumarioides может способствовать развитию возбудителя по полному циклу. Сообщается (26) о более высокой пластичности формы гриба P. triticina , приуроченной к виду I. fumarioides , по сравнению с той, которая поражаетй Thalictrum spp., что повышает конкурентоспособность местных изолятов. Источником инфекции для Северного Казахстана могут служить пораженные посевы озимой и яровой пшеницы на западе республики и в сопредельных областях России. За счет преобладания западных ветров в период вегетации культуры создаются благоприятные условия для воздушного заноса инфекции (27). По другим данным (12, 28), заражение яровой пшеницы в Северном Казахстане происходит при переносе спор воздушными потоками из южной части республики с возделываемой в этом регионе озимой пшеницы из-за отсутствия географических барьеров между севером и югом Казахстана.
Таким образом, с использованием методического подхода, позволяющего снизить влияние растения-хозяина на результаты анализа вирулентности возбудителя бурой ржавчины, нами показано высокое сходство популяций Puccinia triticina Erikss. на Урале, в Западной Сибири и Северном Казахстане. Этим подтверждается предположение о существовании единой популяции патогена на указанной территории. Для предотвращения эпифитотий Puccinia triticina на сопредельной территории России и Казахстана рекомендуется постоянно обновлять сортимент сортов пшеницы, расширять его генетическое разнообразие и применять мозаичное размещение сортов с соблюдением оптимальных площадей, занятых генетически однородными сортами.
Список литературы Генетическая структура российских и казахстанских популяций возбудителя бурой ржавчины Puccinia triticina Erikss. по вирулентности и SSR маркерам
- Шаманин В.П., Петуховский С.Л. Ценность челночного исходного материала яровой мягкой пшеницы для Западной Сибири. Вестник Омского государственного аграрного университета, 2012, 4(8): 4-9.
- Белан И.А., Россеева Л.П., Мешкова Л.В., Блохина Н.П., Першина Л.А., Трубочеева Н.В. Создание сортов мягкой пшеницы, устойчивых к грибным заболеваниям, для условий Западной Сибири и Урала. Вестник Алтайского государственного аграрного университета, 2017, 1(147): 5-14.
- Койшыбаев М. Динамика развития видов ржавчины и септориоза и защита пшеницы от них. Защита и карантин растений, 2015, 9: 21-26.
- Kolmer J.A., Kabdulova M.G., Mustafina M.A., Zhemchuzhina N.S., Dubovoy V. Russian populations of Puccinia triticina in distant regions are not differentiated for virulence and molecular genotype. Plant Pathol., 2015, 64(2): 328-336 ( ) DOI: 10.1111/ppa.12248
- Shamanin V., Salina E., Wanyera R., Zelenskiy Y., Olivera P., Morgounov A. Genetic diversity of spring wheat from Kazakhstan and Russia for resistance to stem rust Ug99. Euphytica, 2016, 121(2): 287-296 ( ) DOI: 10.1007/s10681-016-1769-0
- Тюнин В.А., Шрейдер Е.Р., Гультяева Е.И., Шайдаюк Е.Л. Характеристика вирулентности популяций Рuccinia triticina и перспективы использования генов Lr24, Lr25, LrSp в селекции яровой мягкой пшеницы на Южном Урале. Вавиловский журнал генетики и селекции. 2017, 21(5): 523-529 ( ) DOI: 10.18699/VJ17.269
- Дьяков Ю.Т. Популяционная биология фитопатогенных грибов. М., 1998.
- Kolmer J.A., Hanzalova A., Goyeau H., Bayles R., Morgounov A. Genetic differentiation of the wheat leaf rust fungus Puccinia triticina in Europe. Plant Pathol., 2013, 62: 21-31 ( ) DOI: 10.1111/j.1365-3059.2012.02626.x
- McCallum B., Ceto-Coh P., Xue A. Physiologic specialization of Puccinia triticina, the causal agent of wheat leaf rust, in Canada in 2010. Can. J. Plant Pathol., 2016, 38(4): 440-447 ( ) DOI: 10.1080/07060661.2016.1261047
- Гультяева Е.И., Аристова М.К., Шайдаюк Е.Л., Казарцев И.А. Структура азиатских популяций Puccinia triticina по вирулентности и микросателлитным маркерам. Микология и фитопатология, 2017, 51(1): 54-59.
- Kolmer J. Leaf rust of wheat: pathogen biology, variation and host resistance. Forests, 2013, 4(1): 70-84 ( ) DOI: 10.3390/f4010070
- Kolmer J.A., Ordo_ez M.E. Genetic differentiation of Puccinia triticina populations in Central Asia and the Caucasus. Phytopathology, 2007, 97(9): 1141-1149 ( ) DOI: 10.1094/PHYTO-97-9-1141
- Михайлова Л.А., Гультяева Е.И., Мироненко Н.В. Методы исследований структуры популяций возбудителя бурой ржавчины пшеницы Рuccinia recondita Rob. ex Desm. f. sp. tritici. СПб, 2000.
- McIntosh R.A., Wellings C.R., Park R.F. Wheat rusts. An atlas of resistance genes. Plant Breeding Institute, University of Sydney, CSIRO, Australia, 1995.
- Long D.L., Kolmer J.A. A North American system of nomenclature for Puccinia recondita f. sp. tritici. Phytopathology, 1989, 79(5): 525-529.
- Justesen A.F., Ridout C.J., Hovm_ller M.S. The recent history of Puccinia striiformis f. sp. tritici in Denmark as revealed by disease incidence and AFLP markers. Plant Pathol., 2002, 51: 13-23 ( ) DOI: 10.1046/j.0032-0862.2001.00651.x
- Duan X., Enjalbert J., Vautrin D., Solignac M., Giraud T. Isolation of 12 microsatellite loci, using an enrichment protocol, in the phytopathogenic fungus Puccinia triticina. Mol. Ecol. Notes, 2003, 3(1): 65-67 ( ) DOI: 10.1046/j.1471-8286.2003.00350.x
- Szabo L.S., Kolmer J.A. Development of simple sequence repeat markers for the plant pathogenic rust fungus Puccinia triticina. Mol. Ecol. Notes, 2007, 7(4): 708-710 ( ) DOI: 10.1111/j.1471-8286.2007.01686.x
- Serfling A., Kr_mer I., Lind V., Schliephake Е., Ordon F. Diagnostic value of molecular markers for Lr genes and characterization of leaf rust resistance of German winter wheat cultivars with regard to the stability of vertical resistance. Eur. J. Plant Pathol., 2011, 130(4): 559-575 ( ) DOI: 10.1007/s10658-011-9778-2
- Сибикеев С.Н., Маркелова Т.С., Дружин А.Е., Веденеева М.Л., Сингх Д. Оценка набора интрогрессивных линий яровой мягкой пшеницы селекции НИИСХ Юго-Востока на устойчивость к расе стеблевой ржавчины Ug99+Sr24 (TTKST). Доклады РАСХН, 2011, 2: 3-5.
- Михайлова Л.А. Генетика взаимоотношений возбудителя бурой ржавчины и пшеницы/Под ред. М.М. Левитина. СПб, 2006.
- Павлова Т.В., Михайлова Л.А. Роль миграции спор возбудителя бурой ржавчины пшеницы Puccinia recondita Rob. ex Desm. f. sp. tritici в формировании популяций и возникновении эпифитотий. Микология и фитопатология, 1997, 31(5): 60-66.
- Волкова Г.В. Изучение и использование генетического потенциала устойчивости пшеницы к грибным заболеваниям. Защита и карантин растений, 2010, 9: 13-17.
- Берлянд-Кожевников В.М., Дмитриев А.П., Будашкина Е.Б., Шитова И.Т., Рейтер В.Г. Устойчивость пшеницы к бурой ржавчине (генетическое разнообразие популяций гриба и растения-хозяина). Новосибирск, 1978.
- Лебедев В.Б. Ржавчина пшеницы в Нижнем Поволжье. Саратов, 1998.
- Сорокина Г.К. Динамика расового состава и специализация возбудителя бурой ржавчины пшеницы (Рuccinia recondita Rob. ex Desm. f. sp. tritici Erikss. et Henn.) на территории европейской части СССР. Автореф. канд. дис. М., 1978.
- Турапин В.П., Мостовой В.А. Ржавчинные болезни зерновых культур в Республике Казахстан и борьба с ними. Алматы, 1995.
- Койшибаев М.К. Болезни зерновых культур: симптомы, распространение и вредоносность, специализация, биологические особенности, структура популяций возбудителей и интегрированная защита посевов. Алматы, 2002.


