Генетические эффекты в соматических клетках мышей, подвергнутых хроническому γ-облучению в малых дозах, и у их потомков
Автор: Раскоша О.В., Башлыкова Л.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 4 (28), 2016 года.
Бесплатный доступ
В экспериментах, проведенных на половозрелых мышах линии Af, установлены особенности влияния хронического γ-облучения в дозах 10, 20 и 30 сГр на степень поврежденности генома клеток костного мозга и щитовидной железы. Через четыре месяца после воздействия ионизирующего излучения выявлено изменение доли двунитевых разрывов ДНК в соматических клетках животных при частоте встречаемости клеток с микроядрами в обоих органах в пределах нормы. Более выраженные цитогенетические эффекты обнаружены в костном мозге по сравнению со щитовидной железой, в котором отмечена нелинейная зависимость проявления нестабильности генома от дозы облучения. Результаты, полученные на потомках (F1), подтверждают данные о наследуемости эффектов радиационно-индуцированной нестабильности генома.
Ионизирующее излучение, малые дозы, щитовидная железа, костный мозг, нестабильность генома
Короткий адрес: https://sciup.org/14992865
IDR: 14992865 | УДК: 575.155:575.113:599.323.4:539.166
Текст научной статьи Генетические эффекты в соматических клетках мышей, подвергнутых хроническому γ-облучению в малых дозах, и у их потомков
Актуальность проблемы
Изучение нестабильности генома соматических клеток организма после действия ионизирующего излучения (ИИ) в дозах, реально встречающихся в природных условиях, а также исследование возможности наследования радиационно-индуцированных изменений представляется актуаль- ной проблемой современной радиобиологии. Полагают, что радиационно-индуцированная нестабильность генома является следствием неточной репарации повреждений структуры генома, так как облучение может менять его доступность для системы регуляции экспрессии генов [1]. Особенность этого эффекта проявляется в эпигенетическом характере наследования, т.е. в наследовании изме- ненного состояния генной экспрессии [2]. К настоящему времени накоплены данные, свидетельствующие о повышении нестабильности генома, в том числе и в соматических клетках, у потомства родителей, облученных в разных дозах [2–4]. Однако обнаруженная в области малых доз радиации нелинейность на кривых доза–эффект не позволяет получить законченного представления о закономерностях реакции биологических систем на воздействие факторов низкой интенсивности.
Для выявления особенностей биологического действия ИИ в малых дозах важным является изучение генетических эффектов в соматических клетках органов и тканей, в том числе обладающих разной пролиферативной активностью, таких как костный мозг и щитовидная железа. Костный мозг общепризнанно относится к наиболее радиочувствительным органам с быстрым темпом пролиферации, что позволяет даже при сравнительно небольшом облучении организма обнаруживать генетические нарушения в его клетках. Для определения эффектов после длительного воздействия ИИ перспективным представляется исследование ответной реакции щитовидной железы, состоящей преимущественно из медленно обновляющихся клеточных популяций, что, по данным [5], способствует накоплению структурных изменений ДНК после действия различных факторов.
Цель работы – изучить молекулярные и клеточные эффекты в костном мозге и щитовидной железе мышей линии Af, подвергнутых хроническому γ-облучению в диапазоне малых доз (10, 20 и 30 сГр), и проследить возможность наследования радиационно-индуцированных изменений в потомстве животных первого поколения (F 1 ).
Материал и методы
Эксперименты проводили на половозрелых мышах линии Af (n=96), полученных из питомника экспериментальных животных Института биологии Коми НЦ УрО РАН. Животные находились под воздействием ИИ в течение 29, 56 и 84 сут при мощности экспозиционной дозы 150 мкГр/ч (с кратковременными перерывами на кормление, смену поилок и уборку помещения), суммарные поглощенные дозы составили 10, 20 и 30 сГр, соответственно (опытные группы). Источником γ-излучения служили две ампулы, содержащие 0,474·106 и 0,451·106 кБк 226Ra, разнесенные на расстояние 2,5 м. Суммарную поглощённую дозу облучения определяли по показаниям термолюминесцентных дозиметров (ДТУ-01) с детекторами ДТГ-4 (LiF) на дозиметрической термолюминесцентной установке ДВГ–02ТМ (НПП "Доза", Россия). Для получения потомства (F1) во всех опытных группах (10, 20 и 30 сГр) сразу после облучения самцов спаривали с самками, семьи формировали из расчета один самец на одну/две самки, при этом учитывали их родословную, подбирая неродственных животных. Самцов через четыре месяца после облучения подвергали декапитации с последующим взятием материала для молекулярных и цитогенетических исследований клеток костного мозга и щитовидной железы. Одновременно с соответ- ствующими опытными группами в идентичные условия были посажены на размножение мыши контрольных групп. У потомков F1 (самцы, n=64), полученных от опытных и контрольных животных, материал для анализов брали у двух-трехмесячных особей (в каждой группе было пять–восемь зверьков).
Для цитогенетических исследований клеток костного мозга и щитовидной железы применяли микроядерный тест, который является информативным и быстрым способом индикации генотоксичности факторов внешней среды, в том числе и радиационной природы [6]. Для приготовления суспензии клеток костного мозга из бедренной кости с помощью фосфатно-солевого буфера (рН 7.4) вымывали костномозговую жидкость. Суспензию клеток щитовидной железы получали путем ферментативной диссоциации в 0,25%-ном растворе коллагеназы (Collagenase type IА, Sigma, USA). В зависимости от размеров ткани время инкубации составляло 40–60 мин. В суспензии клеток обоих органов добавляли гипотонический раствор (0,56% КCl, 20 мин, 37°С) и фиксировали охлажденной смесью метанола и ледяной уксусной кислоты (3:1), после чего клетки раскапывали на предметные стекла. Для окраски генетического материала использовали акридиновый оранжевый («Sigma»; 2 мкг/мл в фосфатно-солевом буфере). С помощью флуоресцентного микроскопа «Axioscop А1» ("Carl Zeiss", Jena) подсчитывали число клеток с микроядрами (МЯ) в обоих органах (1 тыс. клеток на препарат). В костном мозге на этих же препаратах анализировали митотический индекс (МИ) и долю клеток, элиминирующих по пути апоптоза [7]. Для подсчета разных типов клеток использовали лабораторный счетчик «СЛФ-ЭЦ-11-01М» (НПФ "Медтех", Россия).
Двунитевые разрывы ДНК (ДР ДНК) определяли по методу «ДНК-комет» в нейтральной версии рН, который основан на электрофорезе иммобилизованных в агарозу отдельных клеток [8]. Электрофорез осуществляли в трис-боратном буфере (рН 8.2, 4°C) при напряжении 1 В/см в течение 20 мин, с последующей фиксацией слайдов в 70° этаноле в течение 10 мин. «ДНК-кометы» визуализировали под микроскопом «Axioscop А1» с помощью видеосистемы на основе цифровой камеры «AxioCam» с программой «AxioVision SE64, Release 4.8.2» (“Carl Zeiss”, Германия) при флуоресцентном режиме, длина волны возбуждающего света – 450-490 нм, запирающий фильтр 510 нм. Для анализа фотоизображений «ДНК-комет» применяли программу «Со-met Score Pro» (“TriTek Corp.”, США), на слайде обрабатывали не менее 50–100 «комет» на каждое животное. Рассчитывали среднее значение %ТDNA, отражающее процент ДНК в «хвосте кометы»[8], вычисляли средние значения частоты клеток с неповрежденной и/или низко фрагментированной ДНК (практически не имеющие «хвоста кометы» или с небольшим «хвостом», диапазон 0-10%TDNA) и с высоко фрагментированной ДНК (имеющие более 40% ДНК в «хвосте кометы»). Достоверность различий между сравниваемыми группами оценивали по t-критерию Стьюдента и U-критерию Манна-Уитни.
Результаты и обсуждение
Результаты цитогенетического исследования костного мозга показали, что через четыре месяца после хронического γ-облучения мышей в диапазоне доз 10-30 сГр частота клеток с МЯ была в пределах значений, характерных для необлученных животных (рис. 1). В ответ на радиационное воздействие в этом органе происходило статистически значимое понижение относительно нормы элиминации клеток по пути апоптоза (во всех опытных группах) и уровня МИ (после доз 10 и 20 сГр). Известно, что замедление клеточного цикла (снижение МИ) может быть обусловлено остановкой клеточного цикла в точках контроля целостности ДНК, необходимой для увеличения продолжительности и эффективности репарации повреждений ДНК [9]. Сравнение ранжированных данных (см. таблицу) по процентному содержанию ДНК в «хвосте кометы» показало, что у мышей, подвергнутых радиационному воздействию в дозе 30 сГр, среднее значение %ТDNA было статистически значимо ниже нормы. По нашему мнению, на это повлияло увеличение в два раза (р<0,001) числа неповрежденных и/или малоповрежденных клеток, что может свидетельствовать об активации систем репарации ДНК в ответ на действие ионизирующей радиации в этой дозе. Средние значения %ТDNA у мышей, облученных в дозах 10 и 20 сГр, были в пределах нормы, однако ранжирование клеток по классам в зависимости от степени фрагментации ДНК в «хвосте кометы» позволило выявить различия с контролем и в этих опытных группах, причем направленность изменений зависела от дозы воздействия. Так, в костном мозге животных, облученных в дозе 10 сГр, по сравнению с контролем было снижено в 1,7 раза количество клеток с неповрежденной и/или низко фрагментированной ДНК (<10% ДНК в «хвосте кометы»; р<0,001), а после воздействия ИИ в дозе 20 сГр изменялась частота встречаемости клеток с высоко фрагментированной ДНК, когда более 40% ДНК находилось в «хвосте кометы» (понижение в 1,8 раза; р<0,01).
У потомков (F 1 ) облученных мышей по сравнению с потомками животных контрольной группы в клетках костного мозга выявлено статистически значимое повышение индукции клеток с МЯ, и наиболее ярко это проявлялось после доз 10 и 20 сГр (рис. 1). Данные литературы [4] и полученные нами результаты свидетельствуют о том, что увеличение частоты встречаемости МЯ в костном мозге является следствием повышенного уровня нестабильности генома соматических клеток потомков, облученных родителей. Кроме того, в костном мозге потомков, рожденных от облученных родителей, уменьшалась в 1,5–2,8 раза относительно нормы доля клеток с мало поврежденной ДНК (во всех
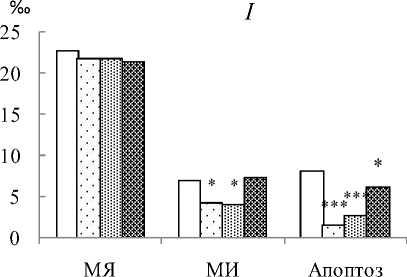
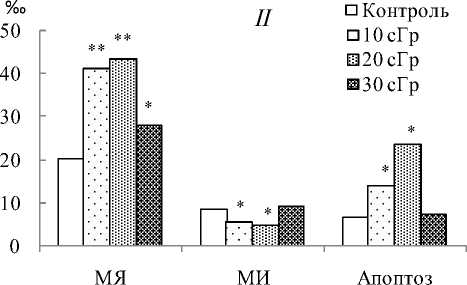
Рис. 1. Цитогенетические эффекты в клетках костного мозга мышей линии Af, подвергнутых хроническому γ -облучению в малых дозах ( I ), и у их необлученных потомков F1 ( II ).
Примечание. МЯ – микроядра, МИ – митотический индекс. Здесь и в таблице различия с контролем статистически значимы при *р<0.05, **р<0.01 и ***р<0.001.
Результаты метода ДНК-комет, проведенного на соматических клетках мышей линии Af, подвергнутых хроническому γ -облучению в малых дозах, и у их необлученных потомков (F 1 )
|
Группы животных |
Варианты эксперимента |
Костный мозг |
Щитовидная железа |
||||
|
%TDNA |
0-10% TDNA |
41-100% TDNA |
%TDNA |
0-10% TDNA |
41-100% TDNA |
||
|
Облученные животные |
Контроль |
23,3±0,3 |
13,1±0,8 |
5,7±0,6 |
31,7±0,96 |
18,6±1,1 |
33,3±1,3 |
|
10 сГр |
24,6±0,4 |
7,6±1,1*** |
4,0±0,8 |
31,9±0,97 |
19,3±1,9 |
34,7±2,3 |
|
|
20 сГр |
23,2±0,4 |
13,7±1,4 |
3,1±0,7** |
27,7±0,8* |
19,7±1,8 |
17,4±1,7*** |
|
|
30 сГр |
19,6±0,5*** |
27,9±1,8*** |
6,3±1,0 |
30,4±1,0 |
16,79±1,96 |
21,3±2,15*** |
|
|
Потомки облученных животных (F 1 ) |
Контроль |
15,6±0,6 |
40,2±2,6 |
5,3±1,2 |
15,8±0,8 |
42,6±2,9 |
5,2±1,3 |
|
10 сГр |
19,3±0,4*** |
23,8±1,3*** |
3,4±0,6 |
15,8±0,7 |
50,7±1,98* |
5,35±0,9 |
|
|
20 сГр |
24,7±0,8*** |
26,6±1,3*** |
12,2±1,0*** |
18,2±0,8* |
42,6±2,2 |
7,6±1,2 |
|
|
30 сГр |
25,6±0,5*** |
14,2±1,2*** |
12,9±1,2*** |
15,78±0,7 |
46,6±2,1 |
4,8±0,9 |
|
Примечание: %TDNA – среднее значение ДНК в «хвосте кометы»; 0-10%TDNA – диапазон встречаемости клеток с низко фрагментированной ДНК, 41-100%TDNA – диапазон встречаемости клеток с высоко фрагментированной ДНК.
опытных группах) и увеличивалось в 2,4 раза количество клеток с фрагментацией ДНК более 40% (родители были облучены в дозах 20 и 30 сГр) (см. таблицу). В результате средние значения содержания ДНК в «хвосте комет» в костном мозге потомков всех опытных групп были статистически значимо выше контроля (р<0,001). По данным литературы [4, 10], повреждения ДНК, с одной стороны, являются субстратом для репаративных ферментов в клетке, а с другой – запускают программу клеточной гибели – апоптоз. В условиях проведенного эксперимента воздействие ИИ на мышей в дозах 10 и 20 сГр вызывало в костном мозге у их потомков статистически значимое повышение частоты встречаемости апоп-тозных клеток и уменьшение доли МИ, чего не наблюдали у животных в случае, если их родителей подвергали радиационному воздействию в большей дозе (30 сГр). Изменение пролиферативной активности и элиминации клеток под воздействием малых доз ИИ может свидетельствовать о перестройке работы системы защиты клеток, которая к тому же передается следующему поколению животных. Полагаем, что изменения МИ и количества апоптозных клеток в костном мозге потомков животных, облученных в дозах 10 и 20 сГр, являются ответной реакцией на повышенный уровень повреждений ДНК и свидетельствуют об изменении программы поддержания стабильности генома не только через активацию процессов репарации ДНК, но и апоптоза.
Данные микроядерного теста, проведенного на щитовидной железе мышей, показали, что после хронического воздействия ИИ в разных дозах число клеток с МЯ в исследуемой ткани, как и в костном мозге, сохранялось в пределах значений, соответствующих контролю (рис. 2). Применение метода «ДНК-комет» позволило выявить изменения на молекулярном уровне в геноме тироцитов животных, облученных в дозах 20 и 30 сГр: после радиационного воздействия в этих дозах число клеток с высоким содержанием разрывов нитей ДНК (диапазон 41–100%TDNA) было ниже нормы в 2 и 1,6 раза, соответственно (см. таблицу). Это повлияло на средние значения содержания ДНК в «хвосте кометы» (20 сГр; р≤0,01). О понижении доли тироцитов с ДР ДНК после облучения животных в дозе 30 сГр свидетельствуют результаты, описанные нами ранее в работе [11], где использовали интегральный показатель «Olive tail moment», учитывающий и длину
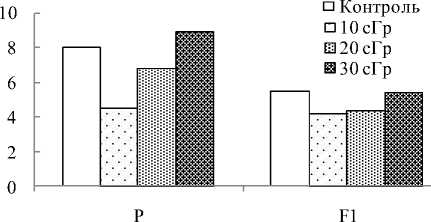
Рис. 2. Частота клеток с МЯ в щитовидной железе мышей линии Af, подвергнутых хроническому γ -об-лучению в малых дозах, и у их необлученных потомков F1.
«хвоста кометы», и плотность содержания ДНК в «хвосте». Наряду с этим выявлено, что после воздействия ИИ в максимальной дозе была значительно повышена частота встречаемости клеток на стадии позднего апоптоза, когда более 90% ДНК выходило за пределы «головы кометы» [7]. Малые дозы облучения (20 и 30 сГр) могли явиться адаптирующим фактором и вызвать усиление репарации разрывов нитей ДНК в клетках щитовидной железы, которое в конечном итоге привело по сравнению с нормой к понижению числа поврежденных клеток и усилению апоптоза (30 сГр). Следует отметить, что в условиях проведенного эксперимента в щитовидной железе мышей, подвергнутых воздействию ИИ в дозах 10-30 сГр, число клеток, в которых ДНК находилось вблизи «головы кометы», было в пределах значений, характерных для необлученных животных.
При сравнительном цитогенетическом анализе клеток щитовидной железы потомков мышей, полученных от контрольных и облученных (разными дозами) родителей, не обнаружено статистически значимых отличий по частоте встречаемости клеток с МЯ. Тем не менее, при изучении фрагментации ДНК в тироцитах потомков выявлены некоторые особенности, проявляющиеся в зависимости от используемой при экспонировании их родителей дозы. В связи с этим заслуживают внимания данные о повышении доли неповрежденных клеток (диапазон 0-10%TDNA; р≤0,05) в щитовидной железе потомков мышей, облученных в дозе 10 сГр, а с увеличением дозы облучения животных до 20 сГр, наоборот, у их потомков происходило удлинение «хвоста кометы». Это может свидетельствовать о повышении ДР ДНК в тироцитах мышей данной опытной группы.
Заключение
Таким образом, можно сделать вывод об эффективности хронического воздействия ИИ в малых дозах (10-30 сГр) на костный мозг и щитовидную железу – органы, обладающие разной пролиферативной активностью. Применение цитогенетического и молекулярного методов показало, что через четыре месяца после хронического воздействия ИИ в малых дозах отмечено изменение доли ДР ДНК в клетках костного мозга и щитовидной железы, при этом частота встречаемости клеток с МЯ после облучения мышей в обоих органах сохранялась в пределах нормы. В ответ на малые дозы ИИ более выраженные эффекты на клеточном и молекулярном уровнях установлены в костном мозге по сравнению со щитовидной железой. Важным является выявленная в костном мозге нелинейная зависимость проявления нестабильности генома от дозы облучения, когда большая эффективность наблюдалась после низких доз радиационного воздействия (10 и 20 сГр по сравнению с 30 сГр). Результаты, полученные на потомках F 1 , подтверждают данные о наследуемости эффектов радиационно-индуцированной нестабильности генома. Обнаруженные в потомстве нарушения проявлялись как и у их родителей, преимущественно в клетках костного мозга с наследованием нелинейного характера зависимости доза–эффект.
Работа поддержана из средств темы НИР «Сохранение коллекций экспериментальных животных для фундаментальных исследований».
Список литературы Генетические эффекты в соматических клетках мышей, подвергнутых хроническому γ-облучению в малых дозах, и у их потомков
- Заварыкина Т.М. Структурные изменения ДНК при действии низкоинтенсивной ионизирующей радиации в малых дозах: Автореф. дис. канд. мед. наук. М., 2008. 26 с
- Дуброва Ю.Е. Нестабильность генома среди потомков, облученных родителей. Факты и интерпретация//Генетика. 2006. Т. 42. №10. С. 1335-1347
- Воробцова И.Е. Трансгенерационная передача радиационно-индуцированной нестабильности генома//Радиационная биология. Радиоэкология. 2006. Т.46. №4. С. 441-446
- Кузнецова E.А., Заичкина С.И., Сирота Н.П. и др. Индукция редко-и плотноионизирующими излучениями повреждений ДНКвлейкоцитах крови и цитогенетических повреждений в полихроматофильных эритроцитах костного мозга мышей и их потомков//Радиационная биология. Радиоэкология. 2014. Т. 54. № 4. С. 341-349
- Гансбургский М.А. Анализ клеток с микроядрами в оценке пролиферации эпителия щитовидной железы: Автореф. дис. канд. мед. наук. М., 2005. 21 с
- Полиорганный микроядерный тест в эколого-гигиенических исследованиях/Под ред. Ю.А. Рахманина, Л.П. Сычевой. М.: Гениус, 2007. 312 с
- Тронов В.А. Репарация ДНКиапоптоз//Цитология. 1999. Т. 41. № 5. С. 405-410
- Olive P.L., Banath J.P. Detection of DNA double-strand breaks through the cell cycle after exposure to X-rays, bleomycin, etoposide and 125IdUrd//Int. J. Radiat. Biol. 1993. Vol. 64. № 4. Р. 349-358
- Жижина Г.П. Влияние малых доз низкоинтенсивной ионизирующей радиации на структуру и функции ДНК//Радиац. биология. Радиоэкология. 2011. Т. 51. № 2. С. 218-228
- Oliver F.J., Menissierde Murcia J., and de Murcia G. Poly(ADP-Ribose)Polymerase in the Cellular Response to DNA Damage, Apoptosis and Disease//Am. J. Hum. Genet. 1999. №64. Р. 1282-1288
- Раскоша О.В. Оценка стабильности генома в клетках щитовидной железы мышей после хронического воздействия ионизирующего излучения в малой дозе, и у их потомков//Успехи современного естествознания. 2016. № 4. С. 48-52


