Генетические методы улучшения качества пшеницы твердых сортов, адаптированных к климатическим условиям России с особым акцентом на коммерческие характеристики зерна
Автор: Шевченко Сергей Николаевич, Мальчиков Петр Николаевич, Мясникова Марина Германовна, Натоли Винченцо, Де Вита Паскуале, Марчелла Джулияни
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-2 т.20, 2018 года.
Бесплатный доступ
Реформы экономики, проведённые в России в 90-е годы ХХ века, привели к значительному сокращению посевных площадей под твёрдой пшеницей и значительному падению потребления продуктов её переработки. Большое количество макаронных изделий и крупы производилось в то время из более дешёвой мягкой пшеницы. Качество, питательная и диетическая ценность этих изделий значительно уступают аналогам из твёрдой пшеницы. В этот же период увеличился импорт макаронных изделий высокого качества в основном итальянского производства. В то же время климат и плодородные почвы степных районов России позволяют производить достаточное количество зерна для удовлетворения внутренних потребностей и экспортировать его в страны Европейского Союза, где зерно твёрдой пшеницы является единственным продуктом импорт, которого, не облагается пошлиной и имеет премиальную цену. Несмотря на эти условия, высокая конкуренция и требования к качеству зерна осложняют доступ отечественных производителей на рынок ЕС. Основным препятствием при этом являются европейские требования к качеству клейковины, которые значительно отличаются от нормативов отечественного ГОСТа, в соответствие с которым создаются сорта твёрдой пшеницы в России. В связи с этим противоречием (хороший климат и возможности производства с одной стороны и отсутствие адаптированных сортов необходимого качества с другой), актуальным селекционно-генетическим направлением следует признать создание отечественных сортов с высоким качеством клейковины, удовлетворяющим требования европейского рынка. Практическая реализация этого направления - цель исследований, представленных в настоящей публикации. Основная задача перед коллективом исследователей из России и Италии сводилась к поиску путей ускоренного переноса генетических систем высокого качества клейковины в генофон адаптированных к степным регионам России генотипов и создание на основе этого исходного материала конкурентоспособных, коммерческих сортов яровой твёрдой пшеницы. В качестве базовых генотипов были использованы три линии безенчукской селекции, в качестве доноров высокого качества клейковины (параметр индекс глютена - IG) сорта Kofa (Канада), Aureo, Achille (оба Италия). В настоящей публикации приведены результаты селекции новых генотипов с высоким качеством на основе генетической системы сорта Kofa. Беккроссирование сопровождалось отбором в расщепляющихся поколениях с применением технологии геномной селекции. Растения, несущие аллель-вариации от Кофа (блок QTLна 1А хромосоме), были оценены с помощью 100 молекулярных маркёров SSR (Single sequence Repeat), покрывающих все хромосомы геномов А и В, для отбора растений, наиболее близких генетически российской линии, использованной в качестве материнской формы при скрещивании. В результате проведённой работы получены новые генотипы, названные Таганрог (Taganrog) и Бурбон (Bourbon). Эти линии в тестовых испытаниях показали величину IG равную 85 единицам, что соответствует лучшим итальянским сортам, которые особенно ценятся при производстве макаронных изделий.
Пшеница твёрдых сортов, генетические методы улучшения, климатические условия, характеристики зерна, качество клейковины
Короткий адрес: https://sciup.org/148313903
IDR: 148313903 | УДК: 631.52
Текст научной статьи Генетические методы улучшения качества пшеницы твердых сортов, адаптированных к климатическим условиям России с особым акцентом на коммерческие характеристики зерна
Пшеница твердых сортов ( Triticum turgidum sbsp., durum Desf., известная также как Triticum durum Desf.,) является одним из основных пи-
Марчелла Джулияни, доктор биологических наук, профессор.
плекс морфологических признаков и особенности химического состава зерна. Этот вид пшеницы имеет удлиненное, широкое, твердое с ярко-желтым цветом и повышенным содержанием белка зерно, которое используется для производства широкой гаммы продуктов. Основная масса выращиваемого зерна идет на изготовление макаронных изделий. Современная технология производства пасты требует специальных сортов, отличающихся высокими показателями твердости, стекловидности зерна, наличию в нём каротиноидных пигментов, которые придают макаронным изделиям классический желтый цвет, высоким содержанием белка и хорошим качеством клейковины, оцениваемому по индексу глютена (IG). Последний показатель очень важен для широкого применения технологии высокотемпературной сушки макаронных изделий, кардинально увеличивающей производительность и эффективность производства пасты. Эта технология производства макарон в настоящее время широко применяется в Европе, Северной Америке и Австралии. В России также применяют эту технологию особенно на предприятиях с участием иностранного капитала. Основным препятствием для её повсеместного распространения в России и странах СНГ является отсутствие сортов с требуемой генетической основой качества клейковины.
Целью настоящей работы были поиск путей ускоренного переноса генетических систем высокого качества клейковины в генофон адаптированных к степным регионам России генотипов и создание на основе этого исходного материала конкурентоспособных, коммерческих сортов яровой твёрдой пшеницы. Реализация этой программы на первом этапе исследований включала оценку качества различных линий твёрдой пшеницы, имеющихся в России и предоставленных Самарским НИИСХ в распоряжение итальянских исследователей (Crea-CI Italy, Факультет сельского хозяйства Университета г. Фоджа ) и российского предприятия Agroliga Plant Selection Center участника фонда «Сколково». Изучение качественных параметров этих селекционных линий, в частности оценка индекса глютена (IG), позволило установить, что величины этого индекса у всех генотипов значительно меньше требований стандартов наиболее премиального европейского рынка. В то же время итальянские селекционные линии, изученные в одном и том же полевом эксперименте в условиях Среднего Поволжья (Самарский НИИСХ), отличающиеся высоким качеством клейковины по IG, показали низкий уровень адаптации по урожайности, - примерно 30-40% относительно местных сортов. Эти результаты инициировали второй этап исследований, с задачами осуществления рекомбинации генетических систем адаптивности и качества клейковины, носителями которых являются российский и итальянский селекционный материал соответственно. Для этого были отобраны три российские линии лучшие по урожайности, адаптации и устойчивости к болезням. Выбор этих линий был сделан по результатам трехлетних экспериментов в условиях Самарского НИИСХ. Они были включены в систему скрещиваний и беккрос-сирования с сортами Kofa, Aureo и Achille. В данной статье приведены результаты изучения потомства, полученного от скрещивания с сортом Kofa.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исходный генетический материал – источники адаптивности и высокого качества клейковины. В качестве рекуррентных родительских генотипов использованы российские сорта и новые селекционные линии (оригина-тор Самарский НИИСХ), отобранные по результатам полевых экспериментов в 2016 и 2017 гг., по урожайности и адаптивности В качестве доноров генетических систем качества клейковины использованы сорта: Kofa (Канада),Achille, Aureo (Италия). В 2016 г. были изучены 50 генотипов в том числе 6 сортов, включённых в реестр селекционных достижений, 38 селекционных линий и 6 итальянских сортов. В 2017 г. испытания были продолжены с 18 лучшими по данным изучения в 2016 году линиями, в том числе с 4-мя сортами, включёнными в реестр селекционных достижений и 6-ю новыми итальянскими линиями. Условия для формирования урожайности в годы изучения очень сильно различались. В 2016 году отмечены засуха, сильные эпифитотии фузариозной листовой пятнистости, стеблевой ржавчины, в средней степени наблюдалось распространение мучнистой росы. В 2017 году очень благоприятные условия температурного режима, большое количество осадков и незначительная патогенная нагрузка в процессе роста растений и налива зерна, способствовали формированию высокого урожая. Средняя урожайностьв 2017 году (4,2т/га) была в 3 раза выше, чем в 2016 году. Оценка качества зерна в оба года проведена по содержанию белка, каротиноидных пигментов, IG, SDS микроседиментации и профилю одномерного SDS-page по электрофоретическим спектрам глютенина - HMW ( высокомолекулярный) и LMW ( низкомолекулярный), а также по спектру блоков глиадина.
Схема и процедуры селекции. Три лучшие линии по результатам испытаний 2016 г. были скрещены с сортом Кофа - донором блока генов
(Qtl на 1А хромосоме) по увеличению IG. После самоопыления поколения F1 было получено около 500 растений F2 по каждому отдельному скрещиванию (в трех скрещиваниях всего 1500 растений). На стадии трех листьев от каждого растения были взят растительный материал для выделения ДНК и определения присутствия нужного блока генов (Qtl -1А). Растения, несущие аллель-вариации Кофа (блок QTLна 1А хромосоме), были оценены с помощью 100 молекулярных маркёров SSR (Single sequence Repeat), покрывающих все хромосомы геномов А и В, для отбора растений, генетически наиболее близких российской линии, использованной в качестве материнской формы при скрещивании. Отобранные растения были выращены в камере интенсивного выращивания, где с помощью регулировки температуры и времени освещения было стимулировано интенсивное кущение, каждое раскустившееся растение, было клонировано путем прореживания и высаживания на среду с интенсивным корневым развитием. Таким путем было получено по 20 клонов от каждого отобранного растения в F2. Это позволило получить достаточное количество семян для проведения тестов (фенотипирования) качества по SDS микроседиментации и SDS-page для контроля электрофоретических спектров глютенина (HMW, LMW) и глиадина. Было отобрано 10 растений по каждому скрещиванию со всеми желаемыми характеристиками. Каждое растение было повторно скрещено с российской линией и по каждому прародителю F2BС1 были отобраны только линии с аллель-вариациями от Кофа (блок генов Qtl на 1А хромосоме). Как и с растениями F2,здесь также были проведены процедуры клонирования растений и феноти-пирования качества клейковины. В этом цикле также было сохранено 10 растений с необходимыми характеристиками для повторного скрещивания (ВС2). Все операции генотипирования, геномной селекции, фенотипирования качества клейковины и клонирования линий, были аналогичны проведённым на предыдущих этапах (F2, F2BC1). Часть семян, отобранных растений, была оставлена для размножения. Другая часть была параллельно с размножением использована для анализа качества клейковины. При этом был добавлен анализ по %UPP (Unextract polymeric protein) - процент не извлекаемых полимерных белков. В результате в F2BC2 были отобраны 3 растения – по одному для каждого скрещивания и только потомства 2-х растений были размножены in vitro, получено 10000 растений каждой линии, которые были использованы для размножения и получения коммерческой партии семян. На рис 1 показана схема и порядок выполнения всех представленных выше работ.
Русская линия (материнская форма) x итальянская линия (отцовская форма)
Геном RS X Геном IT + QTL
j| 1° СКРЕЩИВАНИЕ
F1 Растение с цитоплазмой русской линии X Русская линия
(50% Русский геном и 50% итальянский геном) САМООПЫЛЕНИЕ F1
РАСТЕНИЯ F2
Селекция растений F2 по каждому F1, носителю нужных диапазонов SDS, блоки QTLs по коэффициенту клейковины (анализ SDS в связке с коэффициентом клейковины), тест 100 SSR (Single Sequence Repeat) по отбору растений с наибольшей долей в геномоме русской линии и оценка Мономерного SDS-Page по селекции нужных диапазонов.
2° СКРЕЩИВАНИЕ
F2BC1 Растения, прошедшие селекцию по блоку генов (Qtl)s, коэффициенту клейковины (SDS) и наибольшему геному русской линии с цитоплазмой: русская линия X Русская линия
(75% Русского генома и 25% итальянского генома)
Селекция растения BC1 с нужными QTLs и с геномом наиболее близким к русской линии и снова скрещенная с русской линией. Анализ SDS microsedimentaion и %UPP.
3° СКРЕЩИВАНИЕ
F2BC2 Растения с цитоплазмой: русская линия X Русская линия
90% Русского генома и 10% итальянского генома)
Селекция растения F2BC2 с нужным QTLs и с геномом (100 SSR marker),наиболее близким к русской линии, и самооплодотворение последнего. Анализ SDS microsedimentaion и %UPP
4° РАЗМНОЖЕНИЕ IN VITRO
Размножение in vitro растения F2BC2S1,растение с 95% русского генома и качественными итальянскими блоками QTLs. Получение 300.000 ростков для пересадки в делянки 2000 кв.м.
5° РАЗМНОЖЕНИЕ
Размножениев поле площадью 2000 кв.м. производством 400 кг семян.
Схема - рис. 1. Порядок выполнения всех работ по переносу генов качества клейковины в российский генофонд
Взятие геномной ДНК. Была осуществлена стандартная процедура взятия геномной ДНК, применяемая и повторяемая на любом образце зерновых. Взятие проведено из материалов листьев, полученных от смешивания проб 20 рас- тений, выращенных в торфяной теплице. Фаза отбора листовых проб определялась состоянием растений, выращенных в торфяной теплице, при полном развитии 3-4-х листьев, то есть с запасом в 10 дней до крайнего срока. Сразу после сбора материал был лиофилизирован, а затем мелко перемолот с использованием ступки с добавлением стерильного кварцевого порошка. Решение о взятии ДНК из листьев, а не непосредственно из зерна, связано с более высокой чистотой извлекаемой из листового материала ДНК.
Выбор маркеров SSR (Single Sequence Repeat), ассоциированных с наиболее близким блоком генов (Q TL) (Quantitative Trait Loci), при проверке значения индекса глютена , и компонента спектра высокомолекулярного глютенина - HMW (Hight Molecul а r Weigth), ассоциированного с локусом GLU-B1.
В процессе селекции были использованы молекулярные маркеры для перевода в нужные линии основных QTLS (Quantitative Trait Loci). Для выполнения данной программы было решено использовать два маркера блоков QTLs (Quantitative Trait Loci), которые в большей степени ассоциированы с хорошим показателем IG и микроседиментации - SDS, то есть блоки QTLs, имеющиеся в сорте Кофа и обнаруженные Bubcvsky et al. (2008), расположенные на хромосоме 1 A в интервале между двумя маркерами SSR Barc 148 и SNP (Single Nucleotide Polimorfism) BM140362 и на хромосоме 1 B в соответствии с блоком Glu-b1 высокомолекулярных глютенинов (HMW: Higth Molecular Weight). В отношении блока Qtl, расположенного на хромосоме 1 B, работу с применением молекулярных маркеров не проводили, ограничившись оценкой наличия аллеля HMW от Кофа (6+8), который оказался отличным от того, который имели отобранные российские линии (аллельный вариант - 7+8). Эти дваблока Qtls обеспечивали нам не менее 40% вариативности по IG.
Выбор маркеров SSR (Single Sequence Repeat) для характеризации генотипа линий. При характеристике генотипа использовались результаты работы Natoli. V (2008). В соответствии с методикой были, на основании информативности (PIC: InformationContent), отобраны 100 SSR (Single Sequence Repeat) маркеров с тем, чтобы ими были представлены все аллель-формы отличные от двух родителей 3371 и сорта Kofa. Кроме того, для правильной характеристики линий, 100 пар праймеров, соответствующих такому же количеству маркеров-микросателлитов (SSR), были отобраны также для того, чтобы обеспечить хорошее покрытие двух геномов А и В пшеницы твёрдых сортов. Обычно эти праймеры имеют высокую специализацию по локусам и только в немногих случаях последовательности, используемые для создания праймеров, оказывались идентичными на уровне 2 гоме-ологичных геномов, допуская одновременное применение микросателлитных локусов в обоих геномах A и B. Использованные SSRs включают в себя i) общедоступный набор, имеющийся в базе данных GrainGenes : WMC (Xwmc, Gupta et al., 2002), BARC (Xbarc, Song et al. 2002 и 2005), CFA и CFD (Xcfa и Xcfd Sourdille et al. 2001; Guyomarc’h et al. 2002) и WMS (Xgwm), (Röder et al., 1998; Somers et al., 2004; Sourdille et al., 2004). В работе Natoli. V(2008), уровень полиморфизма каждого локуса SSR, был выражен коэффициентом полиморфизма, известным как PIC (“Polymorphic Information Content” или gene diversity index”), в котором учитывается как количество аллелей, имеющихся в определенном локусе, так относительная частота каждого аллеля (Anderson et al., 1992, Kremer at al., 1998). Этот показатель рассчитывается по формуле: PIC = 1 – Σpj2, где pj – частота jго аллеля в рассмотренных линиях. Коэффициент PIC представляет собой вероятность того, что в определённом локусе две линии, выбранные случайно из анализируемых, отличаются друг от друга. Полученное значение PIC по каждому локусу было сопоставлено с максимальным теоретическим значением, достижимым в зависимости от числа имеющихся аллелей. Коэффициент PIC достигает максимального значения, когда все аллели равномерно распределены по линиям (то есть имеют одинаковую частоту). При выборе локуса SSR принимался во внимание другой дополнительный коэффициент PIC (также рассчитываемый на основании работы Natoli. V (2008) -“число эффективных аллелей” (“effective number of allels”), обозначаемый как Ae: Ae = 1 / (1 – PIC). Он представляет собой теоретическое число аллелей, имеющих каждая одинаковую частоту в изучаемом материале, в котором значение PIC равно реально наблюдаемому значению в данном локусе. Значение Ae всегда меньше наблюдаемого числа аллелей. Чем сильнее значение Ae приближается к наблюдаемому, тем выше уровень информативности и дискрими-национности (возможности разделения) локуса (Kremer et al., 1998).
Количественные анализы или фено-типирование качества клейковины. SDS-PAGE (Sodium Dodecyl Sulphate - PolyAcrylamide Gel Electrophoresis, то есть электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) использовался для анализа белковых экстрактов. Принцип, на котором основывается эта технология электрофореза, заключается в действии денатурата SDS; он способен интегрироваться с белками в постоянном соотношении 1,4 г SDS на каждый грамм белка. Сепарация происходит из-за разницы молекулярного веса, учитывая то, что соотношение масса/заряд для каждого денатурированного белка с SDS остается постоянным.
Коэффициент седиментации – SDS test (Dick and Quick 1983), показывает полученный объем осаждения в определенных условиях из взвеси одного образца муки в растворе молочной кислоты и додецилсульфата натрия (SDS). Методика использует свойство резервных белков желатинировать в присутствии SDS; чем больше объем осаждения, тем выше реологическое качество муки или крупки. Количество использованного образца составляет один грамм (микроседиментация). Коэффициент четко ассоциирован с индексом глютена (IG) (J.Ross et al. Can J. Plant 2009 ). Этот тест был использован для оценки силы клейковины у родительских линий, F2, F2Bc1 и F2Bc2, где количество крупки было ограниченным.
Индекс глютена (IG, AACC Method 38-12) применялся для оценки российских линий, выращенных в 2016 г. на экспериментальном поле Самарского НИИСХ, характеризует силу внутримолекулярных и межмолекулярных связей, определяющих силу и прочность клейковины. Проведено сравнение этого показателя с уровнем SDS седиментации и электрофоретическими спектрами проламиновых экстрактов в SDS-Page, для уверенности отбора на начальных этапах селекции.
Size exlusion fast performance liquid chromatography (SE-FPLC) (Жидкостная хроматография с высокой степенью исключения) , из каждого образца крупки, было взято две вытяжки (SDS-извлекаемые белковые полимеры и SDS-неизвлекаемые белковые полимеры) в соответствии с Morel et.al.(2000) с поправками, описанными Tronsmo et.аl.(2002). Пропорция SDS-белковых полимеров в вытяжках из общего количества белковых полимеров (%UPP) рассчитывалось по формуле [F1*/(F1* + F1)] x 100, а процент белковых мономеров от белковых полимеров рассчитывался по формуле (F3+F4)/ (F1*+F1+F2), где F1*= большие неизвлекаемые полимеры, с F1 по F4=иные извлекаемые белковые полимеры.
Размножение in vitro. Размножение in vitro производилось, начиная с семени, проросшего на агаре, содержащем основную смесь Murashige and Skoog basal (medium), с добавлением гибереллиновой кислоты для облегчения развития стеблей, начинаяс клеток зачаточного колоса. Прорастание происходило при 18°C при 8 часов освещении в сутки. После прорастания температура доводилась до 12°C без изменения времени освещения. По мере того, как формировались стебли побегов кущения, они извлекались и помещались в другой сосуд с агаром того же состава и при тех же условиях роста.
Анализ генетической схожести м при помощи маркеров SSR (Single sequence Repeat). В матрицах генетической схожести (GSij) из возможных пар линий, включая два родителя скрещивания, оценивалось 100 уже отобранных маркеров SSR (Single Sequence Repeat), использованных в работе Natoli.V ( 2008 ). Идентификационный номер каждой аллели по отдельному маркеру был выражен числом от 1 до 4 (количество форм аллелей на использованные маркеры) для их анализа. Схожесть между парами линий рассчитывалась по коэффициенту схожести “Simple matching” :пропорция маркеров, представляющих одни и те же аллели.Указан-ный коэффициент рассчитывался по следующей формуле:GSij = m/n, где m = число вариантов аллелей отдельного маркера SSR, показывающих совместимость их состояния, то есть одинаковое число вариаций в i и j (в нашем случае соответствует номеру маркера, по которому наши ли-ниипоказывают ту же аллель), аn = общее число сравнимых маркеров. Коэффициент различия по каждому из локусов SSR был рассчитан по формуле GD=1-∑ p 2 j , где p -частота jй аллели внутри популяции (Powell et al . 1996). Расчет генетической схожести проведён с использованием программы SIMQUAL пакета NTSYS-pc ver. 2.0 (Rohlf, 1997). На основании, полученных таким образом матриц схожести был выполнен кластерный анализ и были построены соответствующие диаграммы по методу UPGMA (“Unweighed Pair-Group Method Arithmetic Average”) («Метод расчёта средней арифметической неравномерных парных групп») с использованием программы Jump8.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Предварительная агрономическая и качественная оценка российских и итальянских линий в условиях экспериментального поля Самарского НИИСХ. В 2016 г. изучались 48 генотипов в том числе 6 российских сортов, включённых в реестр селекционных достижений и 6 итальянских линий. Результаты изучения качества по IG, представленные в табл. 1., показывают низкие значения этого индекса у российских линий и сортов и подтверждают высокий уровень итальянских линий при выращивании в условиях Среднего Поволжья. Анализы диапазонов SDS-Page, касающиеся линий, испытанных в г. Самара в 2016 г., показывают, что ни одна российская линия не имеет того же профиля относительно сорта, референсного по качеству, а именно Кофа (рис. 2), что стало для нас подтверждением того, что диапазон Кофа (Glu.B1) может быть легко оценен для передачи в выбранные российские линии.
Таблица 1. Предварительная агрономическая и качественная оценка российских и итальянских линий в условиях экспериментального поля Самарского НИИСХ, Безенчук, 2016г.
|
Сорт |
Урожайность Безенчук, 2016 г. |
Белок ( % ) |
Индекс желтизы (коорд. b) |
Клейковина влажная (14%) |
Клейковина сухая t.q.( % ) |
Клейковина сухая s.s. ( % ) |
Индекс глютена (%) |
|
|
т/га |
% St Б 210 |
Метод Infrate c ± 1,00 % |
Метод Minolta ± 2,00 |
Метод UNI N. 10275 -01/1994 |
Метод UNI N. 10275 -01/1994 |
Метод UNI N. 10275 -01/1994 |
Метод UNI N. 10690 -09/19971115 |
|
|
Sp3/5 |
3,35 |
130,2 |
14,2 |
28,2 |
30,5 |
9,9 |
11,8 |
63,5 |
|
Sp3/7 |
2,99 |
116,2 |
14,3 |
27,1 |
26,8 |
8,6 |
10,2 |
64,3 |
|
Sp3/6 |
2,96 |
115,1 |
15,0 |
27,6 |
36,1 |
11,7 |
13,9 |
32,1 |
|
Sp3/3 |
2,73 |
106,2 |
14,6 |
30,8 |
31,0 |
10,4 |
12,3 |
29,9 |
|
Sp3/4 |
2,64 |
102,7 |
14,6 |
26,9 |
29,8 |
10,4 |
12,4 |
65,6 |
|
Sp3/9 |
2,61 |
101,7 |
13,6 |
26,5 |
27,1 |
9,0 |
10,8 |
18,8 |
|
Sp3/2 |
2,40 |
106,1 |
14,6 |
32,1 |
32,4 |
10,7 |
12,7 |
68,5 |
|
Sp3/8 |
2,09 |
81,3 |
14,0 |
25,3 |
28,4 |
9,5 |
11,3 |
68,4 |
|
Sp3/10 |
1,99 |
93,2 |
14,1 |
25,4 |
24,1 |
7,8 |
9,3 |
66,6 |
|
1961d-14 |
1,85 |
97,1 |
13,4 |
33,0 |
27,7 |
9,1 |
10,8 |
67,5 |
|
Sp3-1 |
1,82 |
80,3 |
14,5 |
31,8 |
31,7 |
10,5 |
12,5 |
67,5 |
|
1653d-8 |
1,72 |
101,4 |
14,1 |
28,5 |
30,4 |
9,9 |
11,8 |
52,5 |
|
1874d-2 |
1,72 |
117,3 |
13,6 |
27,1 |
28,2 |
9,0 |
10,7 |
68,3 |
|
1469d-59 |
1,64 |
112,2 |
15,1 |
30,0 |
31,7 |
10,5 |
12,5 |
63,5 |
|
1970d-1 |
1,64 |
112,0 |
13,9 |
28,2 |
30,7 |
10,3 |
12,2 |
61,4 |
|
Sp3-1 |
1,63 |
114,5 |
13,5 |
31,8 |
27,8 |
9,1 |
10,8 |
61,3 |
|
1927d-1 |
1,63 |
93,9 |
12,6 |
27,3 |
25,5 |
8,1 |
9,7 |
65,3 |
|
1970d-2 |
1,61 |
110,3 |
14,6 |
28,1 |
30,8 |
10,2 |
12,2 |
60,3 |
|
Б210 |
1,59 |
100,0 |
14,4 |
27,1 |
30,3 |
9,6 |
11,5 |
32,2 |
|
1874d-6 |
1,57 |
107,4 |
14,0 |
26,4 |
29,1 |
9,4 |
11,3 |
66,2 |
|
1874d-2 |
1,55 |
89,2 |
13,9 |
28,3 |
25,1 |
8,5 |
10,2 |
2,6 |
|
Золотая |
1,53 |
96,3 |
14,8 |
25,6 |
24,7 |
8,4 |
10,0 |
68,6 |
|
1322а-19 |
1,53 |
107,5 |
13,3 |
31,7 |
28,4 |
9,4 |
11,2 |
60,5 |
|
Триада |
15,2 |
90,0 |
14,8 |
21,5 |
16,6 |
6,0 |
7,1 |
68,6 |
|
2024d-3 |
1,50 |
102,6 |
13,8 |
29,3 |
30,3 |
9,8 |
11,7 |
57,3 |
|
1528d-67 |
1,48 |
101,0 |
13,9 |
25,4 |
25,9 |
8,5 |
10,1 |
61,5 |
|
1967d-21 |
1,46 |
83,7 |
14,1 |
28,3 |
29,1 |
9,5 |
11,4 |
59,5 |
|
1953d-3 |
1,46 |
99,7 |
13,6 |
23,3 |
25,0 |
8,2 |
9,8 |
64,1 |
|
БЗ |
1,45 |
101,4 |
15,2 |
31,1 |
34,6 |
11,5 |
13,8 |
62,7 |
|
1938d-5 |
1,44 |
82,8 |
14,3 |
22,2 |
27,7 |
9,3 |
11,1 |
67,5 |
|
марина |
1,33 |
93,1 |
14,4 |
24,5 |
28,4 |
9,3 |
11,1 |
51,5 |
|
Б209 |
1,33 |
83,4 |
14,5 |
23,5 |
16,4 |
5,6 |
6,7 |
67,5 |
|
Б209 |
1,31 |
91,6 |
14,6 |
23,1 |
8,8 |
1,0 |
1,2 |
68,5 |
|
Италия |
0,63 |
39,4 |
20,0 |
24,2 |
50,0 |
16,4 |
19,4 |
87,9 |
|
Италия |
0,55 |
34,3 |
20,7 |
22,1 |
48,0 |
15,9 |
18,9 |
88,5 |
|
Италия |
0,49 |
30,7 |
20,0 |
24,3 |
51,1 |
16,4 |
19,5 |
88,5 |
|
Италия |
0,48 |
30,4 |
20,0 |
23,6 |
45,2 |
14,8 |
17,6 |
89,6 |
|
Италия |
0,31 |
19,7 |
19,9 |
19,6 |
42,9 |
13,9 |
16,5 |
84,6 |
|
Италия |
0,29 |
18,6 |
19,8 |
19,6 |
39,4 |
12,8 |
15,2 |
90,5 |
|
СРЕДНЕЕ |
1,60 |
90,9 |
14,9 |
26,3 |
30,3 |
9,9 |
11,8 |
61,7 |
|
HCP0,05 |
0,21 |
|||||||
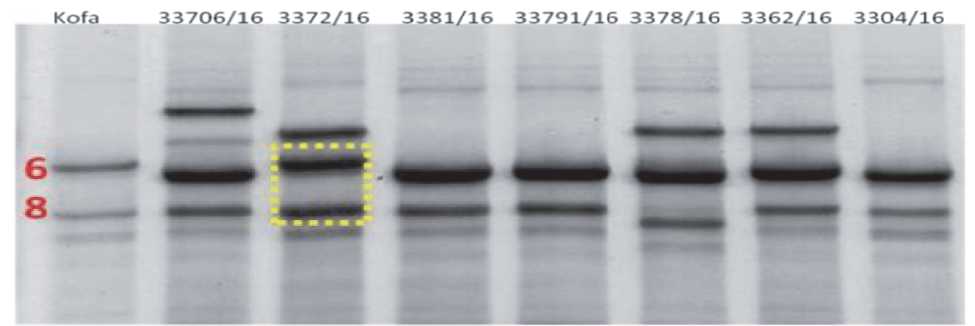
Рис. 2. Пример SDS-Page (диапазоны, обнаруженные на российских линиях), испытания в г. Безенчук, 2016 г.
Таблица 2. Агрономическая и качественная оценка российских и итальянских линий в условиях экспериментального поля Самарского НИИСХ, Безенчук, 2017 г.
|
Сорт |
Происхождение |
Урожай, т/га |
Критерий Дунка на |
Дата колошения, июль |
Устойчивость /Восприимчивость к патогенам |
|||
|
Perynophora triticirepentis, R…S,% |
Blumeria graminis |
Puccinia graminis |
||||||
|
Трубкование |
Цветение |
тип/% |
тип/% |
|||||
|
Без.209 |
стандарт низкорослый (генRht1B1b) |
3,13 |
ab |
05 |
R |
MR (10) |
4/5. |
4/5. |
|
Без.210 |
основной стандарт среднерослый (RhtAnh) |
4,96 |
jk |
03-04 |
R/MR |
R/MR |
4/5. |
4/5. |
|
Без.золот истая |
скороспелый стандарт среднерослый (RhtAnh) |
4,45 |
f-j |
01 |
R |
R |
4/10. |
4/7,5. |
|
Золотая |
Позднеспелый стандарт |
4,36 |
g-k |
08 |
R |
R |
R |
4/3. |
|
GSD-399 |
Италия |
4,28 |
e-j |
04 |
R |
R(5) |
R |
4/5. |
|
GSD-30 |
Италия |
4,37 |
g-j |
04 |
R |
R |
R |
4/5. |
|
CANNAVA RO |
Италия |
3,77 |
b-f |
06 |
R |
R |
4/5. |
4/15. |
|
PIETRAFIT IA |
Италия |
2,68 |
a |
04 |
S(40) |
S(50) |
R |
4/3. |
|
QULRATO |
Италия |
3,22 |
a-c |
03 |
S(30) |
S(40) |
R |
4/3. |
|
TORREBIA NA |
Италия |
3,30 |
a-c |
04 |
MR/MS(2 0) |
MR/MS(2 0) |
R |
4/10. |
|
1591D-21 (Триада) |
Без. 209/ 646D-37 (Rht1B1b) |
4,37 |
g-j |
05 |
R |
R |
R |
4/5. |
|
1916D-14 |
Марина/Без золотист |
4,82 |
h-k |
04 |
R |
R |
4/10. |
4/5. |
|
1970D-2 |
495D-7/ Без.золотистая |
3,87 |
c-f |
05 |
R |
R(5) |
4/25. |
4/5. |
|
SP-3/2 |
Безенчук. Нива / 653d-58 |
5,17 |
k |
03 |
R |
R |
4/10. |
4/5. |
|
1469D-59 (Taganrog) |
495D6/Марина |
4,89 |
i-k |
04 |
R |
R |
R |
4/5. |
|
1874D-2 |
Безен.207/Безен. нива |
3,85 |
c-f |
03 |
R |
R |
4/5. |
4/5. |
|
SP-3/8 |
1694D-4/653D-58 |
4,09 |
d-g |
06 |
R |
R |
4/5. |
4/5. |
|
m=5,32% |
||||||||
|
HCP0,05 |
0,61 |
|||||||
Таблица 3. Идентифицированные в сортах и линиях безенчукской селекции аллели локусов Glu A-3 и Glu B-1, Безенчук, 2016 г.
|
Сорт |
Происхождение |
Аллели локусов |
|
|
GluA-3 |
GluB-1 |
||
|
1528D-67 |
Памяти Чеховича / Безенчукская нива |
N |
6+8 |
|
SP-3/4 |
653D-58/B207 |
N |
7+8 |
|
1469D-59 |
495D-6/Maрина |
N |
7+8 |
|
1916D-2 |
Mарина/653D-44 |
N |
7+8 |
|
SP-3/8 |
1694D-4/653D-58 |
N |
7+8 |
|
1591D-21 |
Б209/646D-37 |
N |
7+8 |
|
Золотая |
Б205/837D-22 |
N |
7+8 |
|
Без. 209 |
Г942/Г1434 |
N |
7+8 |
|
1970D-1 |
495D-7/653D-44 |
1 |
7+8 |
|
1970D-2 |
495D-7/653D-44 |
1 |
7+8 |
|
SP-3/10 |
B209/1464D-4 |
1 |
7+8 |
|
1874D-2 |
B207/BN |
2* |
6+8 |
|
1429D-10 |
ICARO/B202 |
2* |
7+8 |
|
1322A-19 |
PD44/SZ//D2005/3/451D-5 |
2* |
7+8 |
|
1967D-1 |
495D-22/1464D-4 |
2* |
7+8 |
|
1938D-5 |
Донская элегия/653D-58 |
2* |
7+8 |
|
SP-3/5 |
653D-58/B207 |
2* |
7+8 |
|
SP-3/7 |
653D-58/B207 |
2* |
7+8 |
|
1927D-1 |
653D-58/B207 |
2* |
7+8 |
|
SP-3/1 |
BN/653D-58 |
2* |
7+8 |
|
SP-3/2 |
BN/653D-58 |
2* |
7+8 |
|
1916D-14 |
Marina/BZ |
2* |
7+8 |
|
Кофа |
Стандарт (донор качества) |
N |
6+8 |
Таблица 4 . A) Расстояние популяции F2; B) Расстояние популяции F2BС2
|
A |
В |
||||||
|
номер кластера |
расстояние |
основная линия |
ассоциированная линия |
номер кластера |
расстояние |
основная линия |
ассоциированная линия |
|
11 |
2,951495 |
4 |
8 |
11 |
0,84699 |
6 |
8 |
|
10 |
3,30205 |
4 |
10 |
10 |
0,84699 |
4 |
10 |
|
9 |
3,426896 |
2 |
3 |
9 |
1,436141 |
7 |
1469D-59 (код3371) |
|
8 |
3,564303 |
2 |
6 |
8 |
1,597099 |
2 |
5 |
|
7 |
3,573413 |
1 |
1469D-59 (код 3371) |
7 |
1,613414 |
3 |
9 |
|
6 |
4,034812 |
4 |
7 |
6 |
1,815022 |
2 |
3 |
|
5 |
4,43412 |
2 |
4 |
5 |
2,357919 |
4 |
6 |
|
4 |
4,550319 |
1 |
5 |
4 |
2,757134 |
1 |
7 |
|
3 |
4,906437 |
1 |
9 |
3 |
3,2999606 |
2 |
4 |
|
2 |
5,93352 |
1 |
2 |
2 |
4,391424 |
1 |
2 |
|
1 |
6,873258 |
1 |
Кофа |
1 |
12,85216 |
1 |
Кофа |
Таблица 5. SE-FPLC (Size exlusion fast performance liquid chromatography
|
Образец |
Fl* |
Fl |
F2 |
F3 |
F4 |
Tot ale |
% F1* |
F1 % |
% F2 |
% F3 |
% F4 |
F1*+ F1 |
F3+ F4 |
F1*+ F1 +F2 |
Mon/ pol |
UPP % |
|
Кофа |
40,3 |
103,0 |
42,3 |
109,6 |
147,6 |
442,7 |
9,1 |
23,3 |
9,6 |
24,8 |
33,3 |
143,2 |
257,2 |
185,5 |
1,4 |
28,1 |
|
07 (geno tip) 3371 |
22,1 |
40,2 |
33,9 |
60,2 |
117,8 |
274,1 |
8,1 |
14,7 |
12,4 |
22,0 |
43,0 |
62,2 |
178,0 |
96,1 |
1,9 |
35,5 |
|
01 (geno tip) 3369 |
36,0 |
40,7 |
51,1 |
87,7 |
177,2 |
392,6 |
9,2 |
10,4 |
13,0 |
22,3 |
45,1 |
76,7 |
264,9 |
127,8 |
2,1 |
47,0 |
GENETIC METHODS OF IMPROVING WHEAT QUALITY OF DURU CALTIVARS ADAPTED TO CLIMATE CONDITIONS OF RUSSIA WITH SPECIAL ACCENT
ON COMMERCIAL CHARACTERISTICS OF GRAIN
-
1 Samara Research Scientific Institute of Agriculture, Bezenchuk, Samara Region, Russia
-
2 Limited Liability Company “Agroliga Center for Plant Breeding”, participator of the Skolkovo Foundation, Moscow, Russia
-
3CREA - CI, Italy
Sergey Shevchenko, Corresponding Member of RAS, Doctor of Agricultural Science, Director of Scientist of Samara Research Scientific Institute of Agriculture.
Marcella Giuliani, Doctor of Biological Sciences, Professor.
В то же время по урожайности все российские линии и сорта значительно превосходили итальянские сорта.
К лучшим линиям, подтвердившим высокий уровень адаптивности в 2017 году (табл. 2), с неплохим уровнем качества и хорошим выходом зерна отнесены: 1591Д-21 – Триада, SP3/2, 1469Д-59 (табл. 3).
Эти линии были включены в качестве материнских компонентов в гибридизацию с сортом Kofa для получения рекомбинантов, несущих блок QTL на хромосоме 1А и электрофоретические компоненты глютенинового блока GluB-1 от сорта Kofa и коадаптированный блок генов приспособленности к условиям Среднего Поволжья от линий местной селекции.
Анализ генетической схожести по маркерам SSR (Single Sequence Repeat). Анализ схожести растений в популяциях F2, полученных от скрещивания с тремя отобранными российскими линиями, показал, что уже в F2 возможно выделить линии с нужным блоком QTL от сорта Коfа и необходимой аллелью электрофоретического спектра блока компонентов глютенина Glu-B1,
также соответствующим сорту Кофа, которые по другим маркерам генетически наиболее схожие с российской линией, использованной в качестве материнского родителя (таб.4 A ; В; Рис.3. A; В).
Эта технология подтвердила целесообразность её применения для достижения цели – получения рекомбинантов генов качества и адаптивности. После второго повторного скрещивания и выделения линии (07) генетически очень схожей с российской линией, анализ генетической схожести показал, что цель была достигнута (Рис.3 B). Оценка фенотипа подтверждает эту схожесть, действительно, выбранная линия неотличима от российской линии 3371 (1469D-59), использованной для сопоставления. Это же было сделано в отношении скрещивания с российской линией 3379 (SP-3/2) (данные не приводятся). Анализ качества по SDS седимен-тациии SE-FPLC (Size exlusion fast performance liquid chromatography -Экспресс-хроматография с высокой степенью исключения) . Две линии F2BC2, идентифицированные в процессе селекционной работы с двумя популяциями, полученными от скрещивания сорта Кофа с ли-
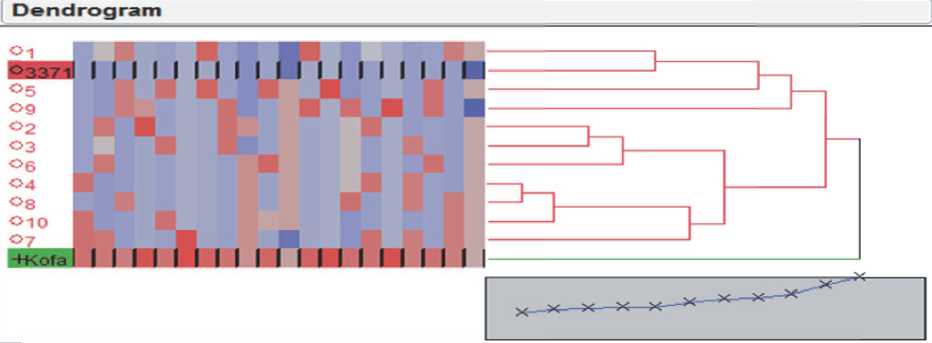
A
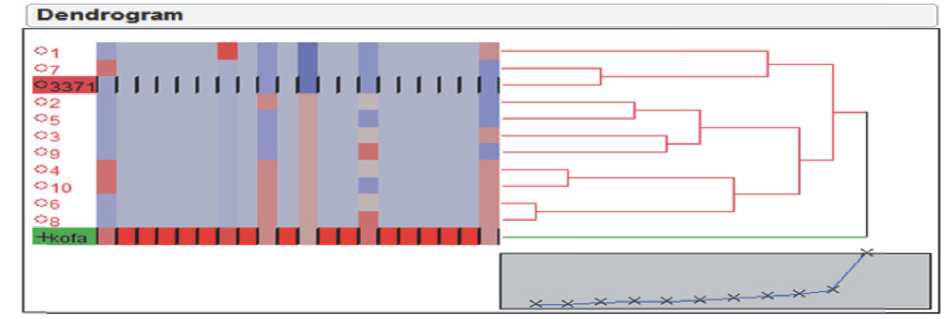
B
Рис. 3. А – Дендрограмма популяции F2; ; В – Дендрограмма популяции F2BС2
ниями 3371 и 3379, и имеющие блок Qtl Кофа по хромосоме 1А, по IG, компонентам глютенина в локусе Glu-B1 также от Коfа, были изучены через SE-FPLC (Size exlusion fast performance
liquid chromatography) и SDS седиментации. Полученные значения показали очень хороший уровень качества клейковины, даже выше, чем у сорта Кофа (табл.5).
Список литературы Генетические методы улучшения качества пшеницы твердых сортов, адаптированных к климатическим условиям России с особым акцентом на коммерческие характеристики зерна
- Bubcvsky et al. QTL analysis of pasta quality using a composite microsatellite and SNP map of durum wheatTheor Appl Genet (2008) 117:1361-1377
- Dick and Quick. A Modified Screening Test for Rapid Estimation of Gluten Strength in Early-Generation Durum Wheat Breeding Lines.Cereal Chem 1983. 60: 315 - 318.
- Gianibelli et al. Relationships between biochemical parameters and quality characteristics of durum wheats. 1995: Pages 146-152 in: Wheat Structure, Biochemistry and Functionality. J. P. Schofield, ed. RACI: Melbourne.
- Kremer et al. Measures of polymorphism within and among populations. In: Molecular tools for screening biodiversity. Plants and animals. 1998.Karp A., Isaac P., and Ingram D. S. (Eds.) Chapman & Hall London. Pp. 302-311.
- Natoli V. Ph.D Tesis. 2008: Isolation in the wheat of durum varieties of genes involved in the mechanisms of adaptation of water stress in the Mediterranean environment


