Генетические предикторы ремоделирования миокарда и работоспособность сердца при гипертонии
Автор: Кривощеков Сергей Георгиевич, Суворова Ирина Юрьевна, Баранов Виктор Ильич, Шевченко Игорь Владиленович
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Цель работы - проанализировать клинико-физиологические и генетические аспекты ремоделирования миокарда левого желудочка при гипертонической болезни (ГБ) с учётом среднесуточных нагрузок на мышцы миокарда и выяснить связь полиморфизма генов-кандидатов (АСЕ, AGT, NOS3, ADRA2B) с различными типами ремоделирования миокарда. Материалы и методы. Обследованы 255 больных ГБ I-II стадии с наличием и отсутствием ГЛЖ: женщин - 158 (64±10 лет), мужчин - 97 (60±10 лет). Диагноз ГБ стоял не менее 6 мес. Регулярной терапии не проводилось. Протокол включал сбор анамнеза, измерение роста, веса, артериального давления (АД) и пульса (ЧСС), суточный мониторинг АД (СМАД) и ЭКГ, проведение биохимического анализа крови, эхокардиографическое исследование сердца (ЭхоКГ), генетический анализ. Рассмотрена связь полиморфизма генов-кандидатов (АСЕ, AGT, NOS3, ADRA2B) с конкретным типом ремоделирования миокарда. Результаты. У пациентов с ГЛЖ, по сравнению с пациентами без гипертрофии, выявлено достоверное снижение эффективности работы миокарда (как общей работоспособности, так и удельной силы миокарда), нарастающее по степени выраженности: от эксцентрической к концентрической гипертрофии и концентрическому ремоделированию. При ГЛЖ снижалась способность поддерживать среднесуточную напряженность в стенке магистральных артерий. По частоте встречаемости генотипов II и ID гена ACE гипертоники с ремоделированным миокардом достоверно отличались от группы контроля, представленной популяционной выборкой жителей г. Новосибирска. К концентрическому ремоделированию миокарда больше были предрасположены гипертоники с аллелями генов ACE II и ADRA2B II. Заключение. Разные типы структурных изменений миокарда, которые наблюдаются у части больных эссенциальной АГ, обусловлены генетической предрасположенностью к специфическому ремоделированию мышцы сердца в ответ на повышенную гемодинамическую нагрузку.
Гипертоническая болезнь, гипертрофия миокарда левого желудочка, ремоделирование миокарда, среднесуточная работа миокарда, эхокардиография, полиморфизм генов асе, асе gene
Короткий адрес: https://sciup.org/14113289
IDR: 14113289 | УДК: 616.127; | DOI: 10.23648/UMBJ.2017.27.7085
Текст научной статьи Генетические предикторы ремоделирования миокарда и работоспособность сердца при гипертонии
Введение. В ряде случаев развитие артериальной гипертонии (АГ) сопровождается структурными изменениями сердца – ремоделированием, прежде всего гипертрофией миокарда левого желудочка (ГЛЖ). Установлено, что при ГЛЖ наблюдаются изменения процессов реполяризации миокарда желудочков и увеличение длительности интервалов внутрисердечной проводимости, а ремоделирование сердца нередко предшествует клиническим проявлениям сердечной недостаточности, развитию гипертензии и сопряжено с увеличением риска внезапной смерти
[1-4]. По архитектонике ЛЖ на основе эхокардиографического метода и с привлечением таких показателей, как индекс массы миокарда левого желудочка (ИММЛЖ) и относительная толщина стенки ЛЖ (ОТС), выделяются: концентрическая гипертрофия (увеличение ММ и ОТС), эксцентрическая гипертрофия (увеличение ММ при нормальной ОТС), концентрическое ремоделирование (нормальная ММ и увеличенная ОТС), нормальная геометрия ЛЖ [5]. Являясь самостоятельным фактором риска развития сердечно-сосудистых осложнений, гипертрофия левого желудочка значительно ухудшает прогноз у больных АГ (увеличивается риск развития инфаркта миокарда и внезапной смерти, возникновения аритмии и сердечной недостаточности). Однако ГЛЖ выявляется только у половины больных АГ [6], т.е. есть несоответствие между степенью и продолжительностью гипертонического состояния и выраженностью гипертрофии сердца. Установлено, что изменение формы левого желудочка происходит за счет гипертрофии кардиомиоцитов, а также гипертрофии и гиперплазии интерстициальных клеток и эндотелия [7], что постепенно приводит к увеличению массы и объема нормальных структур сердца. Результаты многочисленных исследований, проведенных в различных странах и популяциях, свидетельствуют о существенном вкладе наследственности в патогенез артериальной гипертонии [8, 9]. Вместе с тем АГ - многофакторное заболевание. Существует немало сведений об общности этиологических и патогенетических факторов АГ, ожирения, нарушений углеводного и липидного обмена, что позволило объединить эти состояния в единое понятие метаболического сердечно-сосудистого синдрома [10].
Немаловажную роль в клинической практике для оценки методов применяемой терапии АГ имеет состояние сосудов. При длительной антигипертензивной терапии через 3 мес. происходит уменьшение жесткости сосудистой стенки (по скорости распространений пульсовой волны), а через 12 мес. -снижение ИММЛЖ [11]. Также показано, что не только уровень АД, но и масса тела, а также активация различных гормонов имеют значение в развитии ГЛЖ. Полагают, что эти факторы оказывают синергический эффект в отношении активации процессов ремоделирования миокарда. Наконец, среди факторов, стимулирующих рост кардиомиоцитов и миокардиальных фибробластов, большое значение имеют симпатическая нервная система, ренин-ангиотензиновая система, а также инсулин и инсулиноподобные факторы роста [10, 12]. Считается, что суточный профиль АД, который широко используется в клинике для ранней диагностики АГ, позволяет выявить дисбаланс активности отделов вегетативной нервной системы, повышение активности симпатического и снижение активности парасимпатического отделов, а также повышение уровня катехоламинов в крови, оказывающих повреждающее действие на различные органы-мишени при АГ [13].
Известно, что процент лиц, у которых не снижается ночное давление, среди гипертонических больных значительно выше, чем среди здоровых людей, что связывают с нарушением баланса активности симпатического и парасимпатического отделов вегетативной нервной системы [11]. Однако связь суточной ритмики АД с гипертрофией миокарда изучена мало.
Интересно, что изменение морфологических структур сердца может развиваться у здоровых людей (спортсменов), демонстрируя при этом особенности, связанные с типами гемодинамики [14, 15]. Высказывается мнение, что при АГ ремоделирование миокарда (избыточная гипертрофия) является, с одной стороны, компенсаторной реакцией, дающей сердцу возможность работать в условиях повышенного артериального давления, а с другой - одним из этапов прогрессирования патологических изменений миокарда [16]. При этом развитие чрезмерной гипертрофии миокарда может не только не улучшать, но и препятствовать росту физической работоспособности спортсмена, а в дальнейшем - становиться причиной возникновения аритмий [17].
Вместе с тем установлено, что развитие разных типов ремоделирования связано не только с повышенной гемодинамической нагрузкой, но и с влиянием на сердце много- численных нейрогуморальных факторов, степень активности которых генетически детерминирована. В связи с этим активно ведутся поиски генов-кандидатов, влияющих на процессы ремоделирования миокарда, и изучение связи этих генов с конкретным типом ремоделирования [18–20]. Наибольшее внимание привлекают гены, кодирующие компоненты ренин-ангиотензиновой системы (ACE, AGT, AGTR1), гены ключевых симпатических рецепторов (ADRB2, ADRB3), а также гены, дефекты которых могут приводить к дисфункции эндотелия (NOS3, MTHFR, APOE). Через артериальное давление, сосудистое сопротивление, частоту сердечных сокращений, ударный объём эти гены почти прямо связаны с суточной нагрузкой на сердце.
Возникает предположение, что анализ генетических маркеров, ассоциированных с гипертонической болезнью и ремоделированием миокарда, вкупе с оценкой эффективности работы сердца позволит понять, почему не все индивиды с АГ предрасположены к патологическому ремоделированию миокарда, а также выявить клинико-генетические маркеры риска АГ и ремоделирования миокарда для своевременного начала профилактики сердечно-сосудистых осложнений.
Цель исследования. Проанализировать клинико-физиологические и генетические аспекты ремоделирования миокарда левого желудочка при гипертонической болезни с учётом среднесуточных нагрузок на мышцы миокарда и выяснить связь полиморфизма генов-кандидатов ( АСЕ, AGT, NOS3, ADRA2B ) с различными типами ремоделирования миокарда.
Задачи исследования:
-
1. Выяснить среднесуточную нагрузку и эффективность работы миокарда у пациентов-гипертоников с различными формами ГЛЖ по сравнению с пациентами-гипертониками без ГЛЖ.
-
2. Оценить у пациентов, страдающих гипертонической болезнью, ассоциацию полиморфизма генов, отвечающих за работоспособность сердца ( АСЕ, AGT, NOS3, ADRA2B ), с формированием различных типов ремоделирования миокарда левого желудочка.
Материалы и методы. На базе клиники НИИ физиологии и фундаментальной меди- цины обследовано 255 больных гипертонической болезнью (ГБ) I–III стадий в возрасте от 34 до 87 лет (средний возраст – 63±10 лет), из них женщин – 158 (средний возраст – 64±10 лет), мужчин – 97 (средний возраст – 60±10 лет). Диагноз ГБ стоял не менее 6 мес. Больные не получали регулярной антигипертензивной терапии. Средний возраст больных в группе с ГЛЖ – 66,3±12,0 года, в группе без гипертрофии – 59,8±11,0 года.
Из исследования исключались лица с симптоматическими гипертензиями, приобретенными и врожденными пороками сердца. Также не включали больных с острыми и обострениями хронических заболеваний, больных со вторичной АГ и другими заболеваниями сердечно-сосудистой системы, которые могут сопровождаться изменениями геометрии миокарда (ИБС, сердечная недостаточность, клапанные поражения, кардиомиопатии). Протокол обследования был одобрен этическим комитетом при ИФФМ.
Общие данные включали: 1) сбор анамнеза, в т.ч. длительность заболевания, фактор курения и частоты приема алкоголя; 2) антропометрию (рост, вес, индекс массы тела (индекс Кетле)); 3) общеклиническое и биохимическое исследование крови (уровень общего холестерина (ОХС), триглицеридов (ТГ), мочевой кислоты); 4) СМАД; 5) эхокардиографическое исследование с последующим расчетом стандартных индексов, в т.ч. индекса массы миокарда левого желудочка.
Эхокардиография. Все пациенты были обследованы в одной и той же лаборатории клиники НИИ физиологии и фундаментальной медицины. Больных с признаками локальных нарушений сократимости, снижением фракции выброса (ФВ) менее 50 % (по Simpson) в исследование не включали. Эхокардиографию проводили на аппарате GE Voluson E-8 в М-модальном и двумерном режимах в стандартных эхокардиографических позициях по общепринятой методике.
Массу миокарда ЛЖ рассчитывали по формуле R. Devereux и N. Reichek:
МЛЖ=1,04((ТМЖП+ТЗСЛЖ+КДРЛЖ)3-
-
- (КДРЛЖ)3)-13,6,
где МЛЖ – масса левого желудочка, г; 1,04 – плотность сердечной мышцы, г/см3; ТМЖП – толщина межжелудочковой перегородки, см; ТЗСЛЖ – толщина задней стенки левого желудочка, см; КДРЛЖ – конечный диастолический размер левого желудочка, см.
Площадь поверхности тела (ППТ, м2) рассчитывали по формуле Мостеллера:
ППТ=(Вес (кг)∙Рост (см)/3600)0,5.
ИММЛЖ рассчитывали по формуле ИММЛЖ=ММЛЖ/ППТ.
Типы ремоделирования определяли в соответствии с классификацией A. Ganau по соотношению ИММЛЖ и ОТСЛЖ [5]. Согласно последним европейским рекомендациям [11], за гипертрофию принимали ИММЛЖ для мужчин более 115 г/м2 и для женщин более 95 г/м2. ОТСЛЖ рассчитывали для каждого пациента как (ТЗСЛЖ+ТМЖП)/КДРЛЖ. За повышение относительной толщины стенок принимали значения параметра более 0,42 ед. [11].
Пациенты с ГБ были разделены на 4 группы: с нормальной геометрией ЛЖ (НГ), концентрическим ремоделированием (КР) (нормальный ИММЛЖ и увеличенная ОТС), концентрической (КГ) (увеличение ИММЛЖ и увеличенная ОТС) и эксцентрической гипертрофией (ЭГ) (увеличение ИММЛЖ при нормальной ОТС) миокарда.
Суточный мониторинг АД . Суточное мониторирование АД проводили на аппарате Astrocard Holtersystem 2F (ЗАО «Медитек», Россия). Для оценки колебаний АД в суточном цикле (день-ночь) рассчитывали степень ночного снижения АД, характеризуемую как разность средних величин АД в дневной и ночной период времени, в процентах по отношению к среднедневному уровню. Выраженность перепада оценивали по показателю суточного индекса (СИ, %), на основе которого определяли типы суточных профилей АД: dipper (СИ 10–22 %), non-dipper (СИ<10 %), over-dipper (СИ>22 %), nightpeaker (СИ<0 %).
Расчет суточной работы сердца . Работу миокарда левого желудочка по обеспечению кровотока по большому кругу кровообращения за сутки принимали за суточную работу миокарда (СРМ, кДж), которую рассчитывали по формуле
СРМ=УО∙срЧСС∙срАД∙сутки∙1,92∙10-4, где УО – ударный объём сердца, мл; срЧСС – среднесуточная частота сердечных сокращений, уд./мин; срАД – среднесуточное артериальное давление, мм рт. ст.; 1,92∙10-4 – размерный коэффициент, кДж/(мл∙(уд./мин)∙(мм рт. ст.)∙сут).
Среднесуточную напряжённость , создаваемую гладкомышечной мускулатурой в стенке общих сонных артерий (СНОСА), т.е. силу, создаваемую единицей площади сечения артериальной стенки, препятствующую растяжению сосуда артериальным давлением, определяли по формуле
СНСА=(срАД∙(dОСАпр)/(ИМОСАпр+ +срАД∙(dОСАлев)/ИМОСАлев)/4, где срАД – среднесуточное артериальное давление, ммHg; dОСАпр, dОСАлев – диаметр правой и левой общих сонных артерий, мм; ИМОСАпр, ИМОСАлев – размер интимы-медиа правой и левой общих сонных артерий, мм.
Тестирование на инсерционно-делецион-ный (I/D) полиморфизм генов АСЕ, AGT, NOS3 и полиморфизм 4а/4в гена ADRA2B проводили методом полимеразной цепной реакции с фланкирующими праймерами (по методикам Salimi и Snapir) [21, 22] у пациентов вышеописанной выборки (84 чел.: 47 женщин (возраст 64±10 лет) и 37 мужчин (возраст 60±10 лет)). Группы контроля представлены популяционными выборками жителей г. Новосибирска из 504 чел. для гена ADRA2B , 927 чел. для гена АСЕ , 604 чел. для гена AGT и 220 чел. для гена NOS3 , обследованных в рамках международных проектов ВОЗ MONICA (Мониторинг заболеваемости и смертности от сердечно-сосудистых заболеваний) и HAPIEE (Health, Alcohol and Psychosocial factors In Eastern Europe). Группы были сопоставимы по полу и возрасту.
Статистическую обработку данных проводили с помощью стандартного пакета программы STATISTICA (версия 10.0). Проверку на нормальность распределения изучаемых количественных показателей осуществляли по тесту Колмогорова–Смирнова. Статистическую значимость различий средних величин оценивали с помощью теста Манна– Уитни. Достоверность отличий частоты встречаемости определяли по методу хи-квадрата Пирсона (df=1) и по точному критерию Фишера. Статистически значимыми счи- тали различия при p<0,05 (*, **, *** обозначены соответственно p<0,05, p<0,01, p<0,001).
Результаты и обсуждение. Ремоделирование миокарда и суточная гемодинамика. По результатам эхокардиографии все пациенты были разделены на 2 группы: в 1-ю группу вошли больные ГБ в сочетании с ремоделированием миокарда (179 чел.), во 2-ю группу – пациенты без ремоделирования (нормальная геометрия сердца) (59 чел.). У пациентов 1-й группы встречались все типы ремоделирования ЛЖ: эксцентрическая гипертрофия – 108 чел., концентрическая гипертрофия – 60 чел., концентрическое ремоделирование – 11 чел.
При сравнении средних и максимальных значений показателей САД и ДАД в ночное время установлены их более высокие значения в 1-й группе по сравнению со 2-й (p<0,05), однако в каждой группе встречались все типы суточных кривых АД. Тип over-dipper в 1-й группе составил 23 %, во 2-й – 21 %, nondipper – 40 и 39 %, night-peaker – 12 и 14 %, dipper – 25 и 26 % соответственно. Таким образом, ночная гипертония у пациентов обеих групп выражена приблизительно одинаково. На основании полученных данных можно заключить, что ремоделирование миокарда при эссенциальной гипертонии не является фактором, усиливающим нарушения суточной динамики АД.
При оценке гендерных особенностей внутри каждой группы выявлено, что такие показатели, как рост, площадь тела, ММЛЖ, среднее ДАД ночью и среднее ДАД днем, уровень мочевой кислоты в крови, достоверно выше у мужчин, чем у женщин. Тем не менее при анализе данных не получено доказательств влияния фактора «пол» на развитие различных типов гипертрофии миокарда.
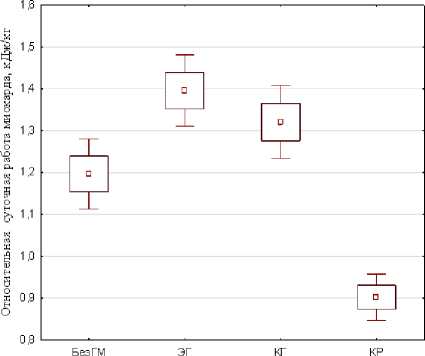
Суточная работа сердца у пациентов с гипертонией при разных видах ремоделирования ЛЖ. Любопытные результаты были получены при расчёте относительной работы миокарда. Напомним, что масса сердца и, соответственно, работа миокарда пропорциональны массе тела человека, поэтому для оценки сердечной нагрузки у больных мы применили нормирование СРМ на вес тела (СОРМ – суточная относительная работа миокарда, кДж/кг). На рис. 1 видно, что у больных с ЭГ и КГ СОРМ выше, чем у больных без гипертрофии на 16 и 11 %. Особняком стоит малочисленная (11 чел.) группа больных с КР, в которой СОРМ снижено на 30 %. Можно предположить, что это связано с малоподвижным образом жизни пациентов с данным видом гипертрофии. Если исходить из того, что СОРМ отражает предъявляемый сердцу среднесуточный запрос тканей организма на кровообращение, то высокие значения энергозатрат на кровоснабжение единицы массы тела свидетельствуют о высоком гидравлическом сопротивлении микроцирку-ляторной части кровеносной системы.
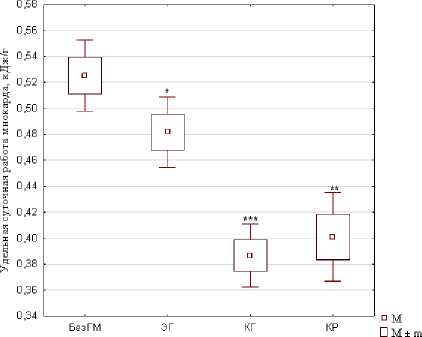
Для сопоставления работоспособности сердечной мышцы у лиц с различными видами гипертрофии была рассчитана среднесуточная удельная работа миокарда: УРМ=СРМ/ММЛЖ. В группах с ремодели-рованным миокардом среднесуточная работа, выполняемая единицей массы сердечной мышцы, оказалась достоверно ниже: ЭГ на 10 %; КГ на 35 %; КР на 32 % (рис. 1).
Возникает предположение, что в данном случае создаётся конфликтная физиологическая ситуация: «запрос» от сосудистой системы к производимой сердцем суточной работе у лиц с гипертрофией миокарда больше, а возможность выполнять работу единицей массы миокарда меньше. Мы предполагаем, что это поддерживает миокард, как и всякую перегруженную работой мышцу, в состоянии перманентной гипертрофии.
Среднесуточная напряженность в мышце миокарда и стенке магистральных артерий у больных ГБ с ремоделированием и без ремоделирования миокарда. Как известно, напряжение – сила, развиваемая единицей площади сечения мышцы: (сила мышцы) /(площадь сечения мышцы). Напряжение, развиваемое в задней стенке левого желудочка у больных с эксцентрической (наиболее благоприятной) гипертрофией, практически не отличается от напряжения, развиваемого в группе больных без гипертрофии (рис. 2). В группах с концентрической гипертрофией и концентрическим ремоделированием напряжение ниже на 15 % (p<0,01). Это подтверждает наше предположение об уменьше- нии силы сократимости кардиомиоцитов у гипертоников, подверженных необратимому ремоделированию сердечной мышцы. Аналогичная картина наблюдается по группам ремоделирования при оценке среднесуточной напряжённости, создаваемой гладкомышечной мускулатурой в стенке общих сонных артерий. Напряжение в стенке меньше: ЭГ на 12 %, КГ на 14 %, КР на 10 % (табл. 1).
Вид плдлрофии мио карда
1М± 1,96*ш
Вид гипертрофии миокарда
Рис. 1. Относительная и удельная суточная работа миокарда у больных гипертонией с различными типами ремоделирования миокарда
Относительная суточная работа миокарда – работа, выполняемая миокардом за сутки на единицу веса тела, кДж/кг. Удельная суточная работа миокарда – работа, выполняемая единицей массы миокарда за сутки, кДж/г. M – среднее значение, m – ошибка среднего. БезГМ – без гипертрофии миокарда, ЭГ – эксцентрическая гипертрофия миокарда, КГ – концентрическая гипертрофия миокарда, КР – концентрическое ремоделирование миокарда
Полученные данные позволяют предположить, что у больных с гипертрофией миокарда не только кардиомиоциты, но и гладкие мышцы магистральных артерий не могут развивать достаточного напряжения. Вследствие этого стенки артерий при «нормальной» толщине мышечного слоя не могут развивать нужную сжимающую силу. Поэтому для обеспечения адекватного сосудистого тонуса толщина гладкомышечной стенки артерий увеличивается, артерия «гипертрофируется». Этот неблагоприятный процесс усугубляется повышенным среднесуточным АД.
Видимо, у части больных с гипертрофированным миокардом имеются сочетанные изменения в сократительном аппарате мышц сердца и артерий. Эти дефекты скорее всего являются генетически обусловленными.
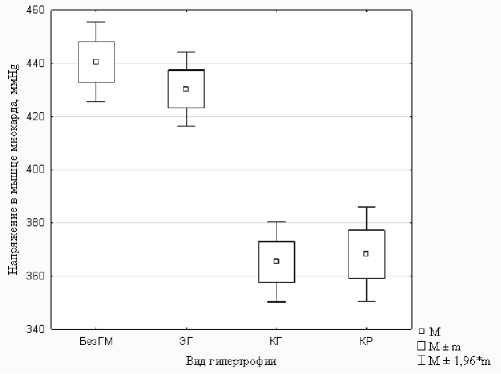
Рис. 2. Среднесуточное напряжение задней стенки левого желудочка миокарда. Напряжение мышцы миокарда = (срАД∙(КСР+КДР)/ЗСЛЖ)/2
Таблица 1
Характеристика стенок магистральных артерий при гипертонии у больных с ремоделированным и неремоделированным миокардом, M±m (n)
|
Измеряемая величина |
Артерия |
Без гипертрофии миокарда |
Эксцентрическая гипертрофия |
Концентрическая гипертрофия |
Концентрическое ремоделирование |
|
Среднесуточное напряжение в стенке, мм рт. ст. |
СрНапр |
302,0±9,0 (33) |
265,0±6,5 (62)** |
260,0±8,6 (33)** |
274,0±11,3 (6)* |
|
ПрОСА |
304,0±9,3 (39) |
268,0±7,5 (68)** |
263,0±9,0 (36)** |
272,0±16,2 (7)* |
|
|
ЛеОСА |
295,0±8,8 (33) |
261,0±6,1 (63)** |
257,0±8,8 (33)** |
272,0±6,1 (6)* |
|
|
ПрВСА |
259,0±7,5 (38) |
253,0±6,3 (62) |
239,0±6,2 (36)* |
229,0±7,4 (4)* |
|
|
ПрПА |
242,0±8,0 (38) |
227,0±6,9 (64)* |
213,0±8,8 (36) |
209,0±6,1 (4) |
|
|
ОТС артериальная |
ПрОСА |
0,170±0,001 (51) |
0,20±0,01 (86)** |
0,20±0,01 (49)** |
0,19±0,01 (9)* |
|
ЛеОСА |
0,180±0,001 (44) |
0,200±0,003 (77)** |
0,20±0,01 (44)** |
0,180±0,004 (8) |
|
|
ПрВСА |
0,200±0,001 (50) |
0,200±0,001 (79) |
0,23±0,01 (49)** |
0,22±0,01 (6)* |
|
|
ПрПА |
0,217±0,006 (50) |
0,229±0,005 (81)* |
0,251±0,010 (45)* |
0,224±0,008 (6) |
|
|
Диаметр артерии, мм |
ПрОСА |
6,07±0,08 (51) |
6,15±0,08 (87) |
6,36±0,09 (49)* |
6,53±0,28 (9)* |
|
ЛеОСА |
5,94±0,09 (44) |
5,95±0,07 (77) |
6,33±0,11 (44)* |
6,33±0,22 (8)* |
|
|
ПрВСА |
4,70±0,05 (50) |
4,93±0,06 (79)* |
4,83±0,07 (49) |
4,82±0,18 (6) |
|
|
ПрПА |
3,19±0,07 (50) |
3,23±0,06 (81) |
3,20±0,07 (48) |
3,27±0,13 (6) |
|
|
Комплекс интима-медиа ОСА, мм |
Правый |
1,05±0,03 (51) |
1,20±0,03 (87)* |
1,27±0,04 (49)** |
1,21±0,06 (9)* |
|
Левый |
1,06±0,02 (51) |
1,18±0,02 (87)* |
1,31±0,05 (49)** |
1,22±0,07 (9)* |
|
|
Толщина интимы, мм |
ПрОСА |
0,88±0,02 (51) |
0,94±0,01 (88)* |
0,97±0,02 (49)** |
0,98±0,04 (9)* |
|
ЛеОСА |
0,89±0,02 (44) |
0,95±0,02 (77)* |
1,04±0,02 (44)** |
0,99±0,05 (8)* |
|
|
ПрВСА |
0,94±0,02 (50) |
1,00±0,01 (79)* |
1,07±0,03 (49)* |
1,05±0,03 (6)* |
|
|
ПрПА |
0,68±0,02 (50) |
0,73±0,01 (81)* |
0,78±0,02 (48)* |
0,73±0,04 (6) |
Список литературы Генетические предикторы ремоделирования миокарда и работоспособность сердца при гипертонии
- Суровцева М.В., Козиолова Н.А., Чернявина А.И., Шатунова И.М. Анализ маркёров внезапной сердечной смерти у больных стабильной стенокардией и артериальной гипертензией в зависимости от степени выраженности гипертрофии левого желудочка. Российский кардиологический журнал. 2012; 5 (7): 52-57.
- Dame B., Girerd X., Safar M.E. Pulsatile versus steady component of blood pressure: a cross-sectional analysis and a prospective analysis on cardiovascular mortality. Hypertension (Dallas). 1989; 13: 392-400.
- Shimbo D., Muntner P., Mann D. Association of Left Ventricular Hypertrophy With Incident Hypertension: The Multi-Ethnic Study of Atherosclerosis. Am. J. Epidemiol. 2011; 173 (8): 898-905.
- Рязанов А. С. Клинико-генетические аспекты развития гипертрофии миокарда левого желудочка. Российский кардиологический журнал. 2003; 2: 93-98.
- Ganau A., Devereux R.B., Roman M.J. Patterns of left ventricular hypertrophy and geometric remоdeling in essential hypertension. J. Am. Coll. Cadiol. 1992; 19: 1550-1558.
- Кахраманова С.М. Особенности ремоделирования миокарда левого желудочка при эссенциаль-ной гипертонии с различной вариабельностью ритма сердца. Профилактическая медицина. 2011; 1: 8-10.
- Рубанова М. П. Органическая и функциональная диастолическая дисфункция левого желудочка у больных артериальной гипертензией при разных вариантах вегетативного сопровождения стресса и типах ремоделирования сердца. Российский медицинский журнал. 2012; 3: 7-9.
- Хромцова О.М. Вариабельность сердечного ритма и структурно-функциональное состояние левого желудочка при гипертонической болезни. Саратовский научно-медицинский журнал. 2010; 6 (3): 600-605.
- Tutal E., Sayin B., Ertugrul D. T. Is there the link between hyperuricemia, morning blood pressure surge, and non-dipping blood pressure pattern in metabolic syndrome patients? International Journal of Nephrology and Renovascular Disease. 2013; 6: 71-77.
- Kim J., Wende A.R., Sena S., Theobald H.A. Insulin-like growth factor I receptor signaling is required for exercise-induced cardiac hypertrophy. Molec Endocrinol (Baltimore, Md). 2008; 22: 2531-2543.
- Mancia G., Fagard R., Narkiewicz K. Guidelines for the management of arterial hypertension The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). European Heart Journal. 2013; 34: 2159-2219.
- De Simone G., Pasanisi F., Contaldo F. Link of nonhemodynamic factors to hemodynamic determinants of left ventricular hypertrophy. Hypertension. 2001; 38: 13-18.
- Lambert E.A., Lambert G.W. Stress and Its Role in Sympathetic Nervous System Activation in Hypertension and the Metabolic Syndrome. Curr Hypertens Rep. 2011; 13: 244-248.
- Krivoschekov S.G., Pinigina I.A. Cardiovascular adaptation to high physical activity in the North. Int. J. Circumpolar Health. 2010; 7: 174-178.
- Pinigina I.A., Makharova N. V., Krivoschekov S.G. Structural-functional changes in the cardiovascular system during high athletic activity in aboriginals of Yakutia. J. Human Physiology, 2010; 36 (2): 238-244.
- Menick D.R., Li M.S., Chernysh O. Transcriptional Pathways and Potential Therapeutic Targets in the Regulation of Ncx Expression in Cardiac Hypertrophy and Failure. Adv. Exp. Med. Biol. 2013; 961: 125-135.
- Jujic A., Leosdottir M., Ostling G. A genetic variant of the atrial natriuretic peptidegene is associated with left ventricular hypertrophy in a non-diabetic population -the Malmo preventive project study. BMC Medical genetics. 2013; 14: 64.
- Кобалава Ж.Д., Котовская Ю.В. Артериальная гипертензия. М.: Медиа; 2001. 208.
- Ахметов И.И., Линде Е.В., Рогозкин В.А. Ассоциация полиморфизмов генов-регуляторов с типом адаптации сердечно-сосудистой системы к физическим нагрузкам. Вестник спортивной науки. 2008; 1: 38-41.
- Линде Е.В., Ахметов И.И., Орджоникидзе З.Г. Генетические факторы и формирование гипертрофии миокарда левого желудочка у высококвалифицированных спортсменов. Наука и спорт: современные тенденции. 2014; 3 (2): 43-49.
- Snapir A., Mikkelsson J., Perola M. Variation in the alpha2B-adrenoceptor gene as a risk factor for prehospital fatal myocardial infarction and sudden cardiac death. J. Am. Coll. Cardiol. 2003; 41 (2): 190-194.
- Salimi S., Firoozrai M., Nourmohammadi I. Endothelial nitric oxide synthase gene intron-4 VNTR polymorphism in patients with coronary artery disease in Iran. Indian. J. Med. Res. 2006; 124 (60): 683-688. PMID: 17287556.
- Bluemke D.A., Kronmal R.A., Lima J.A. The relationship of left ventricular mass and geometry to incident cardiovascular events: the MESA (Multi-Ethnic Study of Atherosclerosis) study. J. Am. Coll. Cardiol. 2008; 52 (25): 2148-2155.
- Минушкина Л.О., Затейщиков Д.А., Затейщикова А.А. Полиморфизм гена эндотелиальной NO-синтазы и гипертрофии миокарда у больных артериальной гипертензией. Кардиология. 2002; 3: 30-34.
- Snapir A., Mikkelsson J., Perola M. Variation in the alpha2B-adrenoceptor gene as a risk factor for prehospital fatal myocardial infarction and sudden cardiac death. J. Am. Coll. Cardiol. 2003; 41 (2): 190-194. PMID: 12535806, DOI: 10.1016/S0735-1097(02)02702-X
- Pontremoli R., Ravera M., Viazzi F. Genetic polymorphism of the renin-angiotensin system and organ damage in essential hypertension. Kidney Int. 2000; 57 (2): 561-569.
- Карпов Р.С., Пузырев К.В. Молекулярно-генетический анализ гипертрофии миокарда левого желудочка. Кардиология. 2001; 6: 25-30.


