Генетический полиморфизм возбудителя вирусной диареи (болезни слизистых оболочек) крупного рогатого скота на молочных комплексах Сибири
Автор: Котенева С.В., Нефедченко А.В., Глотова Т.И., Глотов А.Г.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология
Статья в выпуске: 6 т.53, 2018 года.
Бесплатный доступ
Вирусная диарея (болезнь слизистых оболочек) крупного рогатого скота (ВД-БС КРС) распространена на территории Российской Федерации и наносит значительный экономический ущерб молочному скотоводству (особенно интенсивному), инфицированность в разных регионах достигает от 65 до 100 %. Заболевание вызывают два вида вируса - BVDV-1 и BVDV-2 (Bovine viral diarrhea virus), причем второй считается более вирулентным. Существенную роль в поддержании стационарного неблагополучия хозяйств играют персистентно инфицированные (ПИ) животные, которые становятся постоянным эндогенным источником возбудителя в стаде. Кратковременными источниками возбудителя могут быть транзитно инфицированные (ТИ) животные, у которых болезнь протекает в острой форме. На основании мониторинга генетической структуры вирусов, циркулирующих в локальных популяциях скота, можно получить необходимые сведения об эволюции, географии и путях распространения патогена. Но объем таких работ в России недостаточен. Мы впервые провели филогенетический анализ двух типов вируса вирусной диареи, выделенных от животных иностранного и отечественного происхождения с различными клиническими проявлениями болезни, и установили преобладание BVDV-1b у ПИ и ТИ животных, а также циркуляцию BVDV-2b и BVDV-2c на молочных комплексах Сибири (BVDV-2b и BVDV-2c у животных иностранного и отечественного происхождения выявлены в России впервые)...
Крупный рогатый скот, вирусная диарея (болезнь слизистых оболочек), субтипы, геном, полимеразная цепная реакция, 5´-нетранслируемый регион (5´-utr), нуклеотидный сиквенс, молекулярная эпизоотология, филогенетический анализ
Короткий адрес: https://sciup.org/142220072
IDR: 142220072 | УДК: 619:616.98:578.833.3(571.1/.5) | DOI: 10.15389/agrobiology.2018.6.
Текст научной статьи Генетический полиморфизм возбудителя вирусной диареи (болезни слизистых оболочек) крупного рогатого скота на молочных комплексах Сибири
Вирусная диарея (болезнь слизистых оболочек) крупного рогатого скота (ВД-БС КРС) распространена во всем мире (1), в том числе в России: инфицированность скота в разных регионах достигает 65-100 % (2-6). Значение этой инфекции в условиях интенсификации молочного и мясного животноводства возрастает. Ее наиболее экономически значимые последствия — репродуктивные нарушения и болезни респираторного тракта, по- этому к инфицированию в большей степени чувствительны серонегативные телки случного возраста и телята до 6-месячного возраста (7-9). Стационарное неблагополучие хозяйств поддерживается из-за наличия персистентно инфицированных (ПИ) особей, которые становятся постоянным эндогенным источником возбудителя. Транзитно инфицированные (ТИ) животные, у которых болезнь протекает в острой форме, могут быть кратковременными источниками (1).
У КРС болезнь вызывают два генетически различающихся вида вируса — BVDV-1 и BVDV-2 (10), представленные цитопатогенным (ЦП) и нецитопатогенным (НЦП) биотипами (1, 11). Распространение видов и субтипов вируса имеет региональные особенности и зависит от характера ведения животноводства, плотности размещения, продуктивности, частоты ввода новых животных и других факторов (12). Первый вид вируса распространен во всем мире (1), но чаще обнаруживается в странах Европы. Наибольшее количество субтипов (до 21) выявлено у КРС в Италии (13) и Китае (14). BVDV-2 от КРС выделен в США (15), Канаде (16), Бразилии (17), Аргентине (18), Уругвае (19), Германии (20), Словакии (21), Италии (22), Южной Корее (23), Японии (24) и Монголии (25). Этот вид вируса, считающийся более вирулентным, подразделяется на шесть субтипов (2а-2f) (26) и преобладает в США и Канаде (до 50 % всех выделенных штаммов) (1). Для видовой дифференциации вируса используют метод нуклеотидного сиквенса геномной РНК с исследованием 5´-нетранслируемого региона (5´-UTR), подходящего для амплификации (28, 29). В России работы по филогенетическому анализу изолятов носят фрагментарный характер: установлено широкое распространение BVDV-1 среди КРС в Центральном регионе (30) и выявлены два антигенно различающихся штамма вируса (1m и 1а) в популяции лесных бизонов и домашнего скота (31).
Ранее мы определили основные половозрастные группы животных, наиболее подверженных риску инфицирования, которые могут использоваться как индикаторные и быть источником возбудителя в стаде (4).
В настоящей работе мы впервые провели филогенетический анализ двух типов вируса вирусной диареи (болезни слизистых оболочек), выделенных от животных иностранного и отечественного происхождения с различными клиническими проявлениями болезни, и установили преобладание BVDV-1b у ПИ и ТИ животных и циркуляции BVDV-2b и BVDV-2c на молочных комплексах Сибири.
Цель работы — изучение генетического полиморфизма возбудителей вирусной диареи (болезни слизистых оболочек) крупного рогатого скота, циркулирующих среди персистентно и транзитно инфицированных животных, в том числе импортируемых, на крупных молочных комплексах.
Методика. Исследования (2006-2017 годы) выполняли на семи молочных комплексах в Западной и Восточной Сибири (Тюменская, Новосибирская, Иркутская области, Красноярский край, Северный Казахстан) с поголовьем 800 и более дойных коров черно-пестрой породы (среднегодовая продуктивность 7000-10000 л и выше), где специфическую профилактику болезни не проводили или применяли инактивированные вакцины (4). Условия кормления и содержания соответствовали физиологическим и зоотехническим нормам.
Отбирали пробы биоматериала (кровь, сыворотка крови, выделения из носа, лимфоидные органы, легкие, вагинальные выделения) от клинически здоровых персистентно инфицированных животных, транзитно инфицированных животных с репродуктивными нарушениями и респираторным синдромом, а также абортированных плодов. Персистентную инфекцию диагностировали только при выявлении РНК вируса в парных пробах сыворотки крови, отобранных с интервалом в 30 сут. Всего изучили 479 проб биоматериала.
Для выделения вирусной РНК и обратной транскрипции использовали коммерческие наборы «РИБО-сорб» и «Реверта-L» («ФБУН ЦНИИЭ Роспотребнадзора», Россия).
РНК вируса в пробах биоматериала выявляли в полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) с использованием универсальных пар праймеров: 324 (sense) — 5´-ATGCCC(T/A)TAGTAGGA-CTAGCA-3´, 326 (antisense) — 5´-TCAACTCCATGTGCCATGTAC-3´ (33), фланкирующих регион 5´-UTR с последующим филогенетическим анализом. Состав реакционной смеси (объем 30 мкл): 5 мкл кДНК; 1½Taq буфер без Mg2+ (ООО «Лаборатория Медиген», Россия), 0,4 мМ dNTP, 3,3 мМ MgCl2, 0,15 пкМ каждого праймера, 1,5 IU SmartTaq ДНК-полимеразы, вода (до 30 мкл). Режим амплификации: 5 мин при 95 °С (1 цикл); 20 с при 95 °С, 30 с при 54 °С, 40 с при 72 °С (45 циклов); 7 мин при 72 °С (1 цикл). Продукты ПЦР анализировали методом электрофореза в 2 % агарозном геле в Трис-боратном буфере (рН 8,0) по стандартной методике.
Последовательность нуклеотидов в вирусном геноме определяли с использованием набора BigDye 3.1 («Applied Biosystems», США) при секвенировании по обеим цепям ДНК. Полученные нуклеотидные последовательности анализировали при помощи пакетов программ BioEdit 7.0.0 и Lasergene 7.1.0 . Филогенетическую дендрограмму строили методом ближайшего соседа в программе MEGA 7.0 . Топологию ветвей дендрограммы подтверждали методом бутстреп анализа (1000 шагов репликации) (13, 34). Нуклеотидные последовательности синтезируемых фрагментов анализировали методами выравнивания с последовательностями других штаммов BVDV-1, BVDV-2, опубликованными в GenBank (ТСИШ), используя программу ClustalW (35).
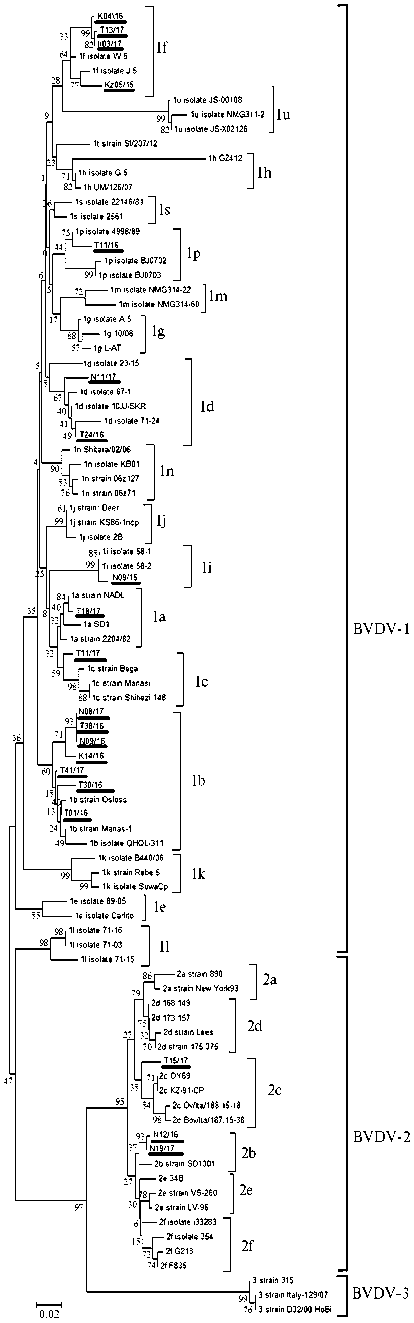
Результаты. РНК вируса обнаружили в 20 (4,17 % от числа исследованных) пробах, в том числе в 10 из Тюменской области, 6 — из Новосибирской, 1 — из Иркутской, 2 — из Красноярского края, 1 — из Северного Казахстана (табл.). Среди ПИ и ТИ животных установили циркуляцию двух видов вируса. Филогенетический анализ выявил семь субтипов BVDV-1: 1а (5 %), 1b (35 %), 1c (5 %), 1d (10 %), 1f (20 %), 1i (5 %), 1p (5 %). Вирус второго типа обнаружили в 15 % проб, из них BVDV-2b — в 10 %, BVDV-2с — в 5 %. Преобладающим субтипом был BVDV-1b (рис., размещен на сайте журнала .
Распространение субтипов имело некоторые географические различия. BVDV-1а выявили только в Тюменской области во внутренних органах абортированного плода. BVDV-1b, кроме Тюменской, присутствовал в Новосибирской области и Красноярском крае. В Красноярском крае он был выделен от животных местной породы, в Новосибирской области — от нетели, завезенной из Германии, и у местного скота, а в Тюменской области — от животных, завезенных из Голландии, США, Словении и Дании. Источником вируса были ПИ животные.
BVDV-1с обнаружили в Тюменской области в пробе сыворотки крови теленка с респираторной патологией, рожденного нетелью из Голландии, BVDV-1d — в Тюменской области в хозяйстве, куда завезли скот из Франции, а также в Новосибирской области у телят местной породы с респираторной патологией. BVDV-1f выявили в Северном Казахстане в сыворотке крови теленка с респираторной патологией, рожденного нетелью, завезенной из Германии, в Иркутской области в сыворотки крови коровы местной породы, в Красноярском крае в сыворотке крови коровы 1240
Генетический полиморфизм возбудителей вирусной диареи (болезни слизистых оболочек) крупного рогатого скота, циркулирующих среди персистентно инфицированных животных на молочных комплексах Западной и Восточной Сибири
Известно, что пестивирусы благодаря строению своего генома обладают значительной мутационной активностью, которая выражается в постоянном увеличении генотипического и фенотипического многообразия штаммов, влияющего на вирулентность. Их роль в патологии животных до конца не изучена. Кроме того, полиморфизм вирусов затрудняет диагностику болезней и может снижать эффективность вакцинации (1, 12). Наиболее распространены BVDV-1a и BVDV-1b, их роль описана при различных формах болезни, и они, наряду с BVDV-2a, включены в состав коммерческих вакцин во всем мире (1). Сообщалось о выявления BVDV-1f в Словении (36) и Австрии (33) у ПИ животных с высокой частотой. Спорадически этот субтип вируса выявляли в Италии (37) и Турции (38), но данные о клинических синдромах, вызываемых им, не представлены.
В нашей стране нет данных о выявлении различных субтипов BVDV-2 и их связи с клиническими формами проявления болезни. Ранее нами было установлено наличие вируса второго типа у животных с различной патологией, однако субтипирование провести не удалось (32). В настоящей работе нами впервые в России установлена циркуляция вируса субтипов BVDV-2b и BVDV-2c.
Согласно данным литературы, BVDV-2a и BVDV-2b признаны основными этиологическими агентами патологии воспроизводства и системной инфекции и распространены в основном в странах Северной и Южной
■ 1g isolate A 5 ■-----1g 10/08
BVDV-1
1j isolate 2B
• 2e strain VS-260
1c strain Bega
11c strain Manasi
93 r N12/16 37[1N19/17
991— 1k isolate SuwaCp
J 71.2c OY89 58__|12cKZ-91-CP
7511p isolate 4998/89
[- 1p isolate BJ0702 9911p isolate BJ0703
BVDV-2
BVDV-3
I 3 strain 315 "ggjj 3 strain Italy-129/07 76*3 strain D32/00 HoBi
Филогенетическая дендрограмма, построенная на основе анализа последовательно сти участка 5´-нетранслируемой области (5´-UTR) генома у возбудителей вирусной диареи (болезни слизистых оболочек) крупного рогатого скота BVDV-1 и BVDV-2, выявленных в хозяйствах Сибири (20062017 годы) . Выравнивание последовательностей методом ClustalW. Топология дерева восстановлена методом NeighborJoining. Матрица генетических расстояний рассчитана с применением метода минимальной эволюции. Внешняя группа — последовательности вируса BVDV-3. Около каждого узла дендрограммы указана бутстреп-поддержка. Исследованные изоляты выделены подчеркиванием. Для референтных штаммов указано название и номер в базе данных GenBank (NCBI).
Америки (1, 15, 16). Мы выявляли BVDV-2b во внутренних органах абортированного плода и мертворожденного теленка местной породы в Новосибирской области. BVDV-2c — редкий субтип вируса, обнаруженный в 2013-2014 годах в Германии (Северная Рейн-Вестфалия и Нижняя Саксония) при массовой вспышке ВД-БС у серонегативных животных. Он вызывал снижение молочной продуктивности у коров, лихорадку, респираторное заболевание и геморрагический энтерит у телят, нетелей и коров (40, 41). В 2016 году установлена его циркуляция среди мелких жвачных животных в Южной Италии (42).
Мы проводили исследование в хозяйствах, где осуществлялся ввоз новых животных из разных источников, в том числе из-за рубежа. Наши результаты показали, что разнообразие видов и субтипов вируса достаточно велико. В предыдущей работе среди местного и завозного скота при острых вспышках болезни ВД-БС КРС мы выявили циркуляцию 6 субтипов BVDV-1 (a, b, c, g, p, k) и BVDV-2 без дифференциации на субтипы (32). В настоящем исследовании подтверждена циркуляция и преобла- дание BVDV-1b у ПИ и ТИ животных. Кроме того, обнаружены три новых субтипа вируса первого типа (BVDV-1d, BVDV-1f и BVDV-1i), а также циркуляция новых субтипов BVDV-2b и BVDV-2с, ранее не выявленных в России. Нужно осторожно относиться к факту обнаружения их на территории нашей страны, учитывать потенциальную патогенность и отсутствие в составе коммерческих вакцин.
Поскольку в России меняется стратегия ведения животноводства и возрастает количество молочных мега-ферм, на которые из многих источников поступают животные с разным инфекционным статусом, изучение генетического полиморфизма вируса становится все более актуальным. Сопоставление данных о происхождении животных с результатами филогенетических исследований может помочь в определении источников, путей заноса возбудителей в тот или иной регион, а также в выявлении, отслеживании новых и высоковирулентных штаммов вирусов. Это особенно важно при вакцинации животных, когда генетические профили вакцинных штаммов и вирусов, циркулирующих на конкретной территории, не совпадают (29). В настоящее время в России применяются в основном инактивированные и живые вакцины на основе штаммы субтипов 1а, 1b и 2а (1, 12). В некоторых случаях генетический профиль вакцинных штаммов может не полностью соответствовать генетическому спектру пе-стивирусов, циркулирующих в конкретной стране или регионе. Выявленное нами генетическое многообразие вирусов вирусной диареи способно снижать эффективность специфической профилактики болезни. Кроме этого, для формирования стационарного неблагополучия по ВД-БС КРС и непрерывного эпизоотического процесса важное значение имеет замкнутый цикл мать—теленок. Это приводит к рождению персистентно инфицированного потомства, которое становится постоянным эндогенным источником вируса в стаде, что снижает эффективность специфической профилактики. Поэтому вакцинация будет более эффективной при условии полного удаления ПИ животных из стада (1, 4).
Таким образом, на молочных комплексах Сибири среди персистентно и транзитно инфицированных животных циркулируют возбудители вирусной диареи (болезни слизистых оболочек) крупного рогатого скота двух видов. Филогенетический анализ выявил семь субтипов BVDV-1 — 1а (5 %), 1b (35 %), 1c (5 %), 1d (10 %), 1f (20 %), 1i (5 %), 1p (5 %) и два субтипа BVDV-2 — 2b (10 %) и 2с (5 %). Преобладающим субтипом был BVDV-1b. Впервые на территории России установлена циркуляция BVDV-2b и BVDV-2c среди животных иностранного и отечественного происхождения, а также выявлена взаимосвязь между принадлежностью вирусов к субтипу и клиническими синдромами, вызываемыми ими: BVDV-1а — патология воспроизводства, 1b — персистентно инфицированные животные, 1с, 1d, 1i, 1p — респираторная патология, 1f — ПИ животные и респираторная патология, BVDV-2b и 2с — патологии воспроизводства и системная инфекция животных. Полученные нами данные могут быть полезны при изучении молекулярной эпизоотологии вирусов, разработке более точных диагностических тестов, охватывающих разнообразные генетические варианты, создании вакцин, а также для повышения эффективности программ контроля инфекции.
Список литературы Генетический полиморфизм возбудителя вирусной диареи (болезни слизистых оболочек) крупного рогатого скота на молочных комплексах Сибири
- Ridpath J.F. Bovine viral diarrhea virus: global status. Vet. Clin. N. Am.-Food A., 2010, 2(5): 105-121 ( ) DOI: 10.1016/j.cvfa.2009.10.007
- Верховская А.Е., Сергеев В.А., Алипер Т.И., Иванов Е.В. Особенности диагностики и профилактики вирусной диареи крупного рогатого скота. Ветеринария, 2009, 8: 3-7.
- Глотов А.Г., Глотова Т.И., Петрова О.Г., Нефедченко А.В., Татарчук А.Т., Котенева С.В., Ветров Г.В., Сергеев А.Н. Распространение вирусных респираторных болезней крупного рогатого скота. Ветеринария, 2002, 3: 17-21.
- Глотов А.Г., Глотова Т.И., Семенова О.В., Котенева С.В., Никонова А.А. Индикаторы циркуляции возбудителей вирусной диареи (болезни слизистых оболочек) крупного рогатого скота на молочных комплексах в условиях Сибири. Сельскохозяйственная биология, 2016, 51(4): 483-490 ( ) DOI: 10.15389/agrobiology.2016.4.483rus
- Шилова Е.Н., Ряпосова М.В., Шкуратова И.А., Вялых Е.В. Вирусная диарея -болезнь слизистых оболочек крупного рогатого скота в Уральском регионе. Ветеринария, 2014, 5: 19-21.
- Юров Г.К., Алексеева С.В., Диас Хименес К.А., Неустроев М.П., Юров К.П. Антигенные свойства нецитопатогенных штаммов диареи-болезни слизистых крупного рогатого скота. Российский ветеринарный журнал. Сельскохозяйственные животные, 2013, 2: 24-26.
- Черных О.Ю., Шевченко А.А., Джаилиди Г.А., Мищенко В.А., Мищенко А.В., Шевкопляс В.Н. Проблемы вирусной диареи крупного рогатого скота. Труды Кубанского государственного аграрного университета, 2016, 58: 194-198.
- Глотов А.Г., Глотова Т.И. Роль возбудителя вирусной диареи-болезни слизистых оболочек в этиологии респираторных патологий крупного рогатого скота. Ветеринария, 2017, 6: 3-12.
- Baker J.C. The clinical manifestations of bovine viral diarrhea infection. Vet. Clin. N. Am.-Food A., 1995, 11(3): 425-445 ( )
- DOI: 10.1016/S0749-0720(15)30460-6
- Vilček Š., Ďurkovič B., Kolesàrovà M., Greiser-Wilke I., Paton D. Genetic diversity of international bovine viral diarrhea virus (BVDV) isolates: Identification of a new BVDV-1 genetic group. Vet. Res., 2004, 35(5): 609-615 ( 2004036)
- DOI: 10.1051/vetres:
- Ridpath J.F. Bovine viral diarrhea virus. In: Encyclopedia of virology/B.W.J. Mahy, M.H.V. van Regenmortel (eds.). Elsevier, Oxford (UK), 2008: 374-380.
- Yesilbag K., Alpay G., Becher P. Variability and global distribution of subgenotypes of bovine viral diarrhea virus. Viruses, 2017, 9(6): 128 ( )
- DOI: 10.3390/v9060128
- Giammarioli M., Ceglie L., Rossi E., Bazzucchi M., Casciari C., Petrini S., De Mia GM. Increased genetic diversity of BVDV-1: recent findings and implications thereof. Virus Genes, 2015, 50(1): 147-151 ( )
- DOI: 10.1007/s11262-014-1132-2
- Deng M., Ji S., Fei W., Raza S., He C., Chen Y., Chen H., Guo A. Correction: Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China. PLoS ONE, 2015, 10(7): e0134777 ( )
- DOI: 10.1371/journal.pone.0134777
- Evermann J.F., Ridpath J.F. Clinical and epidemiologic observations of bovine viral diarrhea virus in the northwestern United States. Vet. Microbiol., 2002, 89(2-3): 129-139 ( )
- DOI: 10.1016/S0378-1135(02)00178-5
- Carman S., Van Dreumel T., Ridpath J., Hazlett M., Alves D., Dubovi E., Tremblay R., Bolin S., Godkin A., Anderson N. Severe acute bovine viral diarrhea in Ontario, 1993-1995. J. Vet. Diagn. Invest., 1998, 10(1): 27-35 ( )
- DOI: 10.1177/104063879801000106
- Silveira S., Weber M.N., Mósena A.C., Da Silva M.S., Streck A.F., Pescador C.A., Flores E.F., Weiblen R., Driemeier D., Ridpath J.F., Canal C.W. Genetic diversity of Brazilian bovine pestiviruses detected between 1995 and 2014. Transbound. Emerg. Dis., 2017, 64(2): 613-623 ( )
- DOI: 10.1111/tbed.12427
- Pecora A., Malacari D.A., Ridpath J.F., Perez Aguirreburualde M.S., Combessies G., Odeón A.C., Romera S.A., Golemba M.D., Wigdorovitz A. First finding of genetic and antigenic diversity in 1b-BVDV isolates from Argentina. Res. Vet. Sci., 2014, 96(1): 204-212 ( )
- DOI: 10.1016/j.rvsc.2013.11.004
- Maya L., Puentes R., Reolón E., Acuña P., Riet F., Rivero R., Cristina J., Colina R. Molecular diversity of bovine viral diarrhea virus in Uruguay. Arch. Virol., 2016, 161(3): 529-535 ( )
- DOI: 10.1007/s00705-015-2688-4
- Tajima M., Frey H.R., Yamato O., Maede Y., Moennig V., Scholz H., Greiser-Wilke I. Prevalence of genotypes 1 and 2 of bovine viral diarrhea virus in Lower Saxony, Germany. Virus Res., 2001, 76(1): 31-42 ( )
- DOI: 10.1016/S0168-1702(01)00244-1
- Novácková M., Jacková A., Kolesárová M., Vilcek S. Genetic analysis of a bovine viral diarrhea virus 2 isolate from Slovakia. Acta Virol., 2008, 52(3): 161-166.
- Luzzago C., Lauzi S., Ebranati E., Giammarioli M., Moreno A., Cannella V., Masoero L., Canelli E., Guercio A., Caruso C., Ciccozzi M., De Mia G.M., Acutis P.L., Zehender G., Peletto S. Extended genetic diversity of bovine viral diarrhea virus and frequency of genotypes and subtypes in cattle in Italy between 1995 and 2013. Biomed. Res. Int., 2014, 2014: 147-145 ( )
- DOI: 10.1155/2014/147145
- Oem J.K., Hyun B.H., Cha S.H., Lee K.K., Kim S.H., Kim H.R., Park C.K., Joo Y.S. Phylogenetic analysis and characterization of Korean bovine viral diarrhea viruses. Vet. Microbiol., 2009, 139(3-4): 356-360 ( )
- DOI: 10.1016/j.vetmic.2009.06.017
- Yamamoto T., Kozasa T., Aoki H., Sekiguchi H., Morino S., Nakamura S. Genomic analyses of bovine viral diarrhea viruses isolated from cattle imported into Japan between 1991 and 2005. Vet. Microbiol., 2008, 127(3-4): 386-391 ( )
- DOI: 10.1016/j.vetmic.2007.08.020
- Ochirkhuu N., Konnai S., Odbileg R., Odzaya B., Gansukh S., Murata S., Ohashi K. Molecular detection and characterization of bovine viral diarrhea virus in Mongolian cattle and yaks. Arch. Virol., 2016, 161(8): 2279-2283 ( )
- DOI: 10.1007/s00705-016-2890-z
- Giangaspero M., Apicellab S., Harasawa R. Numerical taxonomy of the genus Pestivirus: New software for genotyping based on the palindromic nucleotide substitutions method. J. Virol. Methods, 2013, 192(1-2): 59-67 ( )
- DOI: 10.1016/j.jviromet.2013.04.023
- Schweizer M., Peterhans E. Pestiviruses. Annu. Rev. Anim. Biosci., 2014, 2: 141-163 ( )
- DOI: 10.1146/annurev-animal-022513-114209
- Simmonds P., Becher P., Collett M.S., Gould E.A., Heinz F.X., Meyers G., Monath T., Pletnev A., Rice C.M., Stiasny K., Thiel H.-J., Weiner A., Bukh J. Family Flaviviridae. In: Virus taxonomy: Ninth report of the international committee on taxonomy of viruses/A.M.Q. King, M.J. Adams, E.B. Carstens, E.J. Lefkowitz (eds.). Elsevier Academic Press, San Diego, 2011: 1003-1020.
- Vilcek S., Durkovic B., Kolesarova M., Paton D.J. Genetic diversity of BVDV: consequences for classification and molecular epidemiology. Prev. Vet. Med., 2005, 72(1-2): 31-35 ( )
- DOI: 10.1016/j.prevetmed.2005.08.004
- Шульпин М.И., Аянот П.К., Мищенко В.А. Индикация вируса диареи крупного рогатого скота, генотипирование и филогенетический анализ изолятов, выявленных на территории Российской Федерации. Вопросы вирусологии, 2003, 5: 41-46.
- Юров Г.К., Алексеенкова С.В., Диас Хименес К.А., Неустроев М.П., Юров К.П. Антигенные свойства нецитопатогенных штаммов вируса диареи-болезни слизистых крупного рогатого скота. Российский ветеринарный журнал. Сельскохозяйственные животные, 2013, 2: 24-26.
- Глотов А.Г., Котенева С.В., Глотова Т.И., Трегубчак Т.В., Максютов Р.А. Молекулярная эпизоотология вирусной диареи крупного рогатого скота в Сибири. Ветеринария, 2017, 12: 14-20.
- Vilček S., Herring A.J., Herring J.A., Nettleton P.F, Lowings J.P., Paton D.J. Pestiviruses isolated from pigs, cattle and sheep can be allocated into at least three genogroups using polymerase chain reaction and restriction endonuclease analysis. Arch. Virol., 1994, 136(3-4): 309-323 ( )
- DOI: 10.1007/BF01321060
- Kumar S., Stecher G., Tamura K. MEGA 7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Mol. Biol. Evol., 2016, 33: 1870-1874 ( )
- DOI: 10.1093/molbev/msw054
- Felsenstein J. Phylogenies and the comparative method. The American Naturalist, 1985, 125(1): 1-15 ( )
- DOI: 10.1086/284325
- Toplak I., Sandvik T., Barlič-Maganja D., Grom J., Paton D.J. Genetic typing of bovine viral diarrhoea virus: most Slovenian isolates are of genotypes 1d and 1f. Vet. Microbiol., 2004, 99: 175-185 ( )
- DOI: 10.1016/j.vetmic.2003.12.004
- Giammarioli M., Pellegrini C., Casciari C., Rossi E., De Mia G.M. Genetic diversity of bovine viral diarrhea virus 1: Italian isolates clustered in at least seven subgenotypes. J. Vet. Diagn. Invest., 2008, 20(6): 783-388 ( )
- DOI: 10.1177/104063870802000611
- Yeşilbağ K., Förster C., Bank-Wolf B., Yilmaz Z., Alkan F., Ozkul A., Burgu I., Rosales S.C., Thiel H.J., König M. Genetic heterogeneity of bovine viral diarrhoea virus (BVDV) isolates from Turkey: identification of a new subgroup in BVDV-1. Vet. Microbiol., 2008, 130(3-4): 258-267 ( )
- DOI: 10.1016/j.vetmic.2008.01.016
- Yeşilbağ K., Förster C., Ozyiğit M. Alpay G., Tuncer P., Thiel H.J., König M. Characterization of bovine viral diarrhea virus BVDV isolates from an outbreak with hemorrhagic enteritis and severe pneumonia. Vet. Microbiol., 2014, 169: 42-49 ( )
- DOI: 10.1016/j.vetmic.2013.12.005
- Jenckel M., Hoper D., Schirrmeier H., Reimann I., Goller K.V., Hoffmann B., Beer M., Mixed triple: allied viruses in unique recent isolates of highly virulent type 2 bovine viral diarrhea virus detected by deep sequencing. J. Virol., 2014, 88: 6983-6992 ( )
- DOI: 10.1128/JVI.00620-14
- Gethmann J., Homeier T., Holsteg M., Schirrmeier H., Saßerath M., Hoffmann B., Beer M., Conraths F.J. BVD-2 outbreak leads to high losses in cattle farms in Western Germany. Heliyon, 2015, 1(1): e00019 ( )
- DOI: 10.1016/j.heliyon.2015.e00019
- Decaro N., Lucente M.S., Lanave G., Gargano P., Larocca V., Losurdo M., Ciambrone L., Marino P.A., Parisi A., Casalinuovo F., Buonavoglia C., Elia G. Evidence for circulation of bovine viral diarrhea virus type 2c in ruminants in Southern Italy. Transbound. Emerg. Dis., 2017, 64(6): 1935-1944 ( )
- DOI: 10.1111/tbed.12592
- S.V. Koteneva, A.V. Nefedchenko, T.I. Glotova, A.G. Glotov


