Генетическое разнообразие и симбиотическая эффективность клубеньковых микросимбионтов остролодочника таймырского (Oxytropis taimyrensis (Jurtz.) A. et D. Love), астрагала холодного (Astragalus frigidus (L.) A.Gray) и астрагала Тугаринова (Astragalus tugarinovii Basil.) из Арктической Якутии
Автор: Кузнецова И.Г., Карлов Д.С., Гуро П.В., Сазанова А.Л., Тихомирова Н.Ю., Лащинский Н.Н., Белимов А.А., Сафронова В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Крайний Север, Арктика, Антарктика: новые агротехнологии
Статья в выпуске: 5 т.59, 2024 года.
Бесплатный доступ
Бобовые растения обладают значительным потенциалом для интродукции в арктических регионах России. Одно из ключевых свойств бобовых растений - способность формировать азотфиксирующий симбиоз с клубеньковыми бактериями (ризобиями). Однако изучению биоразнообразия и симбиотической эффективности арктических ризобий на территории России уделяется недостаточно внимания. В настоящей работе впервые описаны 13 штаммов порядка Hyphomicrobiales (ранее Rhizobiales ), изолированных из клубеньков Oxytropis taimyrensis , Astragalus frigidus и A. tugarinovii , произрастающих в Арктической Якутии. Изучена способность девяти ризобиальных штаммов Rhizobium sp. 7/1-1, 19-1/1, 20-1/1 и 33-1/1, R. giardinii 20/1-1, M. norvegicum 20/1-4 и Mesorhizobium sp. 9-4/1, 25-2/1 и 32-2/1 нодулировать дикорастущие арктические бобовые Oxytropis adamsiana и Astragalus frigidus и кормовые бобовые Trifolium repens и Medicago sativa в условиях микровегетационного опыта. Целью работы было выделение и изучение генетического разнообразия штаммов порядка Hyphomicrobiales , изолированных из клубеньков дикорастущих бобовых Oxytropis taimyrensis (Jurtz.) A. et D. Love, Astragalus frigidus (L.) A.Gray и Astragalus tugarinovii Basil., собранных в Арктической зоне Якутии, а также выявление способности ризобиальных штаммов формировать азотфиксирующие клубеньки на корнях кормовых и дикорастущих бобовых растений Trifolium repens L., Medicago sativa L., Oxytropis adamsiana (Trautv.) Jurtzev и Astragalus frigidus (L.) A.Gray в условиях микровегетационного эксперимента по кросс-нодуляции. Корневые клубеньки дикорастущих популяций O. taimyrensis , A. frigidus , A. tugarinovii были собраны в 2021 году в окрестностях оз. Севастьян-Кюеле и на о. Тит-Ары в ходе российско-немецкой экспедиции в дельту реки Лены. Штаммы микроорганизмов выделяли по стандартной методике с использованием маннито-дрожжевой питательной среды YMA. Геномную ДНК из чистых культур выделяли с помощью наборов DNeasy Blood&Tissue kit («QIAGEN N.V.», Германия) и Monarch® («New England Biolabs», США). Первичная идентификация штаммов была проведена методом ПЦР с последующим секвенированием последовательностей фрагмента маркерного гена 16S рРНК (900-1400 п.н.) ( rrs ). Способность девяти арктических штаммов из рода Rhizobium и Mesorhizobium формировать азотфиксирующие клубеньки на корнях Trifolium repens L., Medicago sativa L., O. adamsiana и A. frigidus изучена в условиях стерильного микровегетационного опыта. Изучаемые штаммы были выделены в настоящей работе и ранее из клубеньков арктических бобовых Lathyrus palustris L., Vicia cracca L. и Hedysarum arcticum B. Fedtsch, произрастающих в дельте р. Лена . Растения культивировали в стерильных стеклянных сосудах объемом 50 мл, содержащих 3 г вермикулита и 6 мл среды Красильникова-Кореняко. Проростки были инокулированы суспензиями индивидуальных штаммов в количестве 106 клеток/сосуд. В качестве положительного контроля использовали коммерческие штаммы Rhizobium leguminosarum RCAM1365 и Sinorhizobium meliloti RCAM1750 из Сетевой биоресурсной коллекции в области генетических технологий для сельского хозяйства (ФГБНУ ВНИИСХМ, г. Санкт-Петербург). Неинокулированные растения служили отрицательным контролем. По окончании культивирования проводили подсчет клубеньков и определяли сырую биомассу растений. Азотфиксирующую активность определяли ацетиленовым методом с помощью газового хроматографа GC-2014 («Shimadzu», Япония). Полученные изоляты были отнесены к родам Rhizobium (сем. Rhizobiaceae ), Mesorhizobium (сем. Phyllobacteriaceae ), Bosea (сем. Boseaceae ) и Tardiphaga (сем. Bradyrhizobiaceae ). Штаммы Rhizobium sp. 7/1-1, Tardiphaga robiniae 7/2-2 и 7/4-2 были выделены из A. tugarinovii , штаммы Mesorhizobium sp. 25-2/1, 25А/5-1, Bosea sp. 25А/1-3, B. lathyri 25А/2-1, B. psychrotolerans 25А/2-2 и 25А/4-1 - из A. frigidus , тогда как штаммы Mesorhizobium sp. 9-4/1, T. robiniae 9/1-5, 9/3-1 и 9/5-1 - из клубеньков O. taimyrensis. В условиях стерильного микровегетационного опыта штамм R. giardinii 20/1-1 не формировал клубеньки ни в одном из вариантов инокуляции, в то время как остальные восемь штаммов были способны образовывать как неэффективные, так и азотфиксирующие клубеньки в зависимости от варианта инокуляции бобовых растений. В отношении местных арктических видов O. adamsiana и A. frigidus более активными оказались штаммы, выделенные из местных видов бобовых ( O. taimyrensis , A. frigidus , H. arcticum ), в то время как культурные растения M. sativa и T. repens оказались отзывчивее на инокуляцию штаммами, выделенными из заносных растений L. palustris и V. cracca .
Арктическая якутия, бобовые растения, пастбищные и сенокосные агрофитоценозы, бобово-ризобиальный симбиоз, азотфиксирующие клубеньковые бактерии
Короткий адрес: https://sciup.org/142243784
IDR: 142243784 | УДК: 579.841.3:579.64:579.262:582.736 | DOI: 10.15389/agrobiology.2024.5.927rus
Текст научной статьи Генетическое разнообразие и симбиотическая эффективность клубеньковых микросимбионтов остролодочника таймырского (Oxytropis taimyrensis (Jurtz.) A. et D. Love), астрагала холодного (Astragalus frigidus (L.) A.Gray) и астрагала Тугаринова (Astragalus tugarinovii Basil.) из Арктической Якутии
В последнее время развитию сельского хозяйства в Арктической зоне Российской Федерации уделяется все более пристальное внимание (1, 2). Устойчивое развитие животноводства и кормопроизводства на базе местных биологических ресурсов, адаптированных к сложным почвенно-климатическим условиям Арктики, позволит создать новые рабочие места и обеспечит местное население качественными и свежими продуктами питания, что будет способствовать повышению привлекательности северных территорий России (3). Так, И.С. Хантимер (4) показал возможность создания высокопродуктивных многолетних сенокосных лугов в Большеземельской тундре с целью обеспечения кормовой базой животноводческого хозяйства, расположенного в окрестностях г. Воркуты.
Ключевым высокобелковым компонентом природных сенокосов и пастбищ служат бобовые растения, которые широко распространены от Арктики до антарктических островов (5). Например, кормовое растение клевер ползучий (Trifolium repens L.) — одно из наиболее продуктивных пастбищных растений, значительно улучшающих плодородие и структуру почвы. Специально для выращивания в холодных регионах селекционерами выводятся холодостойкие сорта этого вида (6). Люцерна посевная Medicago sativa L. характеризуется высокой экологической пластичностью, устойчивостью к неблагоприятным условиям и относительно высокой зимостойкостью. Используется в травосмесях с многолетними злаковыми травами для создания культурных пастбищ и восстановления деградированных почв (7). Растения родов Остролодочник (Оxytropis DC.) и Астрагал (Astragalus L.) широко распространены в умеренных и арктических зонах Северного полушария, где служат кормом для диких и сельскохозяйственных животных и птиц (8, 9). Так, в тундровой зоне Восточной Сибири встречаются остролодочник таймырский (Oxytropis taimyrensis (Jurtz.) A. et D. Love) и астрагал Тугаринова (Astragalus tugarinovii Basil.), которые растут в основном на остепненных склонах, осыпях и в сухих редкостойных лиственничных лесах (10, 11). Вид O. adamsiana (Trautv.) Jurtzev распространен на Таймыре и в Северной Якутии, растет в тундре, редколесьях и в высокогорьях, где служит одним из важных компонентов пищевого рациона травоядных животных (8, 10-12). Вид A. frigidus (L.) A.Gray — широко распространенное за полярным кругом холодоустойчивое растение с высоким содержанием белка, рекомендованное к использованию в качестве кормовой и лекарственной культуры. На пастбищах хорошо поедается сельскохозяйственными животными и северными оленями (8). Показано, что включение бобовых растений в состав травосмесей пастбищных и сенокосных угодий способствует решению проблемы дефицита кормового белка и обеспечивает экономное расходование ресурсов в кормопроизводстве и земледелии на Европейском Севере России (13-15).
Ключевым фактором для продуктивного возделывания бобовых культур служат их микросимбионты, которые могут участвовать в питании растений-хозяев, защите от патогенов и фитофагов, а также в регуляции развития и адаптации к условиям, вызывающим стресс. Один из основных лимитирующих факторов распространения и продуктивности растений на Крайнем Севере — недостаточная обеспеченность почвы легко доступными для растений соединениями азота (16).
Симбиотические клубеньковые бактерии (ризобии), фиксируя атмосферный азот, обеспечивают стабильное снабжение растений этим важнейшим биогенным элементом. Многие бобовые вступают в симбиоз только с определенными видами микроорганизмов. Основными микросимбионтами растений рода Клевер ( Trifolium , триба Trifolieae Endl.) служат штаммы вида Rhizobium leguminosarum bv. trifolii (17) . Однако из корневых клубеньков различных видов Trifolium выделяют также и не типичные для этого рода бактерии, родственные видам Rhizobium и Agrobacterium (18, 19). Бобовые растения рода Люцерна ( Medicago L . ) входят в группу перекрестной инокуляции с представителями родов Донник ( Melilotus (L.) Mill.) и Пажитник ( Trigonella L.) , формирующие азотфиксирующий симбиоз со штаммами Ensifer meliloti (ранее Sinorhizobium meliloti ), однако в их клубеньках могут присутствовать и представители других родов, например Agrobacterium (20). Показано, что микросимбионты растений Astragalus могут принадлежать родам Rhizobium , Sinorhizobium , Bradyrhizobium , Mesorhizobium и Bosea (21-24). Для растений Oxytropis типичными микросимбионтами считаются представители рода Mesorhizobium , но встречаются и Rhizobium , Sinorhizobium , Bradyrhizobium , Bosea и Tardiphaga (21, 22, 25).
Бобово-ризобиальные отношения характеризуются сложной многокомпонентной структурой. Их экологическая и практическая роль обусловлена тем, что формирование взаимовыгодного растительно-микробного симбиоза оказывает влияние на качество урожая и свойства почвы в любой климатической зоне. Поэтому изучение биоразнообразия арктических ри-зобий имеет важное значение для развития сельского хозяйства в условиях Крайнего Севера.
В настоящей работе впервые описаны 13 штаммов порядка Hyphomi-crobiales (ранее Rhizobiales ), изолированных из клубеньков Oxytropis taimyrensis , Astragalus frigidus и A. tugarinovii , произрастающих в Арктической Якутии. Изучена способность девяти ризобиальных штаммов Rhizobium sp. 7/1-1, 191/1, 20-1/1 и 33-1/1, R. giardinii 20/1-1, M. norvegicum 20/1-4 и Mesorhizobium sp. 9-4/1, 25-2/1 и 32-2/1 нодулировать дикорастущие арктические бобовые Oxytropis adamsiana и Astragalus frigidus и кормовые бобовые Trifolium repens и Medicago sativa в условиях микровегетационного опыта.
Целью работы было выделение и изучение генетического разнообразия штаммов порядка Hyphomicrobiales , изолированных из клубеньков дикорастущих бобовых Oxytropis taimyrensis (Jurtz.) A. et D. Love, Astragalus frigi-dus (L.) A.Gray и Astragalus tugarinovii Basil., собранных в Арктической зоне Якутии, а также выявление способности ризобиальных штаммов формировать азотфиксирующие клубеньки на корнях кормовых и дикорастущих бобовых растений Trifolium repens L., Medicago sativa L., Oxytropis adamsiana (Trautv.) Jurtzev и Astragalus frigidus (L.) A. Gray в условиях микровегетаци-онного эксперимента по кросс-нодуляции.
Методика. В ходе российско-немецкой экспедиции в дельту р. Лена в 2021 году в окрестностях оз. Севастьян-Кюеле (71°31 ‘ 37.3 ’’ N 128°49 ‘ 20.1 ’’ E)
и на о. Тит-Ары (71°57 ‘ 32.7 ’’ N 127°05 ‘ 53.3 ’’ E) были собраны корневые клубеньки и семена дикорастущих популяций бобовых растений O. taimyrensis , A. frigidus и A. tugarinovii .
Штаммы микроорганизмов выделяли по стандартной методике с использованием маннито-дрожжевой питательной среды YMA (Novikova and Safronova, 1992) после стерилизации клубеньков в течение 1 мин в 96 % этаноле. Чистые культуры изолятов (после последовательного двойного клонирования) были помещены на длительное хранение на станцию низкотемпературного автоматизированного хранения биологических образцов при -80 °С («Liconic Instruments», Лихтенштейн). Информация о штаммах представлена в Интернет-базе данных Сетевой биоресурсной коллекции в области генетических технологий для сельского хозяйства .
Геномную ДНК из чистых культур выделяли с помощью наборов DNeasy Blood&Tissue kit («QIAGEN N.V.», Германия) и Monarch® («New England Biolabs», США). Первичная идентификация штаммов была проведена методом ПЦР с последующим секвенированием последовательностей фрагмента маркерного гена 16S рРНК (900-1400 п.н.). Для амплификации использовали пару праймеров fD1 5´-AGAGTTTGATCCTGGCTCAG-3´ и rD1 5´-AAGGAGGTGATCCAGCC-3´ (26). Условия ПЦР были следующими: 3 мин 30 с при 95 °С (первичная денатурация); 1 мин 10 с при 94 °С (денатурация), 40 с при 56 °С (отжиг праймеров), 2 мин 10 с при 72 °С (элонгация) (35 циклов); 6 мин 10 с при 72 °С (финальная элонгация). Состав реакционной смеси для ПЦР: 38 мкл milli-Q H 2 O («Евроген», Россия), 5 мкл буфера (ООО «Компания Хеликон», Россия), 5 мкл набора dNTP (ЗАО «Евроген», Россия), по 0,5 мкл праймеров (ЗАО «Евроген», Россия), 0,5 мкл Taq-полимеразы (ООО «Компания Хеликон», Россия) и 1 мкл (50100 нг) мДНК. Амплификацию проводили на приборе T100 Thermal Cycler («Bio-Rad», США). Количество ДНК оценивали визуально с помощью электрофореза в 1,0 % агарозном геле в 0,5½ TАE-буфере с использованием маркера молекулярной массы MassRuler («Fermentas», Литва). Очистку ПЦР-продукта из агарозного геля осуществляли с помощью набора Cleanup S-Cap (ЗАО «Евроген», Россия).
Очищенную ДНК секвенировали на генетическом анализаторе ABI PRISM 3500xl («Life Technologies», США) на базе Центра коллективного пользования «Геномные технологии, протеомика и клеточная биология» Всероссийского НИИ сельскохозяйственной микробиологии (ЦКП ГТПиКБ ФГБНУ ВНИИСХМ). Полученные последовательности анализировали с помощью программы ChromasLite 2.6.4 . Для множественного выравнивания и сравнения нуклеотидных последовательностей использовали программу ClustalOmega . Поиск последовательностей близкородственных типовых штаммов осуществляли в базе данных GenBank . Нуклеотидные последовательности были депонированы в GenBank под номерами PP512682-PP512693, PP578216.
Для постановки микровегетационного опыта (МВО) по кросс-ноду-ляции использовали семена дикорастущих арктических ( A. frigidus и O. adam-siana ) и кормовых ( T. repens и M. sativa ) бобовых растений, а также 9 бактериальных штаммов, полученных в настоящей работе и выделенных ранее из клубеньков арктических бобовых Lathyrus palustris L., Vicia cracca L. и Hedysarum arcticum B. Fedtsch. (27).
Семена растений скарифицировали и поверхностно стерилизовали в 98 % H 2 SO 4 в течение 5 мин, тщательно промывали стерильной водопро-930
водной водой и проращивали на фильтровальной бумаге в чашках Петри при 25 °С в темноте в течение 3-5 сут (в зависимости от вида растения). Растения культивировали в стерильных стеклянных сосудах объемом 50 мл, содержащих 3 г вермикулита. В каждый сосуд добавляли по 6 мл среды Красильникова-Кореняко (K 2 HPO 4 — 1,0 г/л, MgSO 4 •7H 2 O — 1,0 г/л, Ca 3 (PO 4 ) 2 — 0,2 г/л, FeSO 4 – 0,02 г/л), а также смесь микроэлементов по Федорову объемом 1 мл следующего состава: H 3 ВО 3 — 0,05, (NH 4 ) 2 MoO 4 — 0,05, KCl — 0,005, NaBr — 0,005, ZnSO 4 •7H 2 O — 0,003, MnSO 4 — 0,002 г/л.
Пробирки, содержащие по 2 проростка, инокулировали суспензиями индивидуальных штаммов в количестве 106 клеток на сосуд. Каждый вариант инокуляции был представлен четырьмя-пятью повторностями в зависимости от качества и уровня всхожести семян конкретного вида растения. Положительным контролем служили коммерческие штаммы Rhizobium leguminosarum RCAM1365 и Sinorhizobium meliloti RCAM1750 из Сетевой био-ресурсной коллекции в области генетических технологий для сельского хозяйства (ФГБНУ ВНИИСХМ, г. Санкт-Петербург). Неинокулированные растения использовались в качестве отрицательного контроля.
Растения выращивали в фитотроне при 18-22 °С в течение 30 сут при относительной влажности 50 % и четырехуровневом режиме освеще-ния/температуры: ночь (18 °С, 8 ч), утро (200 мкмоль квантов м - 2•с - 1, 20 °С, 2 ч), день (400 мкмоль квантов м " 2-с - 1, 23 °С, 12 ч), вечер (200 мкмоль квантов м - 2 •с - 1, 20 °С, 2 ч). Освещение осуществлялось лампами L36W/77 FLUORA («OSRAM Licht AG», Германия). После окончания культивирования сырую биомассу растений взвешивали и подсчитывали образовавшиеся клубеньки. Азотфиксирующую активность клубеньков определяли ацетиленовым методом с помощью газового хроматографа GC-2014 («Shimadzu», Япония).
Данные МВО обрабатывали стандартным методом однофакторного дисперсионного анализа (ANOVA) в статистической среде R (v. 4.2.3; R Core Team, 2023). Определяли средние значения ( M ) и стандартные отклонения (±SD) для каждого из измеряемых симбиотических параметров в каждом варианте инокуляции. При статистически значимых результатах ANOVA (p < 0,05) проводился тест Дункана для множественного сравнения средних с помощью пакета agricolae.
Результаты. Арктическое озеро Севастьян-Кюеле (рис. 1) расположено в подзоне типичных тундр в 10 км южнее пос. Тикси среди невысоких гор Приморского кряжа. Территория относится к области сплошного распространения многолетнемерзлых грунтов. Почвы щебнистые маломощные криоземы. Растительность окрестностей озера представлена различными вариантами тундр от дриадовых и типчаковых на дренированных позициях до болотистых на понижениях вблизи озера с преобладанием кустарничковозеленомошных тундр. Большие площади заняты подвижными мелкощебнистыми осыпями с оригинальными слабо сомкнутыми растительными сообществами. Климат суровый. Продолжительность лета всего 2 мес, со средней температурой июля 11 °С (28).
Остров Тит-Ары (см. рис. 1) расположен в южной части дельты Лены и сформирован преимущественно песчаными аллювиальными отложениями. Это один из наиболее крупных островов Нижней Лены и самая северная область распространения лесов на территории Восточной Сибири. Растительность острова представлена редкостойными лиственничными лесами в сочетании с сообществами кустарниковых тундр, ольшатниками и гигрофильными злаковниками. Территория входит в состав государственного природного заповедника «Усть-Ленский» и относится к ресурсному резервату «Лена-Дельта» (29, 30).
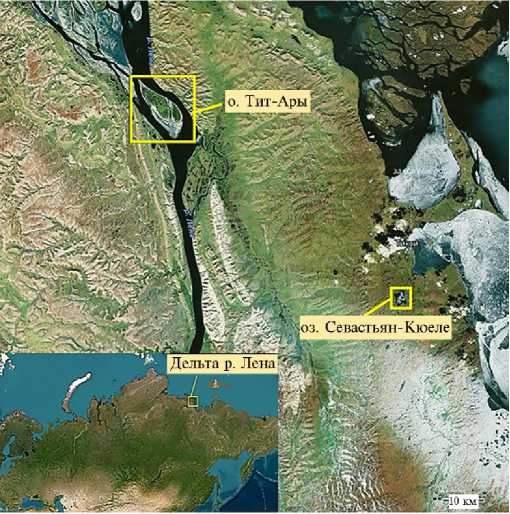
Рис. 1. Места сбора растений Oxytropis taimyrensis (Jurtz.) A. et D. Love, Astragalus frigidus (L.) A. Gray и Astragalus tugarinovii Basil. на о. Тит-Ары (дельта реки Лены) и в районе оз. Сева-стьян-Кюеле (окрестности Тикси).
-
1. Изоляты, выделенные из клубеньков Astragalus tugarinovii Basil., Oxytropis tai-myrensis (Jurtz.) A. et D. Love и Astragalus frigidus (L.) A. Gray, собранных в районе оз. Севастьян-Кюеле и на о. Тит-Ары (2021 год)
Место сбора
¹ штамма
Ближайший типовой штамм
Сходство гена rrs , %
Результат идентификации
Astragalus tugarinovii
оз. Севастьян-
7/1-1
R. brockwellii CC275e
100
Rhizobium sp.
Кюеле
R. sophorae LMG 27901
R. anhuiense CCBAU 23252
R. indicum JKLM 12A2
7/2-2
T. robiniae R-45977
99,93
Tardiphaga robiniae
7/4-2
T. robiniae R-45977
99,93
Tardiphaga robiniae
Oxytropis taimyrensis
оз. Севастьян-
9/1-5
T. robiniae R-45977
99,93
Tardiphaga robiniae
Кюеле
9/3-1
T. robiniae R-45977
99,93
Tardiphaga robiniae
9-4/1
M. jarvisii ATCC 33669
99,93
Mesorhizobium sp.
M. carmichaelinearum MonP1N1
99,92
9/5-1
T. robiniae R-45977
99,93
Tardiphaga robiniae
Astragalus frigidus
о. Тит-Ары
25А/1-3
B. lathyri R-46060
99,13
Bosea sp.
25-2/1
M. shangrilense CCBAU 65327
99,85
Mesorhizobium sp.
M. qingshengii CCBAU 33460
25А/2-1
B. lathyri R-46060
100
Bosea lathyri
25А/2-2
B. psychrotolerans 1131
99,93
Bosea sp.
B. vaviloviae Vaf18
99,86
25А/4-1
B. psychrotolerans 1131
100
Bosea sp.
B. vaviloviae Vaf18
99,78
25А/5-1
M. shangrilense CCBAU 65327
99,92
Mesorhizobium sp.
M. qingshengii CCBAU 33460
-
2. Эффект инокуляции бобовых растений Oxytropis adamsiana (Trautv.) Jurtzev и Astragalus frigidus (L.) A. Gray арктическими изолятами в условиях стерильного микровегетационного опыта ( M ±SD)
-
3. Эффект инокуляции бобовых растений Trifolium repens L. и Medicago sativa L. арктическими изолятами и коммерческими штаммами Rhizobium leguminosarum bv. viciae RCAM1365 и Sinorhizobium meliloti RCAM1750 в условиях стерильного микровегетационного опыта ( M ±SD)
Вариант инокуляции
Число клубеньков на
растение
Сырая биомасса, мг/растение
Ацетилен-редуктазная активность, мкмоль C 2 H 4• растение - 1• сут - 1
побег
корень
общая масса
Trifolium repens ( n = 5)
Без инокуляции
0
47,6±4,3ab
46,0±19,5bc
93,6±23,1
0
R. leguminosarum bv. viciae RCAM1365
6,6±1,8b
58,0±8,4a
29,0±8,9c
87,0±16,4
0,9±0,5
Rhizobium sp. 19-1/1*
5,4±1,5b
53,0±14,8a
60,0±12,2abc
113,0±24,4
0
Rhizobium sp. 33-1/1*
5,4±1,1b
43,6±8,6ab
50,0±18,7ab
93,6±24,0
0
Rhizobium sp. 20-1/1*
2,2±0,8c
44,0±7,1ab
45,0±11,2bc
89,0±13,4
0
Mesorhizobium sp. 32-2/1*
3,0±1,0c
50,0±15,2a
46,0±18,2bc
96,0±20,7
0
R. giardinii 20/1-1
0
54,0±20,7a
52,0±25,9abc
106.0±42,2
н/о
Mesorhizobium sp. 9-4/1
0
44,0±5,5ab
64,0±23,0ab
108,0±22,8
н/о
Mesorhizobium sp. 25-2/1
0
32,0±13,0b
70,0±12,2ab
102,0±21,7
н/о
Rhizobium sp. 7/1-1
0
44,0±8,9ab
76,0±18,2a
120,0±22,4
н/о
M. norvegicum 20/1-4**
0
44,0±11,4ab
58,0±21,7ab
102,0±26,8
н/о
Без инокуляции
Medicago s 0 42,0±8,4ab
ativa ( n = 57,6±18,4
5)
99,6±16,5
0
S. meliloti RCAM1750
9,0±3,4a
48,8±19,6a
40,4±8,0
89,2±25,2
0,9±0,4
Rhizobium sp. 19-1/1*
2,0±0,7c
38,0±11,0abc
66,4±20,3
104,4±26,7
0
Rhizobium sp. 33-1/1*
2,4±0,5c
36,0±11,9abc
48,6±17,5
84,6±22,6
0
Rhizobium sp. 20-1/1*
2,4±0,4c
26,0±15,2bc
46,4±20,1
72,4±33,6
0
Mesorhizobium sp. 32-2/1*
0
26,0±5,5bc
44,0±13,4
70,0±18,7
н/о
R. giardinii 20/1-1**
0
24,0±4,2c
31,8±16,2
55,8±14,8
н/о
Mesorhizobium sp. 9-4/1***
0
33,0±14,8abc
46,0±17,1
79,0±26,6
н/о
Mesorhizobium sp. 25-2/1***
5,2±1,3b
38,0±11,0abc
50,0±15,8
88,0±25,9
0
Rhizobium sp. 7/1-1***
3,2±0,4c
36,0±11,4abc
52,0±19,2
88,0±17,9
0
M. norvegicum 20/1-4**
0
28,0±4,5bc
52,0±19,2
80,0±17,3
н/о
Из клубеньков бобовых растений O. taimyrensis , A. tugarinovii и A. frigidus , собранных в районе оз. Севастьян-Кюеле и на о. Тит-Ары, было выделено соответственно 4, 3 и 6 изолятов. Штаммы 7/1-1, 9-4/1, 25-2/1 и 25А/5-1 формировали колонии на 3-4-е сут, остальные — на 5-6-е сут. На основании анализа гена rrs изоляты были отнесены к родам Rhizobium (сем.
Rhizobiaceae ), Mesorhizobium (сем. Phyllobacteriaceae ), Bosea (сем. Boseaceae ) и Tardiphaga (сем. Bradyrhizobiaceae ) порядка Hyphomicrobiales (табл. 1).
Штамм 7/1-1 из клубенька A. tugarinovii показал 100 % сходство по rrs гену сразу с девятью типовыми штаммами: R. brockwellii CC275e, R. sopho-rae LMG 27901, R. indigoferae CIP 108029, R. anhuiense CCBAU 23252, R. in-dicum JKLM 12A2, R. ruizarguesonis UPM1133, R. laguerreae FB206, R. legumi-nosarum LMG 14904, R. leguminosarum bv. viciae USDA 2370. Уточнение видовой принадлежности штамма 7/1-1 будет определено по результатам секвенирования и анализа его полного генома.
Штамм 9-4/1 из клубенька O. taimyrensis показал более 99,9 % сходства по rrs гену с типовыми штаммами M. jarvisii ATCC 33669 и M. carmi-chaelinearum MonP1N1 . Штамм M. jarvisii ATCC 33669 впервые был выделен из клубеньков лядвенца рогатого ( Lotus corniculatus L.) (31), тогда как штамм M. carmichaelinearum MonP1N1 выделен из клубеньков монтигены новозеландской ( Montigena novae-zelandiae (Hook.f.) Heenan), произрастающей на Южном острове в Новой Зеландии (32).
Штаммы 25-2/1 и 25А/5-1 из клубеньков A. frigidus демонстрировали наибольшее сходство по гену rrs (более 99,85 %) с типовыми штаммами M. shangrilense CCBAU 65327 и M. qingshengii CCBAU 33460, выделенными соответственно из клубенька караганы двуцветной ( Caragana bicolor Kom.) и астрагала китайского ( A. sinicus L.) (33, 34).
Штаммы 25А/1-3, 25А/2-1, 25А/2-2 и 25А/4-1 из клубеньков A. frigidus на основании анализа rrs гена были отнесены к роду Bosea. Штаммы 25А/1-3 и 25А/2-1 показали соответственно 99,13 и 100 % сходства с ближайшим типовым штаммом B. lathyri R-46060, выделенным из клубенька чины широколистной ( L. latifolius L.), произрастающей в Бельгии (35). Штаммы 25А/2-2 и 25А/4-1 были родственны на уровне 99,86-100 % сходства с типовыми штаммами B. psychrotolerans 1131 и B. vaviloviae Vaf18. Штамм B. psychrotolerans 1131 был выделен из воды оз. Мичиган (США) и описан как психротроф-ный представитель класса Proteobacteria , тогда как штамм B. vaviloviae Vaf18 был выделен из клубенька вавиловии прекрасной ( Vavilovia formosa (Steven) Fed) , произрастающей на Северном Кавказе (Российская Федерация) (36, 37). Следует отметить, что представители рода Bosea присутствуют в клубеньках различных видов бобовых растений: Lupinus , Lathyrus , Robini a, Vavilovia , Caragana, Spartocytisus , Vicia , Astragalus , Oxytropis , Hedysarum (24, 26, 35-40). Однако способность штаммов Bosea к самостоятельному формированию клубеньков до сих пор не установлена.
Изоляты 7/2-2, 7/4-2 и 9/1-5, 9/3-1, 9/5-1, выделенные соответственно, из A. tugarinovii и O. taimyrensis , показали 99,93 % сходства по гену rrs с ближайшим типовым штаммом T. robiniae R-45977. Представители вида T. robiniae встречаются в клубеньках узколокальных эндемиков рода Остролодочник, реликтового растения вавиловии прекрасной ( Vavilovia formosa (Steven) Fed. ), робинии ложноакациевой ( Robinia pseudoacacia L.) (25, 41 ), а также в клубеньках других видов бобовых (24, 26, 40) . Показано, что геномы некоторых штаммов T. robiniae могут содержать отдельные симбиотические гены ( nod, nif и fix ) (25) .
Способность девяти ризобиальных штаммов Rhizobium sp . 7/1-1, 191/1, 20-1/1 и 33-1/1, R. giardinii 20/1-1, M. norvegicum 20/1-4 и Mesorhizobium sp. 9-4/1, 25-2/1 и 32-2/1 нодулировать дикорастущие арктические бобовые O. adamsiana и A. frigidus (табл. 2) и сельскохозяйственные кормовые бобовые T. repens и M. sativa (табл. 3) изучали в условиях стерильного микрове-гетационного опыта.
|
Вариант инокуляции |
Число клубеньков на растение |
Сырая биомасса, мг/растение |
Ацетилен-редуктазная активность, мкмоль C 2 H 4• растение - 1• сут - 1 |
|||
|
побег |
корень |
общая масса |
||||
|
Без инокуляции |
Oxytropis adamsiana ( n = 4) 0 33,2±8,6 17,7±4,4bcd 50,8±10,6 |
0 |
||||
|
Rhizobium sp. 19-1/1* |
0 |
42,4±11,4 |
26,2±10,9ab |
68,6±13,5 |
н/о |
|
|
Rhizobium sp. 33-1/1* |
0 |
45,9±7,7 |
27,9±5,9a |
73,8±11,3 |
н/о |
|
|
Rhizobium sp. 20-1/1* |
0 |
40,2±12,6 |
22,0±7,4abcd |
62,2±19,4 |
н/о |
|
|
Mesorhizobium sp. 32-2/1* |
0 |
28,5±7,8 |
14,8±2,0d |
43,3±7,9 |
н/о |
|
|
R. giardinii 20/1-1** |
0 |
40,6±6,8 |
15,5±4,5cd |
56,1±10,4 |
н/о |
|
|
Mesorhizobium sp. 9-4/1*** |
2,0±0,0b |
43,7±19,3 |
17,9±5,3abcd |
62,4±21,4 |
0,6±0,12a |
|
|
Mesorhizobium sp. 25-2/1*** |
4,8±0,8a |
44,7±5,2 |
24,5±6,8abc |
69,2±6,3 |
0,6±0,24a |
|
|
Rhizobium sp. 7/1-1*** |
0 |
44,7±13,4 |
15,2±4,0cd |
59,8±12,3 |
н/о |
|
|
M. norvegicum 20/1-4** |
4,0±1,4a |
41,0±4,0 |
16,7±3,9bcd |
57,7±8,2 |
0,6±0,18a |
|
|
Без инокуляции |
As 0 |
tragalus 51,2±2,2ab |
frigidus ( n 14,2±4,9c |
= 5) 65,4±5,8b |
c |
0 |
|
Rhizobium sp. 19-1/1* |
0 |
41,0±7,4bc |
21,8±4,9bc |
62,8±8,0b |
c |
н/о |
|
Rhizobium sp. 33-1/1* |
0 |
26,0±8,9e |
36,0±15,2a |
62,0±21,7bc |
н/о |
|
|
Rhizobium sp. 20-1/1* |
0 |
54,6±7,1a |
33,2±9,3ab |
87,8±4,4a |
н/о |
|
|
Mesorhizobium sp. 32-2/1* |
0 |
42,0±8,4bc |
28,0±8,4ab |
70,0±15,8b |
н/о |
|
|
R. giardinii 20/1-1** |
0 |
24,0±5,5e |
22,2±7,4bc |
46,2±10,6 |
c |
н/о |
|
Mesorhizobium sp. 9-4/1*** |
1,8±0,4a |
30,0±10,0de |
23,0±6,7bc |
53,0±13,0bc |
0,1±0,02b |
|
|
Mesorhizobium sp. 25-2/1*** |
1,8±0,4a |
30,0±7,1de |
22,0±4,5bc |
52,0±4,5b |
c |
0,2±0,02a |
|
Rhizobium sp. 7/1-1*** |
0 |
20,0±7,1e |
26,0±5,5abc |
46,0±5,5c |
н/о |
|
|
M. norvegicum 20/1-4** |
0,8±0,4b |
38,0±10,4cd |
23,0±9,7bc |
61,0±18,8bc |
0 |
|
Пр и м еч ани е. н/о — не определялось; * — штаммы, ранее изученные на способность формировать азотфиксирующие клубеньки на кормовых бобовых растениях V. cracca , V. sativa , L. sativus и L. pratensis (22); ** — штаммы, ранее выделенные из клубеньков арктического дикорастущего бобового H. arcticum (42); *** — штаммы, полученные в настоящей работе.
a, b, c, d, e Разными латинскими буквами отмечены варианты, различия между которыми статистически значимы (критерий Дункана, p < 0,05). В вариантах без буквенного ранжирования статистически значимых групповых различий (р > 0,05) выявлено не было и тест Дункана не проводился.
Пр и м еч ани е. н/о — не определялось.
— штаммы, ранее изученные на способность формировать азотфиксирующие клубеньки на кормовых бобовых растениях V. cracca, V. sativa, L. sativus и L. pratensis (22); ** — штаммы, ранее выделенные из клубеньков арктического дикорастущего бобового H. arcticum (42); *** — штаммы, полученные в настоящей работе.
-
a, b, c, d, e Разными латинскими буквами отмечены варианты, различия между которыми статистически значимы (критерий Дункана, p < 0,05). В вариантах без буквенного ранжирования статистически значимых групповых различий (р > 0,05) выявлено не было и тест Дункана не проводился.
Ранее штаммы Rhizobium sp. 19-1/1 и 33-1/1, Rhizobium sp. 20-1/1 и Mesorhizobium sp. 32-2/1, R. giardinii 20/1-1 и M. norvegicum 20/1-4 были выделены соответственно из клубеньков арктических дикорастущих бобовых чины болотной ( L. palustris ), вики мышиной ( V. cracca ) и копеечника арктического ( H. arcticum ), собранных в дельте р. Лены и окрестностях п. Тикси в Арктической зоне Якутии (27, 42). У штаммов Mesorhizobium sp. 32-2/1 и Rhizobium sp . 19-1/1, 20-1/1 и 33-1/1 обнаружена способность формировать преимущественно неазотфиксирующие клубеньки на корнях сельскохозяйственных бобовых V. cracca , V. sativa , L. sativus и L. pratensis (27). Для двух штаммов R. giardinii 20/1-1 и M. norvegicum 20/1-4 была установлена видовая принадлежность на основе молекулярно-филогенетических методов (42).
Мы показали, что на растениях O. adamsiana клубеньки (рис. 2, в, г) эффективные образовывались в трех вариантах инокуляции штаммами Meso-rhizobium sp. 9-4/1, 25-2/1 и M. norvegicum 20/1-4. Несмотря на одинаковую азотфиксирующую активность, число клубеньков в вариантах варьировалось. Средние значения массы побегов и общей сырой массы растений в большинстве вариантов инокуляции были выше по сравнению с вариантом без инокуляции, однако статистически значимых групповых различий между вариантами не наблюдалось (см. табл. 2). Следует отметить, что штаммы Mesorhizobium sp. 9-4/1, 25-2/1 и M. norvegicum 20/1-4 были выделены соответственно из клубеньков O. taimyrensis , A. frigidus и H. arcticum , что указывает на широкую специфичность растений O. adamsiana и, предположительно, позволяет этому виду лучше адаптироваться к различным почвенноклиматическим условиям Арктики. Интересно, что наиболее высокие симбиотические параметры (общая сырая биомасса, масса побегов и корней) были отмечены в варианте инокуляции штаммом Rhizobium sp. 33-1/1, хотя клубеньков на O. adamsiana он не образовывал. Для объяснения этого эффекта необходимо изучить способность штамма Rhizobium sp. 33-1/1 к продукции фитогормонов ауксинов и цитокининов, влияющих на восприимчивость корневой системы растений.
На A. frigidus клубеньки (см. рис. 2, а, б) образовывались в трех вариантах инокуляции штаммами M. norvegicum 20/1-4, Mesorhizobium sp. 252/1 и 9-4/1, тогда как эффективный симбиоз был отмечен только в двух последних случаях (см. табл. 2). В большинстве вариантов средние значения массы побега были достоверно (p < 0,05) ниже по сравнению с контролем без инокуляции. Однако в вариантах с Rhizobium sp. 20-1/1, 33-1/1 и Meso-rhizobium sp. 32-2/1 средние значения массы корня оказались выше (p < 0,05) по сравнению с неинокулированным контролем. В случае со штаммом Rhi-zobium sp. 20-1/1 и средние значения общей массы растения также были достоверно (p < 0,05) выше по сравнению с другими вариантами инокуляции.
На T. repens неэффективные клубеньки (рис. 3, в, г) образовывались в четырех вариантах инокуляции штаммами Mesorhizobium sp. 32-2/1, Rhizobium sp. 19-1/1, 33-1/1 и 20-1/1 (см. табл. 3). В вариантах инокуляции Mesorhizobium sp. 32-2/1 и Rhizobium sp. 20-1/1 среднее количество клубеньков было достоверно (p < 0,05) меньше по сравнению с коммерческим штаммом R. leguminosarum RCAM1365. Отметим, что в варианте инокуляции Rhizobium sp. 7/1-1 среднее значение массы корня было достоверно выше, тогда как среднее значение общей биомассы растения оказалось недостоверно выше в сравнении с положительным контролем. В варианте со штаммом Mesorhizobium sp. 25-2/1 также показано, что среднее значение массы побега выше по сравнению с вариантом инокуляции с R. leguminosarum RCAM1365 (p < 0,05).
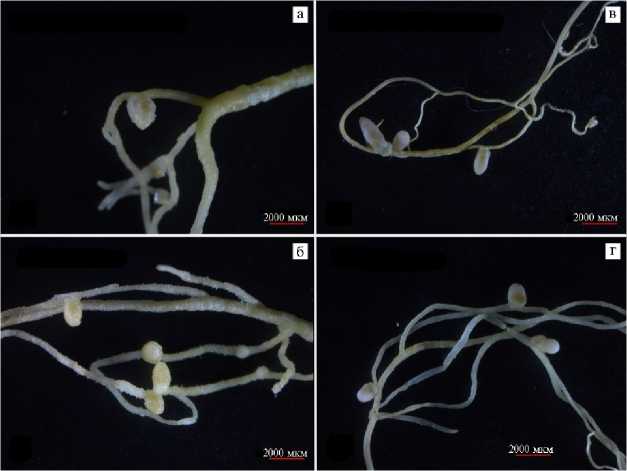
Рис. 2. Клубеньки на корнях Astragalus frigidus (L.) A.Gray (а, б) и Oxytropis adamsiana (Trautv.) Jurtzev (в, г) , полученные при инокуляции растений штаммами Mesorhizobium sp. 9-4/1 (б, г) и 25-2/1 (а, в) (микровегетационный опыт) .
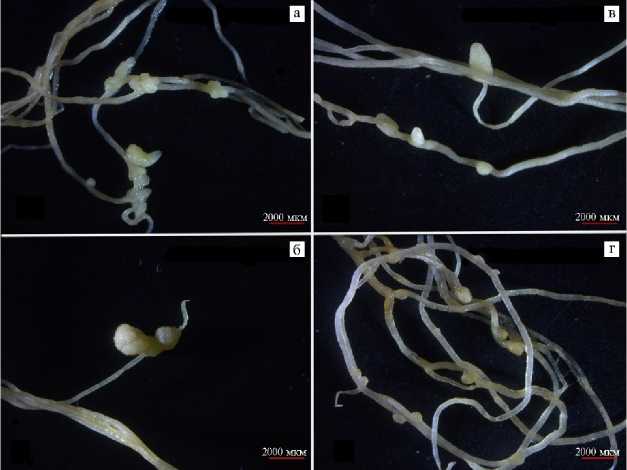
Рис. 3. Клубеньки и клубенькоподобные формирования на корнях Medicago sativa L. (а, б) и Trifolium repens L. (в, г) , полученные при инокуляции растений штаммами Rhizobium sp. 20-1/1 (а) , 19-1/1 (в) , и 33-1/1 (б, г) (микровегетационный опыт) .
На M. sativa неэффективные клубеньки формировались в пяти вариантах инокуляции штаммами Mesorhizobium sp. 25-2/1, Rhizobium sp. 19-1/1, 33-1/1, 20-1/1 и 7/1-1. Помимо типичных клубеньков, в некоторых вариантах инокуляции на корнях M. sativa формировались клубенькоподобные образования (см. рис. 3, а, б). В варианте инокуляции штаммом Rhizobium sp. 19-1/1 среднее значение массы корня и общей биомассы было выше в сравнении с остальными вариантами и коммерческим штаммом S. meliloti RCAM1750, однако статистически значимых различий между ними не наблюдалось. При инокуляции штаммом R. giardinii 20/1-1 отмечали пони- женные значения всех симбиотических параметров в сравнении с S. meliloti RCAM1750, однако достоверные (p < 0,05) отличия были зафиксированы только для средних значений массы побега.
Ранее в работе А.Е. Крисс и соавт. из клубеньков дикорастущих бобовых Oxytropis nigrescens (Pall.) Fisch., O. maydelliana Trautv., Astragalus alpinus L., A. umbellatus Bunge и Hedysarum obscurum L., произрастающих в тундре Чукотского полуострова, о-ва Колючин и Врангеля, было изолировано 8 бактериальных штаммов, не способных в вегетационных опытах образовывать клубеньки на корнях кормовых бобовых растений клевера, донника, люцерны, гороха и вики. Однако наблюдалась способность некоторых штаммов образовывать клубеньки на дикорастущих бобовых H. alpinum L., H. sibiricum Poir. и A. trautvetteri Bunge., при этом азотфиксирующая активность клубеньков не изучалась (43). В корневых клубеньках дикорастущих популяций бобовых растений Lathyrus pratensis L., Vicia cracca L., Trifolium repens L. и Astragalus schelichowii Turcz., собранных в окрестностях города Норильска, были обнаружены представители родов Rhizobium (сем. Rhizobi-aceae ), Bosea (сем. Boseaceae ) и Tardiphaga (сем. Bradyrhizobiaceae ), однако изучение симбиотических параметров (общая сырая биомасса растений, уровень азотфиксирующей активности и т.д.) бобово-ризобиального симбиоза не проводилось (40).
В работах D. Prevost с соавт. (44, 45) была продемонстрирована способность штаммов, выделенных из клубеньков арктических видов бобовых Astragalus и Oxytropis , произрастающих в Канаде, эффективно нодулировать кормовое бобовое растение эспарцет виколистный ( Onobrychis viciifolia ), произрастающий в умеренных широтах. Показано, что арктические ризобии были более эффективны, чем ризобии (коммерческие штаммы) умеренных широт, в улучшении роста и продуктивности эспарцета в условиях низкотемпературных лабораторных и полевых опытов. По мнению некоторых авторов (46, 47), АТФаза, транспортирующая β-глюкан, который участвует в прикреплении бактериальных клеток к корням растений для инициирования симбиотического взаимодействия, может играть решающую роль в инициировании симбиоза при низких температурах. Повышенный уровень синтеза белков холодового шока у арктических ризобий также может быть одной из причин их адаптации к экстремальным условиям Севера (47). Изучение эффективности симбиоза бобовых с арктическими ризобиями позволяет отбирать наиболее эффективные азотфиксирующие штаммы, адаптированные к местным экстремальным почвенно-климатическим условиям, а также использовать их в качестве основы для селекции и направленного генетического конструирования штаммов, перспективных для внедрения в сельскохозяйственную практику на Крайнем Севере (27).
Таким образом, из клубеньков арктических дикорастущих бобовых растений Oxytropis taimyrensis, Astragalus frigidus и Astragalus tugarinovii было выделено 13 изолятов, относящихся к родам Rhizobium, Mesorhizobium, Bosea и Tardiphaga из порядка Hyphomicrobiales (α-Proteobacteria). Штаммы Rhizo-bium sp. 7/1-1, Tardiphaga robiniae 7/2-2 и 7/4-2 были выделены из A. tuga-rinovii, штаммы Mesorhizobium sp. 25-2/1, 25А/5-1, Bosea sp. 25А/1-3, B. lathyri 25А/2-1, B. psychrotolerans 25А/2-2 и 25А/4-1 — из A. frigidus, тогда как штаммы Mesorhizobium sp. 9-4/1, T. robiniae 9/1-5, 9/3-1 и 9/5-1 — из клубеньков O. taimyrensis. В результате постановки микровегетационного опыта с участием дикорастущих арктических (Oxytropis adamsiana и Astragalus frigidus) и сельскохозяйственных кормовых (Trifolium repens и Medicago sativa) бобовых растений штамм R. giardinii 20/1-1 был единственным, не сформировавшим клубеньки ни в одном из вариантов инокуляции. В целом в отношении местных арктических видов O. adamsiana и A. frigidus были более активны штаммы, выделенные из местных же видов бобовых (O. taimyrensis, A. frigidus, H. arcticum), в то время как культурные растения M. sativa и T. repens оказались более отзывчивы на инокуляцию штаммами Rhizobium sp. 191/1 и 33-1/1, Rhizobium sp. 20-1/1 и Mesorhizobium sp. 32-2/1, выделенными соответственно из заносных бореальных растений L. palustris и V. cracca. Наблюдаемый симбиоз во всех случаях инокуляции характеризовался относительно низкой азотфиксирующей активностью и не приводил к статистически значимому увеличению массы побегов и общей массы растений, хотя прибавка в ряде случаев достигала 34-36 % относительно неинокулирован-ного контроля. Однако необходимо отметить существенный позитивный эффект в отношении массы корней, выявленный у ряда штаммов (M. nor-vegicum 20/1-4, Mesorhizobium sp. 9-4/1, 25-2/1 и 32-2/1, Rhizobium sp. 7/1-1 и 20-1/1, 33-1/1), которые не образуют симбиоз в отдельных вариантах или формируют неактивные клубеньки. Для понимания механизма этого эффекта необходимо секвенирование полногеномных последовательностей штаммов, а также поиск и функциональное изучение соответствующих рост-стимулирующих генов синтеза ауксинов, гиббереллинов и цитокининов. Следует отметить, что способность распространенного на Таймыре и в Якутии вида O. adamsiana формировать эффективный симбиоз с тремя арктическими ризобиальными штаммами позволяет рассматривать его в качестве перспективного компонента при создании высокопродуктивных бобово-злаковых агрофитоценозов в различных почвенно-климатических условиях Арктики.
Выражаем благодарность руководству и координаторам экспедиции «Лена 2021» за организацию и проведение экспедиции в район дельты реки Лены. Искренне благодарим Сергея Александровича Правкина (ААНИИ) за помощь в сборе и транспортировке семян бобовых культур. Выражаем благодарность коллективу научно-исследовательской станции «Остров Самойловской» и лично Федору Виссанионовичу Селяхову за предоставленный транспорт.
Список литературы Генетическое разнообразие и симбиотическая эффективность клубеньковых микросимбионтов остролодочника таймырского (Oxytropis taimyrensis (Jurtz.) A. et D. Love), астрагала холодного (Astragalus frigidus (L.) A.Gray) и астрагала Тугаринова (Astragalus tugarinovii Basil.) из Арктической Якутии
- Unc A., Altdorff D., Abakumov E., Adl S., Baldursson S., Bechtold M., Cattani D., Firbank L., Grand S., Gudjonsdottir M., Kallenbach C., Kedir A., Li P., McKenzie D., Misra D., Na-gano H., Neher D., Niemi J., Oelbermann M., Borchard N. Expansion of agriculture in northern cold-climate regions: a cross-sectoral perspective on opportunities and challenges. Frontiers in Sustainable Food Systems, 2021, 5: 663448 (doi: 10.3389/fsufs.2021.663448).
- Найденов Н.Д. Сельское хозяйство Арктики: диалектика культуры и экономики (на примере городов Воркуты, Норильска и Якутска). Научный вестник Ямало-Ненецкого автономного округа, 2020, 3(108): 12-17.
- Суровцев В.Н. Развитие молочного скотоводства в Арктической зоне республик Карелия и Коми, Архангельской области: возможности и формы поддержки. Арктика: экология и экономика, 2023, 13(1): 149-157 (doi: 10.25283/2223-4594-2023-1-149-157).
- Хантимер И.С. Сельскохозяйственное освоение тундры. Л., 1974.
- Камелин Р.В. Флора Земли: флористическое районирование суши. СПб, Барнаул, 2017.
- Rhodes I., Collins R.P., Evans D.R. Breeding white clover for tolerance to low temperature and grazing stress. Euphytica, 1994, 77: 239-242 (doi: 10.1007/BF02262636).
- Румянцева М.Л., Владимирова М.Е., Мунтян В.С., Степанова Г.В., Саксаганская А.С., Кожемяков А.П., Орлова А.Г., Becker A., Симаров Б.В. Высокоэффективные штаммы клубеньковых бактерий Люцерны (Medicago varia L.): молекулярно-генетическая характеристика и использование в сопряженной селекции. Сельскохозяйственная биология, 2019, 54(6): 1306-1323 (doi: 10.15389/agrobiology.2019.6.1306rus).
- Кормовые растения сенокосов и пастбищ СССР. Т. 2. Двудольные (Хлорантовые – Бобовые) /Под ред. И.В. Ларина. Л., 1951.
- Розенфельд С.Б. Питание казарок и гусей в Российской Арктике. М., 2009.
- Секретарева Н.А. Сосудистые растения Российской Арктики и сопредельных территорий. М., 2004.
- Малышев Л.И. Разнообразие рода Остролодка (Oxytropis) в Азиатской России. Turczaninowia, 2008, 11(3): 5-141.
- Холина А.Б., Артюкова Е.В., Якубов В.В., Хорева М.Г., Мочалова О.А., Санданов Д.В., Селютина И.Ю. Генетическая дивергенция близкородственных видов Oxytropis strobilacea, Oxytropis adamsiana, Oxytropis vassilczenkoi ряда Strobilacei секции Orobia (Fabaceae) Азиатской России. Известия Российской академии наук. Серия биологическая, 2023, 1: 11-21 (doi: 10.31857/S1026347023010067).
- Спиридонов А.М. Многолетние бобовые травы в земледелии и кормопроизводстве Северо-Запада РФ: монография. М., Берлин, 2021 (doi: 10.23681/618741).
- Экологические основы управления продуктивностью агрофитоценозов восточноевропейской тундры /Под ред. И.Б. Арчеговой, М.В. Гецен. Л., 1991.
- Котелина Н.С., Арчегова И.Б., Романов Г.Г., Турубанова Л.П. Особенности природопользования и перспективы природовосстановления на Крайнем Севере России. Екатеринбург, 1998.
- Beermann F., Teltewskoi A., Fiencke C., Pfeiffer E.-M., Kutzbach L. Stoichiometric analysis of nutrient availability (N, P, K) within soils of polygonal tundra. Biogeochemistry, 2015, 122: 211-227 (doi: 10.1007/s10533-014-0037-4).
- Проворов Н.А., Воробьев Н.И. Генетические основы эволюции растительно-микробного симбиоза /Под ред. И.А. Тихоновича. СПб, 2012.
- Efrose R.C., Rosu C.M., Stedel C., Stefan A., Sirbu C., Gorgan L.D., Labrou N.E., Flemetakis E. Molecular diversity and phylogeny of indigenous Rhizobium leguminosarum strains associated with Trifolium repens plants in Romania. Antonie van Leeuwenhoek, 2018, 111: 135-153 (doi: 10.1007/s10482-017-0934-3).
- Youseif S.H., El-Megeed F.H.A., Mohamed A.H, Ageez A., Veliz E., Martínez-Romero E. Diverse Rhizobium strains isolated from root nodules of Trifolium alexandrinum in Egypt and symbiovars. Systematic and Applied Microbiology, 2021, 44(1): 126-156 (doi: 10.1016/j.syapm.2020.126156).
- Kang W., Xu L., Jiang Z., Shi S. Genetic diversity and symbiotic efficiency difference of endo-phytic rhizobia of Medicago sativa. Canadian Journal of Microbiology, 2019, 65(1): 68-83 (doi: 10.1139/cjm-2018-0158).
- Laguerre G., van Berkum P., Amarger N., Prevost D. Genetic diversity of rhizobial symbionts isolated from legume species within the genera Astragalus, Oxytropis, and Onobrychis. Applied and Environmental Microbiology, 1997, 63(12): 4748-4758 (doi: 10.1128/aem.63.12.4748-4758.1997).
- Ampomah O.Y., Mousavi S.A., Lindstrom K., Huss-Danell K. Diverse Mesorhizobium bacteria nodulate native Astragalus and Oxytropis in arctic and subarctic areas in Eurasia. Systematic and applied microbiology, 2017, 40(1): 51-58 (doi: 10.1016/j.syapm.2016.11.004).
- Wdowiak S., Małek W. Numerical analysis of Astragalus cicer microsymbionts. Current Microbi-ology, 2000, 41: 142-148 (doi: 10.1007/s002840010108).
- Kuznetsova I.G., Sazanova A.L., Safronova V.I., Pinaev A.G., Verkhozina A.V., Tikho-mirova N.Y., Osledkin Y.S., Belimov A.A. Genetic diversity among microsymbionts of Lathyrus, Vicia, Oxytropis and Astragalus legume species from Baikal region. Agricultural Вiology, 2015, 50(3): 345-352 (doi: 10.15389/agrobiology.2015.3.345eng).
- Safronova V.I., Guro P.V., Sazanova A.L., Kuznetsova I.G., Belimov A.A., Yakubov V.V., Chi-rak E.R., Afonin A.М., Gogolev Y.V., Andronov E.E., Tikhonovich I.A. Rhizobial microsymbi-onts of Kamchatka Oxytropis species possess genes of the Type III and VI secretion systems, which can affect the development of symbiosis. Molecular Plant-Microbe Interactions, 2020, 33(10): 1232-1241 (doi: 10.1094/MPMI-05-20-0114-R).
- Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study. Journal of Bacteriology, 1991, 173(2): 697-703 (doi: 10.1128/jb.173.2.697-703.1991).
- Карлов Д.C., Гуро П.В., Сазанова А.Л., Кузнецова И.Г., Н.Ю. Тихомирова, Лащин-ский Н.Н., Павлов И.С., Белимов А.А., Сафронова В.И. Генетическое разнообразие и симбиотическая эффективность микросимбионтов чины болотной (Lathyrus palustris L.) и горошка мышиного (Vicia cracca L.), произрастающих в Арктической Якутии. Сельскохо-зяйственная биология, 2023, 58(3): 403-415 (doi: 10.15389/agrobiology.2023.3.403rus).
- Большиянов Д.Ю., Савельева Л.А., Пестрякова Л.А., Вахрамеева П.С., Баранская А.В. Методика извлечения палеогеографической информации из донных отложений арктического озера Севастьян-Кюеле. Известия Русского географического общества, 2013, 145(2): 49-65.
- Иванова Е.И. К изученности флоры мхов острова Тит-Ары (низовье р. Лены). Вестник СВФУ, 2012, 9(3): 52-57.
- Исаев А.П., Габышева Л.П., Михалева Л.Г., Соломонов Н.Г. Растительные сообщества острова Тит-ары (Восточная Сибирь). Современные проблемы науки и образования, 2016, 6: 527.
- Martínez-Hidalgo P., Ramírez-Bahena M.H., Flores-Félix J.D., Rivas R., Igual J.M., Mateos P.F., Martínez-Molina E., León-Barrios M., Peix Á., Velázquez E. Revision of the taxonomic status of type strains of Mesorhizobium loti and reclassification of strain USDA 3471T as the type strain of Mesorhizobium erdmanii sp. nov. and ATCC 33669T as the type strain of Mesorhizobium jarvisii sp. nov. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(Pt6): 1703-1708 (doi: 10.1099/ijs.0.000164).
- De Meyer S.E., Andrews M., James E.K., Willems A. Mesorhizobium carmichaelinearum sp. nov., isolated from Carmichaelineae spp. root nodules. International Journal of Systematic and Evolu-tionary Microbiology, 2019, 69(1): 146-152 (doi: 10.1099/ijsem.0.003120).
- Lu Y.L., Chen W.F., Wang E.T., Han L.L., Zhang X.X., Chen W.X., Han S.Z. Mesorhizobium shangrilense sp. nov., isolated from root nodules of Caragana species. International Journal of Sys-tematic and Evolutionary Microbiology, 2009, 59(12): 3012-3018 (doi: 10.1099/ijs.0.007393-0).
- Zheng W.T., Li Y. Jr., Wang R., Sui X.H., Zhang X.X., Zhang J.J., Wang E.T., Chen W.X. Mesorhizobium qingshengii sp. nov., isolated from effective nodules of Astragalus sinicus. Interna-tional Journal of Systematic and Evolutionary Microbiology, 2013, 63(6): 2002-2007 (doi: 10.1099/ijs.0.044362-0).
- De Meyer S.E., Willems A. Multilocus sequence analysis of Bosea species and description of Bosea lupini sp. nov., Bosea lathyri sp. nov. and Bosea robiniae sp. nov., isolated from legumes. In-ternational Journal of Systematic and Evolutionary Microbiology, 2012, 62(10): 2505-2510 (doi: 10.1099/ijs.0.035477-0).
- Albert R.A., McGuine M., Pavlons S.C., Roecker J., Bruess, J., Mossman S., Sun S., King M., Hong S., Farrance C.E., Danner J., Joung Y., Shapiro N., Whitman W.B., Busse H.J. Bosea psychrotolerans sp. nov., a psychrotrophic alphaproteobacterium isolated from Lake Michigan wa-ter. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(5): 1376-1383 (doi: 10.1099/ijsem.0.003319).
- Safronova V.I., Kuznetsova I. G., Sazanova A.L., Kimeklis A.K., Belimov A.A., Andronov E.E., Pinaev A.G., Chizhevskaya E.P., Pukhaev A.R., Popov K.P., Willems A., Tikhonovich I.A. Bosea vaviloviae sp. nov. a new species of slow-growing rhizobia isolated from nodules of the relict species Vavilovia formosa (Stev.) Fed. Antonie Van Leeuwenhoek, 2015, 107(4): 911-920 (doi: 10.1007/s10482-015-0383-9).
- Pulido-Suárez L., Flores-Félix J.D., Socas-Pérez N., Igual J.M., Velázquez E., Péix Á., León-Barrios M. Endophytic Bosea spartocytisi sp. nov. coexists with rhizobia in root nodules of Spar-tocytisus supranubius growing in soils of Teide National Park (Canary Islands). Systematic and Applied Microbiology, 2022, 45(6): 126374 (doi: 10.1016/j.syapm.2022.126374).
- Sazanova A.L., Safronova V.I., Kuznetsova I.G., Karlov D.S., Belimov A.A., Andronov E.E., Chirak E.R., Popova J.P., Verkhozina A.V., Willems A., Tikhonovich I.A. Bosea caraganae sp. nov., a new species of slow-growing bacteria isolated from root nodules of the relict species Caragana jubata (Pall.) Poir. originating from Mongolia. International Journal of Systematic and Evolutionary Microbiology, 2019, 69(9): 2687-2695 (doi: 10.1099/ijsem.0.003509).
- Kuznetsova I.G., Karlov D.S., Sazanova A.L., Guro P.V., Alekhina I. A., Tikhomirova N.Yu., Pospelov I. N., Pospelova E.B., Belimov A.A., Safronova V.I. Genetic diversity of microsymbionts of legumes Lathyrus pratensis L., Vicia cracca L., Trifolium repens L., and Astragalus schelichowii Turcz. growing near Norilsk in Arctic Russia. Russian Journal of Plant Physiology, 2023, 70(8): 187 (doi: 10.1134/S1021443723602161).
- De Meyer S.E., Coorevits A., Willems A. Tardiphaga robiniae gen. nov., sp. nov., a new genus in the family Bradyrhizobiaceae isolated from Robinia pseudoacacia in Flanders (Belgium). Systematic and Applied Microbiology, 2012, 35(4): 205-214 (doi: 10.1016/j.syapm.2012.02.002).
- Karlov D.S., Guro P.V., Kuznetsova I.G., Sazanova A.L., Alekhina I.A., Tikho-mirova N.Yu., Lashchinsky N.N., Belimov A.A., Safronova V.I. Genetic identification of micro-symbionts of the legume Hedysarum arcticum B. Fedtsch, growing on Samoylov Island in the Lena River Delta (Arctic Zone of Yakutia), Russia. Microbiology, 2024, 93: 380-384 (doi: 10.1134/S0026261723604220).
- Крисс А.Е., Кореняко А.И., Мигулина В.М. Клубеньковые бактерии в Арктике. Микро-биология, 1941, 10(1): 61-71.
- Prévost D., Bromfield E.S.P. Effect of low root temperature on symbiotic nitrogen fixation and competitive nodulation of Onobrychis viciifolia (sainfoin) by strains of arctic and temperate rhi-zobia. Biol. Fertil. Soils, 1991, 12(3): 161-164.
- Prévost D., Drouin P., Laberge S., Bertrand A., Cloutier J., Lévesque G. Cold-adapted rhizobia for nitrogen fixation in temperate regions. Canadian Journal of Botany, 2003, 81(12): 1153-1161 (doi: 10.1139/b03-113).
- Gage D.J. Infection and invasion of roots by symbiotic, nitrogen-fixing Rhizobia during nodula-tion of temperate legumes. Microbiology and Molecular Biology Reviews, 2004, 68(2): 280-300 (doi: 10.1128/MMBR.68.2.280-300.2004).
- Ghobakhlou A.F., Johnston A., Harris L. Antoun H., Laberge S. Microarray transcriptional pro-filing of Arctic Mesorhizobium strain N33 at low temperature provides insights into cold adaption strategies. BMC Genomics, 2015, 16: 383 (doi: 10.1186/s12864-015-1611-4).


