Генетическое разнообразие микросимбионтов байкальских видов чины ( Lathyrus), горошка ( Vicia), остролодочника ( Oxytropis) и астрагала ( Astragalus)
Автор: Кузнецова И.Г., Сазанова А.Л., Сафронова В.И., Пинаев А.Г., Верхозина А.В., Тихомирова Н.Ю., Оследкин Ю.С., Белимов А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Разнообразие и эволюция микробно-растительных систем
Статья в выпуске: 3 т.50, 2015 года.
Бесплатный доступ
Клубеньковые бактерии (ризобии) - грамотрицательные почвенные микроорганизмы, вступающие во внутриклеточный симбиоз с бобовыми растениями и обеспечивающие фиксацию атмосферного азота. Для понимания эволюции специфических растительно-микробных взаимодействий особое значение имеют симбиотические системы с участием эндемичных или реликтовых видов. Цель нашей работы состояла в создании представительной коллекции штаммов-микросимбионтов эндемичных бобовых растений Байкальского региона, а также в оценке их биоразнообразия. Мы изучили таксономическое положение 69 штаммов, выделенных из корневых клубеньков чины низкой ( Lathyrus humilis ), горошка байкальского ( Vicia baicalensis ), астрагала монгольского ( Astragalus mongholicus ) и остролодочника лесного ( Oxytropis sylvatica ). Для первичной оценки внутривидового разнообразия штаммов проводили RFLP-анализ последовательности между генами 16S- и 23S-рРНК (ITS-региона). По его результатам исследуемые изоляты были разделены на 33 группы с идентичным набором фрагментов ДНК. Видовую принадлежность штаммов определяли методом секвенирования гена 16S-рРНК ( rrs ). Анализ его последовательности показал, что 23 штамма принадлежали к родам Rhizobium и Mesorhizobium и формировали 3 статистически достоверно различающихся кластера с уровнем поддержки более 95 %. Для уточнения таксономического положения клубеньковых бактерий рода Bosea использовали метод секвенирования более вариабельного ITS-региона. Филогенетический анализ показал значительное генетическое разнообразие микросимбионтов изученных растений. Ризобиальные изоляты принадлежали к 5 родам: Rhizobium (сем. Rhizobiaceae ), Mesorhizobium и Phyllobacterium (сем. Phyllobacteriaceae ), Bosea и Tardiphaga (сем. Bradyrhizobiaceae ). Кроме этого, были получены изоляты, не относящиеся к клубеньковым бактериям и принадлежащие родам Herbiconiux, Leifsonia, Burkholderia и Stenotrophomonas. Известно, что некоторые виды этих родов могут присутствовать в клубеньках бобовых растений, а также быть обитателями ризосферы и филосферы различных представителей флоры. Присутствие нетипичных ризобиальных микросимбионтов в клубеньках изученных растений может свидетельствовать об активно происходящих процессах формирования взаимоотношений между партнерами в бобово-ризобиальных системах Байкальского региона.
Бобовые растения байкальского региона, таксономия ризобий, секвенирование генов рибосомальных рнк
Короткий адрес: https://sciup.org/142133596
IDR: 142133596 | УДК: 631.461.51:577.2 | DOI: 10.15389/agrobiology.2015.3.345rus
Текст научной статьи Генетическое разнообразие микросимбионтов байкальских видов чины ( Lathyrus), горошка ( Vicia), остролодочника ( Oxytropis) и астрагала ( Astragalus)
Клубеньковые бактерии (ризобии) — обширная генетически разнородная группа почвенных грамотрицательных микроорганизмов, способных вступать во внутриклеточный симбиоз с бобовыми растениями и обеспечивать фиксацию атмосферного азота. Одна из актуальных задач современной биотехнологии — изучение механизмов взаимодействия бобовых растений с ризобиями, что необходимо для проведения научно обоснованной селекции высокоэффективных растительно-микробных систем (1).
Для понимания эволюции специфических растительно-микробных взаимодействий особое значение имеют симбиотические системы с участием эндемичных или реликтовых бобовых растений, служащих промежуточным звеном между исчезнувшими и современными видами. К таким уникальным объектам относятся бобовые растения Байкальского региона: чина низкая ( Lathyrus humilis ) — позднеплейстоценовый реликт южноси-бирско-североуральского ареала (2); астрагал монгольский ( Astragalus mongholicus ) — редкое лекарственное растение (3, 4); эндемики Забайка-
Секвенирование гена rrs микросимбионтов Vicia baicalensis было выполнено при финансовой поддержке Российского научного фонда (Соглашение ¹ 14-26-00094).
лья горошек байкальский ( Vicia baicalensis ) и остролодочник лесной ( Oxy-tropis sylvatica ) (5) .
Немногочисленные данные по микросимбионтам рода Astragalus свидетельствуют о большом разнообразии этих микроорганизмов, которые принадлежат к различным родам порядка Rhizobiales : Rhizobium , Sinorhizobium , Bradyrhizobium и Mesorhizobium (6-9). Виды чины и горошка нодулируются бактериями Rhizobium leguminosarum bv. viciae (10-12), среди микросимбионтов остролодочника описаны ризобиальные и мезо-ризобиальные штаммы (7, 13). Однако микросимбионты байкальских представителей этих родов растений ранее изучены не были.
Цель нашей работы состояла в создании представительной коллекции штаммов-микросимбионтов эндемичных бобовых растений Забайкалья (чины низкой, астрагала монгольского, горошка байкальского и остролодочника лесного), а также в определении их таксономического положения с помощью метода секвенирования 16S-рДНК и ITS-региона.
Методика. Объектом исследования были 69 штаммов, изолированных согласно описанию (14) из корневых клубеньков чины низкой Lathy-rus humilis и горошка байкальского Vicia baicalensis (по две популяции), а также астрагала монгольского Astragalus mongholicus и остролодочника лесного Oxytropis sylvatica (по одной популяции), которые произрастали на побережье Чивыркуйского залива (Забайкалье). Штаммы выращивали на маннитно-дрожжевом агаре (YMA) при 28 ° С (7).
Для первичной оценки внутривидового разнообразия штаммов был проведен RFLP-анализ последовательности между генами 16S- и 23S-рРНК (ITS-региона). Амплифицированную ДНК обрабатывали рестриктазой MspI, после чего проводили электрофорез рестрицированных ДНК-фрагментов в стандартном режиме (15). Видовую принадлежность штаммов определяли методом секвенирования гена 16S-рРНК ( rrs ). Для уточнения таксономического положения клубеньковых бактерий рода Bosea использовали метод секвенирования более вариабельного ITS-региона.
Для амплификации 16S-рДНК (около 1500 bp) использовали праймеры fD1 (5´-AGAGTTTGATCCTGGCTCAG-3´) и rD1 (5´-AAGGAGGTG-ATCCAGCC-3´), для амплификации ITS-региона (800 bp) — праймеры FGPS1490-72 (5´-TGCGGCTGGATCCCCTCCTT-3´) и FGPL-132 (5´-CCGGGTTTCCCCATTCGG-3´). Полученный ПЦР-продукт очищали посредством выделения из геля (15) для последующего секвенирования.
Поиск гомологичных последовательностей проводили с помощью базы данных GenBank (программа BLAST). Конструирование филогенетического дерева осуществляли в программе MEGA v. 4.0.2 (метод NeighborJoining). Для сравнения пар последовательностей использовали число различающихся нуклеотидов.
Результаты. Штаммы, которые были исследованы в работе, представлены в таблице.
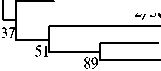
По скорости роста изоляты разделились на две группы: у 9 штаммов видимые колонии образовывались на 5-6-е сут роста на среде YMA, остальные штаммы образовывали колонии на 3-и-4-е сут. По результатам RFLP-анализа ITS-региона исследуемые изоляты были разделены на 33 группы с идентичным набором фрагментов ДНК. Один представитель из каждой группы был отобран для секвенирования гена rrs . Анализ его последовательности показал, что 23 штамма принадлежали к родам Rhizobium и Mesorhizobium и формировали 3 статистически достоверно различающихся кластера с уровнем поддержки более 95 % (рис. 1).
Таксономическая структура штаммов-микросимбионтов, выделенных из корневых клубеньков у эндемичных бобовых растений Байкальского региона (по результатам секвенирования rrs гена и ITS-региона)
|
Вид микросимбионта |
Номер штамма-микросимбионта бобовых растений |
|||
|
чины низкой Lathyrus humilis |
астрагала монгольского Astragalus mongholicus |
горошка байкальского Vicia baicalensis |
остролодочника лесного Oxytropis sylvatica |
|
|
Rhizobium sp. |
2/5(1), 2/12М |
– |
– |
– |
|
Rhizobium |
1/10К, 2/10К |
– |
11/2, 11/3К, 11/4М, |
12/13М, 12/16К |
|
leguminosarum bv. trifolii Mesorhizobium metallidurans |
– |
3/14С1, 3/14С2 |
11/7К, 11/12М, 11/19, 11/20, 11/21, 11/22, 11/23, 11/24К, 11/24М, 11/25, 11/33, 11/34К, 11/34М, 11/35, 11/36, 11/37К, 11/37М, 11/38, 11/39, 11/42К, 11/42М, 11/43К, 11/44К, 11/44М, 11/45К, 11/46, 11/47К, 11/47М, 11/48К, 11/48М, 13/3, 13/4, 13/6М, 13/7, 13/8К, 13/9М, 13/11 – |
– |
|
Mesorhizobium ciceri |
2/13К |
– |
– |
– |
|
Tardiphaga robiniae |
1/11М |
3/6М, |
– |
12/11(1) |
|
Bosea sp. |
– |
3/11С, 3/21(2) 3/5М, |
– |
12/22М |
|
Bosea vaviloviae |
– |
3/31К 3/25 |
– |
– |
|
Herbiconiux sp. |
1/3М, 1/5М, |
– |
– |
– |
|
Burkholderia sp. |
1/14М, 1/15М – |
3/8К |
13/5 |
– |
|
Leifsonia sp. Stenotrophomonas sp. |
– – |
3/23М, 3/27К 3/17 |
11/7М |
– – |
|
Phyllobacterium sp. – П р и м еч ани е. Прочерки означают отсутствие изолятов. |
13/12М |
– |
||
Кластер I включал 19 штаммов, изолированных из чины низкой, горошка байкальского и остролодочника лесного (соответственно 3, 14 и 2 штамма), а также два типовых штамма R. leguminosarum bv. trifolii ATCC14480Т и R. leguminosarum bv . viciae ATCC10004Т. На основании результатов секвенирования гена rrs (см. табл.) изоляты 1/10K, 2/10K, 11/3K, 11/4M, 11/7K, 11/12M, 11/21, 11/23, 11/24K, 11/34M, 11/37M, 12/13M, 12/16K, 13/3, 13/4, 13/6M, 13/7M, 13/8K были идентифицированы как R. leguminosarum bv. trifolii (степень сходства с типовым штаммом ATCC14480Т составляла 99,7-99,9 %).
Кластер II сформировали штамм 2/5(1), изолированный из чины низкой, и типовой штамм H152Т вида Rhizobium giardinii , который был описан для штаммов-микросимбионтов фасоли обыкновенной (16). Однако, поскольку сходство между этими штаммами по гену rrs составляло всего 99,0 %, штамм 2/5(1) был идентифицирован как Rhizobium sp . (см. табл.).
Три изолята были отнесены к роду Mesorhizobium (см. рис. 1, табл.). Штаммы 3/14С1 и 3/14С2 (кластер III), выделенные из астрагала монгольского, были идентифицированы как Mesorhizobium metallidurans и M. ciceri (гомология с типовыми штаммами STM2683Т и NBRC100389Т по гену rrs составила соответственно 100 и 99,6 %).
На рисунке 2 представлена rrs-филограмма, отражающая таксономическое положение 9 медленнорастущих ризобиальных изолятов в пределах семейства Bradyrhizobiaceae. Штаммы 1/11M, 3/6M, 3/11C, 3/21(2), 12/11(1), выделенные из разных растений, сформировали кластер IV с ти- повым штаммом Tardiphaga robiniae LMG26467Т и были отнесены к этому
2/10K
11/21
11/3K
Rhizobium leguminosarum bv trifolii ATCC14480T
11/37M
11/12M
13/7M
13/3
13/4
' 11/7K
11/34M
13/8K
13/6M
, 12/13M
12/16K
11/4M
11/23
' 11/24K
1/10K
1---2/12M
---Rhizobium leguminosarum bv viciae ATCC10004T
—Rhizobium leucaenae LMG9517T
I--- Rhizobium tropici CIAT899T 97 'Rhizobium freirei PRF81T
y~ Rhizobium leguminosarum bv phaseoli ATCC14482T
40 ’----- Rhizobium etli CFN42T
70 Ц 44*
-------Rhizobium mesoamericanum CCGE501T
-Rhizobium grahamii CCGE502T
Rhizobium alamii GBV016T
—Rhizobium sullae IS123T
_______I---- Rhizobium gallicum R602spT
99^--- Rhizobium mongolense USDA1844T
99 |---- Rhizobium giardinii H152T
।-------9/^(i)
-----Rhizobium selenitireducens BIT
Rhizobium vignae CCBAU05176T
-------------------Rhizobium undicola LMG11875T
56i Mesorhizobium ciceri NBRC100389T
37j 37J
.Ш
| 2/ 13K
-----Mesorhizobium australicum WSM2073T
—Mesorhizobium loti ATCC33669T
----------Mesorhizobium alhagi CCNWXJ12-2T
~Mesorhizobium opportunistum WSM2075T
•Mesorhizobium amorphae ACCC19665T
—Mesorhizobium huakuii IFO15243T
Mesorhizobium plurifarium LMG11892T гMesorhizobium mediterraneum LMG17148T *
Qd |3/14C1
I HI
\Mesorhizobium metallidurans STM2683T 89I3/14C2
0,005
Рис. 1. Rrs -филограмма, отражающая таксономическое положение изолятов родов Rhizo-bium и Mesorhizobium . Исследуемые штаммы обозначены жирным шрифтом. Литерой «Т» отмечены типовые штаммы; I-III — статистически достоверно различающиеся кластеры.
виду (уровень сходства по гену rrs 99,8-99,9 %). Кластер V с уровнем статистической поддержки 99,0 % был образован четырьмя штаммами 3/5M, 3/31К, 12/22М, 3/25 и двумя типовыми штаммами рода Bosea ( B. lathyri и B. vaviloviae ). Сходство изолятов с типовыми штаммами B. lathyri LMG26379Т и B. vaviloviae Vaf-18Т по гену rrs составило соответственно 98,4-99,4 и 99,4-100 %. Следует отметить, что вид B. vaviloviae был описан совсем недавно, в 2015 году, для трех штаммов-микросимбионтов реликтового бобового растения Vavilovia formosa , произрастающего в Северной Осетии (17). Поэтому байкальские изоляты, принадлежащие к роду Bosea и имеющие высокую степень сходства с видом B. vaviloviae , представляют большой интерес для дальнейшего изучения.
У штаммов 3/5M, 3/31К, 12/22М и 3/25 был проведен анализ по- следовательностей ITS-региона, поскольку этот метод обладает большей разрешающей способностью при идентификации близкородственных штаммов,
S3\Bradyrhizobium rifense CTAW71T V Bradyrhizobium cytisl CTAW11T
— Bradyrhizobium yuanmingense 100594T
Bradyrhizobium arachidis CCBAU051107T
\Bradyrhizobium huanghuaihaiense CCBAU23303T 64 'Bradyrhizobium iriomotense NBRC102520T
-Bradyrhizobium daqingense CCBAU15774T
Bradyrhizobium betae LMG21987T
Bradyrhizobium japonicum USDA6T
Bradyrhizobium canariense BTA-1T r— Nitrobacter vulgaris DSM10236T
^4 Nitrobacter alkalicus AN IT
69 * Nitrobacter winogradskyi Nb-255T -----Nitrobacter hamburgensis X14T
-Rhodopseudomonas rhenobacensts DSM12706T
Rhodopseudomonas palustris ATCC17001T
'■Rhodopseudomonas faecalis JCM11668T
-Metalliresistens boonkerdii 106595T
1/11M
12/11(1)
3/21(2)
' 3/11C
—Tardiphaga robiniae LMG26467
3/6M
> IV
[ Bradyrhizobium retamae LMG 27393T
^Bradyrhizobium lablabi CCBAU23086T ^ABradyrhizobium pachyrhizi PAC48T 45— Bradyrhizobium jicamae PAC68T
Bosea lathy ri LMG26379T
3/5M
12/22
3/31
3/25
Bosea vaviloviae Vaf-18T
951 Bosea minatitlanensis AMX5 IT Г* Bosea robiniae LMG26381T
'—Bosea thiooxidans DSM9653T 8^ Bosea massiliensis 63287T
J* Bosea lupini LMG26383T
59[1^об’ей eneae 34614T
9У Bosea vestrisii 34635T
0,01 1
Рис. 2. Rrs- филограмма, отражающая таксономическое положение изолятов в пределах семейства Bradyrhizobiaceae . Исследуемые штаммы обозначены жирным шрифтом. Литерой «Т» отмечены типовые штаммы; IV, V — статистически достоверно различающиеся кластеры.
чем секвенирование rrs гена (9). Дендрограмма, представленная на рисунке 3, демонстрирует корреляцию между результатами секвенирования гена rrs и ITS-региона. Все изоляты кластеризовались вместе с типовыми штаммами B. lathyri LMG26379Т и B. vaviloviae Vaf-18Т при уровне статистической поддержки 99,0 %. Однако максимальные уровни гомологии по ITS-региону между этими изолятами и типовым штаммам B. lathyri и B. vaviloviae были низкими — соответственно 84,9 и 89,4 %. Исключением стал изолят 3/25, сходство ITS-региона которого с типовым штаммом B. vaviloviae Vaf-18Т составило 97,8 %. На основании секвенирования гена rrs и последовательности ITS-региона он был отнесен к виду B. vaviloviae. Таксономическое положение остальных изолятов рода Bosea остается неясным, поскольку считается, что штаммы клубеньковых бактерий одного вида не могут иметь меньше 95 % гомологии по ITS-региону (9). Анализ последовательностей гена rrs у других байкальских изолятов показал их принадлежность к родам Herbiconiux (4 штамма), Leifsonia (2 штамма), Burkholderia (2 штамма), Stenotrophomonas (2 штамма) и Phyllobacterium (1 штамм). По данным литературы, представители этих родов могут присутствовать в клубеньках бобовых растений (18, 19), а также быть обитателями ризосферы и филосферы различных растений (20, 21).
■Bradyrhizobium daqingense CCBAU15774T
■Bradyrhizobium huanghuaihaiense CCBAU23303T
ЯЗ - Bradyrhizobium yuanmingense CCBAU1007 IT
'p - nruuyrriizouium ^h '—Bradyrhizobium
2§ '—Bradyrhizobiumj
arachidis CCBAU051107T
Bradyrhizobium japonicum LMG6138T
39 92I
68l
9 ll
r- Bradyrhizobium canariense BTA-1T ii— Bradyrhizobium betae LMG21987T V Bradyrhizobium cytisi CTAW11T ^-Bradyrhizobium rifense CTAW71T '—Bradyrhizobium iriomotense NBRC102520T —Bradyrhizobium pachyrhizi PAC48T
—Bradyrhizobium retamae Rol9T ।—Bradyrhizobium jicamae PAC68T
'---Bradyrhizobium lablabi CCBAU23086T
----Nitrobacter hamburgensis DSM10229T
------Nitrobacter winogradskyi DSM10237T
-------------Tardiphaga robiniae LMG26467T
----------Bhodopseudomonas palustris ATCC17001T
-------------Bosea sp. ORS1414
------Bosea sp. STM358
- I-12/12M
1__ ____Bosea lathyri LMG26379T
9W/3iK 48 П
3/5M
1-3/25
• Bosea vaviloviae Vaf-17
L Bosea vaviloviaeNed-\%T
Bosea vaviloviae Vaf-43
0,05
Рис. 3. ITS-филограмма, отражающая таксономическое положение изолятов рода Bosea , выделенных из клубеньков астрагала монгольского ( Astragalus mongholicus ) и остролодочника лесного ( Oxytropis sylvatica ). Исследуемые штаммы обозначены жирным шрифтом. Литерой «Т» отмечены типовые штаммы.
Таким образом, среди микросимбионтов чины низкой встречаются ризобиальные штаммы видов Rhizobium spp . , Mesorhizobium ciceri , Tardiphaga robiniae , а также представители рода Herbiconiux (сем. Microbacteriaceae ) . В числе симбионтов астрагала монгольского обнаружены представители родов Mesorhizobium , Bosea , Tardiphaga , Leifsonia , Burkholderia и Stenotro-phomonas. Из клубеньков остролодочника лесного были получены изоля-ты, относящиеся к видам R. leguminosarum bv. trifolii , T. robiniae и Bosea sp. Из клубеньков горошка байкальского выделены 40 штаммов, принадлежащих к виду R. leguminosarum bv. trifolii и по одному представителю родов Phyllobacterium и Burkholderia. Следует отметить, что присутствие нетипичных ризобиальных микросимбионтов в клубеньках бобовых растений ( M. ciceri и T. robiniae у чины; Bosea spр . и T. robiniae у астрагала и остролодочника; Phyllobacterium sp . у горошка) может свидетельствовать об активных процессах формирования взаимоотношений между партнерами в бобово-ризобиальных системах Байкальского региона .
Авторы благодарят сотрудников СИФИБР СО РАН Л.Е. Макарову за помощь в организации экспедиции на побережье Чивыркуйского залива и А.А. Киселеву за проведение идентификации растений.
Л И Т Е Р А Т У Р А
-
1ФГБНУ Всероссийский НИИ сельскохозяйственной Поступила в редакцию
микробиологии, 30 марта 2015 года196608 Россия, г. Санкт-Петербург—Пушкин, ш. Подбельского, 3, е-mail: v.safronova@rambler.ru ;
-
2ФГБНУ Сибирский институт физиологии
и биохимии растений СО РАН,664033 Россия, г. Иркутск, ул. Лермонтова, 132
Sel’skokhozyaistvennaya biologiya [ Agricultural Biology ], 2015, V. 50, ¹ 3, pp. 345-352
GENETIC DIVERSITY AMONG MICROSYMBIONTS OF Lathyrus, Vicia, Oxytropis AND Astragalus LEGUME SPECIES FROM BAIKAL REGION
I.G. Kuznetsova1, A.L. Sazanova1, V.I. Safronova1, A.G. Pinaev1, A.V. Verkhozina2, N.Yu. Tikhomirova1, Yu.S. Osledkin1, A.A. Belimov1

В рамках форума проходит выставка-конференция «Биоиндустрия». Научное руководство конференции осуществляют Комитет по здравоохранению Санкт-Петербурга, СЗГМУ им. И.И. Мечникова, Санкт-Петербургская государственная химико-фармацевтическая академия, Всероссийский НИИ cельскохозяйственной микробиологии.
Контакты и информация:
Список литературы Генетическое разнообразие микросимбионтов байкальских видов чины ( Lathyrus), горошка ( Vicia), остролодочника ( Oxytropis) и астрагала ( Astragalus)
- Тихонович И.А., Борисов А.Ю., Цыганов В.Е. Интеграция генетических систем растений и микроорганизмов при симбиозе. Успехи совр. биол., 2005, 125(3): 227-238.
- Красная книга ХМАО -Югры. Встречи с животными и растениями, 2015 (http://animals.ecougra.ru).
- Choi I.-S., Choi B.-H. Isolation and characterization of ten microsatellite loci from Korean Astragalus mongholicus (Fabaceae). J. Genet., 2013, 92: 73-76 (http//www.ias.ac.in/jgenet/OnlineResources/92/e73.pdf).
- Кузьмина Е.А. Клональное микроразмножение астрагала монгольского (Astragalus mongholicus Bge.). М., 2012 (http://www.rusnauka.com/29_NIOXXI_2012/Biologia/11_117925.doc.htm).
- Положий В.А., Выдрина С.Н., Курбатский В.И., Никифорова О.Д. Флора Сибири. Том 9 Fabaceae (Leguminosae). Новосибирск, 1994.
- Gao J., Terefework Z., Chen W., Lindstrom K. Genetic diversity of rhizobia isolated from Astragalus adsurgens growing in different geographical regions of China. J. Biotechnol., 2001, 91: 155-168 ( ) DOI: 10.1016/S0168-1656(01)00337-6
- Laguerre G., van Berkum P., Amarger N., Prevost D. Genetic diversity of rhizobial symbionts isolated from legume species within the genera Astragalus, Oxytropis, and Onobrychis. Appl. Environ. Microbiol., 1997, 63(12): 4748-4758.
- Wdowiak S., Malek W. Numerical analysis of Astragalus cicer microsymbionts. Curr. Microbiol., 2000, 41: 142-148 ( ) DOI: 10.1007/s002840010108
- Сафронова В.И., Чижевская Е.П., Белимов А.А., Павлова Е.А. Определение таксономического положения микросимбионтов копеечника (Hedysarum) и астрагала (Astragalus) на основе анализа генов рибосомальных РНК. Сельскохозяйственная биология, 2011, 3: 61-64.
- Drouin Р., Prevost D., Antoun H. Physiological adaptation to low temperatures of strains of Rhizobium leguminosarum bv. viciae associated with Lathyrus spp. FEMS Microbiol. Ecol., 2000, 32: 111-120 ( ) DOI: 10.1111/j.1574-6941.2000.tb00705.x
- Drouin Р., Prevost D., Antoun H. Classification of bacteria nodulating Lathyrus japonicus and Lathyrus pratensis in Northern Quebec as strains of Rhizobium leguminosarum biovar viciae. Int. J. Syst. Bacteriol., 1996, 46(4): 1016-1024 ( ) DOI: 10.1099/00207713-46-4-1016
- Van Cauwenberghe J., Verstraete B., Lemaire B., Lievens B., Michiels J., Honnay O. Population structure of root nodulating Rhizobium leguminosarum in Vicia cracca populations at local to regional geographic scales. Syst. Appl. Microbiol., 2014, 37(8): 613-621 ( ) DOI: 10.1016/j.syapm.2014.08.002
- Zhang R.J., Hou B.C., Wang E.T., Li Y. Jr., Zhang X.X., Chen W.X. Rhizobium tubonense sp. nov., isolated from root nodules of Oxytropis glabra. Int. J. Syst. Evol. Microbiol., 2011, 61(3): 512-517 ( ) DOI: 10.1099/ijs.0.020156-0
- Novikova N., Safronova V. Transconjugants of Agrobacterium radiobacter harbouring sym genes of Rhizobium galegae can form an effective symbiosis with Medicago sativa. FEMS Microbiol. Lett., 1992, 93: 261-268 ( ) DOI: 10.1016/0378-1097(92)90472-Z
- Румянцева М.Л., Симаров Б.В., Онищук О.П. и др. Биологическое разнообразие клубеньковых бактерий в экосистемах и агроценозах. Теоретические основы и методы. СПб, 2011.
- Amarger N., Macheret V., Laguerre G. Rhizobium gallicum sp. nov. and Rhizobium giardinii sp. nov. from Phaseolus vulgaris nodules. Int. J. Syst. Bacteriol., 1997, 47(4): 996-1006 ( ) DOI: 10.1099/00207713-47-4-996
- Safronova V.I., Kuznetsova I.G., Sazanova A.L., Kimeklis A.K., Belimov A.A., Andronov E.E., Pinaev A.G., Chizhevskaya E.P., Pukhaev A.R., Popov K.P., Willems A., Tikhonovich I.A. Bosea vaviloviae sp. nov. a new species of slow-growing rhizobia isolated from nodules of the relict species Vavilovia formosa (Stev.) Fed. Antonie van Leeuwenhoek, 2015, 107: 911-920 ( ) DOI: 10.1007/s10482-015-0383-9
- Сardoso J.D., Hungria M., Andrade D.S. Polyphasic approach for the characterization of rhizobial symbionts effective in fixing N2 with common bean (Phaseolus vulgaris L.). Appl. Microbiol. Biotechnol., 2012, 93: 2035-2049 ( ) DOI: 10.1007/s00253-011-3708-2
- Lei X., Wang E.T., Chen W.F., Sui X.H., Chen W.X. Diverse bacteria isolated from root nodules of wild Vicia species grown in temperate region of China. Microbiology, 2008, 190(6): 657-671 ( ) DOI: 10.1007/s00203-008-0418-y
- Qiu F., Huang Y., Sun L., Zhang X., Liu Z., Song W. Leifsonia ginsengi sp. nov., isolated from ginseng root. Int. J. Syst. Evol. Microbiol., 2007, 57(2): 405-408 ( ) DOI: 10.1099/ijs.0.64487-0
- Behrendt U., Schumann P., Hamada M., Suzuki K., Spröer C., Ulrich A. Reclassification of Leifsonia ginsengi (Qiu et al. 2007) as Herbiconiux ginsengi gen. nov., comb. nov. and description of Herbiconiux solani sp. nov., an actinobacterium associated with the phyllosphere of Solanum tuberosum L. Int. J Syst. Evol. Microbiol., 2011, 61(5): 1039-1047 ( ) DOI: 10.1099/ijs.0.021352-0


