Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh., расположенных на северной границе ареала вида
Автор: Федоренко Ольга Михайловна, Грицких Марина Витальевна, Лебедева Ольга Николаевна, Титов Александр Федорович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 2 (115), 2011 года.
Бесплатный доступ
Генетическое разнообразие, rapd-маркеры, северная граница ареала вида, краевые популяции
Короткий адрес: https://sciup.org/14749857
IDR: 14749857
Текст статьи Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh., расположенных на северной границе ареала вида
Генетическое разнообразие является основой адаптивных и эволюционных изменений в популяциях и вместе с тем выступает одним из важнейших факторов их устойчивости [1], [8]. Поэтому вопросы о роли генетического полиморфизма и механизмах поддержания этого вида изменчивости составляют одну из центральных проблем популяционной генетики. Также к числу широко обсуждаемых относится и вопрос о величине популяционно-генетического разнообразия в центре и на периферии ареалов видов. Ранее, основываясь на результатах изучения хромосомной и морфологической изменчивости, исследователи склонялись к мнению, что степень полиморфизма почти всегда убывает по мере приближения к границе видового ареала и что периферические популяции зачастую моно-морфны [5], [10], [11]. Появление и широкое применение метода электрофореза белков не только позволило выявить в природных популяциях существование огромной генетической изменчивости [4], но и по-иному рассматривать ее распределение по территории ареала. Так, Левонтин, учитывая высокую нестабильность условий существования на периферии ареала, под- черкивал: «...в разное время отбираются совершенно разные генотипы. Не удивительно, что генная гетерозиготность здесь высокая...» [13].
Территория Карелии является северной границей ареала распространения арабидопсиса ( Arabidopsis thaliana (L.) Heynh.) – модельного объекта многих генетических исследований. Самые северные его популяции известны в Карелии на широте 62°55´, в Норвегии – 67°20´. Условия произрастания растений на северной границе ареала вида являются экстремальными из-за резких колебаний температур, дефицита тепла летом и холодных зим, значительной изменчивости фотопериодических условий. В таких условиях среды под влиянием естественного отбора неизбежно происходят изменения в распределении аллельных частот, связанные с разной приспособленностью генотипов.
Ранее с помощью изоферментного анализа нами была изучена генетическая вариабельность 10 природных популяций арабидопсиса северной части ареала вида [7], расположенных вдоль широтного градиента (61°16´ – 62°12´с. ш.) на протяжении примерно 150 км. В результате было выявлено значительное генетическое разнообра-
зие северных природных популяций, почти в 2,5 раза превышающее уровень изменчивости популяций этого вида в центре ареала (Англия, 54°00´ с. ш.) [9], а также превышение средних значений популяционных характеристик других самоопыляющихся видов растений [12] (табл. 1). Причем чем севернее располагалась популяция, тем, как правило, выше оказывалась доля полиморфных локусов (P 95% ): r = 0,68, P < 0,05.
В настоящей работе представлены результаты изучения генетического разнообразия природных популяций A. thaliana , расположенных на северной границе ареала вида, с помощью RAPD-анализа – метода, который имеет ряд достоинств и преимуществ, позволяя, в частности, исследовать геном в целом и выявлять полиморфизм большого числа локусов.
МАТЕРИАЛ И МЕТОДИКА
В работе исследованы семь популяций ара-бидопсиса, расположенные на территории Карелии вдоль широтного градиента на протяжении около 200 км (географические координаты самой северной популяции – 62°55´ с. ш., 34°25´ в. д., а самой южной – 61°49´ с. ш., 35°10´ в. д.). Две популяции островные, расположены на островах Онежского озера – Радколье и Климецкий, остальные – континентальные. Названия континентальных популяций даны в соответствии с близлежащими населенными пунктами (д. Царевичи, ст. Шуйская, д. Косалма, с. Кончезеро, г. Медвежьегорск), а островных – по географическим названиям островов.
Материалом для молекулярно-генетического анализа послужили растения A. thaliana , выращенные в лабораторных условиях в смеси земли и песка (2 : 1) под люминесцентными лампами из семян, собранных в ходе экспедиции 2008 года. Выделение ДНК из листьев 30 взрослых растений каждой популяции проводили по протоколу
Мёллера и др. [14]. Полимеразную цепную реакцию (ПЦР) осуществляли с помощью шести RAPD-праймеров произвольных последовательностей: № 2 (5'-GTGTCGAGTC-3'), № 4 (5'-AGGTCTGACG-3'), № 7 (5'-GTCGATCGAG-3'), № 8 (5'-CGAGCCGATC-3'), OPC-5 (5'-GATGA CCGCC-3'), P-01D (5'-AGCAGCGTCG-3'), («Син-тол», Россия). Амплификацию ДНК проводили по следующему температурному профилю: начальная денатурация 2 мин при 94 °С, следующие 35 циклов по схеме 94 °С (60 с), 35 °С (40 с), 72 °С (40 с) и конечная элонгация 10 мин при 72 °С. Продукты амплификации разделяли методом электрофореза в 6-процентном полиакриламидном геле в TBE-буферном растворе. ПЦР-продукты окрашивали бромистым этидием и фотографировали в проходящем УФ-свете. Анализ молекулярной массы фрагментов осуществляли относительно маркера молекулярной массы (100 bp – 1 Kb) («Силекс», Россия).
Статистическую обработку полученных результатов проводили с использованием стандартных подходов и методов, принятых в популяционно-генетических исследованиях [2], и пакетов программ POPGENE [18] и PHYLIP ( http://evolution.genetics.washington.edu ). Для этого были составлены бинарные матрицы, в которых присутствие или отсутствие в спектре одинаковых фрагментов ДНК обозначали как «1» или «0». Для определения уровня генетического разнообразия популяций вычисляли показатели генетического разнообразия: долю полиморфных локусов при 95-процентном и 99процентном критериях (P), ожидаемую гетерозиготность (Н exp ). Генетическую дифференциацию популяций определяли по коэффициенту генетической дистанции Нея (D N ) [15]. Кластерный анализ с формированием ветвей дендрограммы производили невзвешенным парногрупповым методом UPGMA (пакет программ PHYLIP).
Таблица 1
Показатели генетического разнообразия в популяциях A. thaliana
Популяция Географические координаты, с. ш. P95%, % P99%, % H exp
|
RAPD-анализ, карельские популяции |
||||
|
Климецкий |
61°49´ |
44,63 |
47,93 |
0,164 ± 0,018 |
|
Царевичи |
62°01´ |
48,76 |
48,76 |
0,170 ± 0,017 |
|
Косалма |
62°01´ |
29,75 |
36,36 |
0,110 ± 0,016 |
|
Шуйская |
62°00´ |
34,71 |
39,67 |
0,121 ± 0,016 |
|
Радколье |
62°05´ |
56,20 |
66,12 |
0,205 ± 0,017 |
|
Кончезеро |
62°08´ |
17,36 |
23,97 |
0,048 ± 0,010 |
|
Среднее |
38,57 |
43,80 |
0,136 ± 0,016 |
|
|
Медвежьегорск |
62°55´ |
14,88 |
33,06 |
0,063 ± 0,018 |
|
Аллозимный анализ |
||||
|
Карельские популяции [7] |
61°16´ – 62°12´ |
35,00 |
43,70 |
0,124 ± 0,056 |
|
Британские популяции [9] |
54°00´ |
– |
16,50 |
0,055 |
|
Самоопылители, среднее по 33 видам [12] |
– |
– |
18,99 |
0,058 |
Примечание. Р95% и P99% – доля полиморфных локусов при 95-процентном и 99-процентном критериях соответственно; Hexp – ожидаемая гетерозиготность.
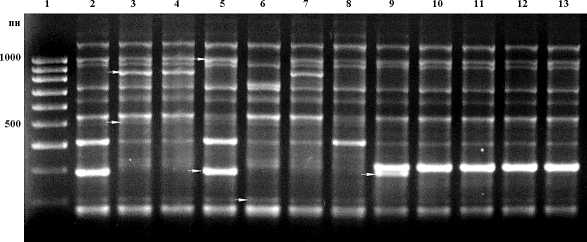
Рис. 1. RAPD-спектры геномной ДНК растений A. thaliana из популяции Радколье (2–8) и Климецкий (9–13), полученные с помощью праймера OPC-5: 1 – маркер молекулярной массы (100 пн – 1000 пн). Стрелками отмечены полиморфные фрагменты ДНК
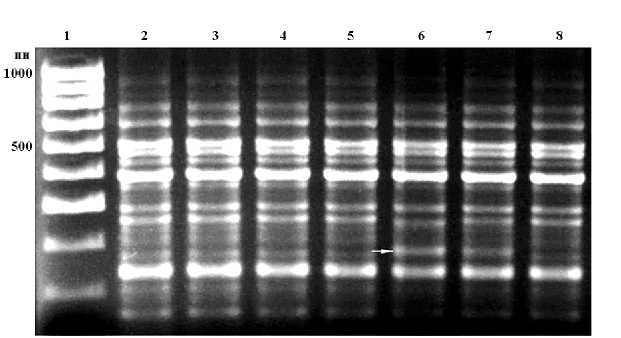
Рис. 2. RAPD-спектры геномной ДНК растений A. thaliana из популяции Медвежьегорск (2–8), полученные с помощью праймера № 8: 1 – маркер молекулярной массы (100 пн – 1000 пн). Стрелкой отмечены полиморфные фрагменты ДНК
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В целом была изучена вариабельность 121 RAPD-локуса двух островных и пяти континентальных популяций A. thaliana . На электрофореграммах спектров фрагментов ДНК отдельных растений выявлялись как мономорфные, общие для всех образцов, так и полиморфные фрагменты (рис. 1, 2). На основании частот фрагментов ДНК были вычислены основные показатели уровня генетического разнообразия в исследуемых популяциях – доля полиморфных локусов (P) при 95-процентном и 99-процентном критериях и ожидаемая гетерозиготность (H exp ) (табл. 1).
Проведенный анализ показал, что уровень генетического разнообразия природных популяций A. thaliana, расположенных на северной периферии ареала вида, оказался сопоставимым с установленным ранее с помощью аллозимного метода [7], то есть в 2–2,5 выше, чем в популяциях центральной части ареала [9]. Столь высокий популяционный полиморфизм нетипичен для самоопыляющихся видов растений (табл. 1). В связи с этим предполагается, что значительный уровень генетиче ского разнообразия араби-допсиса в северной части его ареала может быть связан с жесткими экологическими условиями произрастания, в которых сильный естественный отбор может быстро менять свое направле- ние [4], [16], [17]. Однако самая северная популяция арабидопсиса, находящаяся в районе Медвежьегорска, проявила значительно более низкий уровень изменчивости по доле полиморфных локусов (P95% = 14,88 %) и ожидаемой гетерозиготности (Hexp= 0,063) по сравнению со средними значениями этих параметров для популяций, расположенных почти на 200 км южнее. Тем не менее в группе этих популяций наблюдаются заметные колебания значений показателей уровня изменчиво сти (табл. 1). Значительное сокращение генетического разнообразия в некоторых из исследованных популяций, в том числе и в самой северной, может свидетельствовать о более сильном давлении отбора, который приводит к выживанию относительно немногих, наиболее приспособленных к жестким условиям среды генотипов.
Для характеристики генетических взаимоотношений исследованных популяций был использован кластерный анализ методом UPGMA (пакет программ PHYLIP) (рис. 3) на основе значений дистанций Нея (D N ) (табл. 2). Как видно из дендрограммы, популяция, произрастающая в окрестностях Медвежьегорска, существенно отличается от всех других (0,226 < D N > 0,287). Она значительно обособлена и формирует отдельное плечо. Данное обстоятельство указывает на то, что самая северная популяция не только имеет пониженный уровень изменчивости, но и отличается своеобразием генетической структуры. Остальные популяции разделены на два подкластера. Один из них включает две континентальные популяции, которые в широтном градиенте наиболее близки к Медвежьегорску, – Кончезеро и Косалма. Во втором подкластере максимальное генетическое родство показали островные популяции Радколье и Климецкий (D N = 0,079), группирующиеся вместе. Вероятно, особенности микроэволюционных процессов в островных популяциях (ослабление миграционного потока генов, усиление роли дрейфа генов) обусловили особенности их генетической структуры.
Таблица 2
Генетические расстояния (DN) между северными природными популяциями A. thaliana
|
Популяция |
Рад-колье |
Климец-кий |
Ца-ревичи |
Шуйская |
Ко-сал-ма |
Конче-зеро |
Медвежье-горск |
|
Радколье Климец-кий Царевичи Шуйская Косалма Кончезеро Медвежьегорск |
0 0,079 0,103 0,109 0,105 0,131 0,226 |
0 0,088 0,111 0,118 0,118 0,244 |
0 0,098 0,128 0,128 0,245 |
0 0,159 0,121 0,260 |
0 0,109 0,244 |
0 0,287 |
0 |
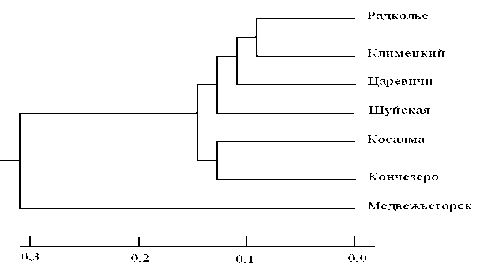
Рис. 3. Дендрограмма генетических различий северных популяций A. thaliana , построенная на основе генетических дистанций Нея
Следует отметить, что островная популяция Радколье показала очень высокий уровень генетического разнообразия, тогда как близкая по географической широте континентальная популяция Кончезеро – низкий (табл. 1). По-видимому, зафиксированные отличия связаны с природноклиматическими условиями произрастания растений этих популяций. В частности, остров Рад-колье характеризуется такими уникальными особенностями, как наличие скальных обнажений и шунгитовых пород [6], которые обусловливают своеобразие микроклиматических и почвенных условий, а растительность представлена большим числом видов, включая редкие для Карелии [3].
Таким образом, результаты проведенного исследования показали, что в целом в северных природных популяциях A. thaliana выявлен значительный объем генетического разнообразия, не характерный для самоопылителей. Отмеченная неоднозначность в распределении величины генетического разнообразия не отрицает, как нам представляется, справедливость обеих гипотез, касающихся уровня полиморфизма периферических популяций. Очевидно, вопрос заключается в том, насколько условия произрастания конкретных популяций приближены к крайним условиям выживания вида. Полученные данные дополняют существующие представления относительно генетического разнообразия краевых природных популяций, расположенных на границах ареала вида, и позволяют по-новому рассматривать формальные противоречия, имеющиеся в результатах, полученных разными авторами и лежащих в основе двух, по сути, прямо противоположных точек зрения по этому принципиально важному вопросу.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы. ГК № 02.740.11.0700.
Список литературы Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh., расположенных на северной границе ареала вида
- Алтухов Ю. П. Генетические процессы в популяциях. М.: Академкнига, 2003. 431 с.
- Животовский Л. А. Статистические методы анализа частот генов в природных популяциях//Итоги науки и техники. Общая генетика. М.: ВИНИТИ, 1983. Т. 8. С. 76-104.
- Кузнецов О. Л. Флора и растительность кижских шхер//Растительный мир Карелии и проблемы его охраны. Петрозаводск, 1993. С. 107-141.
- Левонтин Р. С. Генетические основы эволюции: Пер. с англ. М.: Мир, 1978. 338 с.
- Майр Э. Зоологический вид и эволюция: Пер. с англ. М.: Мир, 1968. 597 с.
- Соколов В. А. Карельские агрономические руды. Петрозаводск: Гос. изд-во Карело-Финской ССР, 1956. С. 22-29.
- Федоренко О. М., Савушкин А. И., Олимпиенко Г. С. Генетическое разнообразие природных популяций Arabidopsis thaliana (L.) Heynh. в Карелии//Генетика. 2001. Т. 37. № 2. С. 223-229.
- Хедрик Ф. Генетика популяций: Пер. с англ. М.: Техносфера, 2003. 592 с.
- Abbott R. J., Gomes М. F. Population genetic structure and outcrossing rate of Arabidopsis thaiana (L.) Heynh.//Heredity. 1989. Vol. 62. Part 3. P. 411-418.
- Carson H. L. The population genetics of Drosophila robusta//Advan. Genet. 1958. Vol. 9. P. 1-40.
- Dobzhansky Th. Genetics and the origin of species. 3rd ed., rev. Columbia. N. Y., 1951. 353 p.
- Hamrick J. L., Linhart I. B., Mitton J. B. Relationship between life history characteristic and electrophoretically detectable genetic variation in plants//Ann. Rev. Ecol. Syst. 1979. Vol. 10. P. 173-200.
- Lewontin R. C. The adaptations of populations to varying environments//Cold Spring Harbor Symp. Quant. Biol. 1957. Vol. 22. P. 395-408.
- Moller E. M., Bahnweg G., Sandermann H., Geiger H.H. A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi, fruit bodies, and infected plant tissues//Nucl. Acids Res. 1992. Vol. 20. № 22. P. 6115-6116.
- Nei M. Genetic distance between populations//Amer. Natur. 1972. Vol. 106. P. 283-292.
- Schwartz M. K., Mills L. S., Ortega Y. et al. Landscape location affects genetic variation of Canada lynx (Lynx Canadensis)//Molecular Ecology. 2003. Vol. 12. P. 1807-1816.
- Stenoien H. K., Fenster Ch. B., Tonteri A., Savolainen O. Genetic variability in natural populations of Arabidopsis thaliana in northern Europe//Molecular Ecology. 2005. Vol. 14. P. 137-148.
- Yeh F. C., Вoyle T. J. B. Population genetic analysis of codominant and dominant markers and quantitative traits//Belgian J. Bot. 1997. Vol. 129. P. 157.


