Генотипическая и физиологическая адаптация сортов ячменя селекции Фанц северо-востока к грибным болезням
Автор: Шешегова Татьяна Кузьмовна, Щеклеина Люция Муллаахметовна, Лисицын Евгений Михайлович
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Агрономия
Статья в выпуске: 8, 2022 года.
Бесплатный доступ
В ФГБНУ ФАНЦ Северо-Востока в 2019-2021 гг. проведена иммунологическая оценка и анализ влияния грибных болезней на фотосинтетический комплекс и зараженность семян у 16 сортов ячменя, созданных за последние 30 лет, для обоснования генотипической и физиологической адаптации растений к микозному поражению. Изучение проводили на фитопатологическом участке при искусственной инокуляции видами Helminthosporium spp. и оценивали по устойчивости к корневым гнилям, сетчатой и темно-бурой пятнистости с использованием общеизвестных методик. Высокой и умеренной устойчивостью к болезням характеризуются сорта Дина, Форвард, Добряк и новые линии 288-12, 52-12 и 94-13. Обнаружена тенденция снижения корневых гнилей и темно-бурой пятнистости у линий ячменя, но по отношению к сетчатой пятнистости прогресса в селекции нет. В структуре микрофлоры семян идентифицировали 8 микробных таксонов. Вид Bipolaris sorokiniana идентифицирован во всех образцах семян, за исключением сорта Дина, с долей в контаминанте от 8,2 % (Андрей) до 71,0 % (Памяти Родиной) и в среднем по сортименту 41,1 %; виды Alternaria spp. и Bacillus spp - в 14 образцах семян со средней долей 30,8 и 8,0 %; Fusarium spp. - у 13 сортов со средней долей 6,8 %. Выявлена слабая зависимость (r) между инфицированностью семян и развитием корневых гнилей (r=0,24), темно-бурой и сетчатой пятнистости (r=0,25 и r=0,16); средняя и достоверная связь (при Р ≥ 095) - между развитием корневых гнилей и темно-бурой пятнистости листьев (r=0,56). Негативное влияние темно-бурой пятнистости проявилось в снижении содержания Chl а (r=-0,134) и Car (r=-0,217); сетчатой пятнистости - в уменьшении ССК (r=-0,439); корневых гнилей - в снижении Chl а (r=-0,325), Chl b (r=-0,316) и Car (r=-0,371).
Hordeum vulgare l, сетчатая и темно-бурая пятнистость, корневые гнили, устойчивость, зараженность семян, фотосинтетические пигменты, корреляционные связи
Короткий адрес: https://sciup.org/140295623
IDR: 140295623 | УДК: 633.16:632.4:631.527 | DOI: 10.36718/1819-4036-2022-8-33-41
Текст научной статьи Генотипическая и физиологическая адаптация сортов ячменя селекции Фанц северо-востока к грибным болезням
Введение. Широкий ареал возделывания ярового ячменя объясняется многогранным использованием зерна в пищевой, пивоваренной, комбикормовой и фармацевтической промышленности [1]. В структуре посевных площадей Кировской области ячмень занимает 70–80 тыс. га, более трети которых занято сортами селекции ФАНЦ Северо-Востока [2, 3].
Несмотря на приспособленность этой культуры к разнообразию средовых факторов (почвенных, производственных) и биотическую устойчивость отдельных сортов, экстремальные агроклиматические условия часто провоцируют усиление вредоносности гельминтоспориозных болезней: корневых гнилей и темно-бурой пятнистости листьев (Bipolaris sorokiniana (Sacc.) Shoem, телеоморфа Cochliobolus sativus Ito et Kurib.), полосатой (Drechslera graminea, теле-оморфа Pyrenophora graminea Ito et Kurib.) и сетчатой (Drechslera teres, телеоморфа Pyrenophora teres Shotm.) пятнистости [3–5]. Интенсивное развитие этих болезней в сортовых биоценозах увеличивает фитосанитарные риски зернопроизводства, поскольку чревато инфицированием формирующегося зерна. Как правило, зерновая масса после уборки представляет собой смесь, состоящую из биологических компонентов, включающих зерно основной культуры, токсичное дефектное зерно и микроорганизмы (грибы, бактерии), присутствующие на поверхности или (и) внутри зерна. По данным В.А. Захаренко и А.С. Васютина [6], потери урожая при выращивании зерновых культур, поражаемых фитопатогенами, составляют 0,283 т/га.
Негативное влияние на общий гомеостаз и продукционный процесс имеют также физиолого-биохимические процессы, обусловленные биотическим и иным поражением листового аппарата растений [7]. Так, ухудшение функции листьев (хлоропластов) проявляется в уменьшении содержания хлорофиллов (Chl a и Chl b), снижении индекса площади зеленого листа и биомассы в целом, что влияет на интенсивность фотосинтеза. Недостаток Chl b запускает преждевременную программу онтогенетического старения, поскольку он активен в регуляции развития растений [8]. Растения с высоким содержанием Chl a и Chl b, каротиноидов (Car) и светособирающих комплексов (ССК) поглощают больше энергии и имеют высокую интенсив- ность фотосинтеза. Принято считать, что оптимизация работы фотосинтетического аппарата способствует росту продуктивности растений до 60 % [9, 10].
Несмотря на то что поражение болезнями можно рассматривать как существенный стрессовый фактор, воздействующий на физиологические и продукционные процессы растений, некоторые восприимчивые сорта ячменя способны формировать высокий урожай, поскольку обладают толерантностью к фитопатогенам. Поэтому изучение генотипической (сортовой) и физиологической адаптации растений к микозному поражению листового аппарата и корневой системы растений на фоне повышенной инфекционной нагрузки патогенов представляет значимый научный и практический интерес. Усилия селекционеров должны быть направлены не только на активизацию фотосинтетического аппарата, но и на создание генотипов, обладающих высокой устойчивостью к стрессорам биогенного и абиогенного типа, что особенно актуально для нашей страны с большим разнообразием почвенно-климатических условий [11, 12].
Поскольку значительную селективную роль в болезнеустойчивости имеет генотип, целью исследований была иммунологическая оценка сортов ярового ячменя, созданных в ФАНЦ Северо-Востока за последние 30 лет, и анализ влияния грибных болезней на фотосинтетический комплекс и зараженность семян.
Условия, материал и методы. Материалом исследований было 16 сортов и новых линий ярового ячменя селекции ФГБНУ ФАНЦ Северо-Востока. Их изучали в 2019–2021 гг. на однометровых делянках фитопатологического участка при искусственной инокуляции видами рода Helminthosporium и оценивали по устойчивости к корневым гнилям, сетчатой и темнобурой пятнистости с использованием методик и шкал М.Ф. Григорьева, Н.А. Родиной, З.Г. Ефремовой, О.С. Афанасенко [13–15].
Структуру микроорганизмов семян изучали после выделения чистой культуры. Семена предварительно обеззараживали в 0,5 % KMnO4 в течение 20 минут с последующим промыванием дистиллированной водой. В стерильных условиях их раскладывали по 10 штук в чашки Петри на картофельно-глюкозный агар в 3-кратной повторности и помещали в термостат при температуре 23–25 °С. Через 5 суток просматривали и пересевали колонии, выросшие вокруг зерновок. Идентификацию микроорганизмов проводили на 14-й день после отсева мицелия, когда диагностические признаки мик-ромицетов наиболее четко выражены. Применяли прямое микроскопирование (микроскоп «Биолам» с увеличением от 40 до 1600) и общеизвестную справочную литературу [16–18]. Частоту встречаемости рода оценивали по числу зерновок, из которых он изолирован, и выражали в процентах от общего количества инфицированных семян.
Для анализа фотосинтетических пигментов, в связи с микозным поражением листового аппарата и корневой системы растений, в фазу цветения отбирали среднюю пробу флаговых листьев. Объем выборки – 25 растений в 4-кратной повторности. Содержание пигментов (хлорофилл a – Chl a, хлорофилл b – Chl b, каротиноиды – Car) оценивали с использованием спектрофотометра UVmini-1240 (SHIMADZU Corporation, Japan) при длинах волн 470; 644,8; 661,6 нм. Выделение пигментов и расчет их содержания проводили по методике H.K. Lichtenthaler, C. Bushmann. В качестве экстрагента применяли 100 %-й ацетон. Содержание хлорофилла ( Chl a, Chl b ) в ССК (светособирающий комплекс) рассчитывали по формуле: ССК = 2,2 ∙ Chlb / (Chl a + Chl b ) ∙ 100, где ССК – светособирающий комплекс Chl a; Chl a – содержание хлорофилла а в исследуемом образце, мг/г; Chl b – содержание хлорофилла b в исследуемом образце, мг/г [19].
Статистическую обработку данных проводили методами дисперсионного и корреляционного анализа с помощью пакета программ AGROS, версия 2.07, и пакета программ Microsoft Office Excel 2007.
Результаты и их обсуждение. Состояние климатических факторов в период вегетации растений во многом определяет уровень неспецифической устойчивости к болезням. Так, по данным С.С. Санина с соавт. [20], избыточное количество осадков, начиная с фазы выхода в трубку, является прогнозом усиления развития микозных пятнистостей листьев и колоса. Погодные условия в 2019–2021 гг. значительно отличались по уровню температуры и количеству осадков в наиболее важные периоды вегетации, о чем косвенным образом свидетельствует гидротермический коэффициент (ГТК). Уровень ГТК в межфазные период «посев– кущение» варьировал от 0,11 до 3,41, «всходы– колошение» – от 0,67 до 1,87, «колошение– созревание» – от 1,40 до 1,82.
Оценивая изучаемые сорта по болезнеустойчивости, следует отметить преобладание у них среднего уровня признака. Судя по максимальному развитию болезней в годы исследований, лишь два сорта (Дина и Форвард) характеризуются устойчивостью к сетчатой пятнистости и шесть (Эколог, Дина, Форсаж, Добряк, 28812, 94-13) – к темно-бурой пятнистости; четыре сорта (Новичок, Тандем, 94-13, 52-12) проявляют умеренную устойчивость к корневым гнилям (табл. 1). В целом относительно лучшее иммунологическое состояние у сортов: Дина, Форвард, Добряк, 288-12, 52-12 и 94-13. Оценивая сорта по устойчивости к двум болезням, обусловленным паразитизмом одного вида Bipolaris soroкiniana, с использованием соответствующих шкал [13, 15], можно отметить, что новые линии характеризуются преимущественно умеренной (развитие болезни до 16 %) и средней (до 25 %) устойчивостью к корневым гнилям и слабой восприимчивостью (до 15 %) к темно-бурой пятнистости. Максимальное развитие болезней у ранее созданных сортов – 16,5–30,0 % (корневые гнили) и 11,0–21,0 % (темно-бурая пятнистость). По отношению к сетчатой пятнистости заметного улучшения у новых сортов и линий не наблюдается.
Таблица 1
|
Сорт, линия |
Год внесения в Госреестр РФ |
Сетчатая пятнистость |
Темно-бурая пятнистость |
Корневые гнили |
|||
|
lim |
Х |
lim |
Х |
lim |
Х |
||
|
Белгородский 100 – станд. |
2010 |
10,3–16,8 |
13,2 |
10,0–12,0 |
11,0 |
16,5–24,0 |
18,8 |
|
Эколог |
1992 |
7,6–18,3 |
13,6 |
9,5–11,0 |
13,0 |
16,0–28,0 |
22,9 |
|
Дина |
1990 |
7,0–9,0 |
8,0 |
8,5–14,0 |
13,0 |
18,0–25,0 |
20,4 |
|
Андрей |
- |
13,5–20,5 |
17,0 |
9,0–16,5 |
14,5 |
14,0–18,5 |
16,6 |
|
Джин |
- |
14,8–20,0 |
16,0 |
12,0–18,0 |
14,0 |
17,2–30,0 |
25,0 |
|
Фермер |
- |
18,5–25,3 |
22,3 |
12,0–19,8 |
14,0 |
18,0–28,8 |
23,5 |
|
Новичок |
2002 |
13,5–45,0 |
19,8 |
11,0–21,0 |
15,0 |
12,8–16,9 |
14,6 |
|
Лель |
2005 |
14,8–23,5 |
16,0 |
9,0–20,0 |
15,0 |
15,0–25,0 |
21,8 |
|
Тандем |
2008 |
18,0–30,0 |
19,0 |
9,5–19,0 |
16,2 |
12,0–16,5 |
13,7 |
|
Родник Прикамья |
2010 |
16,5–26,0 |
18,5 |
10,0–25,0 |
16,0 |
10,6–23,5 |
18,6 |
|
Памяти Родиной |
2014 |
10,5–20,2 |
16,5 |
11,8–20,0 |
15,8 |
16,5–18,8 |
16,3 |
|
Форвард |
- |
8,8–15,0 |
11,0 |
14,0–17,0 |
16,0 |
12,5–26,7 |
20,1 |
|
Форсаж |
- |
9,5–18,0 |
15,0 |
9,8–15,5 |
13,0 |
16,5–19,8 |
18,4 |
|
Добряк |
- |
10,5–17,7 |
13,8 |
8,7–17,8 |
15,0 |
11,8–19,0 |
14,3 |
|
52-12 |
- |
10,2–20,0 |
16,0 |
11,1–17,7 |
15,5 |
14,5–17,5 |
15,0 |
|
288-12 |
- |
11,3–18,5 |
15,8 |
9,8–14,8 |
12,5 |
15,2–19,0 |
17,7 |
|
94-13 |
- |
10,0–23,2 |
19,0 |
8,0–15,0 |
11,0 |
11,0–15,8 |
13,8 |
Примечание: «-» сорта, линии, не внесенные в Государственный реестр РФ.
Степень поражения гельминтоспориозными болезнями сортов ячменя селекции ФАНЦ Северо-Востока, %
В ходе микробиологического анализа семян урожая 2021 г. выявлена в целом их высокая инфицированность, которая составила в среднем 58,5 % и изменялась внутри сортимента от 40 % (Фермер) до 100 % (Памяти Родиной) (рис.). В структуре микрофлоры идентифицировали 8 грибных таксонов: Bipolaris spp., Alter-naria spp ., Cladosporium spp., Stemphylium spp.,
Curvularia spp., Torula spp., Penicillium spp. и Fusarium spp. (F. sporotrichoides, F. oxysporum). Выявлена также бактериальная инфекция (Bacillus spp.) со средней частотой 8,0 %, варьируя от 1,0 % (94-13) до 18,0 % (Лель). Cообще-ства микроорганизмов были разделены на возбудителей болезней растений и семян ячменя (Bipolaris spp., Fusarium spp., Alternaria spp., Cla- dosporium spp. и Bacillus spp.) и сопутствующую микрофлору (Stemphylium spp., Curvularia spp., Torula spp., Penicillium spp.). В структуре фитопатогенов вид Bipolaris sorokiniana идентифици- рован во всех образцах семян, за исключением сорта Дина, с частотой от 8,2 % (Андрей) до 71,0 % (Памяти Родиной) и средней долей 41,1 %.
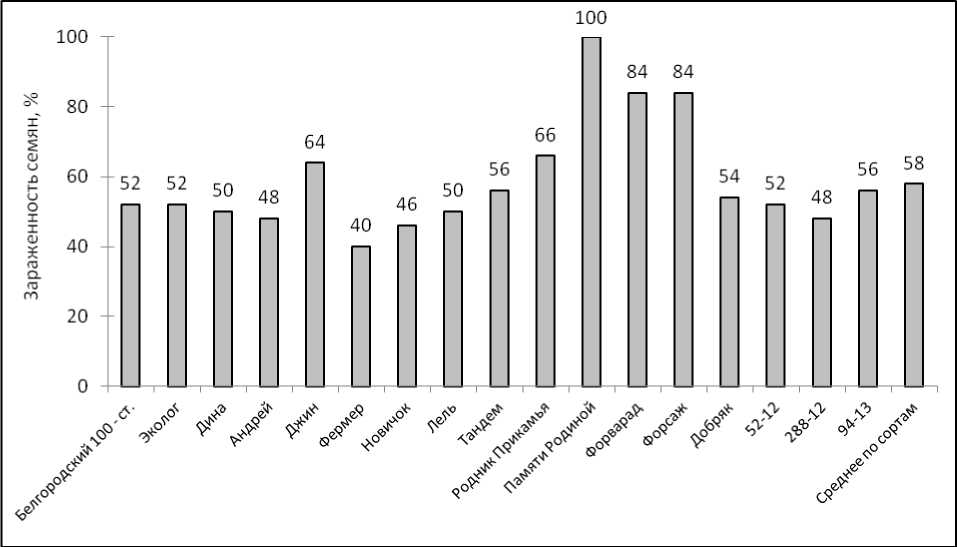
Общая зараженность семян изучаемых сортов и линий ячменя, %
На втором месте по частоте встречаемости находятся виды Alternaria spp. , изолированные из образцов семян 14 сортов со средней долей в контаминанте 30,8 % и варьированием от 10,5 % (Джин) до 53,0 % (Фермер, Форвард). Относительно небольшая частота фузариозной инфекции (в среднем 6,8 %) выявлена у 13 сортов ячменя. Микологи отмечают, что наиболее биологически опасны и токсичны большинство видов Fusarium spp . [21], Alternaria spp . и Bipolaris sorokiniana [22, 23], которые являются обильными представителями микобиоты растений и зерна ячменя.
Виды Cladosporium spp. , среди которых C. herbarum - возбудитель оливковой плесени листьев и колоса, постоянно присутствуют в кон-таминанте семенной инфекции. С относительно большой долей они с выявлены у четырех сортов: Новичок (22,0 %), Форвард (17,2 %), 52-12 (15,2 %) и 94-13 (30,0 %). Среди сопутствующей микрофлоры наибольшая встречаемость у представителей микромицетов Torula spp. и Stemphylium spp., которые идентифицированы в 7 и 6 образцах семян с долей в контаминанте 10,0-32,5 и 9,0-20,0 % соответственно.
В патокомплексе изучаемых сортов выявлено от 3 (Эколог, Лель) до 6 (Джин, Андрей, Добряк, 288-12) микроорганизмов. Не установлено явной сортоспецифичности в изменениях микробиотических комплексов семян ячменя.
В результате корреляционного анализа выявлена слабая зависимость (r) между инфи-цированностью семян ячменя и развитием корневых гнилей (г = 0,24), темно-бурой и сетчатой пятнистостью (r = 0,25 и 0,16). В связи с паразитизмом одного вида Bipolaris sorokiniana установлена также достоверная связь (при Р ≥ 0,95) между развитием корневых гнилей и темнобурой пятнистости листьев (г = 0,56).
Вследствие неблагоприятных факторов среды, в т.ч. и паразитизма видов Helminthosporium spp. , происходит преждевременное усыхание листьев и общее старение растений, что отражается на их продуктивности, поскольку более 70 % азота поступает из стареющих листьев [24]. В условиях 2021 г. мы проанализировали влияние грибной инфекции на состояние пигментного комплекса у изучаемых сортов ячменя (табл. 2). Содержание Chl а в листьях изменялось на 24,3 %, т.е. от 9,87 мг/г
(сорт Андрей) сухой массы до 13,03 мг/г (линия 94-13), Chl b – на 21,0 %, от 6,48 мг/г (сорт Белгородский 100) до 8,20 мг/г (линия 94-13), Car – на 28,1 %, от 2,08 мг/г (сорт Андрей) до 2,89 мг/г (линия 94-13). Наиболее высокие параметры фотосинтетического аппарата выявлены у перспективной линии 94-13, которая характеризуется повышенной устойчивостью к гельминтоспо-риозным болезням; относительно низкие – у восприимчивого сорта Андрей. Известно, что недостаток Chl b негативно влияет на смену этапов онтогенеза у ячменя и приводит к ускоренному старению растений, а его сверхпродукция замедляет этот процесс [8]. В наших исследованиях наиболее низкие показатели Chl b у стандартного сорта Белгородский 100, высокие – у линии 94-13.
Таблица 2
|
Сорт, линия |
Хлорофилл а |
Хлорофилл b |
Каротиноиды |
Соотношение хлорофиллов a/b |
Соотношение суммы хлорофиллов / каротиноидов |
|
Белгородский 100 |
10,97 сd |
6,48 a |
2,58 efg |
1,69 hij |
6,83 b |
|
Эколог |
11,84 ghi |
6,89 abcd |
2,70 gh |
1,72 j |
6,92 bc |
|
Дина |
10,17 ab |
7,32 defg |
2,12 a |
1,39 ab |
8,31 c |
|
Андрей |
9,87 a |
7,32 defg |
2,08 a |
1,35 a |
8,25 bc |
|
Джин |
10,96 cd |
6,63 a |
2,51 def |
1,69 hij |
7,12 a |
|
Фермер |
12,67 jk |
7,80 fgh |
2,87 ij |
1,63 fghij |
7,14 bc |
|
Новичок |
11,63 defgh |
7,33 defg |
2,62 fg |
1,59 defgh |
7,24 bc |
|
Лель |
12,42 ijk |
7,21 bcdef |
2,83 hij |
1,72 ij |
6,95 bc |
|
Тандем |
11,82 fghi |
7,33 defg |
2,53 efg |
1,62 fghij |
7,57 bc |
|
Родник Прикамья |
11,08 cde |
6,75 abc |
2,49 def |
1,65 ghij |
7,16 bc |
|
Памяти Родиной |
11,69 efgh |
7,23 cdef |
2,58 efg |
1,62 fghij |
7,35 bc |
|
Форвард |
11,10 cde |
7,55 efg |
2,43 cde |
1,47 bc |
7,70 bc |
|
Форсаж |
12,00 hi |
7,88 gh |
2,62 fg |
1,52 cdef |
7,60 bc |
|
Добряк |
10,53 bc |
6,82 abcd |
2,30 bc |
1,54 cdefg |
7,53 bc |
|
52-12 |
11,47 defgh |
7,71 fgh |
2,47 cdef |
1,49 bcde |
7,76 bc |
|
288-12 |
11,08 cde |
7,57 fg |
2,34 cd |
1,46 bc |
7,98 bc |
|
94-13 |
13,03 k |
8,20 h |
2,89 j |
1,59 efgh |
7,35 bc |
Примечание: в каждом столбце варианты, сопровождаемые одинаковыми латинскими буквами, не отличаются статистически по критерию Дункана при р ≤ 0,05.
Содержание пигментов в листьях ярового ячменя, мг/г сухой массы
Корреляционный анализ показал неоднозначное действие грибных болезней на содержание фотосинтетических пигментов. Отрицательная зависимость установлена между развитием темно-бурой пятнистости и содержанием Chl а (r = -0,134) и Car (r = -0,217); сетчатой пятнистости и совокупностью Chl а и Chl b в ССК (r = -0,439); корневых гнилей и Chl а (r = -0,325), Chl b (r = -0,316) и Car (r = -0,371). Более сильные взаимосвязи пигментов в связи с развитием корневых гнилей обусловлены негативным вли- янием почвенной инфекции на общий гомеостаз растений, что снижает накопление зеленой биомассы и продукции пигментов.
Заключение. В результате исследований районированные сорта и перспективные линии ячменя селекции ФАНЦ Северо-Востока охарактеризованы по иммунологическому состоянию растений и семян. В ходе 30-летнего цикла селекционной работы произошло некоторое улучшение линий по отношению к корневым гнилям и темно-бурой пятнистости листьев, но нет про- гресса по повышению устойчивости к сетчатой пятнистости. В целом лучшее иммунологическое состояние у трех сортов (Дина, Форвард, Добряк) и трех линий (288-12, 52-12, 94-13). Между инфицированностью семян и развитием болезней зависимость слабая (r = 0,16–0,25); развитием корневых гнилей и темно-бурой пятнистости листьев достоверная (при Р ≥ 0,95) средней степени (r = 0,56). Связь между содержанием фотосинтетических пигментов и разви- тием болезней разнонаправленная и преимущественно слабая. В наибольшей степени негативное влияние на содержание пигментов связано с корневой инфекцией (Chl а: r = -0,325; Chl b: r = -0,316; Car – r = -0,371), что может быть индуцировано ранним увяданием растений и отмиранием листьев из-за поражения корневой системы растений.
Список литературы Генотипическая и физиологическая адаптация сортов ячменя селекции Фанц северо-востока к грибным болезням
- Аниськов Н.И. и др. Оценка адаптивной способности сортов ярового ячменя селекции СибНИИСХ в условиях Сибирского Прииртышья // Вестник ОмГАУ. 2016. № 4 (24). С. 5-9.
- Баталова Г.А. Селекция зерновых культур на иммунитет на северо-востоке европейской территории России // Зерновое хозяйство России. 2017. № 3. С. 8-11.
- Щенникова И.Н, Кокина Л.П. Перспективы селекции ячменя для условий Волго-Вятского региона (аналитический обзор) // Аграрная наука Евро-Северо-Востока. 2021. № 22(1). С. 21-31. DOI: 10.30766/20729081.2021.22.1.21-31.
- Шешегова Т.К. и др. Источники устойчивости ярового ячменя к гельминтоспориозным болезням и их использование в селекции // Аграрная наука Евро-Северо-Востока. 2016. № 54. С. 9-14. DOI: 10.30766/20729081.2016.54.5.09-14.
- Шешегова Т.К. и др. Зависимость грибной инфекции зерновых культур от сезонной динамики климатических факторов // Достижения науки и техники АПК. 2017. Т. 31. № 4. С. 58-62.
- Захаренко В.А., Васютин А.С. Фитосанитарные риски в зерновом производстве // Защита и карантин растений. 2014. № 7. С. 3-7.
- Иванов Л. А. и др. Изменение содержания хлорофиллов и каротиноидов в листьях степных растений вдоль широтного градиента на Южном Урале // Физиология растений. 2013. Т. 60. С. 856-864.
- Kimm H., Guan K., Jiang C, Miao G., Wu G., Suyker A.E., Ainsworth E.A., Bernacchi C.J., Montes C.M., Berry J.A., Yang X., Frankenberg C., Chen M., Köhler P. A physiological signal derived from sun-induced chlorophyll fluorescence quantifies crop physiological response to environmental stresses in the U.S. Corn Belt // Environ. Res. Lett. 2Q21. 16. 124Q51. DOI. 1Q.1Q88/1748-9326/ac3b16.
- Furbank R.T., Quick W.P., Sirault X.R.R. Improving photosynthesis and yield potentisl in cereal crops by targeten genetic manipulation: progress and challenges. Fild. Crop. Res. 2Q15. Vol. 182. pp. 19-29. DOI: 1Q.1Q16/j.fcr.2Q15.Q4.QQ9. 1Q. Хисамова К.Ч., Яшин Е.А., Куликова A.X. Формирование посевов и урожая ячменя в зависимости от применения в системе удобрения соломы и биологического препарата Байкал ЭМ-1 // Вестник Ульяновской государственной сельскохозяйственной академии. 20l6. № 2 (34). С. 65-73. DOI: 1Q.18286/1816-45Q1-2Q16-2-65-73.
- Мокроносов А.Т. Фотосинтетическая функция и целостность растительного организма // 42-е Тимирязевское чтение. М.: Наука, 1983. 64 с.
- Коломейченко В.В., Беденко В.П. Теория продукционного процесса растений и фитоценозов // Вестник Орловского государственного аграрного университета. 2008. № 4 (13). С. 17-21.
- Григорьев М.Ф. Методические указания по изучению устойчивости зерновых культур к корневым гнилям. Л.: ВИР, 1976. 60 с.
- Родина H.A., Ефремова З.Г. Методические рекомендации по селекции ячменя на устойчивость к болезням и их применение в НИИСХ Северо-Востока. М., 1986. 79 с.
- Афанасенко О.С. Устойчивость ячменя к гемибиотрофным патогенам // Идентифицированный генофонд растений и селекция. СПб.: ВИР, 2005. С. 592-6Q9.
- Билай В.И. Фузарии. Киев: Наукова думка, 1977. 442 с.
- Пидопличко Н.М. Грибы - паразиты культурных растений // Определитель. Минск, 1977. Т. 2. 299 с.
- Хасанов Б.А. Определитель грибов - возбудителей «гельминтоспориозов» растений из родов Bipolaris, Drechslera, Exserohilum. Ташкент, 1992. 232 с.
- Lichtenthaler H.K., Bushmann C. Chlorophylls and carotenoids: measurement and characterization by UV-VIS spectroscopy // Current protocols in food analytical chemistry. 2001. F.4.3.1-F.4.3.8. DOI: 10.1002/0471142913.faf0403s01.
- Санин С.С., Корнева Л.Г., Поляков Т.М. Прогноз риска развития эпифитотий септориоза листьев и колоса пшеницы // Защита и карантин растений. 2015. № 3. С. 33-36.
- Гаврилова О.П. и др. Совместная встречаемость метаболитов грибов Alternaría и Fusarium, ассоциированных с зерновыми культурами // Российская сельскохозяйственная наука. 2020. № 6. С. 20-23.
- Орина А.С. и др. Симбиотические взаимоотношения грибов рода Fusarium и Alternaria, колонизирующих зерно овса // Сельскохозяйственная биология. 2017. Т. 52. № 5. С. 986-994.
- Орина А.С. и др. Микромицеты Altermaria spp. и Bipolaris sorokiniana и микотоксины в зерне, выращенном в Уральском федеральном округе // Микология и фитопатология. 2020. Т. 54. № 5. С. 365-377.
- Ospina L.A., Clément G., Masclaux-Daubresse C. Metabolite profiling for leaf Senescence in barley reveals decreases in amino acids and glycolysis intermediates // Agronomy. 2017. 7 (15). DOI:10.3390/agronomy7010015.


