Гены-мишени для получения сортов картофеля (Solanum tuberosum L.) с заданными свойствами крахмала
Автор: Хлесткин В.К., Пельтек С.Е., Колчанов Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
Крахмал - важное сырье органического происхождения, легкодоступное в промышленных масштабах для хозяйственной деятельности человека. Оптимальный набор физико-химических свойств молекул амилозы и амилопектина, составляющих крахмал, значительно варьирует в зависимости от области применения. Молекулярный, надмолекулярный состав и строение этих молекул регулируются генами биосинтеза и могут рассматриваться как фенотипические признаки, по которым возможна селекция. Комбинируя определенные варианты генов, можно запрограммировать растения картофеля на производство крахмала с заданной структурой и свойствами. Цель представленного обзора - обсуждение вариантов генов или их сочетаний, программирующих биосинтез крахмала в той или иной модификации, в зависимости от планируемого практического результата при последовательной постановке задачи на этапах «промышленное применение крахмала®свойства крахмала®белки (ферменты)®кодирующие гены». Для изменения генотипа растений может использоваться как классическая или маркер-опосредованная комбинационная селекция, так и методы генетической инженерии, в том числе получение нетрансгенных растений с заданными свойствами на основе технологий геномного редактирования. Биосинтез крахмала в клетках мякоти клубня картофеля происходит в цитозоле и пластидах с участием семи основных ферментов и завершается в крахмальной грануле (на ее поверхности или внутри) с привлечением еще около десятка ферментов. Так, нокаут гена GBSS кардинально повышает содержание амилопектина в крахмале, достигающее более 98 %, поэтому именно генотипы с нокаутом по указанному гену были получены раньше других генетически модифицированных форм картофеля с измененным крахмалом и протестированы в полевых условиях в качестве технической культуры. Крахмал с высоким содержанием амилопектина дает гели повышенной оптической прозрачности, устойчивости при центрифугировании, а также демонстрирует повышение максимальной и конечной температуры желатинизации и измененные реологические свойства. Если кроме гена GBSS ингибировать гены крахмалсинтаз SSII и SSIII, то крахмал образует гели, которые значительно стабильнее получаемых из обычного крахмала в условиях длительной заморозки и в циклах «замораживание-оттаивание». Ингибирование гена SBEI, кодирующего основной разветвляющий фермент, на практике не приводит к повышению количества амилозы в модифицированном картофеле. Однако совместное подавление экспрессии генов SBEI и SBEII позволяет получать крахмал с высоким содержанием амилозы (60-89 %) с примесью небольшого количества амилопектина. При усилении экспрессии фермента SBEII образуется крахмал с повышенной степенью разветвленности молекул амилопектина и укороченными цепями. При подавлении экспрессии SBEII, наоборот, степень разветвленности амилопектина снижается и возрастает количество удлиненных цепей. Нокаут гена GWD приводит к синтезу амилопектина со сниженным содержанием фосфатных групп и, соответственно, к уменьшению вязкости гелей на основе такого крахмала. Кроме того, скорость биокаталитического гидролиза крахмала с пониженным содержанием фосфатных групп уменьшается. Повышенный уровень экспрессии SSIV приводит к увеличению содержания крахмала в клубнях трансгенных растений как в теплице, так и в полевых условиях. На генетическом уровне можно также корректировать морфологию и кристалличность гранул крахмала. Как правило, морфологические признаки, в том числе физико-хими-ческие свойства крахмала, регулируются не одним-двумя генами, а генной сетью. Поэтому выявление локусов количественных признаков и идентификация диагностических маркеров на их основе позволяет применять методы маркер-ориентированной селекции (marker-assistant selection - MAS) для получения сортов картофеля, продуцирующих крахмал с заданными свойствами, который будет представлять собой оптимальное сырье для тех или иных отраслей промышленности.
Картофель, крахмал, гены биосинтеза, крахмалсинтаза, амилоза, амилопектин, разветвляющий фермент, физико-химические свойства
Короткий адрес: https://sciup.org/142213766
IDR: 142213766 | УДК: 633.491:664.22:631.523:577.21 | DOI: 10.15389/agrobiology.2017.1.25rus
Текст обзорной статьи Гены-мишени для получения сортов картофеля (Solanum tuberosum L.) с заданными свойствами крахмала
Крахмал — одна из немногих сложных органических субстанций, легкодоступных для хозяйственной деятельности человека в промышлен-
Работа выполнена в рамках Проекта ¹ 0324-2016-0006 «Коллекция генотипов сельскохозяйственных растений для проведения фундаментальных исследований в области генетики растений и разработки генетических технологий маркер-ориентированной и геномной селекции».
ном масштабе. С точки зрения однородности состава при богатых возможностях модификации входящих в него молекул амилозы и амилопектина (1, 2) крахмал выигрывает у таких источников органического сырья, как нефть, содержащая в основном более простые молекулы углеводородов в составе трудноразделимых смесей, или лигноцеллюлоза, требующая химических процессов для разделения составляющих ее разнородных поли- и олигомеров. Многообразием продуктов, которые можно получить из крахмала в результате химических или биотехнологических превращений, определяется спектр областей его применения (3). Это доступный, экологичный и экономичный биополимер, который широко используется в нативном или модифицированном виде (рис. 1). В Европе 70-80 % крахмала идет на непищевые нужды (4, 5). В России нативные крахмалы широко применяются в пищевой промышленности (кондитерской, хлебобулочной, при изготовлении колбасных изделий и консервов), а также при производстве гофрокартона (6).
Ферменты биосинтеза крахмала
' Супра)мол екулярт юс строение крахмала
> GBSS
> SSI-SSIV
> GWD
> SBE, SBEII
> ISO
> PULL
> Другие
Практически важные свойства
Гены
> Вязкость гелей
> Прозрачность гелей
> Легкость переработки
> Скорость набухания
> Способность держать форму
> Устойчивость к заморозке-разморозке
> Адгезия
> Плотность
> Способность впитывать и удерживать влагу
> Термостойкость гелей
> Устойчивость к деформациям сдвига
> Устойчивость к ретроградации
> Другие
Отрасли промышленности
> Целлюлозно-бумажная
> Пищевая
> Химическая
> Газо- и нефтедобыча
> Производство клеев и адгезивов
^ Текстильная
> Строительная
> Приготовление кормов и добавок для животных
> Медицина и фармацевтика
> Защита металлов от коррозии
> Сельское хозяйство
> Косметическая
> Другие
> Кристалличность
> Форма зерна
> Соотношение амилоза/амилопектин
> Молекулярная масса
> Число разветвлений
> Длина полимерных цепей
> Фосфорилирование
> Надмолекулярные комплексы амилопектина и амилозы
> Другие
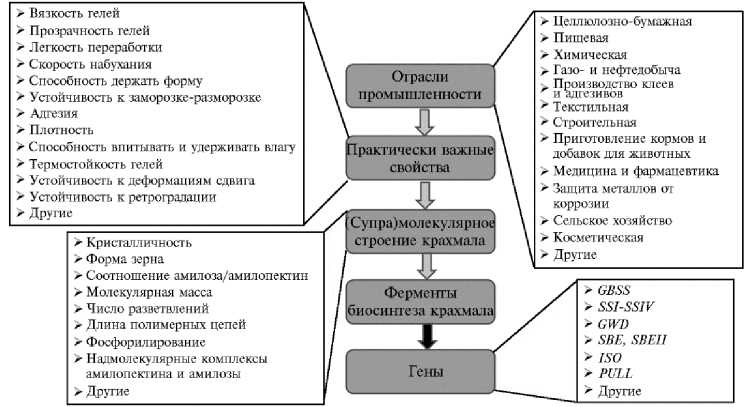
Рис. 1. Молекулярные и надмолекулярные характеристики, которые определяются генами, контролирующими ферментативный биосинтез крахмала в клетке, и обусловливают его практически значимые свойства и области применения. Указаны гены-мишени крахмалсинтаз ( GBSS и SSI-SSIV ), H 2 O-дикиназы ( GWD ), ферментов, разветвляющих крахмал ( SBEI и SBEII ), изоамилазы ( ISO ), пуллуланазы ( PULL ).
Крахмал — сложный углевод растительного происхождения, состоящий из двух видов полимерных молекул (амилозы и амилопектина), каждый из которых представляет собой гомополимер, образованный из одинаковых мономерных звеньев (остатков глюкозы), с общей формулой (C 6 H10O5)n. Молекулярный состав и строение, а также супрамолекулярная организация этих молекул регулируются генами биосинтеза крахмала через соответствующие белки и, следовательно, могут рассматриваться как фенотипические признаки и объекты селекции. Сочетание определенных вариантов таких генов позволяет запрограммировать растение картофеля на производство крахмала с заданной структурой и свойствами.
Практический интерес представляют соотношение амилозы и амилопектина, их разветвленность и молекулярная масса, кристалличность, размер и пористость гранул, количество фосфатных остатков в полимерных цепях, реологические и оптические свойства крахмальных гелей (см. рис. 1). Молекулярными и супрамолекулярными характеристиками нативного крахмала обусловлены его практически значимые качества, благодаря которым та или иная разновидность этого природного полимера может найти при-26
менение в определенной отрасли промышленности. Оптимальный набор физико-химических свойств молекул, составляющих крахмал, значительно варьирует в зависимости от области его использования.
Цель настоящего обзора — обсуждение вариантов генов или их сочетаний, программирующих биосинтез крахмала в разной модификации, в зависимости от планируемого практического результата с последовательной постановкой задачи на этапах «промышленное применение крахма-ла→свойства крахмала→белки (ферменты)→кодирующие гены».
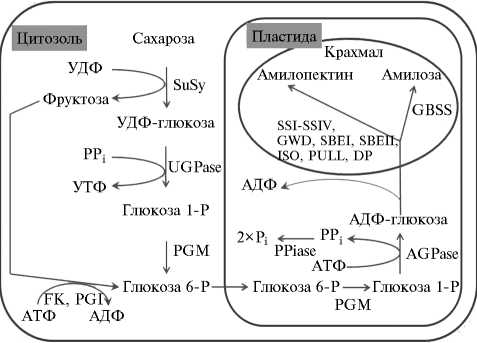
Рис. 2. Схема биосинтеза крахмала в клетке мякоти клубня картофеля (7, 8): SuSy — сахарозосинтаза; UGPase — УДФ-глюкозо-пирофосфорилаза; FK — фруктокиназа; PGM — фосфоглюкомутаза; PGI — фосфоглюкоизомераза; PPiase — пирофосфатаза; AGPase — АДФ-глюкозо-пирофосфорилаза; GBSS — крахмалсинтаза, связанная с крахмальными гранулами; SSI-SSIV — крахмалсинтазы; SBEI-SBEII — ферменты, разветвляющие крахмал; GWD — H 2 O-дикиназа; ISO — изоамилаза; PULL — пуллуланаза; DP — фермент диспропорционирования; PP i — пирофосфат; P i — фосфат.
Биосинтез крахмала в клетках мякоти клубня происходит с участием 7 основных ферментов в цитозоле и пластидах и еще около 10 — на поверхности или внутри крахмальных зерен, находящихся в пластидах (рис. 2).
Знание механизмов биосинтеза позволяет повлиять на процесс с целью скорректировать физико-химические свойства крахмала так, чтобы они лучше соответствовали потребностям определенных отраслей промышленности. Это влияние может быть осуществлено как при комбинационной селекции в ее классическом исполнении или с помо- щью диагностических ДНК-маркеров (marker-assisted selection, MAS — маркер-ориентированная селекция), так и с привлечением генетической инженерии, в том числе для получения нетрансгенных растений с заданными свойствами на основе безопасных технологий геномного редактирования (9, 10). Для маркер-ориентированной селекции и геномного редактирования необходима информация о целевых генах. Одна из сложностей биологического получения крахмала с заданными свойствами заключается в том, что измеряемые физико-химические свойства (признаки) крахмала, как правило, формируются генной сетью в результате работы совокупности различных локусов. Иногда можно выделить несколько самых важных контролирующих генов, ингибирование или активация которых приводит к значимому изменению определенного свойства крахмала, и только в исключительных случаях удается наблюдать простую корреляцию «один ген — один химический признак».
Несмотря на то, что законодательное регулирование Российской Федерации в настоящее время не поддерживает коммерческое производство генетически модифицированных растений, их получение в лабораторных условиях целесообразно по ряду причин (11). Одна из них — подтверждение связи между экспрессией одного либо нескольких генов и свойствами, проявляющимися у полученного организма. Рассмотрим известные примеры влияния генетической модификации картофеля Solanum tuberosum L. на некоторые физико-химические свойства его крахмала.
Высокое содержание амилопектина. Картофельный крахмал содержит около 80 % разветвленного полисахарида амилопектина и 20 % линейного полисахарида амилозы. Основной ген, ответственный за синтез амилозы, — GBSS (granule-bound starch synthase), кодирующий связанную с гранулами крахмалсинтазу. Модификация этого гена кардинально меняет соотношение амилозы и амилопектина (вплоть до содержания амилопектина > 98 %). Именно генотипы с нокаутом по указанному гену GBSS были получены раньше других генно-модифицированных форм картофеля с измененным крахмалом и протестированы в полевых условиях в качестве технической культуры для промышленного использования, например сорт Amflora (EH92-527-1) компании «BASF Plant Science GmbH» (Германия) (12, 13) или сорт компании «Avebe U.A.» (Нидерланды) (14). Совсем недавно нокаут гена GBSS был успешно произведен с использованием новейшей системы геномного редактирования CRISPR/Cas9. Подход, использованный авторами, позволил произвести сайт-направленный мутагенез без встраивания в геном картофеля чужеродной ДНК. То есть были получены модифицированные, но не трансгенные растения картофеля. При этом у 2 % регенерантов редактирование прошло во всех четырех аллелях гена GBSS . Наличия хотя бы одного функционального аллеля гена GBSS достаточно для того, чтобы в клубне синтезировалось значительное количество амилозы, и только ингибирование всех четырех аллелей приводит к образованию крахмала, содержащего в основном амилопектин (15), что существенно сказывается на технических характеристиках крахмала. Крахмал с высоким содержанием амилопектина дает гели повышенной оптической прозрачности и устойчивости при центрифугировании, а также демонстрирует рост (на 5-6 ° С) максимальной и конечной температуры желатинизации (16) и изменение реологических свойств (17). Если кроме гена GBSS ингибировать гены крахмалсинтаз SSII и SSIII , то клубневый крахмал получается низкоамилозным с укороченными концевыми цепями амилопектина. Гели из такого крахмала значительно стабильнее полученных из обычного крахмала как при длительной заморозке, так и в нескольких циклах замораживания и оттаивания (18). Низкоамилозный крахмал лучше подходит для получения загустителей для текстильной и целлюлозно-бумажной промышленности (19).
Высокое содержание амилозы. Для исключения синтеза амилопектина, представляющего собой разветвленный полимер, необходимо ингибировать ген SBE , который кодирует фермент, разветвляющий крахмальные цепи (starch branching enzyme — SBE). Однако репрессия гена основного разветвляющего фермента SBEI на практике не привела к повышению количества амилозы в модифицированном картофеле (20). Нокаут гена SBEII , ответственного за синтез минорной формы разветвляющего фермента SBEII, привел к умеренному увеличению относительного содержания амилозы (на 38 %) (21). И только совместное ингибирование обоих генов SBEI и SBEII позволило получить крахмал с высокой долей амилозы (60-89 %) и примесью небольшого количества разветвленного амилопектина. Таким образом, фермент SBEII необходим для синтеза нормального разветвленного амилопектина и, возможно, усиливает активность SBEI, а вот роль SBEI пока не удается прояснить в деталях, учитывая некоторые различия в механизмах действия этих ферментов (5, 22). Испытания в полевых условиях в течение ряда лет подтвердили, что у сортов картофеля, полученных ингибированием обоих разветвляющих ферментов, высокое содержание амилозы в крахмале сохраняется.
Ингибирование генов SBEI и SBEII также приводит к 5-6-кратному росту числа фосфатных групп в молекулах. Кроме того, при увеличении содержания амилозы в крахмале с 20 до 60-80 % заметно снижается его накопление в клубнях (с 22-23 до 10-15 %), а также уменьшается размер гранул (с 50-63 до 32-39 мкм) (23).
Разветвленность амилопектина. У картофеля за ветвление молекулы амилопектина отвечают только две изоформы SBE: основной SBEI и минорный SBEII разветвляющие ферменты. Конструирование цис-гена, состоящего из фрагментов комплементарной и геномной ДНК (кДНК и гДНК) гена SBEII под контролем сильного промотора другого гена картофеля — GBSS , позволило усилить экспрессию фермента SBEII. У модифицированных форм картофеля разветвленность молекул амилопектина была выше (степень полимеризации 6-12, в основном ближе к 6), а цепи короче, чем у селекционных сортов (24). При подавлении синтеза SBE, наоборот, степень разветвленности амилопектина снижается (25), а число удлиненных фосфорилированных цепей со степенью полимеризации > 14 растет.
При ингибировании экспрессии гена SBE крахмал приобретает способность желатинизироваться при снижении температуры (на 3 ° С) и меньшей концентрации мочевины (агента для желатинизации), уменьшается его вязкость и увеличивается объем при набухании в воде (24).
Содержание фосфатных групп. Некоторые полисахаридные цепочки в гранулах крахмала содержат ковалентно присоединенные фосфатные группы. В промышленности крахмал специально фосфорилируют обработкой ортофосфорной кислотой, получая пищевую добавку Е1410 — крахмал с повышенным содержанием фосфатных групп. Фосфорилированный крахмал с отрицательно заряженными фосфатными группами, которые в растворе отталкиваются друг от друга, значительно быстрее набирает вязкость, дает более прозрачные и вязкие гели, менее склонные к ретроградации. Кроме того, фосфатные остатки могут эффективно связываться с ионами металлов, делая фосфорилированный крахмал эффективным лигандом.
В картофельном крахмале фосфорилированы 0,2-0,5 % глюкозных мономеров, что в несколько раз выше, чем в крахмалах из других источников (26). Самый важный фермент фосфорилирования крахмала — а -глюкан-H2O-дикиназа (27, 28), кодируемый геном GWD . Сообщается, что нокаут гена GWD приводит к синтезу амилопектина со сниженным содержанием фосфатных групп и, соответственно, уменьшению вязкости гелей на основе такого крахмала (27, 29). Установлено также, что скорость био-каталитического гидролиза крахмала, для которого характерно пониженное содержание фосфатных групп, уменьшается (30). Для арабидопсиса показано наличие еще одного фосфорилирующего фермента — фосфоглю-кан-H2O-дикиназы (PWD), который превращает С6-фосфорилированный фрагмент молекулы в С3-фосфорилированный (31). Однако данных о наличии фермента с аналогичным действием у картофеля пока нет.
Важно отметить, что с уменьшением количества разветвлений полимерной цепи глюкана, то есть при подавлении активности разветвляющих ферментов SBE, степень фосфорилирования цепей возрастает (20), иногда даже в 5-6 раз (5).
Методом ассоциативного картирования были выявлены генетические маркеры, связанные со степенью фосфорилирования крахмала по положениям С3 и С6 в остатках D-глюкозы. Показана значимая ассоциация признака с определенными SNP (single nucleotide polymorphism — однонуклеотидный полиморфизм) в генах, кодирующих а -глюкан-H 2 O-ди-29
киназу (GWD), фермент, разветвляющий крахмал (SBEI), и крахмалсинта-зу (SSIII). Также обнаружена связь с полиморфизмом простой повторяющейся последовательности (SSR — simple sequence repeat) внутри гена, кодирующего разветвляющий фермент SBEII. При этом SNP в гене GWD ассоциирован исключительно с C6-фосфорилированием, в гене SSIII — с С3-фосфорилированием, а полиморфные сайты в SBEI и SBEII — и с С3-, и с С6-фосфорилированием (32).
Следовательно, модификации картофеля, направленные на усиление экспрессии гена GWD и (или) подавление проявления генов SBE и SSIII , позволили бы производить востребованный в промышленности крахмал с повышенным содержанием фосфатных групп, минуя стадии химической обработки природного сырья, то есть получать экологичный продукт со сниженной себестоимостью.
Содержание крахмала. Содержание крахмала в клубне зависит от ферментативных реакций как синтеза, так и расщепления крахмала. Три основных стадии образования крахмала контролируются тремя ферментами: АДФ-глюкозо-пирофорсфорилазой (AGPase), крахмалсинтазой (SS) и разветвляющим крахмал ферментом (SBE). Причем именно AGPase (кодируется геном glgc-16 ) катализирует реакцию, лимитирующую скорость биосинтеза крахмала. Действительно, экспрессия трансгена glgc-16 в растениях картофеля повышала содержание крахмала на 30 % (33, 34). Усиление экспрессии SSIV увеличивало количество крахмала в клубнях трансгенных форм как в теплице, так и в полевых условиях с 94 г до 98-137 г на одно растение, обеспечивая рост выхода продукта с 4,25 до 4,40-6,10 т/га (в зависимости от сорта) (35).
Расщепление полимерных цепей крахмала регулируется амилазами. Из-за их активности содержание крахмала в клубне падает с увеличением времени хранения. Недавно было показано, что ген SbAl ингибирует амилазу, замедляя гидролиз крахмала и контролируя его содержание в клубне. При этом количество восстанавливающих сахаров сокращается. Как следствие, чипсы, произведенные из таких клубней, имеют менее интенсивную коричневую окраску (34). Фосфатные группы в молекулах амилопектина способствуют гидролизу крахмала, поэтому сокращение их количества приводит к накоплению этого полисахарида. В картофеле сверхэкспрессия гена, который регулирует содержание фосфора в крахмале у арабидопсиса ( AtPAP2, кодирует фосфатазу пурпурной кислоты), приводит к увеличению выхода (в 2-3 раза) клубней и их размера за счет содержания твердых веществ и крахмала (36).
Селекционное регулирование активности генов, ответственных за фосфорилирование и синтез полимерных цепей крахмала, а также ингибирование амилаз, может быть использовано для получения технических сортов картофеля с повышенным содержанием крахмала.
Кристалличность гранул. Для клубневых крахмалов, включая картофельный, характерно наличие B-полиморфов в кристаллических доменах (37), обычно хорошо структурированных, компактных и ответственных за формирование крахмальных гранул с визуально гладкой поверхностью. Считается, что именно супрамолекулярной организацией ветвей амилопектина в крахмале обусловлена его кристалличность (38). Благодаря выскоупорядоченной структуре гранулы крахмала очень устойчивы к амилолитической деградации (39). Действительно, не обнаружено разницы в размерах кристаллитов амилопектина, толщине кристаллической ламеллы гранул и полиморфной структуре крахмала из клубней картофеля с подавленной экспрессией генов GBSS (кодирует крахмалсинтазу, контролирую-30
щую синтез амилозы) либо GWD и немодифицированных растений. Пониженное содержание ферментов GBSS или GWD влияет лишь на характер дефектов в кристаллитах амилопектина (40). В литературе описано влияние крахмалсинтазы (SSII) у риса (41), связанной с гранулами крахмал-синтазы (GBSS) у представителей Chlamydomonas (42) и белка SGP (starch granule protein — белок крахмальных гранул) у пшеницы (43) на кристалличность зерен крахмала, но экспериментальный материал по картофелю ограничен. Поэтому пока что достаточно сложно предложить стратегию повышения биодоступности и реакционной способности крахмального зерна при помощи селекции или генной модификации. Однако стоит иметь в виду, что облегчение этих процессов в промышленных масштабах могло бы привести к снижению энергозатрат, экономии воды, реагентов и операционного времени, а также обеспечить более глубокую переработку крахмала.
Морфология гранул. Интересно, что экспрессия чужеродного фермента, разветвляющего крахмал (SBE из Escherichia coli ), не усиливает ветвление амилопектина у картофеля, однако заметно изменяет морфологию крахмальных гранул: у амилозосодержащего мутанта образуются бугристые гранулы с глубокими порами, у безамилозной линии — бугристые слипшиеся гранулы (43, 44).
Не каждый вид бактерий или дрожжей способен разрушать супра-молекулярную организацию полимерных молекул крахмала для вовлечения их в биохимические превращения. Из-за ограниченной доступности этого полисахарида степень его модификации при химической обработке также остается низкой, а для ее повышения требуется температура выше температуры желатинизации. В крахмальных гранулах с нарушенной морфологией, увеличенной площадью поверхности, б о льшим размером пор реакционные центры доступнее для химических реагентов и ферментов, вследствие чего могут проявлять повышенную реакционную способность, в том числе при низких температурах.
Генетические маркеры количественных признаков. Несмотря на то, что свойства крахмала в клубнях картофеля удается изменять, влияя на определенное число генов, общий характер проявления экспрессионной активности участков ДНК при формировании количественных признаков значительно сложнее. Методом интервального картирования геномов в популяции диплоидного картофеля было показано, что, например, фосфорилирование крахмала регулируется и (или) контролируется пятью локусами количественных признаков (quantitative trait loci, QTL) на 2-й, 5-й и 9-й хромосомах, а содержание амилозы — шестью локусами на 2-й, 3-й, 5-й, 7-й и 10-й хромосомах. Аналогично были раскрыты локусы, контролирующие размер зерна крахмала, содержание крахмала в клубне и температуру желатинизации крахмала (45, 46). Многие выявленные QTL по локализации совпали с известными генами, кодирующими ферменты биосинтеза крахмала, но обнаружились и такие локусы, в области которых ранее не картировался ни один из генов биосинтеза крахмала. Нуклеотидные последовательности, соответствующие этим QTL, еще не расшифрованы, молекулярные механизмы, с помощью которых они влияют на изменение свойств крахмала, не ясны. Тем не менее, устойчивая ассоциация таких локусов с признаками и наличие ДНК-маркеров, тесно сцепленных с этими локусами, позволяет использовать полученные результаты для маркер-ориентированной селекции. Действительно, для тетрапло-идного картофеля были обнаружены три маркера, связанные с признаками продуктивности — выходом клубней с гектара и содержанием крахмала в клубне (47), которые позже использовали для маркер-ориентированной селекции (48). В другой работе показано, что однонуклеотидные замены в генах, кодирующих инвертазы Pain1 и InvCD141, крахмалсинтазу SSIV, фактор транскрипции StCDF1 и аминопептидазу LapN, ассоциированы с выходом клубней и крахмала и содержанием крахмала в клубне (49). Выявленные SNP также могут использоваться для контролируемого отбора форм картофеля, обладающих заданными технологическими свойствами. Кроме того, маркеры, связанные с желательными количественными признаками у картофеля, возможно, будут обнаружены в его пластидном и митохондриальном геномах. Так, показано, что цитоплазма W/y-типа у европейских сортов картофеля коррелирует с высоким содержанием крахмала (50). Данные о влиянии генов биосинтеза крахмала на его свойства обобщены в таблице 1.
-
1. Гены биосинтеза крахмала, соответствующие ферменты, их влияние на свойства крахмала у картофеля (Solanum tuberosum L.) (7, 50-52)
-
2. Влияние ингибирования и экспрессии генов биосинтеза картофельного крахмала на его физико-химические свойства
Ген или сочетание генов
GBSS
Результат ингибирования или экспрессии
Ингибирование: снижение содержания амилозы
|
Ген |
Номер в базе NCBI |
Группа сцепления |
Ссылка в базе NCBI |
Продукт |
EC |
Свойства крахмала |
|
SuSy |
102577594 |
VII, XII |
Baroja-Fern a ndez E. et al . Plant Cell Physiol, 2003, 44(5): 500-509 |
Сахарозосинтаза |
2.4.1.13 |
Содержание в клубне |
|
UGPase |
102577726 |
XI |
Katsube T. et al . Biochemistry, 1991, 30(35): 8546-8551 |
УДФ-глюкозо-пирофосфорилаза |
2.7.7.9 |
Содержание в клубне |
|
PGM |
102585015 |
Нет данных |
Отсутствует |
Фосфоглюкомутаза |
5.4.2.2 |
Содержание в клубне |
|
FK |
102577816 |
VI |
Smith S.B. et al . Plant Physiol., 1993, 102(3): 1043 |
Фруктокиназа |
2.7.1.4 |
Содержание в клубне |
|
PGI |
102577825 |
Нет данных |
Отсутствует |
Фосфоглюкоизомераза |
5.3.1.9 |
Содержание в клубне |
|
PPiase |
102584131 |
VIII, IX, XII |
du Jardin P. et al . Plant Physiol., 1995, 109(3): 853-860 |
Пирофосфотаза |
3.6.1.1 |
Содержание в клубне |
|
AGPase |
102577790 I, IV, VII, (малая субъ- VIII, XII единица) |
du Jardin P. et al . Plant Mol. Biol., 1991, 16(2): 349-351 |
АДФ-глюкозо-пирофосфорилаза |
2.7.7.27 |
Содержание в клубне |
|
|
GBSS |
102577459 |
VIII, II |
van der Leij F.R. et al . Mol. Gen. Крахмалсинтаза, Genet., 1991, 228(1-2): 240-248 связанная с гранулами |
2.4.1.21 |
Содержание амилозы |
|
|
SSI |
102600045 |
III |
Kossmann J. et al . Planta, 1999, 208(4): 503-511 |
Крахмалсинтаза |
2.4.1.21 |
Содержание в клубне |
|
SSII |
102583115 |
Нет данных |
Kossmann J. et al . Planta, 1999, 208(4): 503-511 |
Крахмалсинтаза |
2.4.1.21 |
Содержание в клубне |
|
SSIII |
102577674 |
II |
Marshall J. et al . Plant Cell, 1996, 8(7): 1121-1135 |
Крахмалсинтаза |
2.4.1.21 |
Содержание в клубне |
|
GWD |
102577510 |
V |
Lorberth R. et al. Nat. Biotech-nol.. 1998, 16(5): 473-477 |
H2O-дикиназа |
2.7.9.4 2.7.9.5 |
Фосфорилирование |
|
SBEI |
102596498 |
IV |
Kossmann J. et al . Mol. Gen. Genet., 1991, 230(1-2): 39-44 |
Фермент, разветвляющий крахмал |
2.4.1.18 |
Ветвление цепей амилопектина |
|
SBEIIA SBEIIB |
102590711 |
IX |
Larsson C.T. et al . Plant Mol. Biol., 1998, 37(3): 505-511 |
Фермент, разветвляющий крахмал |
2.4.1.18 |
Ветвление цепей амилопектина |
|
ISO |
102577466 |
XI |
Sun C. et al . Plant Mol. Biol., 1999, 40(3): 431-443 |
Изоамилаза (гидролиз 3.2.1.68 в точках ветвления) |
Изомеризация крахмала |
|
|
PULL |
102581262 |
Нет данных |
Отсутствует |
Пуллуланаза |
3.2.1.41 |
Изомеризация крахмала |
|
DP |
Различные варианты |
IV |
Отсутствует |
4- а -Глюкотранс-фераза |
2.4.1.25 |
Изомеризация крахмала |
П р и м еч а ни е. NCBI — National Center for Biotechnology Information .
Напомним, что, несмотря на многофакторность влияния многих генов, вовлеченных в биосинтез крахмала, в ряде случаев посредством их ингибирования или, наоборот, сверхэкспрессии удалось изменить некоторые свойства крахмала (табл. 2).
Изменение физико-химических свойств
Повышение оптической прозрачности геля и устойчивости при центрифугировании, повышение (на 56 ° С) максимальной и конечной температуры желатинизации
|
Продолжение таблицы 2 |
|
|
GBSS , SSII , SSIII |
Ингибирование: снижение содер- Стабильность геля при замораживании или циклах жания амилозы, укорочение конце- замораживания-оттаивания, набухание и способность вых цепей амилопектина впитывать воду |
|
SBEI |
Ингибирование: умеренное увели- Не определено чение содержания амилозы, повышение содержания фосфатов, увеличение длины цепей в амилопектине |
|
SBEI и SBEII |
Ингибирование: значительное уве- Снижение температуры желатинизации, вязкости личение содержания амилозы, геля, увеличение объема при набухании в воде, повышение содержания фосфатов увеличение восстанавливающих сахаров, содержания фосфатных групп |
|
SBEII |
Экспрессия: увеличение ветвления Снижение температуры желатинизации, вязкости, амилопектина, снижение степени увеличение объема набухания полимеризации внешних цепей амилопектина |
|
GWD |
Ингибирование: снижение количе- Снижение вязкости геля, снижение скорости ства фосфатных групп биокаталитического гидролиза |
|
glgc-16 SSIV SbAl |
Экспрессия Повышение содержания крахмала в клубне Экспрессия Повышение содержания крахмала в клубне Экспрессия. Ингибирование актив- Увеличение содержания крахмала в клубне, снижение ности амилазы, замедление гидро- эффекта коричневой окраски при термообработке лиза крахмала, сокращение количества восстанавливающих сахаров |
Таким образом, у большинства генов, участвующих в биосинтезе крахмала у картофеля, влияние многофакторное: с одной стороны, каждый ген вовлечен в регуляцию проявления нескольких физико-химических свойств крахмала, с другой — почти каждый признак испытывает на себе влияние нескольких генов. Методы генной инженерии позволяют проверить правильность предположений о роли того или иного гена, а также непосредственно оценить полученный результат инструментальными методами. Если результат совпадает с ожиданиями, подход можно далее использовать в традиционной или маркер-ориентированной селекции для выведения технических сортов, у которых крахмал будет служить оптимальным сырьем для соответствующих отраслей промышленности.
Список литературы Гены-мишени для получения сортов картофеля (Solanum tuberosum L.) с заданными свойствами крахмала
- Murphy P. Starch. In: Handbook of hydrocolloids. Woodhead Publishing Series in Food Science, Technology and Nutrition/G.O. Phillips, P.A. Williams (eds.). CRC Press, Boca Raton, 2009.
- Singh J. Potato starch and its modification. In: Advances in potato chemistry and technology/J. Singh, L. Kaur (eds.). Academic Press, Burlington-San Diego-London-NY, 2016.
- Кряжев В.Н., Романов В.В., Широков В.А. Последние достижения химии и технологии производных крахмала. Химия растительного сырья, 2010, 1: 5-12.
- Wang T.L., Bogracheva T.Ya., Hedley C.L. Starch: as simple as A, B, C? J. Exp. Bot., 1998, 49(320): 481-502 ( ) DOI: 10.1093/jxb/49.320.481
- Schwall G.P., Safford R., Westcott R.J., Jeffcoat R., Tayal A., Shi Y.-Ch., Gidley M.J., Jobling S.A. Production of very-high-amylose potatostarch by inhibition of SBE A and B. Nat. Biotechnol., 2000, 18: 551-554 ( ) DOI: 10.1038/75427
- Исследовательская компания «ID-Marketing». А жизнь-то налаживается… Обзор российского рынка натуральных крахмалов. Российский продуктовый рынок, 2016, 1. Режим доступа: http://www.foodmarket.spb.ru/archive.php?year=2016&number=155&article=2236. Без даты.
- Jobling S. Improving starch for food and industrial applications. Curr. Opin. Plant Biol., 2004, 7: 210-218 (doi 10.1016/j.pbi.2003.12.001).
- Comparot-Moss S., Denyer K. The evolution of the starch biosynthetic pathway in cereals and other grasses. J. Exp. Bot., 2009, 60(9): 2481-2492 (doi 10.1093/jxb/erp141).
- Хлесткина Е.К., Шумный В.К. Перспективы использования прорывных технологий в селекции: система CRISPR/Cas9 для редактирования генома растений. Генетика, 2016, 52(7): 774-787 ( ) DOI: 10.7868/S0016675816070055
- Хлесткина Е.К., Шумный В.К., Колчанов Н.А. Маркер-ориентированная селекция и примеры ее использования в мировом картофелеводстве. Достижения науки и техники АПК, 2016, 30(10): 5-8.
- Кочетов А.В., Шумный В.К. Трансгенные растения как генетические модели для изучения функций генов растений. Вавиловский журнал генетики и селекции, 2016, 20(4): 475-481 ( ) DOI: 10.18699/VJ16.17
- Wandelt C. Quality traits: altered starch composition in potato (BASF Plant Science Company GmbH, Meeting on «Genetic basis of unintended effects in modified plants», 14-15 January 2014, Canada). Ottawa, 2014. Available http://hesiglobal.org/hesi//wp-content/uploads/si-tes/11/2015/12/Quality-traits-altered-starch-composition-in-potato.pdf. No date.
- Ryffel G.U. Making the most of GM potatoes. Nat. Biotechnol., 2010, 28(4): 318 ( ) DOI: 10.1038/nbt0410-318
- Holme I.B., Wendt T., Holm P.B. Intragenesis and cisgenesis as alternatives to transgenic crop development. Plant Biotechnol. J., 2013, 11(4): 395-407 ( ) DOI: 10.1111/pbi.12055
- Andersson M., Turesson H., Nicolia A., Falt A-S., Samuelsson M., Hofvander P. Efficient targeted multiallelic mutagenesis in tetraploid potato (Solanum tuberosum) by transient CRISPR-Cas9 expression in protoplasts. Plant Cell Rep., 2017, 36: 117-128 ( ) DOI: 10.1007/s00299-016-2062-3
- Ortega-Ojeda F.E., Larsson H., Eliasson A.-Ch. Gel formation in mixtures of hydrophobically modified potato and high amylopectin potato starch. Carbohyd. Polym., 2005, 59: 313-327 ( ) DOI: 10.1016/j.carbpol.2004.10.011
- Ortega-Ojeda F.E., Larsson H., Eliasson A.-Ch. Gel formation in mixtures of amylose and high amylopectin potato starch. Carbohyd. Polym., 2004, 57: 55-66 ( ) DOI: 10.1016/j.carbpol.2004.03.024
- Sanchez T., Dufour D., Moreno I.X., Ceballos H. Comparison of pasting and gel stabilities of waxy and normal starches from potato, maize, and rice with those of a novel waxy cassava starch under thermal, chemical, and mechanical stress. J. Agric. Food Chem., 2010, 58: 5093-5099 ( ) DOI: 10.1021/Jf1001606
- Šimkova D., Lachman J., Hamouz K., Vokal B. Effect of cultivar, location and year on total starch, amylose, phosphorus content and starch grain size of high starch potato cultivars for food and industrial processing. Food Chem., 2013, 141: 3872-3880 ( ) DOI: 10.1016/j.foodchem.2013.06.080
- Safford R., Jobling S.A., Sidebottom C.M., Westcott R.J., Cooke D., Tober K.J., Strongitharm B.H., Russell A.L., Gidley M.J. Consequences of antisense RNA inhibition of starch branching enzyme activity on properties of potato starch. Carbohyd. Polym., 1998, 35: 155-168 ( ) DOI: 10.1016/S0144-8617(97)00249-X
- Jobling S.A., Schwall G.P., Westcott R.J., Sidebottom C.M., Debet M., Gidley M.J., Jeffcoat R., Safford R. A minor form of starch branching enzyme in potato (Solanum tuberosum L.) tubers has a major effect on starch structure: cloning and characterization of multiple forms of SBE A. Plant J., 1999, 18(2): 163-171 ( ) DOI: 10.1046/j.1365-313X.1999.00441.x
- Andersson M., Melander M., Pojmark P., Larsson H., Bulow L., Hofvander P. Targeted gene suppression by RNA interference: An efficient method for production of high-amylose potato lines. J. Biotechnol., 2006, 123: 137-148 ( ) DOI: 10.1016/j.jbiotec.2005.11.001
- Hofvander P., Andersson M., Larsson C.-T., Larsson H. Field performance and starch characteristics of high amylose potatoes obtained by antisense gene targeting of two branching enzymes. Plant Biotechnol. J., 2004, 2: 311-320 ( ) DOI: 10.1111/j.1467-7652.2004.00073.x
- Brummell D.A., Watson L.M., Zhou J., McKenzie M.J., Hallett I.C., Simmons L., Carpenter M., Timmerman-Vaughan G.M. Overexpression of STARCH BRANCHING ENZYME II increases short-chain branching of amylopectin and alters the physicochemical properties of starch from potato tuber. BMC Biotechnol., 2015, 15: 28 ( ) DOI: 10.1186/s12896-015-0143-y
- Wikman J., Larsen F.H., Motawiac M.S., Blennow A., Bertoft E. Phosphate esters in amylopectin clusters of potato tuber starch. Int. J. Biol. Macromol., 2011, 48: 639-649 ( ) DOI: 10.1016/j.ijbiomac.2011.02.005
- Bertoft E., Blennow A. Structure of potato starch. In: Advances in potato chemistry and technology/J. Singh, L. Kaur (eds.). Academic Press, Burlington-San Diego-London-NY, 2016.
- Lorberth R., Ritte G., Willmitzer L., Kossmann J. Inhibition of a starch-granule-bound protein leads to modified starch and repression of cold sweetening. Nat. Biotechnol., 1998, 16: 473-477 ( ) DOI: 10.1038/nbt0598-473
- Ritte G., Lloyd J.R., Eckermann N., Rottmann A., Kossmann J., Steup M. The starch-related R1 protein is an alpha -glucan, water dikinase. PNAS, 2002, 99(10): 7166-7171 ( ) DOI: 10.1073/pnas.062053099
- Anders Viksø-Nielsen A., Blennow A., Jørgensen K., Kristensen K.H., Jensen A., Møller B.L. Structural, physicochemical, and pasting properties of starches from potato plants with repressed r1-gene. Biomacromolecules, 2001, 2: 836-843.
- Ritte G., Scharf A., Eckermann N., Haebel S., Steup M. Phosphorylation of transitory starch is increased during degradation. Plant Physiol., 2004, 135: 2068-2077 ( ) DOI: 10.1104/pp.104.041301
- Ritte G., Heydenreich M., Mahlowa S., Haebel S., Koёtting O., Steup M. Phosphorylation of C6-and C3-positions of glucosyl residues in starch is catalysed by distinct dikinases. FEBS Lett., 2006, 580: 4872-4876 ( ) DOI: 10.1016/j.febslet.2006.07.085
- Carpenter M.A., Joyce N., Genet R.A., Cooper R.D., Murray S.R., Noble A.D., Butler R.C., Timmerman-Vaughan G.M. Starch phosphorylation in potato tubers is influenced by allelic variation in the genes encoding glucan water dikinase, starch branching enzymes I and II, and starch synthase III. Front. Plant Sci., 2015, 6: 143 ( ) DOI: 10.3389/fpls.2015.00143
- Stark D.M., Timmerman K.P., Barry G.F., Preiss J., Kishore G.M. Regulation of the amount of starch in plant tissues by ADP glucose pyrophosphorylase. Science, 1992, 258: 287-292 ( ) DOI: 10.1126/science.258.5080.287
- Zhang H., Liu J., Hou J., Yao Y., Lin Y., Ou Y., Song B., Xie C. The potato amylase inhibitor gene SbAI regulates cold-induced sweetening in potato tubers by modulating amylase activity. Plant Biotechnol. J., 2014, 12: 984-993 ( ) DOI: 10.1111/pbi.12221
- Gamez-Arjona F.M., Li J., Raynaud S., Baroja-Fernadez E., Munoz F.J., Ovecka M., Ragel P., Bahaji B., Pozueta-Romero J., Merida A. Enhancing the expression of starch synthase class IV results in increased levels of both transitory and long-term storage starch. Plant Biotechnol. J., 2011, 9: 1049-1060 ( ) DOI: 10.1111/j.1467-7652.2011.00626.x
- Zhang Y., Sun F., Fettke J., Schottler M.A., Ramsden L., Fernie A.R., Lim B.L. Heterologous expression of AtPAP2 in transgenic potato influences carbon metabolism and tuber development. FEBS Lett., 2014, 588: 3726-3731 ( ) DOI: 10.1016/j.febslet.2014.08.019
- van Soest J.J.G., Tournois H., de Wit D., Vliegenthart J.F.G. Short-range structure in (partially) crystalline potato starch determined with attenuated total reflectance Fourier-trans-form IR spectroscopy. Carbohyd. Res., 1995, 279: 201-214 ( ) DOI: 10.1016/0008-6215(95)00270-7
- Manners D.J. Recent developments in our understanding of amylopectin structure. Carbohyd. Polym., 1989, 11(2): 87-112 ( ) DOI: 10.1016/0144-8617(89)90018-0
- Jane J., Wong K.-S., McPherson A.E. Branch-structure difference in starches of A-and B-type X-ray patterns revealed by their Naegeli dextrins. Carbohyd. Res., 1997, 300: 219-227 ( ) DOI: 10.1016/S0008-6215(97)00056-6
- Kozlov S.S., Blennow A., Krivandin A.V., Yuryev V.P. Structural and thermodynamic properties of starches extracted from GBSS and GWD suppressed potato lines. Int. J. Biol. Macromol., 2007, 40: 449-460 ( ) DOI: 10.1016/j.ijbiomac.2006.11.001
- Fan X.Y., Guo M., Li R.D., Yang Y.H., Liu M., Zhu Q., Tang S.Z., Gu M.H., Xu R.G., Yan C.J. Allelic variations in the soluble starch synthase II gene family result in changes of grain quality and starch properties in rice (Oryza sativa L.). J. Agr. Sci., 2017, 155(1): 129-140 ( ) DOI: 10.1017/S0021859615001331
- Wattebled F., Buleon A., Bouchet B., Ral J.-P., Lienard L., Delvalle D., Binderup K., Dauvillee D., Ball S., D’Hulst C. Granule-bound starch synthase I. A major enzyme involved in the biogenesis of B-crystallites in starch granules. Eur. J. Biochem., 2002, 269: 3810-3820 ( ) DOI: 10.1046/j.1432-1033.2002.03072.x
- Yamamori M., Fujita S., Hayakawa K., Matsuki J., Yasui T. Genetic elimination of a starch granule protein, SGP-1, of wheat generates an altered starch with apparent high amylose. Theor. Appl. Genet., 2000, 101: 21-29 ( ) DOI: 10.1007/s001220051444
- Huang X.-F., Nazarian-Firouzabadi F., Vincken J.-P., Ji Q., Suurs L.C.J.M., Visser R.G.F., Trindade L.M. Expression of an engineered granule-bound Escherichia coli glycogen branching enzyme in potato results in severe morphological changes in starch granules. Plant Biotechnol. J., 2013, 11: 470-479 ( ) DOI: 10.1111/pbi.12033
- Werij J.S., Furrer H., van Eck H.J., Visser R.G.F., Bachem C.W.B. A limited set of starch related genes explain several interrelated traits in potato. Euphytica, 2012, 186: 501-516 ( ) DOI: 10.1007/s10681-012-0651-y
- Sliwka J., Sołtys-Kalina D., Szajko K., Wasilewicz-Flis I., Strzelczyk-Zyta D., Zimnoch-Guzowska E., Jakuczun H., Marczewski W. Mapping of quantitative trait loci for tuber starch and leaf sucrose contents in diploid potato. Theor. Appl. Genet., 2016, 129: 131-140 ( ) DOI: 10.1007/s00122-015-2615-9
- Li L., Paulo M.-J., Strahwald J., Lubeck J., Hofferbert H.-R., Tacke E., Junghans H., Wunder J., Draffehn A., van Eeuwijk F., Gebhardt C. Natural DNA variation at candidate loci is associated with potato chip color, tuber starch content, yield and starch yield. Theor. Appl. Genet., 2008, 116: 1167-1181 ( ) DOI: 10.1007/s00122-008-0746-y
- Li L., Tacke E., Hofferbert H.R., Lübeck J., Strahwald J., Draffehn A.M., Walkemeier B., Gebhardt C. Validation of candidate gene markers for marker-assisted selection of potato cultivars with improved tuber quality. Theor. Appl. Genet., 2013, 126(4): 1039-1052 ( ) DOI: 10.1007/s00122-012-2035-z
- Schonhals E.M., Ortega F., Barandalla L., Aragones A., Ruiz de Galarreta J.I., Liao J.-C., Sanetomo R., Walkemeier B., Tacke E., Ritter E., Gebhardt C. Identification and reproducibility of diagnostic DNA markers for tuber starch and yield optimization in a novel association mapping population of potato (Solanum tuberos-um L.). Theor. Appl. Genet., 2016, 129: 767-785 ( ) DOI: 10.1007/s00122-016-2665-7
- Sanetomo R., Gebhardt C. Cytoplasmic genome types of European potatoes and their effects on complex agronomic traits. BMC Plant Biol., 2015, 15: 162 ( ) DOI: 10.1186/s12870-015-0545-y
- Keeling P.L., Myers A.M. Biochemistry and genetic of starch synthesis. Annu. Rev. Food Sci. Technol., 2010, 1: 271-303 ( ) DOI: 10.1146/annurev.food.102308.124214
- Chen X., Salamini F., Gebhardt C. A potato molecular-function map for carbohydrate metabolism and transport. Theor. Appl. Genet., 2001, 102: 284-295 ( ) DOI: 10.1007/s001220051645


