Гепатотоксические, гематологические изменения и элементный статус у беременных крыс линии Wistar при действии наночастиц Zn и ZnO
Автор: Русакова Е.А., Сизова Е.А., Мирошников С.А., Сипайлова О.Ю., Макаев Ш.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Оценка токсических эффектов на модельных объектах
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Наночастицы цинка (Zn НЧ) и оксида цинка (ZnO НЧ) рассматриваются как материалы с низкой токсичностью, поскольку Zn - один из важнейших микроэлементов в организме человека, он обычно присутствует в пищевых продуктах и используется в качестве пищевой добавки. В настоящее время наносоединения на основе цинка относятся к наиболее применяемым, однако данных, позволяющих оценить степень опасности наноматериалов (НМ) для млекопитающих, включая человека (в том числе эмбриотоксические эффекты), пока что явно недостаточно. Целью настоящей работы было изучение потенциально негативных последствий воздействия положительно заряженных наночастиц цинка (Zn НЧ) и оксида цинка (ZnO НЧ) размерностью 90 и 95 нм на метаболические процессы в организме крыс линии Wistar в период беременности и на развитие плода. Оценивали морфологические и биохимические показатели крови, морфофункциональное состояние печени, содержание эссенциальных макро- и микроэлементов в тканях, течение и исход беременности. Содержание эритроцитов (х1012/л), лейкоцитов (х109/л), гемоглобина (г/л), гематокрит (%) определяли на 21-е сут эксперимента с использованием автоматического анализатора URIT-2900 Vet Plus («URIT Medical Electronic Group Co., Ltd», Китай), активность аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ) и лактатдегидрогеназы (ЛДГ) - на автоматическом биохимическом анализаторе CS-T240 («DIRUI Industrial Co., Ltd», Китай) с применением коммерческих биохимических наборов для ветеринарии ДиаВетТест (Россия). Содержание макро- и микроэлементов оценивали методами атомно-эмиссионной и масс-спектрометрии с использованием масс-спектрометра Elan 9000 и атомно-эмиссионного спектрометра Optima 2000V («Perkin Elmer», США). В эксперименте не были выявлены эмбрио-фетальные патологии. Отмечалось достоверное повышение содержания эритроцитов и гемоглобина при введении Zn НЧ. Поступление ZnО НЧ приводило к развитию умеренного лейкоцитоза. Рост активности ферментов (АлАТ, АсАТ, ЛДГ) указывал на развивающиеся деструктивные процессы в ткани печени, интенсивность которых прямо зависела от дозы и вида наночастиц. Биохимические исследования крови подтвердили потенциальный гепатотоксический эффект Zn НЧ и ZnO НЧ, о котором также свидетельствовала микроструктурная реорганизация печени, отражающая, с одной стороны, процессы дистрофии и цитолиза, с другой - регенерацию и функциональную активизацию органа, что можно рассматривать как компенсаторные (адаптационные) реакции на токсическое действие указанных наночастиц. По степени выраженности этих явлений, учитывая сопоставимые дозы, ZnО НЧ следует отнести к наиболее токсичным по сравнению с Zn НЧ. Введение Zn НЧ и ZnO НЧ в оцениваемых дозировках не приводило к критическим изменениям общего пула макро- и микроэлементов, а также содержания Zn в печени крыс и тканях плода. Происходило накопление некоторых эссенциальных элементов, что, однако, не влияло на течение и исход беременности.
Крысы, наночастицы цинка, кровь, печень, беременность, плод, химические элементы
Короткий адрес: https://sciup.org/142213960
IDR: 142213960 | УДК: 615.9:546.47-022.532]:57.084.1 | DOI: 10.15389/agrobiology.2016.4.524rus
Текст научной статьи Гепатотоксические, гематологические изменения и элементный статус у беременных крыс линии Wistar при действии наночастиц Zn и ZnO
Наночастицы цинка (Zn НЧ) и оксида цинка (ZnO НЧ) — одна из наиболее часто используемых групп наноматериалов (1). ZnO НЧ применяют при изготовлении пластмасс, керамики, стекла, цемента, каучука, смазочных материалов, красок, мазей, клеев, герметиков, пигментов, батарей, ферритов, антипиренов и т.д. (2). Zn НЧ и ZnO НЧ обладают свойством УФ-экранирования, антибактериальным и дезодорирующим эффектом с потенциалом широкого использования в косметологии при произ-
∗ Работа проведена в рамках проекта Российского научного фонда ¹ 14-36-00023. Гематологические исследования выполнены по стандартизированным методикам в лаборатории «Агроэкология техногенных наноматериалов» и Испытательном центре ФГБНУ Всероссийского НИИ мясного скотоводства (аттестат аккредитации RA. RU.21ПФ59 от 02.12.15). Анализ образцов ткани экспериментальных животных на содержание химических элементов проводили в лаборатории АНО «Центр биотической медицины», г. Москва (аттестат аккредитации ГСЭН.RU.ЦАО.311, Регистрационный номер в Государственном реестре РОСС RU. 0001.513118).
водстве солнцезащитных кремов (3), в пищевой промышленности в качестве добавок и в составе упаковок (4), как фунгицидов в сельском хозяйстве (5), в качестве противоопухолевых лекарственных средств (6, 7).
Поскольку цинк относится к эссенциальным микроэлементам, принято рассматривать наночастицы Zn как вещества с низкой токсичностью. Однако есть сообщения, что вдыхание паров ZnO может сопровождаться развитием литейной лихорадки (8, 9). При этом сложно прогнозировать эффекты при контакте с наночастицами цинка, так как наноматериалы обладают высокой реакционной способностью (10), хорошо диспергируются в разных средах (11), а их поглощение живыми системами может происходить по различным механизмам (12).
В настоящее время ощущается нехватка информации о потенциальной опасности наноматериалов (НМ) для здоровья человека, в частности о возможном токсическом влиянии на эндокринную и репродуктивную системы (13, 14). Имеются данные, позволяющие предположить, что воздействие НМ может нарушать регуляцию концентрации сывороточных половых гормонов. Некоторые наноматериалы вызывают эндокринную дисфункцию (13). Установлено эмбриотоксическое действие нанокремнезема (70 нм), которое выражается в рассасывании плода или ограничении его роста и развития (15).
Мы впервые показали, что положительно заряженные наночастицы Zn и ZnO размерностью 90 и 95 нм оказывают влияние на общий пул макро- и микроэлементов, а также содержание Zn в печени крыс и тканях плода. При биохимических исследованиях крови был установлен потенциальный гепатотоксический эффект этих наночастиц. При этом происходящая микроструктурная реорганизация печени отражала процессы дистрофии и цитолиза. В то же время имели место компенсаторные реакции, обеспечивающие регенерацию и восстановление функции органа.
Цель работы заключалась в оценке возможных негативных последствий действия наночастиц Zn и ZnO на гематологические показатели, морфофункциональное состояние печени и содержание эссенциальных химических элементов у лабораторных крыс в период беременности.
Методика. Эксперименты выполняли в соответствии с протоколами Женевской конвенции и принципами надлежащей лабораторной практики (Национальный стандарт Российской Федерации ГОСТ Р 534342009) (16), а также с инструкциями, рекомендуемыми «The Guide for the Care and Use of Laboratory Animals (National Academy Press Washington, D.C. 1996)». Уход за животными осуществлялся согласно правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ 3 51000.4-96) (17). Соблюдались требования гуманного обращения с животными (18). В эксперименте применялись стандартные процедуры эксплуатации биообъектов.
Использовали Zn и ZnO НЧ размером 90,0±2,0 и 95,0±2,0 нм с удельной площадью поверхности 5,34 и 4,5-6,0 м2/г. Наночастицы произведены ООО «Передовые порошковые технологии» (г. Томск) и ООО «Платина» (г. Москва) методом электрического взрыва проволоки в атмосфере аргона. Состав Zn НЧ — Zn (90 %), сорбированные газы, ZnO и H2O. Состав ZnO НЧ, определенный плазмохимическим методом: ZnO — 96 %, оксиды других металлов — 4 %. Препараты Zn НЧ и ZnO НЧ для внутрибрюшинного введения готовили в изотоническом физиологическом растворе, обрабатывая в течение 30 мин на ультразвуковом диспергаторе УЗДН-2Т («НПП Академприбор», Россия) (5 кГц, 300 Вт, 10 мкА).
Исследования выполнялись на крысах линии Wistar в условиях медико-биологической клиники (виварий Оренбургского государственного университета). Были отобраны самцы и самки в возрасте 10 нед. Животных содержали при температуре 20,8-23,0 °С и относительной влажности 45-57 % с искусственным освещением продолжительностью 12 ч при 10-15-кратном воздухообмене; для спаривания отбирали равное число самцов и самок. Наступление беременности определяли по наличию вагинальные пробки и сперматозоидов в мазке при ежедневных исследованиях. Беременных крыс отсаживали в клетку с проволочными крышками из нержавеющей стали. Поение и кормление (стандартный рацион) не ограничивали.
Здоровых 3-месячных беременных самок массой 250-300 г ( n = 60) случайным образом распределили в шесть групп (контрольная и пять экспериментальных). В I группе крысы получили ZnНЧ (из расчета 1,4 мг на 1 кг живой массы); во II — Zn НЧ (2,8 мг/кг); в III — Zn НЧ (7,1 мг/кг); в IV — ZnO НЧ (1,4 мг/кг) и в V — ZnO НЧ (8,9 мг/кг). Наночастицы (в контроле — 0,2 мл физиологического раствора) вводили самкам на ранних сроках беременности (сразу после ее диагностики) 1-кратно внутрибрюшинно с соблюдением правил асептики и антисептики. На протяжении всего периода беременности животных ежедневно осматривали для выявления клинических признаков (смертность, общий внешний вид и поведение). По окончании эксперимента (21-е сут) крыс декапировали под нембуталовым наркозом.
Содержание эритроцитов ( х 1012/л), лейкоцитов ( х 10 9 /л), гемоглобина (г/л) и гематокрит (%) определяли на автоматическом гематологическом анализаторе URIT-2900 Vet Plus ( « URIT Medical Electronic Group Co., Ltd», Китай), активность (Ед/л) аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ) и лактатдегидрогеназы (ЛДГ) — на автоматическом биохимическом анализаторе CS-T240 ( « DIRUI Industrial Co., Ltd», Китай) с применением коммерческих биохимических наборов для ветеринарии ДиаВетТест (Россия).
Для морфологических исследований кусочки печени фиксировали в 10 % нейтральном формалине и заливали в парафиновую смесь HISTO-MIX® (ООО «БиоВитрум», Россия). Гистологические срезы толщиной 56 мкм готовили на полуавтоматическом микротоме (МЗП 01, «Техном», Россия), окрашивали гематоксилином и эозином и просматривали под световым микроскопом MT 5300L («Meiji Techno Co., Ltd», Япония, х 400).
Содержание химических элементов в исследуемых образцах ткани определяли с использованием масс-спектрометра Elan 9000 и атомноэмиссионного спектрометра Optima 2000V («Perkin Elmer», США).
При статистическом анализе сравнивали данные, полученные в опытных группах, с контролем с помощью программного обеспечения SPSS 19.0 («IBM Corporation», США) и Statistica 10 («StatSoft Inc.», США). Величина с p < 0,05 считалась статистически значимой. Показатели массы тела матери подвергали дисперсионному анализу (ANOVA) и тесту множественного сравнения Шеффе, который применяли, когда различия были значительными (19).
Результаты. Гематологические показатели и морфофункциональные изменения в печени крыс. Нами установлен факт достоверного повышения содержания эритроцитов в группах, получавших Zn НЧ в дозировке 2,8 и 7,1 мг/кг. К окончанию опыта этот показатель у животных из II и III групп превышал контрольные значения соответственно на 17,40 и 11,30 % (p < 0,05) (табл. 1).
По гемоглобину отмечалось достоверное увеличение в I и II груп- пах — соответственно на 4,85 и 19,80 % (р ≤ 0,05) относительно контрольной группы (см. табл. 1).
Число лейкоцитов в крови животных из IV и V группы было выше соответственно на 74,90 и 17,00 % (p ≤ 0,01) по сравнению с контролем. Zn НЧ в дозе 7,1 мг/кг вызывали значимые изменения в содержании лейкоцитов (см. табл. 1). Аналогичное действие наночастиц при внутрибрюшинном введении описано ранее (20).
1. Гематологические показатели у беременных крыс линии Wistar на 21-е сут после внутрибрюшинного введения наночастиц (НЧ) Zn и ZnO в разных дозировках ( Х ± х )
Показатель
Лейкоциты, 109/л Эритроциты, 1012/л Гемоглобин, г/л Гематокрит, %
контроль
8,23±0,24
7,55±0,25
156,70±7,17
40,30±1,82
I 7,63±0,22 7,98±0,27 164,30±6,19* 41,60±4,13
Группа
II I III I IV I V 7,97±0,69 6,03±0,23* 14,40±0,50 9,67±0,23**
8,86±0,23* 8,40±0,26* 8,12±0,09 7,73±0,13
187,70±6,67* 171,70±11,20 166,30±3,45 158,70±5,96
47,90±1,44* 45,00±2,41 43,60±0,72 40,80±1,88*
П р и м е ч а н и е. I группа — 1,4 мг/кг Zn НЧ, II группа — 2,8 мг/кг Zn НЧ, III группа — 7,1 мг/кг Zn НЧ, IV группа — 1,4 мг/кг ZnO НЧ, V — 8,9 мг/кг ZnO НЧ.
*, ** Различия с контролем достоверны соответственно при p ≤ 0,05 и p ≤ 0,01.
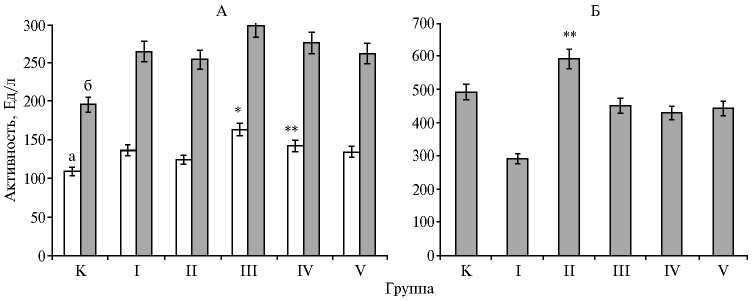
Активность аминотрансфераз (А) и лактатдегодрогеназы (Б) в сыворотке крови беременных крыс линии Wistar на 21-е сут после внутрибрюшинного введения наночастиц (НЧ) Zn и ZnO в разных дозировках: а — аланинаминотрансфераза, б — аспартатаминотрансфераза; I группа — 1,4 мг/кг Zn НЧ, II группа — 2,8 мг/кг Zn НЧ, III группа — 7,1 мг/кг Zn НЧ, IV группа — 1,4 мг/кг ZnO НЧ, V группа — 8,9 мг/кг ZnO НЧ; К — контроль.
*, ** Различия с контролем достоверны соответственно при p ≤ 0,05 и p ≤ 0,01.
Инъекции Zn НЧ и ZnO НЧ изменяли гомеостатические показатели крови, способствуя увеличению активности аминотрансфераз (АлАТ, АсАТ) и ЛДГ. На 21-е сут в III и IV группах показатель по АлАТ достоверно превышал контроль соответственно на 48,60 % (p ≤ 0,05) и 29,60 % (p ≤ 0,01). При поступлении ZnO НЧ в дозе 1,4 мг/кг (IV группа) активность АсАТ в сыворотке крови достоверно возросла на 40,80 % (p ≤ 0,01), в дозе 8,9 мг/кг (V группа) — на 33,80 % (p ≤ 0,001) (рис., А).
Подобное обстоятельство объясняется массированным выходом ферментов в кровяное русло при разрушении клеток, вызванном различными патологическими процессами. Повышение активности АлАТ и АсАТ в плазме крови считают одним из маркеров патологии печени и расценивают как достоверный признак поражения ее паренхимы, поскольку этот показатель находится в прямой зависимости от степени вовлечения ткани печени в патологический процесс (21). Анализ активности лактатдегидрогеназы сыворотки крови выявил достоверное различие с контролем (на 20,68 %, p ≤ 0,01) при введении Zn НЧ в средней дозировке (2,8 мг/кг) (см. рис., Б). Повышение дозы Zn НЧ, а также введение сопоставимых доз ZnО НЧ приводило к снижению показателей по ЛДГ, при этом разница с контролем колебалась от 8,09 до 12,64 %.
Известно, что заболевания, протекающие с некрозом тканей (инфаркт миокарда, некротические поражения почек, гепатиты, панкреатиты), как правило, сопровождаются резким повышением активности лактатдегидрогеназы в сыворотке крови (22), следовательно, можно предположить, что такие изменения в содержании ЛДГ связаны с деструкцией ограниченной популяции клеток.
Анализ активности ферментов (АлАТ, АсАТ, ЛДГ), отражающих функциональное состояние печени, не противоречил данным по оценке ее микроструктурной реорганизации при воздействии наночастиц. Интенсивность такой реорганизации прямо зависела от дозы и вида наночастиц. Так, у крыс, получавших Zn НЧ, фиксировали последствия дистрофических изменений гепатоцитов в центральных частях долек (в виде восстановления балочного строения долек) и остаточные дистрофические явления на небольших участках долек. Возрастало число гепатоцитов с множественными ядрышками, полиплоидными и гиперхромными ядрами, а также повышалась активность клеток Купфера. Очаговые участки с признаками некроза и обширные зоны с зернистой, мелкокапельной и мелковакуольной дистрофией гепатоцитов встречались только при введении ZnО НЧ. Увеличение дозы ZnО НЧ до 8,9 мг/кг, с одной стороны, локально усугубляло некро-дистрофические процессы в печени, с другой — приводило к возрастанию площади островков активной пролиферации гепатоцитов с более крупными, нередко полиплоидными ядрами, что указывает на активизацию регенерации в ткани.
В целом микроструктурную реорганизацию печени к 21-м сут после внутрибрюшинной инъекции наночастиц цинка, при которой, с одной стороны, происходил цитолиз и дистрофические изменения, с другой — процессы регенерации и функциональной активации органа, можно рассматривать как компенсаторные (адаптационные) реакции при гепатоток-сическом действии использованных наночастиц. По степени выраженности этих явлений, учитывая сопоставимые дозы, ZnО НЧ можно отнести к наиболее токсичным по сравнению с Zn НЧ.
Ранее развитие патологии тканей печени и легких описаны на фоне ингаляционного введения ZnO НЧ крысам в дозе 2,5 мг/кг (23). Возможно, ZnO НЧ способны вызывать нарушения в энергетическом обмене, митохондриях и клеточных мембранах в почках крыс (24).
Проблема естественного переноса НЧ из организма матери к плоду до сих пор недостаточно изучена (25). В то же время в литературе описаны эмбриолетальные эффекты некоторых наноматериалов (26). Имеются указания на проникновение наночастиц металлов из организма матери в печень и селезенку эмбрионов (27).
Мы не выявили влияния Zn НЧ и ZnO НЧ на течение беременности. Эмбриональная смертность и соотношение живых и погибших плодов не различались в опыте и контроле, и ни в одной из групп не было недоразвитых зародышей и плодов с внешними пороками. Отсутствовали существенные различия между группами и контролем по числу плодов и их массе. Эти результаты расходятся с данными H. Zhang с соавт. (28), констатировавшими снижение воспроизводительных качеств у крыс под влиянием ZnO НЧ.
Содержание микро- и макроэлементов в тканях беременных крыс и у плода. Количество общего Zn у плодов в I и II группах было соответственно на 10,80 и 5,39 % ниже, чем в кон-528
трольной группе. Отмечалось увеличение этого показателя в III группе на 1,20 %, в IV — на 7,19 % и в V — 12,60 % относительно контроля. Причем только максимальная концентрация Zn (18,8±3,04 мкг/г) при введении ZnO НЧ в дозе 8,9 мг/кг оказала достоверное влияние на фетальное накопление цинка в V группе (табл. 2).
Введение Zn НЧ и ZnO НЧ не сопровождалось значительными изменениями в химическом составе печени крыс-матерей (см. табл. 2), однако прослеживалась тенденция к увеличению содержания эссенциальных элементов в V группе.
2. Содержание химических элементов (мкг/г) в печени крыс-матерей линии Wistar и плоде на 21-е сут после внутрибрюшинного введения Zn НЧ и ZnO НЧ в разных дозировках ( Х ± х )
|
Образец |
1 Zn |
1 Cu Se I |
Fe |
1 Ca |
|
Печень |
24,20±0,97 |
Контроль 3,99±0,07 0,73±0,05 0,11±0,02 |
230,7±46,2 |
37,60±1,21 |
|
Плод |
16,70±2,07 |
4,64±0,09 0,26±0,01 0,02±0,01 |
108,3±18,7 |
441,40±4,83 |
|
Печень |
25,80±2,01 |
I г р у п п а (1,4 мг/кг Zn НЧ) 3,84±0,17 0,48±0,02 0,11±0,02 |
105,5±14,8 |
35,50±1,48 |
|
Плод |
14,90±1,78 |
1,72±0,15 0,16±0,01 0,07±0,17 |
80,5±42,1 |
404,30±19,40 |
|
Печень |
27,40±1,13 |
II г р у п п а (2,8 мг/кг Zn НЧ) 4,01±0,06 0,62±0,01 0,11±0,07 |
207,9±21,7 |
41,00±2,09 |
|
Плод |
15,80±1,80 |
2,46±0,13 0,18±0,06 0,05±0,03 |
99,1±31,4 |
417,70±22,10 |
|
Печень |
30,60±1,09 |
III г р у п п а (7,1 мг/кг Zn НЧ) 4,78±0,10 0,91±0,02 0,12±0,05 |
280,0±32,3 |
50,40±4,04 |
|
Плод |
16,90±1,42 |
3,25±0,63 0,22±0,04 0,03±0,04 |
114,9±26,5 |
452,70±10,10 |
|
Печень |
28,50±1,32* |
IV г р у п п а (1,4 мг/кг ZnO НЧ) 3,99±0,26 0,86±0,02 0,07±0,01 |
219,0±25,0 |
40,80±2,80 |
|
Плод |
17,90±6,46 |
3,25±0,97 0,25±0,00 0,06±0,03 |
96,5±27,6 |
467,50±35,50 |
|
Печень |
33,90±1,71** |
V г р у п п а (8,9 мг/кг ZnO НЧ) 4,93±0,12 0,93±0,05 0,13±0,03 |
279,7±25,9 |
51,10±1,96 |
|
Плод |
18,80±2,04* |
3,43±0,88 0,24±0,03 0,04±0,02 |
118,9±37,6 |
456,70±12,30 |
*, ** Различия с контролем достоверны соответственно при p ≤ 0,05 и p ≤ 0,01.
Характер таких изменений обусловлен некоторым увеличением содержания I, Cu, Fe, Se в печени особей из V группы. В печени крыс из IV группы количество эссенциальных элементов снижалось относительно контроля. Полученные нами результаты свидетельствуют о возможном повышении биодоступности ряда эссенциальных элементов при введении Zn НЧ и ZnO НЧ.
Итак, при внутрибрюшинном введении беременным крысам наночастиц Zn и ZnO (Zn НЧ и ZnO НЧ) мы не наблюдали эмбрио-фетальных патологий. Показано достоверное повышение числа эритроцитов и концентрации гемоглобина на фоне введения Zn НЧ. Поступление ZnО НЧ приводило к развитию умеренного лейкоцитоза. Повышение активности ферментов (аланинаминотрансферазы, аспартатаминотрансферазы и лактатдегидрогеназы) у самок указывает на деструктивные процессы, происходящие в гепатоцитах, интенсивность которых находится в прямой зависимости от дозы и вида наночастиц. Исследованием биохимических параметров крови подтверждается потенциальный гепатотоксический эффект Zn НЧ и ZnO НЧ, о котором свидетельствует микроструктурная реорганизация печени, отражающая, с одной стороны, дистрофические изменения и цитолиз, с другой — регенерацию и функциональную активизацию органа, что можно рассматривать как компенсаторные (адаптационные) реакции на токсическое действие наночастиц. По степени выраженности описанных явлений, учитывая сопоставимые дозы, ZnО НЧ можно отнести к наиболее токсичным по сравнению с Zn НЧ. Введение Zn НЧ и ZnO НЧ в оцененных дозировках не приводит к критическим изменениям пула макро- и микроэлементов, а также к накоплению Zn в печени крыс- матерей и тканях плода. Происходит некоторое накопление эссенциальных элементов, однако оно не влияет на течение и исход беременности.
Список литературы Гепатотоксические, гематологические изменения и элементный статус у беременных крыс линии Wistar при действии наночастиц Zn и ZnO
- Hernández Battez A., González R., Viesca J.L. CuO, ZrO2 and ZnO nanoparticles as antiWear additive in oil lubricants. Wear, 2008, 265(3-4): 422-428.
- Schilling K., Bradford B., Castelli D., Dufour E., Nash J.F., Pape W., Schulte S., Tooley I., van den Bosch J., Schellauf F. Human safety review of «nano» titanium dioxide and zinc oxide. Photochem. Photobiol. Sci., 2010, 9(4): 495-509 ( ) DOI: 10.1039/b9pp00180h
- Gerloff K., Albrecht C., Boots A.W., Förster I., Schins R.P.F. Cytotoxicity and oxidative DNA damage by nanoparticles in human intestinal Caco-2 cells. Nanotoxicology, 2009, 3(4): 355-364 ( ) DOI: 10.3109/17435390.2009.525670
- Jin T., Sun D., Su J.Y., Zhang H., Sue H.J. Antimicrobial efficacy of zinc oxide quantum dots against Listeria monocytogenes, Salmonella enteritidis, and Escherichia coli O157:H7. J. Food Sci., 2009, 74(1): M46-M52 ( ) DOI: 10.1111/j.1750-3841.2008.01013.x
- He L., Liu Y., Mustapha A., Lin M. Antifungal activity of zinc oxide nanoparticles against Botrytis cinerea and Penicillium expansum. Microbiol. Res., 2011, 166(3): 207-215 ( ) DOI: 10.1016/j.micres.2010.03.003
- Rasmussen J.W., Martinez E., Louka P., Wingett D.G. Zinc oxide nanoparticles for selective destruction of tumor cells and potential for drug delivery applications. Expert Opin. Drug Deliv., 2010, 7(9): 1063-1077 ( ) DOI: 10.1517/17425247.2010.502560
- John S., Marpu S., Li J., Omary M., Hu Z., Fujita Y., Neogi A. Hybrid zinc oxide nanoparticles for biophotonics. J. Nanosci. Nanotechnol., 2010, 10(3): 1707-1712.
- Drinker P., Thomson R.M., Finn J.L. Metal fume fever: IV. Threshold doses of zinc oxide, preventative measures, and the chronic effects of repeated exposures. J. Ind. Hyg. Toxicol., 1927, 9: 331-345.
- Blanc P., Wong H., Bernstein M.S., Boushey H.A. An experimental human model of metal fume fever. Ann. Intern. Med., 1991, 114(11): 930-936 ( ) DOI: 10.7326/0003-4819-114-11-930
- Baek M., Chung H.E., Yu J., Lee J.A., Kim T.H., Oh J.M., Lee W.J., Paek S.M., Lee J.K., Jeong J., Choy J.H., Choi S.J. Pharmacokinetics, tissue distribution, and excretion of zinc oxide nanoparticles. Int. J. Nanomed., 2012, 7: 3081-3097 ( ) DOI: 10.2147/IJN.S32593
- Vaseem M., Umar A., Hahn Y.B. ZnO nanoparticles: growth, properties, and applications. In: Metal oxide nanostructures and their applications/A. Umar, Y.B. Hahn (eds.). Valencia, CA, American Scientific Publishers, 2010: 1-36.
- Yah C.S., Simate G.S., Iyuke S.E. Nanoparticles toxicity and their routes of exposures. Pak. J. Pharm. Sci., 2012, 25(2): 477-491.
- Lu X., Liu Y., Kong X., Lobie P.E., Chen C., Zhu T. Nanotoxicity: a growing need for study in the endocrine system. Small, 2013, 9(9-10): 1654-1671 ( ) DOI: 10.1002/smll.201201517
- Iavicoli I., Fontana L., Leso V., Bergamaschi A. The effects of nanomaterials as endocrine disruptors. Int. J. Mol. Sci., 2013, 14(8): 16732-16801 ( ) DOI: 10.3390/ijms140816732
- Yamashita K., Yoshioka Y. Safety assessment of nanomaterials in reproductive developmental field. Yakugaku Zasshi. (Japanese), 2012, 132(3): 331-335.
- ГОСТ Р 53434-2009. Принципы надлежащей лабораторной практики. Технические требования. М., 2010.
- ГОСТ Р 51000.3-1996. Общие требования к испытательным лабораториям. Технические требования. М., 1996.
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских технологиях/Под ред. Н.Н. Каркищенко, С.В. Грачева. М., 2010.
- Scheffé H. A method for judging all contrasts in the analysis of variance. Biometrika, 1953, 40(1/2): 87-110.
- Симонов П.В., Резниченко Л.С., Чекман И.С. Влияние наночастиц меди на клиническую картину и морфологические показатели крови при экспериментальной генерализованной инфекции у крыс. Вестник Витебского государственного медицинского университета, 2015, 14(4): 112-117.
- Клиническая биохимия/Под ред. В.А. Ткачука. М., 2008.
- Шамсутдинова И.Р., Дерхо М.А. Изменения показателей крови лабораторных животных при введении наночастиц серебра. Известия Оренбургского государственного аграрного университета, 2015, 6(56): 122-124.
- Wang L., Ding W., Zhang F. Acute toxicity of ferric oxide and zinc oxide nanoparticles in rats. J. Nanosci. Nanotechnol., 2010, 10(12): 8617-8624 ( ) DOI: 10.1166/jnn.2010.2483
- Yan G., Huang Y., Bu Q., Lv L., Deng P., Zhou J., Wang Y., Yang Y., Liu Q., Cen X., Zhao Y. Zinc oxide nanoparticles cause nephrotoxicity and kidney metabolism alterations in rats. J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng., 2012, 47(4): 577-588 ( ) DOI: 10.1080/10934529.2012.650576
- Surekha P., Kishore A.S., Srinivas A., Selvam G., Goparaju A., Reddy P.N., Murthy P.B. Repeated dose dermal toxicity study of nano zinc oxide with Sprague-Dawley rats. Cutan. Ocul. Toxicol., 2012, 31(1): 26-32 ( ) DOI: 10.3109/15569527.2011.595750
- Ema M., Hougaard K.S., Kishimoto A., Honda K. Reproductive and developmental toxicity of carbon-based nanomaterials: A literature review. Nanotoxicology, 2016, 10(4): 391-412 ( ) DOI: 10.3109/17435390.2016.1073811
- Tsyganova N.A., Khairullin R.M., Terentyuk G.S., Khlebtsov B.N., Bogatyrev V.A., Dykman L.A., Erykov S.N., Khlebtsov N.G. Penetration of pegylated gold nanoparticles through rat placental barrier. Bull. Exp. Biol. Med., 2014, 157(3): 383-385 ( ) DOI: 10.1007/s10517-014-2572-3
- Zhang H., Yang D., Yang H., Liu H. Effect on conception and offspring development in female parenatal rats following intratracheal instillation of nano-C/ZnO and C-ZnO composite nanoparticles. Wei Sheng Yan Jiu. (Chinese), 2008, 37(6): 654-656.


