Герниопластика больших и гигантских грыж пищеводного отверстия диафрагмы полипропиленовым и биокарбоновым имплантатом
Автор: Розенфельд И.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 (52), 2021 года.
Бесплатный доступ
Цель: освещение непосредственных и отдалённых результатов использования биокарбонового имплантата в сравнении со стандартной методикой использования полипропиленового имплантата при оперировании пациентов с большими и гигантскими диафрагмальными грыжами.Материалы и методы. Все пациенты, которым была выполнена аллопластика различными имплантатами, были разделены на две исследовательские группы: I группа из 221 пациента, которым была выполнена аллопластика полипропиленовым сетчатым имплантатом (171 пациент с большими грыжами площадью 10-20 см2 и 50 пациентов с гигантскими грыжами пищеводного отверстия диафрагмы с площадью грыжевого дефекта более 20 см2); II группа из 79 пациентов, которым была выполнена оригинальная аллопластика двухслойным биокарбоновым сетчатым имплантатом (50 пациентов с большими грыжами и 29 пациентов с гигантскими грыжами пищеводного отверстия). Послеоперационные осложнения классифицировались по шкале Clavien, Dindo. Индекс De Meester использовался в качестве критерия сравнения.Результаты. Результаты хирургического лечения являются пилотными и репрезентативными, которые определяют дальнейшую тактику и направление совершенствования операций по удалению больших и гигантских диафрагмальных грыж. Приведены данные по использованию двухслойного биокарбонового имплантата и сравнение с полипропиленовым имплантатом при проведении «оnlay» пластики больших и гигантских диафрагмальных грыж.Заключение. Получены достоверные отличия по рецидивам всех видов в пользу биокарбонового имплантата (5,6 % против 22,8 %; р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Грыжи пищеводного отверстия диафрагмы, герниопластика, полипропиленовый имплантат, биокарбоновый имплантат, техника операции
Короткий адрес: https://sciup.org/143177349
IDR: 143177349 | УДК: 617-089.844 | DOI: 10.20340/vmi-rvz.2021.4.CLIN.3
Текст научной статьи Герниопластика больших и гигантских грыж пищеводного отверстия диафрагмы полипропиленовым и биокарбоновым имплантатом
УДК 617-089.844
Cite as: Rosenfeld I.I. Hernioplasty of large and giant diaphragmal hernias with polypropylene and biocarbonic implant. Bulletin of the Medical Institute REAVIZ. Rehabilitation, Doctor and Health. 2021;4(52):79-87.
Введение ткань, что вызывает появление послеопе-
Исследование посвящено продолжению рационных осложнений и анатомических оптимизации методики проведения опера- рецидивов [8, 9].
тивного вмешательства при грыжах пище- Разработанная методика лапароскопи- водного отверстия диафрагмы, которое ос- ческой двухслойной пластики с использо- новывается на использовании разработан- ванием двухслойного биокарбонового сетной автором модели двухслойного биокар- чатого имплантата имеет два ключевых бонового сетчатого имплантата [1–3]. преимущества.
Целью данного исследования является Во-первых, данная конструкция явля- освещение непосредственных и отдалён- ется не только облегчённой, но и частично ных результатов использования двухслой- включает в себя волокна медицинского ного биокарбонового сетчатого имплантата биокарбона, который представляет собой в сравнении со стандартной методикой ис- сверхпрочный хирургический материал, что пользования полипропиленового импланта- помогает снижать вероятность возникно-та при оперировании пациентов с больши- вения рецидива. Кроме того, конструкция ми и гигантскими грыжами пищеводного также включает в себя рассасывающийся отверстия диафрагмы. на протяжении нескольких месяцев моно-
Классическая методика «onlay» пласти- акрил. При этом вокруг сетки формируется ки полипропиленовой конструкцией пред- негрубая фиброзная ткань, и сморщивание полагает применение имплантата с его по- конструкции происходит в небольшой сте- следующей фиксацией поверх сшитых пени.
диафрагмальных ножек [4–7]. В месте уста- Во-вторых, имплантат из медицинского новки формируется грубая фиброзная биокарбона закрывается диафрагмальны- ми ножками, что способствует непосредственному ограничению сетки с пищеводом. Таким образом, биокарбоновый имплантат не производит «пилящего» эффекта во время дыхательных движений. Полученные преимущества вызывают значительное снижение риска возникновения эзофагеальных осложнений.
Материалы и методы исследования
Хирургическому вмешательству было подвергнуто 300 пациентов с диагнозом большие и гигантские грыжи пищеводного отверстия диафрагмы, оперированные с 2014 по 2018 год. Из 300 пациентов 221 была установлена полипропиленовая сетка, а 79 человек были прооперированы с использованием опытного образца двухслойного биокарбонового сетчатого имплантата по патенту автора (регистрационный № 20181 от 16.07.2018 года).
Пациенты, которым была выполнена аллопластика различными имплантатами, были разделены на 2 группы:
-
- I группа из 221 человека, которым была выполнена аллопластика полипропиленовым сетчатым имплантатом (171 пациент с большими грыжами площадью 10–20 см2 и 50 пациентов с гигантскими грыжами пищеводного отверстия диафрагмы с площадью грыжевого дефекта более 20 см2).
-
- II группа из 79 человек, которым была выполнена оригинальная аллопластика двухслойным биокарбоновым сетчатым имплантатом (50 пациентов с большими грыжами и 29 пациентов с гигантскими грыжами пищеводного отверстия).
Оригинальная авторская методика выполняется следующим образом:
-
1. Происходит выделение краёв пищеводного отверстия диафрагмы. Сетка из медицинского биокарбона шириной от 2–6 см и длиной от 2–8 см складывается вовнутрь биокарбоновым слоем, после того через троакар вводится в брюшную полость, в которой изделие за счёт своей упругости расправляется.
-
2. Имплантат зажимом размещается так, что верхняя часть располагалась возле пищевода, боковые стороны – у диафрагмальных ножек, нижняя часть – у основания ножек. Конструкция полностью повторяет форму эзофагеального отверстия диафрагмы. Благодаря медицинскому биокарбону не происходит сморщивание имплантата, а также за счёт упругости происходит его расправление в горизонтальном положении.
-
3. Происходит фиксация двух отдельных узловых шва. Первый – сквозной шов – прошивается через правую и левую диафрагмальные ножки. Второй – отдельный узловой шов – накладывается на основание диафрагмальных ножек. При операции применяется рассасывающийся хирургический материал.
-
4. Затем конструкция из медицинского биокарбона максимально растягивается в горизонтальном положении, что помогает достичь наибольшей площади соприкосновения изделия с биотканью.
-
5. После хирургического вмешательства в течение пяти дней конструкция из медицинского биокарбона полностью имитирует окружающие ткани и закрывает соответствующий грыжевой дефект. Через один месяц после рассасывания материала возникает наноплёнка в месте проведения герниопластики. Данная наноплёнка удерживает окружающие биологические ткани в заданном положении, что предупреждает развитие анатомического рецидива.
Послеоперационные осложнения классифицировались по шкале Clavien – Dindo, определяющей следующие степени развития осложнений:
-
• I степень – возникновение отклонений после операции, которые не требуют терапевтического лечения (кроме жаропонижающих, обезболивающих и противо-рвотных) или последующих хирургических вмешательств;
-
• II степень – осложнения, которые не угрожают жизни, которые требует медика-
- ментозного лечения, включая гемотрансфузии и парентеральное питание;
-
• III степень – осложнения, которые не представляют угрозы для жизни пациента: III а степень – общая анестезия не применяется; III b степень – требуется применение общей анестезии;
-
• IV степень – осложнения, несущие угрозу жизни пациента, в том числе цереброваскулярные осложнения, которые требуют лечения в условиях госпитальной терапии: IV а степень – дисфункция одного органа, включая диализ; IV b степень – по-лиорганная недостаточность;
-
• V степень – смерть.
Индекс De Meester использовался в качестве критерия сравнения, в норме он равен 14,7.
Результаты исследования
Непосредственные результаты операции
Операционных осложнений в I группе не было. Во II группе отмечено три случая (2,4 %) закрытого пневмоторакса. Была дренирована плевральная полость по Бюлау.
Частота интраоперационных осложнений не имела достоверных отличий между исследованными группами (0,0 % против 2,6 % соответственно, p = 0,0642, критерий Фишера).
В I группе у шести пациентов (3,2 %) наблюдались постоперационные осложнения: три случая развития ателектазов с лихорадкой, один случай инфицирования послеоперационной раны. Возникшие осложнения относились ко II степени по классификации Clavien – Dindo. Кроме того, наблюдался один случай поддиафрагмальной гематомы, требующей пункционного дренирования, что относилось к III а степени по классификации Clavien – Dindo.
Послеоперационные осложнения во II группе имели место у трех пациентов (3,4 %): лихорадка с ателектазами, которые относились ко II степени по классификации Clavien – Dindo.
Отдалённые результаты операции
В I группе из 221 пациента анатомические рецидивы всех видов отмечались у 14 пациентов (6,5 %). Данные рецидивы были распределены следующим образом: анатомический симптомный рецидив и функциональный рецидив наблюдались у шести пациентов (2 %), анатомический симптомный рецидив – у четырех пациентов (1,8 %), анатомический бессимптомный рецидив и функциональный рецидив отсутствовали, анатомический бессимптомный рецидив выявлен у одного пациента (0,3 %). Функциональные рецидивы всех видов определялись у шести пациентов (2,6 %). Из них функциональные симптомные рецидивы определялись у четырех пациентов (1,9 %), функциональный бессимптомный рецидив – у одного пациента (0,4 %). Средний индекс De Meester, измеренный у 162 пациентов, составил 15,7 ± 25,8 (3,3–45,4). Рефлюкс-эзофагит выявлен у десяти пациентов (4,3 %). Функциональная длительная дисфагия имела место у 19 пациентов (8,2 %). Стриктуры пищевода были выявлены в трех случаях (1,3 %). Реоперации выполнены двум пациентам (0,9 %): по поводу анатомического симптомного рецидива и функционального рецидива.
Во II группе из 79 пациентов анатомические рецидивы всех видов определялись у 17 пациентов (21,5 %). Данные пациенты были распределены следующим образом: анатомический симптомный рецидив и функциональный рецидив у пяти пациентов (6,3 %), анатомический симптомный рецидив – у восьми пациентов (10,3 %), анатомический бессимптомный рецидив и функциональный рецидивы – у одного пациента (1,2 %), анатомический бессимптомный рецидив – у трех пациентов (3,1 %). Функциональные рецидивы всех видов были выявлены у трех пациентов (4,6 %). Из них симп-томные функциональные рецидивы были выявлены у двух пациентов (3,1 %), бессимптомный функциональный рецидив – у одного пациента (1,2 %). Средний индекс De Meester, измеренный у 60 пациентов, составил 31,2 ± 51,4 (4,2–87,5). Рефлюкс-эзофагит определялся у девяти пациентов (11,4 %). Функциональная длительная дисфагия была у шести пациентов (7,7 %). Стриктура пищевода наблюдалась в одном случае (1,2 %). Реоперации произведены у четырех пациентов (4,9 %): у двух по поводу анатомического симптомного и функционального рецидива, у одного пациента по поводу стриктуры пищевода и у одного – по поводу анатомического симптомного рецидива.
Обе выборки сопоставлялись по частоте встречаемости интересующего нас критерия. При этом использовался параметрический критерий Фишера. Критерий Фишера позволяет производить оценку достоверности различий между процентными долями обеих выборок, в которых определяется интересующий исследователя признак. Статистика данного теста, так или иначе, сводилась к отношению выборочных дисперсий (сумм квадратов, разделённых на «степени свободы»). При этом, для того чтобы статистика имела распределение Фишера, необходимо числителю и знаменателю быть независимыми случайными величинами и соответствовать сумме квадратов (Х-квадрат). Поэтому необходимо, чтобы данные имели нормальное распределение. Кроме того, также предполагается, что дисперсия случайных величин, квадраты которых суммируются, будет одинаковой.
По частоте послеоперационных осложнений достоверных отличий между исследовательскими группами не отмечалось (2,1 % против 2,4 %, p = 0,5687, точный критерий Фишера). Послеоперационный средний койко-день составил 5,6 ± 1,4 (3–12) дня в I группе и 4,9 ± 1,1 (от 2 до 10) дней во II группе. По послеоперационным койко-дням также между группами достоверных отличий отмечено не было (5,4 ± 1,4 против 5,3 ± 1,5 p = 0,4122, критерий Манна – Уитни).
Отдалённые результаты хирургических операций
По частоте анатомических рецидивов всех видов было выявлено достоверное различие только в пользу I группы (5,3 % против 21,7 %, р < 0,0001, критерий χ 2). По частоте анатомического симптомно-го и функционального рецидива достоверных различий не отмечалось (4 % против 6 %, р = 0,0812, критерий χ 2). По частоте анатомического симптомного рецидива было выявлено достоверное различие в пользу I группы (2,1 % против 10,3 %, р = 0,0006, критерий χ 2). По частоте анатомических бессимптомных и функциональных рецидивов достоверных различий не отмечалось (0,0 % против 1,4 %, р = 0,2557, точный критерий Фишера). По частоте анатомических бессимптомных рецидивов достоверных различий не отмечалось (0,3 % против 2,6 %, р = 0,1618, точный критерий Фишера). По частоте функциональных рецидивов всех видов достоверных различий не отмечалось (2,5 % против 5,2 %, р = 0,2348, точный критерий Фишера). По частоте функциональных симптоматических рецидивов достоверных различий не отмечалось (2,1 % против 3,7 %, р = 0,3345, точный критерий Фишера). По частоте бессимптомных функциональных рецидивов достоверных различий также не отмечалось (0,3 % против 1,1 %, р = 0,4545, точный критерий Фишера). По частоте ре-флюкс-эзофагита выявлено достоверное различие в пользу I группы (4,1 % против 10,3 %, р = 0,0236, критерий χ 2). По частоте функциональной длительной дисфагии пищевода достоверное различие не обнаружено (8,1 % против 8,7 %, р = 0,8612, точный критерий Фишера). По среднему индексу De Meester достоверное различие выявлено не было (15,5 ± 24,7 против 30,2 ± 50,7, р = 0,0659, критерий Манна – Уитни). По частоте эзофагеальных стриктур достоверных различий не отмечалось (1,2 % против 1,3 %, р = 0,7312, точный критерий Фишера). По частоте реопераций отмечалось достоверное различие в пользу
I группы (0,9 % против 4,9 %, р = 0,0397, точный критерий Фишера).
При этом верхний край конструкции из медицинского биокарбона в виде основания треугольника не должен был доходить до пищевода, полностью поднятого кверху на 1 см для исключения непосредственного контакта. Таким образом, создавался «первый пласт». Далее думя-тремя узловыми швами диафрагмальные ножки сшивались между собой, что приводило к полному закрытию имплантата (рис. 2). При этом верхний отдельный узловой шов не должен был доходить до пищевода, полностью поднятого кверху на 0,5–1 см. Таким образом, создавался «второй пласт». Герниопласти-ка выполнялась при введённом в желудок калибровочном зонде диаметром 30 Fr. Последующий этап – фундопликация по Ниссену с длиной манжетки 3 см с использованием калибровочного зонда и нерассасы-вающегося шовного материала.
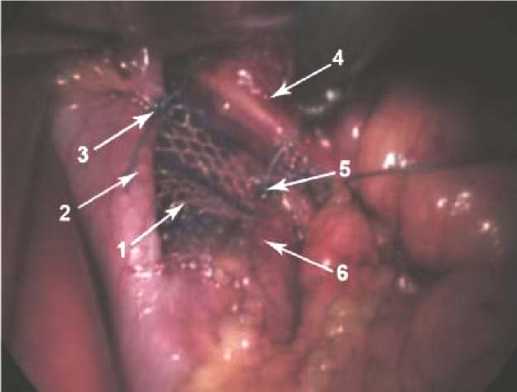
Рис. 1. Фиксация имплантата к диафрагмальным ножкам: 1 – сетчатый имплантат; 2 – правая диафрагмальная ножка; 3 – шов, фиксирующий имплантат к правой ножке диафрагмы; 4 – пищевод; 5 – шов, фиксирующий имплантат к левой ножке диафрагмы; 6 – левая диафрагмальная ножка
Fig. 1. Fixation of the implant to the stems of the diaphragm: 1 – mesh implant; 2 – right leg of the diaphragm; 3 – suture fixing the implant to the right leg of the diaphragm; 4 – esophagus; 5 – suture fixing the implant to the left leg of the diaphragm; 6 – left leg of the diaphragm
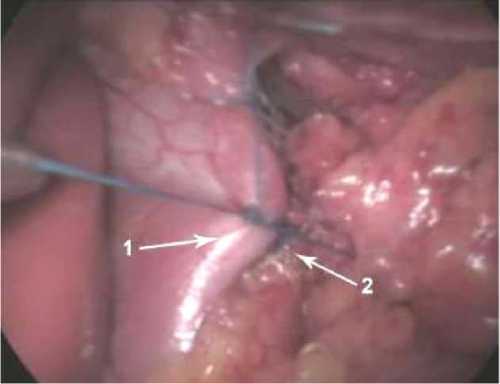
Рис. 2. Сшивание ножек с закрытием имплантата: 1 – правая диафрагмальная ножка; 2 – левая диафрагмальная ножка
Fig. 2. Suturing the legs with closure of the implant: 1 – right leg of the diaphragm; 2 – left leg of the diaphragm
Таким образом, к преимуществам использованной методики относилось предложенное автором техническое решение при выполнении пластики больших и гигантских грыж пищеводного отверстия диафрагмы. Данный способ повышает надёжность оперативного вмешательства при использовании конструкции из медицинского биокарбона, которая формирует нанослой, позволяющий сократить количество постоперационных осложнений благодаря фиксации изделия лишь в двух точках к диафрагмальным ножкам.
Применение особой техники проведения операции при использовании биокарбонового имплантата призвано решить ряд трудностей, которые возникают при выполнении лапароскопической пластики больших и гигантских грыж пищеводного отверстия диафрагмы, а также в послеоперационный период за счёт предотвращения развития анатомических рецидивов и рубцовых стриктур пищевода. Это достигается благодаря оптимизированной схеме и технологии фиксации имплантата.
Наиболее близким к предложенному техническому решению является способ лапароскопической ненатяжной пластики пищеводного отверстия диафрагмы и способ лапароскопической пластики больших и гигантских грыж пищеводного отверстия диафрагмы [2, 3]. Их использование учитывает только особую технику проведения хирургической операции, когда к краям ножек диафрагмы узловыми швами фиксируется полипропиленовая/композитная или облегчённая каркасная политетрафлюоре-тиленовая сетка в 3–5 точках [3].
Недостатками таких способов являются следующие факторы:
-
1. Высокий риск рецидива за счёт возможности образования грыжевого дефекта между пищеводом и верхним краем имплантата.
-
2. Имплантат не рассасывается и может травмировать пищевод с развитием рубцовой и другой ткани.
-
3. Надёжная фиксация сетки указанным способом требует наложения от трех до пяти швов и исключает возможность индивидуального чёткого сопоставления имплантата с грыжевым дефектом.
-
4. Расположение сетки можно проконтролировать только рентгенологически при проведении рентгеноскопии пищевода в послеоперационном периоде, однако, нерассасывающийся металлический элемент значительно повышает риск отторжения имплантата [2].
Предлагается концепция методики при больших и гигантских грыжах пищеводного отверстия диафрагмы двухслойной фикса- ционной пластики частично рассасывающимся биокарбоновым имплантатом, снижающим риск анатомических рецидивов, осложнений, а также болевого синдрома, что способствует повышению уровня жизни пациентов по сравнению с бесфиксацион-ными методами пластики.
Под фиксацией понимается применение внутреннего, непосредственно касающегося ткани пациента, биокарбонового слоя. В предлагаемой методике использованы достижения отечественных учёных, впервые для оперативного лечения больших и, в основном, гигантских грыж пищеводного отверстия диафрагмы. Разработана лапароскопическая методика двухслойной герниопластики пищеводного отверстия облегчённым сетчатым двухслойным имплантатом. Первый слой данной конструкции частично рассасывается, второй слой представляет собой биокарбоновую плёнку на основе карбита. При этом медицинский биокарбон после его изобретения впервые использован в хирургии грыж пищеводного отверстия диафрагмы [1, 3]. Данные преимущества позволяют значительно снизить послеоперационные осложнения, а также риски развития анатомических рецидивов.
Задачей авторской методики является достижение отсутствия «пилящего» эффекта при дыхательных актах диафрагмы, поскольку при классической методике «onlay» пластики предусматривается применение стандартной или облегчённой конструкции с фиксацией её поверх сшитых диафрагмальных ножек. При этом формируется грубая фиброзная ткань, происходит значительное сморщивание имплантата, сохраняется контакт изделия с пищеводом, что приводит к развитию анатомических рецидивов.
Выводы
По частоте рефлюкс-эзофагита, повторным операциям и анатомическим рецидивам достоверных отличий между сравниваемыми группами выявлено не было.
Результаты аллопластики во II группе при использовании биокарбонового имплантата можно считать близкими к удовлетворительным, но они требуют улучшения за счёт использования особой техники проведения операций.
Результаты использования данной методики проведения операций будут статистически сравнены в дальнейших публикациях автора.
Список литературы Герниопластика больших и гигантских грыж пищеводного отверстия диафрагмы полипропиленовым и биокарбоновым имплантатом
- Furnée E, Hazebroek E Mesh in laparoscopic large hiatal hernia repair: a systematic review of the literature. Surgical endoscopy. 2018;27:3998-4008. DOI: 10.1007/s00464-013-3036-y
- Jones R, Simorov A, Lomelin D, et al. Long - term outcomes of radiologic recurrence after paraesophageal hernia repair with mesh. Surgical endoscopy. 2015;29(2):425-430. DOI: 10.1007/s00464-014-3690-8
- Granderath FA, Schweiger UM, Kamolz T Laparoscopic antireflux surgery with routine mesh - hiatoplasty in the treatment of gastroesophageal reflux disease. Journal of gastrointestinal surgery. 2018;3:347-353. DOI: 10.1016/s1091-255x(01)00025-7
- Frantzides CT, Carlson MA, Loizides S Hiatal hernia repair with mesh: a survey of SAGES members. Surgical endoscopy. 2018;27(5):1017-24. DOI: 10.1007/s00464-009-0718-6
- Antoniou SA, Koch OO, Antoniou GA Mesh - reinforced hiatal hernia repair: a review on the effect on postoperative dysphagia and recurrence. Langenbeck'sarchivesofsurgery. 2019;397:19-27. DOI: 10.1007/s00423-011-0829-0
- Nikonov EL Hirurgicheskoe lechenie gryzh pishchevodnogo otverstiya diafragmy i vozmozhnosti novyh endoskopicheskih procedur. Hirurgiya. ZHurnal im. N.I. Pirogova. 2018;5:96-105. (In Russ).
- Lidor AO, Steele KE, Stem M, et al. Long - term quality of life and risk factors for recurrence after laparoscopic repair of paraesophageal hernia. Journal of the American medical association surgery. 2015;150:424-431. DOI: 10.1001/jamasurg.2015.25
- Targarona EM, Grisales S, Uyanik O Long - term outcome and quality of life after laparoscopic treatment of large paraesophageal hernia. World journal of surgery2016;7:1878-1882. DOI: 10.1007/s00268-013-2047-0
- Grubnik VV, Malinovskij AV Kriticheskie aspekty laparoskopicheskoj hirurgii gastroezofageal'-noj reflyuksnoj bolezni i gryzh pishchevodnogo otverstiya diafragmy. Odessa: VMV-tipografiya, 2015. (In Russ).


