Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
Автор: Колядина Ирина Владимировна, Поддубная Ирина Владимировна, Франк Георгий Авраамович, Комов Дмитрий Владимирович, Карселадзе Аполлон Иродионович, Ермилова Валерия Дмитриевна, Вишневская Яна Владимировна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Диагностика и лечение опухолей. Состояние проблемы
Статья в выпуске: 1 (12), 2015 года.
Бесплатный доступ
Введение программ ранней диагностики РМЖ в мире привело не только к увеличению доли неинвазивных карцином и рака молочной железы I стадии, но и к перераспределению биологических подтипов опухолей в популяции скринируемых женщин. В нашей стране доля рака молочной железы I стадии составляет всего 21,4%; биологическое и прогностическое значение размера опухоли (T1a, T1b и T1c) является неизученным. Мы проанализировали клинические и морфологические характеристики, а также прогностическое значение размера опухоли (T1a-b-c) для риска развития рецидива болезни и смерти от ее прогрессирования у 1341 больной раком молочной железы I стадии. Нами выявлено прогрессивное увеличение доли «малых» опухолей (T1a и T1b) в структуре РМЖ I стадии в течение последних 25 лет: доля микрокарцином T1aN0M0 увеличилась с 0,3% до 4,3%; доля опухолей T1bN0M0 - с 8,7 до 22,1%, что говорит об улучшении ранней диагностики заболевания. Рак молочной железы I стадии является гетерогенной группой с благоприятным течением болезни при микрокарциномах размером T1a (≤5мм) и более агрессивном - при опухолях размером T1b (6-10мм) и T1c (11-20мм). Только опухоли размером T1a имеют благоприятный биологический «портрет» (высокую долю люминального А подтипа РМЖ), что отражается на долгосрочных результатах лечения (минимальная доля рецидивов болезни и смертей от рака и лучшие показатели отдаленной выживаемости). Биологические характеристики опухолей размером T1b и T1c являются более агрессивными и представлены высокой частотой протокового рака с люминальным В и тройным негативным иммунофенотипом рака, что существенно ухудшает прогноз болезни. Биология «малых» опухолей должна учитываться при выборе наиболее оптимального адъювантного лечебного алгоритма при раке молочной железы.
Рак молочной железы i стадии, размер опухоли t1a-b-c, биологические подтипы рака молочной железы, скрининговые и "интервальные" раки
Короткий адрес: https://sciup.org/14045522
IDR: 14045522
Текст научной статьи Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
-
1. Oncology Chair of Russian Medical Academy for Postgraduate Education, Moscow, Russia
-
2. N.N. Blokchin Russian Cancer Research Center, Moscow, Russia
Рак молочной железы (РМЖ) — наиболее распространенная женская онкопатология во всем мире; по данным GLOBOCAN 2012 в структуре мировой заболеваемости РМЖ лидирует (25,2% от всех злокачественных опухолей) и стабильно занимает первое место в структуре мировой смертности у женщин (14,7% смертей от злокачественных опухолей) [1]. Показатели заболеваемости РМЖ в мире в течение последних 30 лет увеличились, что связано с абсолютным и относительным ростом заболеваемости. Абсолютный рост обусловлен различными социально-экономическими причинами и представляет собой истинное увеличение числа вновь выявленных случаев РМЖ; относительный рост заболевания связан с улучшением ранней (скрининговой) диагностики патологии [1–3].
Согласно данным официальной статистики в 2013 г. на территории России более полумиллиона (562053) женщин состояло на учете у онколога с диагнозом РМЖ; ежегодно в нашей стране диагностируется не менее 50.000 новых случаев заболевания. Смертность от РМЖ в России в течение долгого времени была на стабильно высоком уровне (17,2 на 100.000 женского населения); однако в последние два года впервые отмечено некоторое снижение показателей смертности (до 15,9 на 100.000 населения). Эти позитивные результаты, безусловно, являются следствием улучшения ранней диагностики заболевания и активного использования адъювантного лекарственного лечения (химиотерапии, эндокринотерапии и таргетной терапии). Несмотря на эти обнадеживающие данные, 5-летний период наблюдения переживают всего 59% российских больных (для сравнения, в США 5-летний период наблюдения переживают 89%, а в Европе 85% больных РМЖ) [1–3].
Молекулярно-генетические исследования последних лет позволили идентифицировать несколько молекулярно-генетических подтипов РМЖ, отличающихся особенностями течения и прогноза; однако, выполнение анализа генной экспрессии не всегда возможно в рутинной клинической практике [4–6]. В 2009 г. была предложена упрощенная суррогатная модель молекулярно-генетической классификации
Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
РМЖ, основанная на показателях экспрессии рецепторов эстрогенов (ER), прогестерона (PR), HER2 и уровня пролиферативной активности Ki67. Согласно международным и отечественным рекомендациям в настоящее время выделено 5 биологических подтипов РМЖ: люминальный А (высокодифференцированные раки ER+PR+HER2-Ki67<20%), люминальный B HER2-негативный (низкодиффе-ренцированнные раки ER+PR±HER2-Ki67> 20%), люминальный B HER2-позитивный (ER+PR±HER2+Ki67любой), тройной негативный рак (ER-PR-HER2-Ki67любой), не люминальный HER2-позитивный (ER-PR-HER2+ Ki67любой). [7–9]. Используемая классификация биологических подтипов опухоли неслучайна; в многочисленных исследованиях показано различное прогностическое и предсказывающее значение иммуногистохимических характеристик опухоли при РМЖ. Наиболее благоприятным является люминальный А подтип РМЖ. Опухоли данного подтипа чаще всего диагностируются в пожилом возрасте, обладают медленным ростом, низким риском развития рецидивов и смерти от прогрессирования [10– 12]. В крупном американском исследовании Parise C. A. и соавт. проанализированы данные Калифорнийского Национального Канцерре-гистра с включением более 61.000 женщин первичным инвазивным РМЖ. Было показано, что 5-летняя выживаемость при люминальных HER2-негативных подтипах опухолей составляет 96%, а у больных с HER2-позитивным или тройным негативным подтипом — всего 76%. Причем, люминальный А подтип чаще отмечен у белокожих женщин в постменопаузе при I– II стадии заболевания [13]. Люминальный B подтип РМЖ отличается более агрессивным течением ввиду высокой пролиферативной активности опухолевых клеток, более низкой экспрессии рецепторов стероидных гормонов в опухоли и наличием экспрессии HER2 (при HER2+ подтипе). Эти характеристики обусловливают более высокий метастатический потенциал опухоли и менее благоприятный, по сравнению с люминальным А подтипом, прогноз болезни [14–16]. Так, в исследовании: Najafi B и соавт. показано, что у пациенток с РМЖ I–II стадии медиана прогрессирования при люминальном B подтипе существенно короче, чем при люминальном А (48,3 мес против 55,4 мес, p<0,05) [17]. Тройной негативный подтип рака характеризуется отсутствием экспрессии рецепторов стероидных гормонов и HER2 в опухоли; это гетерогенная группа, включающая как неблагоприятный базальноподобный РМЖ, так и редкие благоприятные варианты опухолей (медуллярный, слизистый, аденокистозный и др.), также не экспрессирующие ER, PR и HER2 [18–20]. Базальноподобный рак характеризуется более молодым возрастом манифестации заболевания, высокой степенью злокачественности опухоли, высоким индексом пролиферации и ассоциацией с семейным и BRCA-мутированным РМЖ. Такие неблагоприятные характеристики данного подтипа приводят к существенному увеличению риска рецидива в первые 3 года и риска смерти от прогрессирования в первые 5 лет после лечения первичной опухоли [21–23]. HER2-позитивные раки встречаются в 10–30% случаев, характеризуются молодым возрастом манифестации заболевания, высокой агрессией и быстрой диссеминацией опухолевого процесса [24–25]. До введения в рутинную практику моноклонального антитела Трастузумаба (Герцептина) прогноз больных с данным подтипом опухоли был неблагоприятным, показатели выживаемости были низки, отмечался высокий риск прогрессирования и смерти. Введение в адъювантные режимы трастузумаба (с 2006г) позволило снизить риск прогрессирования до 50% и риск смерти до 30% при раннем раке молочной железы [26–29].
Активное внедрение маммографического скрининга в ряде стран мира привело не только к увеличению доли ранних стадий (неинвазивного рака и РМЖ I стадии), но и к перераспределению биологических подтипов карцином в популяции скринируемых женщин. Анализ результатов скрининга покзал существенное увеличение доли люминального А подтипа РМЖ [30–34]. Так, в крупном исследовании Garc i a Fernandez A и соавт. проанализированы биологические подтипы опухолей, выявленных во время скрининговых программ или вне таковых [32]. Более 49.000 женщин, включенных в исследование, прошли маммографический скрининг с 2002 по 2012гг. с раундами в два года; около 40.000 женщин в скрининговых программах не участвовали. При сравнении характеристик опухолей, выявленных при скри-
Диагностика и лечение опухолей. Оригинальные статьи нинге и на стадии клинической манифестации, была отмечена существенная разница: доля люминального А подтипа была на 15% выше в группе скрининга, а тройной негативный рак преобладал среди пациенток, обнаруживших опухоль самостоятельно, что отразилось на показателях общей выживаемости, которая была в 2,6 раза выше среди пациенток со скрининговыми карциномами [32]. В другом крупном популяционном исследовании (Domingo L и соав.) изучены результаты скрининговой программы Испании с 2000 по 2009гг с включением более 645.000 женщин [33]. Авторы проанализировали биологические подтипы скрининовых опухолей и карцином, диагностированных между раундами скрининга (так называемых «интервальных» раков) и получили значимые различия: среди скрининговых карцином преобладали люминальные подтипы РМЖ, а «интервальные» раки были представлены тройным негативным и HER2-позитивным подтипами опухолей [33]. Термин «интервальный» рак появился недавно, но уже ассоциируется с более высоким митотическим потенциалом опухоли и ее способности к бурному росту; такие карциномы успевают вырасти из недиагностируемой микрокарциномы в клинически значимую опухоль за 2-летний интервал между раундами скрининга. Биологические характеристики и показатели отдаленной выживаемости у женщин со скрининговыми, «интервальными» и клинически выявленными раками изучены в крупном британском исследовании the West Midlands Cancer Intelligence Unit с включением более 21000 женщин (50– 74 лет), получивших лечение по поводу рака молочной железы с 1988 по 2004гг [30]. Как отмечают авторы, скрининговые опухоли существенно чаще имели низкую степень агрессии (G1) — 26,4%; доля G1-опухолей среди «интервальных» раков составила 12,3% и всего 7,1% — при клинически выявленных опухолях (p<0,05). Кроме того, скрининговые раки имели размер до 2см (T1) в 79%, «интервальные»-в 54,7% и клинически выявленные — всего 46,7% (p<0,05). Как итог, показатели 10-летней общей выживаемости у женщин со скрининговыми опухолями составили 85,5%, у пациенток с «интервальными» раками — 69,8%, а у пациенток с клинически выявленными карциномами — всего 57,7% [30].
Таким образом, люминальные подтипы опухолей преобладают у пациентком с ранним инвазивным РМЖ I стадии; течение болезни характеризуется низким риском рецидива и высокими показателями отдаленной выживаемости [30–34]. Частота гиперэкспрессии HER2 в популяции женщин с РМЖ I стадии не превышает 10–15%; однако, даже в этой благоприятной клинической ситуации HER2+ статус обусловливает неблагоприятное течение заболевания [35–37]. Так, в исследовании Theriault RL и со-авт. доля HER2+ опухолей среди 1012 женщин раком молочной железы I стадии (T1a-bN0M0) составила всего 9,7%; авторы отмечают существенное увеличение риска развития рецидива болезни при наличии гиперэкспрессии HER2 [35]. Аналогичные данные представлены в Миланском Европейском Институте Онкологии, где выполнен ретроспективный анализ течения болезни у 2130 пациенток РМЖ I стадии (T1a-bN0M0), получивших лечение с 1999 по 2006 гг. HER2+ рак выявлен всего у 7% больных, однако характеризовался неудовлетворительными показателями отдаленной выживаемости [37].
В России только накапливается опыт проведения скрининговых программ ранней диагностики РМЖ; доля карцином I стадии в нашей стране ничтожно мала (всего 21,4%), проблема гетерогенности опухолей размером T1a, T1b и T1c и ее прогностическое значение для риска дальнейшего прогрессирования и смерти является неизученной [2]. Распереде-ление биологических подтипов среди женщин РМЖ I стадии иное, чем в общей популяции женщин: преобладают люминальные раки, доля HER2+ и тройного негативного рака невысока. Однако, агрессивность HER2+ и тройного негативного подтипа РМЖ проявляется уже при микрокарциномах, несмотря на минимальные размеры опухоли и отсутствие поражения регионарных лимфоузлов; течение болезни основывается на биологических характеристиках опухоли [37–39]. В этой ситуации роль адъювантной лекарственной терапии становится особо дискутабельной [40–42]. Модернизация программ скрининга и понимание биологии «малых» опухолей позволит максимально оптимизировать диагностический и лечебный алгоритм при раке молочной железы в нашей стране.
Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
Нами оценена гетерогенность РМЖ I стадии (T1N0M0) в популяции российских женщин (26–88 лет, медиана возраста- 52 года), получивших радикальное лечение (хирургическое ± адъювантное системное и/или лучевое) с 1985 по 2012гг в РОНЦ им. Н. Н. Блохина РАМН и Клинике РМАПО. Анализ морфологических данных первичной опухоли включал: гистологический тип, степень анаплазии, статус рецепторов эстрогена (ER), прогестерона (PR), HER2 и Ki67; оценка проводилась согласно общепринятым критериям от 2013 г. На основании данных о рецепторном статусе были выделены 5 подтипов опухолей. Преобладал люминальный А подтип (ER+PR±HER2- Ki67<20%) — 36% случаев; HER2-негативный люминальный В подтип (ER+PR±HER2- Ki67>20%) отмечен у 25,2% женщин; HER2+ люминальный В подтип (ER+PR±HER2+) — в 9,6%; тройной негативный рак (ER-0 PR-0 HER2–0) у 22,9%; не люминальный HER2+ подтип (ER-0 PR-0 HER2+) — отмечен в 6,3% случаев. В соответствии с размером первичной опухоли мы разделили пациенток на 3 группы: 1) с опухолями не более 5мм (T1aN0M0) — 30 случаев (2,2%); 2) с карциномами 6–10мм (T1bN0M0) — 199 больных, 14,8%; 3) группу больных с опухолями 11–20мм (T1cN0M0) — 1112 случаев,
83%. При сравнении распределения размеров опухолей (T1a, T1b и T1c) в различные годы лечения (<1995 г., 1995–2000 гг., 2000–2005 гг., 2005–2010 гг., >2010 г.) нами отмечено прогрессивное увеличение доли «малых» опухолей (T1a и T1b) с течением времени. Так, опухоли размером T1a практически отсутствовали у больных, получивших лечение до 1995года (0,3%) и были диагностированы уже в 4,3% случаев у женщин, получивших лечение позже 2010 г. Доля карцином T1b увеличилась с 8,7% (<1995 г.) до 22,1% (>2010 г.). Соответственно, сократилась доля опухолей размером T1c с 91% до 73,6% (p<0,0001), что является результатом улучшения уровня инструментальной диагностики, рис. 1.
Нами выявлено, что размер опухоли значимо не коррелировал с возрастом женщин (p>0,05), в отличие от гистологического типа, степени анаплазии и биологического подтипа опухоли (p<0,05). Так, доля протокового рака прогрессивно возрастала с увеличением размера опухоли (при T1a- размере составляла 60%, при T1b-78,4% и при T1c- 82,3%), а доля благоприятных типов опухоли (тубулярный, папиллярный рак) была максимальна (23,3%) при опухолях T1a и составляла всего 5,7% — при опухолях T1c (p=0,002). Доля высоко-
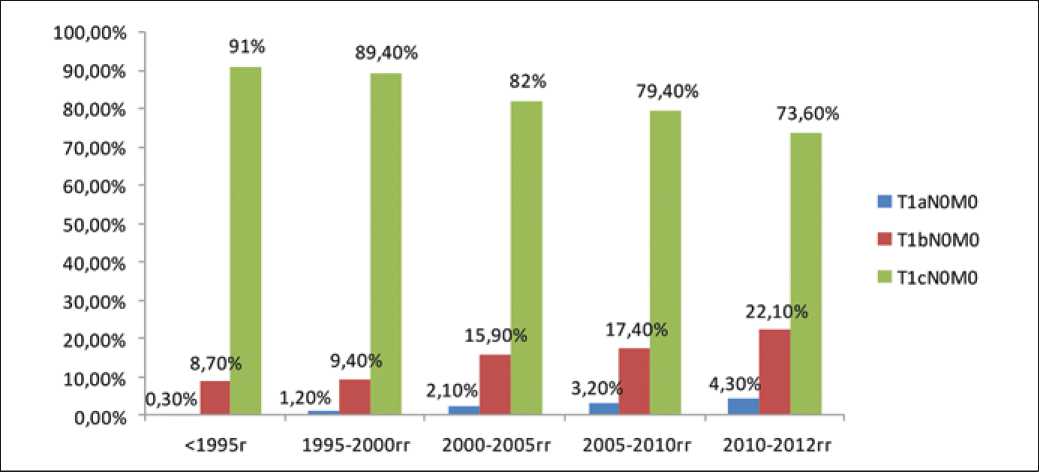
Рис. 1. Распределение размеров опухоли (T1a, T1b и T1c) у пациенток, получивших лечение в различные годы (p<0,0001)
Диагностика и лечение опухолей. Оригинальные статьи
Таблица 1. Биологическая характеристика подгрупп опухолей T1a, T1b и T1c
Люминальный А подтип преобладал среди женщин с опухолями T1a (66,7%), доля его существенно уменьшалась при опухолях T1b (47,8%) и T1c (31,4%). В противоположность этому доля HER2-негативного люминального B подтипа была минимальна при микрокарциномах T1a (6,7%), возрастала до 20,9% (при T1b опухолях) и 27,3% (при карциномах размером T1c). Аналогичные значимые различия мы отметили у пациенток с тройным негативным раком (при размере опухоли T1a- 13,3%; при T1c- 26,2%), p=0,011. Интересно отметить, что HER2+ не люминальный подтип был представлен только у пациенток с размером опухоли T1b и T1c и отсутствовал у женщин с микрокарциномами T1a, табл. 1.
При анализе течения болезни нами выявлено, что при медиане наблюдения 79 месяцев дальнейшее прогрессирование болезни выявлено всего у 4,3% женщин с размером опухоли T1a и существенно выше при T1b (14,5%) и T1c-размере опухоли (23,4%), р=0,021. Кроме того, была отмечена важная прогностическая закономерность (p=0,049): с увеличением размера опухоли увеличивается доля пациенток, умерших от дальнейшего прогрессирования заболевания. Так, при микрокарциномах T1a эта доля минимальна (4,3%); при
Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
Таблица 2. Прогностическое значение размера опухоли (T1a, T1b и T1c) для дальнейшего прогрессирования и смерти у пациенток раком молочной железы I стадии
|
Показатели отдаленного прогноза |
Размер опухоли, T |
Доля в общей популяции |
||
|
<5мм (T1a) |
5–10мм (T1b) |
10–20мм (T1c) |
||
|
30 больных (2,2%) |
199 больных (14,8%) |
1112 больных (83%) |
||
|
Рецидивы |
4,3% |
14,5% |
23,4% |
21,9% |
|
достоверность |
р=0,021 |
|||
|
БРВ |
||||
|
5-летняя |
100% |
89,9% |
82,6% |
84,3% |
|
10-летняя |
83,3% |
78,8% |
74,1% |
75% |
|
15-летняя* |
Нет данных |
Нет данных |
67,3% |
68,8% |
|
достоверность |
p=0,021 |
|||
|
Смерть от любой причины |
8,3% |
10,0% |
17,4% |
16,3% |
|
достоверность |
р=0,27 |
|||
|
ОВ |
||||
|
5-летняя |
92,9% |
96% |
93% |
93,4% |
|
10-летняя |
74,3% |
84,8% |
80% |
80,6% |
|
15-летняя* |
Нет данных |
Нет данных |
69% |
70,2% |
|
достоверность |
р=0,212 |
|||
|
Смерть от рака |
4,3% |
9,4% |
15,3% |
14,3% |
|
достоверность |
р=0,049 |
|||
|
ОСВ |
||||
|
5-летняя |
100% |
96% |
93,7% |
94,2% |
|
10-летняя |
95,7% |
85,8% |
81,5% |
82,5% |
|
15-летняя* |
Нет данных |
Нет данных |
72,8% |
73,9% |
|
достоверность |
p=0,046 |
|||
* Показатели 15-летней выживаемости представлены только для пациенток с T1c-размером опухоли, учитывая недостаточное число наблюдений в подгруппах пациенток с размерами опухоли T1a и T1b.
размере опухолей T1b — 9,4%, а при размере опухоли T1c составила уже 15,3%, табл. 2.
БРВ — безрецидивная выживаемость; ОВ — общая выживаемость; ОСВ — онкоспеци-фическая выживаемость.
Лучшие показатели 5 и 10-летней без-рецидивной выживаемости (БРВ) отмечены у пациенток с микрокарциномами T1a (100% и 83,3%), у больных с опухолями T1b составили 89,9% и 78,8% и были существенно ниже у женщин при размерах карцином T1c (82,6% и 74,1%), р=0,021. При сравнении показателей 5- и 10-летней общей выживаемости (ОВ) мы не выявили существенных различий между подгруппами: у женщин с опухолями T1a — 92,9% и 74,3%; при опухолях T1b- 96% и 84,8% и у пациенток с T1c- размером опухолей- 93% и 80% соответственно (p=0,212).
Однако, при сравнении показателей он-коспецифической выживаемости (ОСВ) было подтверждено прогностическое значение размера опухоли для риска смерти от прогрессирования заболевания. Максимальные показатели 5- и 10-летней онкоспецифиче-ской выживаемости отмечены для пациенток с микрокарциномами T1a (100% и 95,7%); у больных с опухолями T1b составили уже 96% и 85,8% и были существенно ниже при размерах опухоли Т 1c (93,7% и 81,5% соответственно), p=0,046, табл. 2.
Выводы
Рак молочной железы I стадии является гетерогенной группой с благоприятным те-
Диагностика и лечение опухолей. Оригинальные статьи чением болезни при микрокарциномах размером T1a (не более 5мм) и более агрессивном — при опухолях размером T1b (6–10мм) и T1c (11–20мм). Только опухоли размером T1a имеют благоприятный биологический «портрет» (высокую долю люминальных А карцином с низкой степенью злокачественности), что отражается на долгосрочных результатах лечения (минимальная доля рецидивов болезни и смертей от прогресси- рования и наилучшие показатели отдаленной выживаемости). Биологические характеристики опухолей размером T1b и T1c являются более агрессивными и представлены высокой долей люминального В и тройного негативного иммунофенотипа рака, что существенно ухудшает прогноз болезни. Гетерогенность рака молочной железы I стадии необходимо учитывать при выборе адъювантных алгоритмов лечения.
Список литературы Гетерогенность рака молочной железы I стадии: биологическое и прогностическое значение
- GLOBOGAN 2012; www. http://globocan.iarc.fr
- Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. Состояние онкологической помощи населению России в 2013 году. М.: ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, 2014. ил.-235 с. www.oncology.ru
- Е. М. Аксель. Заболеваемость и смертность от рака молочной железы в России. Материалы большой конференции RUSSCO «Рак молочной железы» 22-24 января 2014 г., стр. 35-38
- O’Neill F1, Madden SF, Clynes M et all. A gene expression profile indicative of early stage HER2 targeted therapy response. Mol Cancer. 2013 Jul 1;12:69
- Abramovitz M, Barwick BG, Willis S et all. Molecular characterisation of formalin-fixed paraffin-embedded (FFPE) breast tumour specimens using a custom 512-gene breast cancer bead array-based platform. Br J Cancer. 2011 Nov 8;105 (10):1574-81
- Strehl JD, Wachter DL, Fasching PA et all. Invasive Breast Cancer: Recognition of Molecular Subtypes. Breast Care (Basel). 2011;6 (4):258-264
- E. Senkus, S. Kyriakides, F. Penault-Llorca et all., on behalf of the ESMO Guidelines Working Group* Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†Annals of Oncology 0: 1-17, 2013
- Клинические рекомендации по профилактике, диагностике и лечению больных раком молочной железы/Ассоциация онкологов России; Коллектив авторов, ИГ РОНЦ 2014 г., стр. 1-46; www.oncology.ru
- XVI Российский онкологический конгресс (обзор материалов). Журнал «Опухоли женской репродуктивной системы» 3-4 2012, стр. 6-7
- Pracella D, Bonin S, Barbazza R et all. Are breast cancer molecular classes predictive of survival in patients with long follow-up? Dis Markers. 2013;35 (6):595-605
- Prat A, Cheang MC, Mart n M et all. Prognostic significance of progesterone receptor-positive tumor cells within immunohistochemically definedluminal A breast cancer. J Clin Oncol. 2013 Jan 10;31 (2):203-9
- Kim HS, Park I, Cho HJ and all. Analysis of the potent prognostic factors in luminal-type breast cancer. J Breast Cancer. 2012 Dec;15 (4): 401-6
- Parise CA, Bauer KR, Brown MM et all. Breast cancer subtypes as defined by the estrogen receptor (ER), progesterone receptor (PR), and the human epidermal growth factor receptor 2 (HER2) among women with invasive breast cancer in California, 1999-2004. Breast J. 2009 Nov-Dec;15 (6):593-602
- Cheang MC, Chia SK, Voduc D et all. Ki67 index, HER2 status, and prognosis of patients with luminal B breast cancer. J Natl Cancer Inst. 2009 May 20;101 (10):736-50
- Wang Y, Yin Q, Yu Q et all.. A retrospective study of breast cancer subtypes: the risk of relapse and the relations with treatments. Breast Cancer Res Treat. 2011 Nov;130 (2):489-98
- Zhang HM, Zhang BN, Xuan LX, Zhao P. Clinical characteristics and survival in the operable breast cancer patients with different molecular subtypes. Zhonghua Zhong Liu Za Zhi. 2009 Jun; 31 (6):447-51
- Najafi B, Anvari S, Roshan ZA. Disease free survival among molecular subtypes of early stage breast cancer between 2001 and 2010 in Iran. Asian Pac J Cancer Prev. 2013;14 (10):5811-6
- Nofech-Mozes S, Trudeau M, Kahn HK et all. Patterns of recurrence in the basal and non-basal subtypes of triple-negative breast cancers. Breast Cancer Res Treat. 2009;118:131-137
- Elsamany S, Abdullah S. Triple-negative breast cancer: future prospects in diagnosis and management. Med Oncol. 2014 Feb;31 (2):834
- Bauer KR, Brown M, Cress RD et all. Descriptive analysis of estrogen receptor (ER) -negative, progesterone receptor (PR) -negative, and HER2-negative invasive breast Cancer, the so-called triple-negative phenotype: a population-based study from the California Cancer Registry. Cancer. 2007;109:1721-1728
- Lips EH, Mulder L, Oonk et all.Triple-negative breast cancer: BRCAness and concordance of clinical features with BRCA1-mutation carriers. Br J Cancer. 2013 May 28;108 (10):2172-7
- Dent R, Trudeau M, Pritchard KI et all. Triple-negative breast cancer: clinical features and patterns of recurrence. Clin Cancer Res. 2007;13:4429-4434
- Foulkes WD, Brunet J-B, Stefansson IM et all. The prognostic implication of the basal-like (cyclin E high/p27low/p53+/glomeruloid-microvascular-proliferation+) phenotype of BRCA1-related breast cancer. Cancer Res. 2004;64:830-835
- Slamon DJ, Clark GM, Wong SG et all. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science. 1987 Jan 9;235 (4785):177-82
- Zurawska U, Baribeau DA, Giilck S et all. Outcomes of HER2-positive early-stage breast cancer in the trastuzumab era: a population-based study of Canadian patients. Curr Oncol. 2013 Dec;20 (6): e539-45
- Slamon D, Eiermann W, Robert N, et all. Adjuvant trastuzumab in HER2-positive breast cancer. N Engl J Med 2011; 365:12731283
- Perez EA, Romond EH, Suman VJ and all. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: joint analysis of data from NCCTG N9831 and NSABP B-31. J Clin Oncol. 2011 Sep 1;29 (25):3366-73
- Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et all. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353:1659-72
- Romond EH, Perez EA, Bryant J, et all. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005;353:1673-84
- Nagtegaal ID, Allgood PC., Duffy SW et all. Prognosis and Pathology of Screen-Detected Carcinomas How Different Are They? J Cancer. 2011 Apr; 1360-8
- Coldman A, Phillips N, Wilson C et all. Pan-canadian study of mammography screening and mortality from breast cancer. J Natl Cancer Inst. 2014 Oct 1;106 (11)
- Garc a Fernndez A, Chabrera C, Garc a Font M et all. Mortality and recurrence patterns of breast cancer patients diagnosed under a screening programme versus comparable non-screened breast cancer patients from the same population: analytical survey from 2002 to 2012. Tumour Biol. 2013 Oct 9. http://www.ncbi.nlm.nih.gov/pubmed/24114015
- Domingo L, Salas D, Zubizarreta R et all. on behalf of the INCA Study Group. Tumor phenotype and breast density in distinct categories of interval cancer: results of population-based mammography screening in Spain. Breast Cancer Res. 2014 Jan 10;16 (1): R3
- Bucchi L, Puliti D, Ravaioli A et all. Breast screening: axillary lymph node status of interval cancers by interval year. Breast. 2008 Oct;17 (5):477-83
- Theriault RL, Litton JK, Mittendorf EA et all. Age and survival estimates in patients who have node-negative T1ab breast cancer by breast cancer subtype. Clin Breast Cancer. 2011 Oct;11 (5):325-40
- Curigliano G, Viale G, Bagnardi V et all. Сlinical relevance of HER2 overexpression/amplification in patients with small tumor size and node-negativebreast cancer. J Clin Oncol. 2009 Dec 1;27 (34):5693-9
- Livi L, Meattini I, Saieva C et all. Prognostic value of positive human epidermal growth factor receptor 2 status and negative hormone status in patients with T1a/T1b, lymph node-negative breast cancer. Cancer. 2012 Jul 1;118 (13):3236-43
- Gonzalez-Angulo AM, Litton JK, Broglio KR et all. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2-positive, node-negative tumors 1 cm or smaller. J Clin Oncol. 2009 Dec 1;27 (34):5700-6
- Schroeder MC, Lynch CF, Abu-Hejleh T et all. Chemotherapy Use and Surgical Treatment by Receptor Subtype in Node-Negative T1a and T1b Female BreastCancers, Iowa SEER Registry, 2010-to 2012. Clin Breast Cancer. 2014 Aug 18. pii: S1526-8209 (14) 00164-5
- С. Garbino. St.Gallen international breast cancer conference 2013. Panel voting results, p.1-30
- NCCN breast cancer guidelines professionals http://www.nccn.org/professionals/physician_gls/f_ guidelines.asp#breast
- O'Sullivan CC, Bradbury I, de Azambuja E et all. Efficacy of adjuvant Trastuzumab compared with no Trastuzumab for patients with HER2-positive breast cancer and tumors 2cm: a meta-analysis of the randomized Trastuzumab trials, ASCO meeting presentation, Chicago 2014


