Гибридная костно-хрящевая трансплантация - инновационная методика оперативного лечения рассекающего остеохондрита коленного сустава
Автор: Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Сиротин И.В., Гордиенко Д.И., Храменкова И.В., Шпак М.А.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 1 (39), 2020 года.
Бесплатный доступ
Статья посвящена актуальному направлению современной ортопедии - хирургическому лечения рассекающего остеохондрита коленногосустава. Это заболевание составляет до 2 % от всех заболеваний коленного сустава и встречается приблизительно у 30 пациентов на 100 тыс.человек. Материалы и методы: Авторами статьи разработана методика «Гибридной костно-хрящевой трансплантации», основанная на замещениипатологически измененной субхондральной кости здоровой, спонгиозной ауто костью и имплантации коллагеновой мембраны. Такая методикаоперации применена у 31 больного. В статье приведены показания, противопоказания, техника операции, критерии оценки результатов лечения.Серия описанных клинических наблюдений подтверждает высокую эффективность этой методики операции. Результаты: исходы лечения в сроки до 2-х лет изучены у всех 31 больных. Хорошие результаты лечения отмечены у 26-х больных. Во всех случаяхдостигнута хорошая регенерация костно-хрящевого дефекта. Заключение: Анализ исходов лечения больных после «гибридной костно-хрящевой трансплантации» позволяет авторам статьи рекомендовать этуметодику к широкому применению в клинической практике.
Локальные дефекты хряща, коленный сустав, рассекающий остеохондрит, болезнь кёнига, костно-хрящевой дефект, коллагеноваямембрана, мозаичная пластика
Короткий адрес: https://sciup.org/142226465
IDR: 142226465 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2020.1.59-66
Текст научной статьи Гибридная костно-хрящевая трансплантация - инновационная методика оперативного лечения рассекающего остеохондрита коленного сустава
Введение. Хирургическое лечение рассекающего остеохондрита (РО) коленного сустава (КС) является актуальной проблемой современной ортопедии. Это заболевание, нередко именуемое в литературе как болезнь König, представляет собой локальную форму некроза участка субхондральной кости с распространением на хрящевую ткань [1]. По мере прогрессирования процесса может наступать отделение некротизированного субхондрального фрагмента с образованием свободного хондромного тела КС. В результате этого происходит образование костно-хрящевого дефекта (КХД) различной площади и глубины поражения.
Впервые это заболевание описал в 1887 году F. Konig, предложив термин «расслаивающий остеохондрит». Автор изучил
более десяти клинических наблюдений, важных для понимания патогенеза данного заболевания и классифицировал его как остеохондропатии [1,2].
К этиологическим факторам развития РО отнят: травму, отёк костного мозга с последующей ишемией субхондральной кости; нарушения процессов оссификации; конституциональные и генетические факторы; болезнь перегрузки и др. [3,4,5, 6,7,8,9].
Рассекающий остеохондрит составляет до 2 % от всех заболеваний КС и наиболее часто встречается в возрастных группах 11-13 и 20-40 лет [10,11]. По некоторым данным РО встречается приблизительно у 9,5-29 пациентов на 100 тыс. населения [12,13,14,15].
В 80-85 % случаев РО поражает медиальный мыщелок бедренной кости, в 10-20 % - латеральный мыщелок бедренной кости, до 4 % - суставную поверхность надколенника и в 0,5-0,7 % - область межмыщелковой борозды бедренной кости [12]. В 14-24 % клинических наблюдений РО поражает оба коленных сустава [16,17,18].
Несмотря на разнообразие методик хирургического лечения РО, до сих пор отсутствуют рекомендации в отношении выбора актуального способа хирургической коррекции этой патологии, особенно у пациентов с дефицитом костной ткани в зоне поражения; нет понимания эффективности использования клеточных и биотехнологий для одномоментного восстановления костной и хрящевой тканей; много путаницы в вопросах реабилитации больных, особенно в отношении сроков начала нагрузки на оперированную конечность. Эти и многие другие факторы определяют высокую актуальность данной проблемы.
Цель исследования: разработать современную, высоко эффективную методику хирургического лечения рассекающего остеохондрита коленного сустава, направленную на полное восстановление костной и хрящевой тканей в зоне поражения, а также функции коленного сустава в целом.
Анализ клинического материала. До 2017 года для хирургического лечения больных с РО нами применялись наиболее доступные для широкой клинической практики методики: технология индуцированного матрицей аутохондрогенеза (AMIC) и костно-хрящевая трансплантация (КХТ) в различных комбинациях (ауто, алло, комбинированная), часто обозначаемая в литературе как «мозаичная пластика».
Технология AMIC (autologous matrix-indused chondrogenesis) основана на формировании микропереломов в субхондральной кости, обеспечивающих транспорт костного мозга на поверхность дефекта и регенеративном потенциале его стромальных клеток. Образующийся в результате этого сгусток костного мозга стабилизируется коллагеновой мембраной, имплантируемой на субхондральную кость [3,19,20,21].
Однако, анализ исходов таких операций выявил ряд специфических недостатков и осложнений у каждой. их этих методик. Так, основным недостатком КХТ следует считать дефицит пластического материала при больших по площади поражения дефектах. К наиболее частым осложнениям этой методики мы отнесли лизис костно-хрящевых алло трансплантатов.
Продолжаются дискуссии в отношении необходимости и целесообразности выполнения костной пластики у больных с РО и о том, какой пластический материал может применяться для этого. Анализ исходов применения технологии AMIC без костной пластики показал высокие риски прогрессирующего разрушения субхондральной кости в зоне имплантации коллагеновой мембраны. Доказано разрушение мембраны при ее имплантации на биокомпозитную кость. Выявлены случаи лизиса нестабильной аутологичной костной ткани.
Тщательный анализ клинического материала позволил нам сделать очень важный вывод: коллагеновая мембрана может быть имплантирована только на аутологичную, здоровую, кровоснабжаемую и стабильную костную основу! Только в этом случае реализуется весь биологический потенциал коллагеновых мембран и обеспечиваются качественные процессы неохондрогенеза.
Изучив исходы выполненных нами операций и оценив все риски применения каждой их этих технологий, мы пришли к пониманию необходимости разработки современной методики реконструкции КХД у больных с РО, исключающей большинство из описанных выше проблем и позволяющей одномоментно восстановить костную и хрящевую ткани.
В 2017 году в клинике была разработана методика «Гибридной костно-хрящевой трансплантации» (Патент № 2692228). Она основана на удалении патологически-измененной субхондральной кости, имплантации в эту зону цилиндрических спон-гиозных ауто трансплантатов (взятых из боковых отделов мыщелков бедренной или большеберцовой костей) и имплантации коллагеновой мембраны [22,23,24].
Показания к операции: костно-хрящевые дефекты мыщелков бедренной кости, межмыщелковой борозды и надколенника с дефицитом костной ткани и без; площадь поражения 5-8 см².
Противопоказания к операции: наличие множественных поражений хрящевой ткани; артроз 3-4 стадии и нестабильность коленного сустава; активная стадия асептического некроза; системные аутоиммунные заболевания; изменения механической оси конечности; аллергия на коллаген.
Факторы успеха: здоровый, окружающий КХД гиалиновый хрящ; не измененная механическая ось нижней конечности.
Основным преимуществом гибридной костно-хрящевой трансплантации считаем возможность одномоментного восстановления костной и хрящевой тканей, при больших по площади поражения КХД.
За период 2017-2020 гг. в Университетской клинике травматологии и ортопедии на базе ГКБ № 1 г.Москва, гибридная костно-хрящевая трансплантация выполнена 31 больному с рассекающим остеохондритом КС. Все пациенты находились в наиболее активном и трудоспособном возрасте от 18-45 лет, что, несомненно, носит социальную направленность. Давность заболевания оценивалась со слов больных во время сбора анамнеза, а именно с момента появления первых жалоб до постановки диагноза. Наиболее часто встречались КХД размером 4-6 см². В 24 случаях были поражены медиальные мыщелки, а в 4 случаях – латеральные мыщелки бедренной кости, у 3-х пациентов КХД локализовался на суставной поверхности надколенника.
-
19 больным была имплантирована коллагеновая мембрана Chondro-Gide, синтезированная из свиного коллагена 1 и 3-го
типа. 12 больным имплантирована коллагеновая мембрана Novocart, синтезированная из бычьего коллагена 1 и 3-го типа. Обе мембраны имеют двухслойную структуру, обладают высокой эластичностью и растяжимостью, что минимизирует риски их повреждение при моделировании и имплантации. Пористая часть мембран впитывает в себя клетки костного мозга, а плотная часть мембран препятствует их проникновению в полость коленного сустава, стабилизируя таким образом сгусток костного мозга в зоне имплантации мембраны.
Хотим отметить, что гибридную костно-хрящевую трансплантацию можно выполнить любым набором инструментов, предназначенным для костно-хрящевой трансплантации. Важно соблюдать последовательность всех этапов операции, которые будут описаны в представленном ниже клиническом наблюдении.
Для выполнения основных этапов операции требуется всего лишь два основных инструмента (Рис.1) . Эти инструменты позволяли легко произвести забор цилиндрических костных трансплантатов, гарантированно исключив их разрушение при заборе и последующем выделении. Цилиндрическая полая фреза имеет на своем конце алмазное покрытие, что позволяет без трудностей произвести выпиливание цилиндрического костного столбика. (Рис.1а) . Для предотвращения ожога костной ткани и максимального сохранения её структуры, необходимо в процессе выпиливания костного столбика охлаждать фрезу, орошая её физиологическим раствором. Основной конструктивной особенностью экстрактора для забора костных столбиков является наличие на его внутренней поверхности 3-х выступов-зубцов, гарантирующих отсутствие «эффекта проскальзывания» инструмента и разрушение костного столбика при его выделении (Рис.1б) . Шкалы делений на обоих инструментах облегчают контроль за глубиной их погружения в кость.

Рис.1. Основные инструменты для выполнения «гибридной костно-хрящевой трансплантации»: а-алмазная фреза; б-экстрактор
Важно, еще на этапах предоперационного планирования, основанного на анализе данных МРТ и МСКТ, оценить площадь и глубину КХД. От этого в целом будет зависеть качество замещения патологически измененной субхондральной кости здоровой, аутологичной костной тканью. При больших по площади поражения КХД целесообразно выполнение открытой гибридной костно-хрящевой трансплантации. Выполнение операции артроскопическим (АС) способом может быть сопряжено с большими техническими трудностями, существенным увеличе- нием времени оперативного вмешательства, низким качеством реконструкции КХД.
Представляем серию клинических наблюдений, наглядно показывающих возможности гибридной костно-хрящевой трансплантации.
Клиническое наблюдение №1: Пациентка К., 22 лет, с длительным анамнезом заболевания (рассекающий остеохондрит) до обращения в нашу клинику была дважды оперирована по поводу болезни Кенига медиального мыщелка левой бедренной кости: в ноябре 2018 года больной выполнено АС удаление свободного хондромного тела, а в апреле 2019 года – туннелизация субхондральной кости и АС имплантация коллагеновой мембраны. В нашу клинику больная обратилась в ноябре 2019 года с жалобами на боли в левом коленном суставе, невозможность полноценной нагрузки на оперированную конечность. Больная отмечала, что на протяжении всего времени после перенесенных операций сохранялись болевые ощущения различной степени интенсивности. При МСКТ (Рис.2 а,б) и МРТ (Рис.2 в,г) исследованиях отмечена прогрессирующая деструкция субхондральной кости с большой площадью поражения медиального мыщелка бедра.
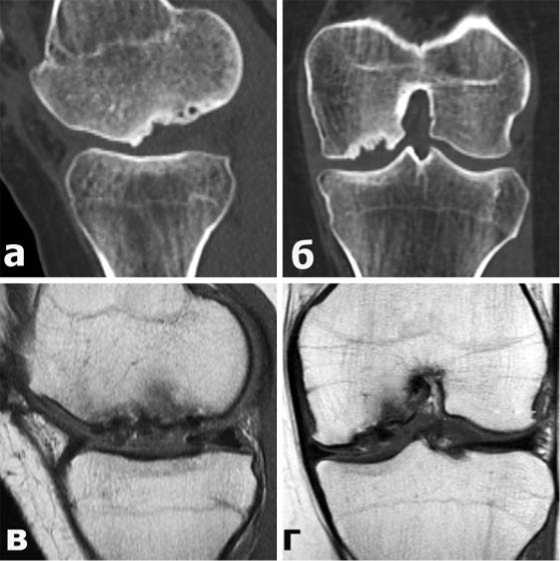
Рис.2 МСКТ (а,б) и МРТ (в,г) картина рассекающего остеохондрита медиального мыщелка бедренной кости у больной К.
В плановом порядке 14.01.2020 г. под эпидуральной анестезией больной выполнена артротомия КС. На контактной поверхности медиального мыщелка бедренной кости, на месте имплантации коллагеновой мембраны обнаружена жизнеспособная, стабильная, несколько гипертрофированная хрящевая ткань, полностью укрывающая субхондральную кость (Рис.3а). Макроскопический результат трансформации мембраны в хрящевую ткань расценен как хороший, что ещё раз подтверждает высокую эффективность технологии AMIC и биологический потенциал коллагеновых мембран для восстановления полнослойных дефектов хряща. После удаления вновь образованной хрящевой ткани образовался полнослойный дефект хряща овальной формы размером 3х2 см. Дно дефекта было представлено кистозно-измененной субхондральной костью. (Рис.3 б,в).
Из эпицентра КХД удалена патологически измененная субхондральная кость на глубину 1 см, в результате чего образовалось 5 цилиндрических дефектов диаметром 13 и 10 мм. Высверливание и удаление патологически измененной субхондральной кости производилось таким образом, чтобы между образовавшимися цилиндрическими дефектами сохранялась костная стенка толщиной 1-2 мм. (Рис.3 г).
Из боковых отделов обоих мыщелков бедренной кости и медиального мыщелка большеберцовой кости произведен забор спон-гиозных цилиндрических ауто трансплантатов диаметром 14 и 11 мм. После моделирования последние были имплантированы в цилиндрические дефекты кости в эпицентре КХД и фиксированы методом заклинивания (за счет разницы диаметров в 1 мм между костными трансплантатами и цилиндрическими дефектами кости). Достигнуто полное замещение патологической субхондральной кости с прочной фиксацией костных трансплантатов. Для обеспечения транспорта костного мозга на поверхность дефекта, спицей диаметром 2,4 мм имплантированные костные трансплантаты и подлежащая субхондральная кость рассверлены на общую глубину 20 мм. (Рис.3д).
После моделирования по форме и размеру дефекта, коллагеновая мембрана уложена на сформированное костное ложе и фиксирована фибриновым клеем. Достигнуто полное замещение дефекта хряща коллагеновой мембраной (Рис.3е).
Места забора спонгиозных цилиндрических ауто трансплантатов (донорские отверстия) заполнены биокерамическими цилиндрическими столбиками, обладающими остеокондуктивны-ми свойствами. (Рис.3 ж,з,и)
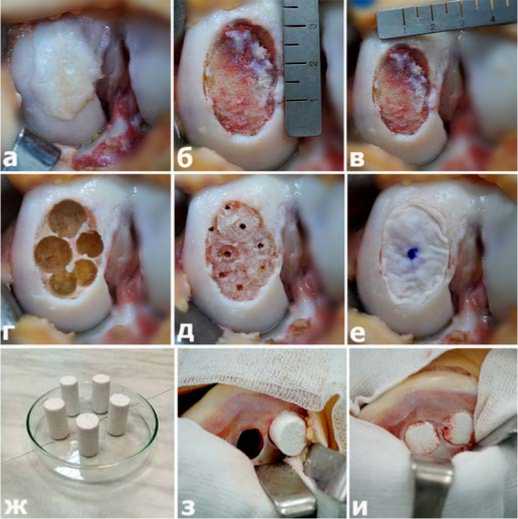
Рис.3. Основные этапы операции – гибридной костно-хрящевой трансплантации у больной К. (разъяснения в тексте).
В послеоперационном периоде в течение 7 дней осуществлялась иммобилизация коленного сустава в положении полного разгибания голени. Пассивные и активные движения в суставе разрешены со 2-й недели после операции. Восстановление объема движений в коленном суставе достигнуто к концу 5-й недели. Дозированная нагрузка на оперированную конечность разрешена через 4 недели, а полная нагрузки – через 6 недель со дня операции.
При контрольном МРТ исследовании через 3 месяца после операции отмечена хорошая консолидация костных трансплантатов и образование хрящевой ткани в зоне имплантации коллагеновой мембраны (отмечены белыми стрелками). (Рис.4 а,б) Ближайшие результаты операции по совокупности признаков расценены как хорошие.
Гистологические исследование удаленной хрящевой ткани показало, что на месте имплантации коллагеновой мембраны образовался волокнистый хрящ с наличием пролиферирующих сосудов и скудной лимфоцитарной инфильтрацией. (Рис.4 в,г). Это исследование еще раз доказывает, что для полноценной и качественной трансформации коллагеновых мембран необходима жизнеспособная и кровоснабжаемая аутологичная костная основа.
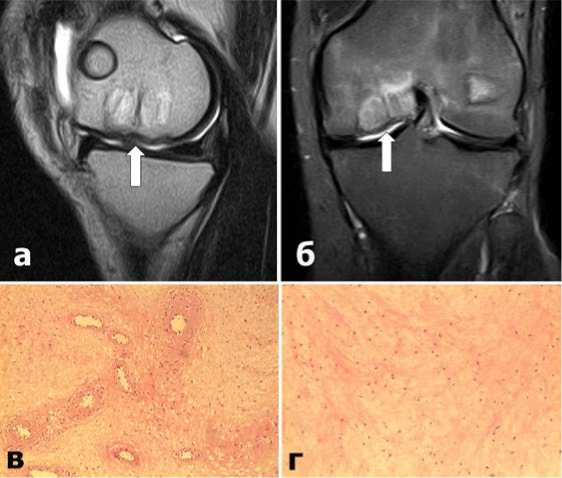
Рис.4. МРТ (а,б) и гистологическая (в,г) картина характера регенерации КХД через 3 месяца после операции.
Клиническое наблюдение №2. Пациент К., 43 лет, обратился в клинику с жалобами на боли в правом КС, ограничения движения в нем, рецидивирующие синовиты. Из анамнеза известно, что больному дважды была выполнена санационная АС, без эффекта от лечения. При МСКТ исследовании (Рис.5 а,б,в) был диагностирован обширный костно-хрящевой дефект медиального мыщелка бедра в виде аневризмальной кисты. От предложенного одномыщелкового эндопротезирования пациент категорически отказался. В плановом порядке под эпидуральной анестезией выполнена артротомия КС, во время которой обнаружен обширный дефект хряща, поражающий практически весь медиальный мыщелок бедренной кости (Рис.5 г). С соблюдением всех этапов описанной выше технологии произведена гибридная костно-хрящевая трансплантация. В связи с обширной зоной поражения мыщелка, забор костного материала производился из обоих коленных суставов. Достигнуто полное замещение патологически измененной субхондральной кости и восстановление конгруэнтности суставной поверхности мыщелка бедра (Рис.5 д). Окончательные размеры дефекта составили 4х2 см (Рис.5 е,ж). Имплантированные костные столбики-трансплантаты и подлежащая субхондральная кость рассверлены на общую глубину 3,5 см (Рис.5 з). На вновь воссозданную костную основу имплантирована коллагеновая мембрана и фиксирована фибриновым клеем. В результате операции достигнуто полное восстановлением костной и хрящевой тканей, а также конгруэнтности мыщелка бедра (Рис.5 и). Все донорские отверстия заполнены биокерамическими цилиндрическими столбиками.
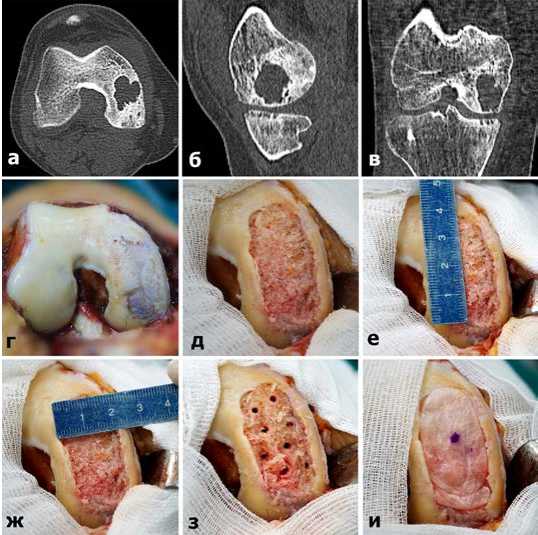
Рис.5. МСКТ (а,б,в) картина обширного КХД у больного К. г,д,е,ж,з,и – основные этапы операции (разъяснения в тексте).
При контрольном МРТ исследовании через 4 месяца отмечены признаки консолидации имплантированных костных трансплантатов без их лизиса (красные стрелки) и образование хрящевой ткани на месте имплантации коллагеновой мембраны (желтые стрелки) (Рис. 6 а,б,в). По совокупности признаков ближайший результат операции расценен как хороший.
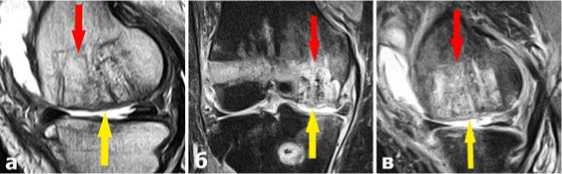
Рис.6. МРТ картина характера консолидации костных ауто трансплантатов (красные стрелки) и качества регенерации хрящевой ткани (желтые стрелки) через 4 месяца после операции.
Это клиническое наблюдение убедительно доказывает возможности гибридной костно-хрящевой трансплантации при реконструкции обширных по площади поражения костно-хрящевых дефектах.
Клиническое наблюдение № 3. Пациент Ф., 44 лет. На основании данных МРТ диагностирован рассекающий остеохондрит надколенника с отделением хрящевого фрагмента (Рис.7 а,б,в). Во время операции на медиальной фасетке надколенника обнаружен кратерообразный костно-хрящевой дефект овальной формы, размером 1,5х1 см и свободное хондромное тело (Рис.7 г). Последнее удалено. Дефицит костной ткани в зоне поражения надколенника восполнен двумя цилиндрическими спонгиозными аутотрансплантатами (Рис.7 д). Коллагеновая мембрана смоделирована по форме и размеру дефекта и подшита к окружающему здоровому гиалиновому хрящу рассасывающимися нитями (толщина 6,0) (Рис.7 е). Достигнуто полное восстановление костной и хрящевой тканей.
Ближайший исход лечения оценен по данным МРТ через 4 месяца после операции. Отмечена качественная консолидация костных аутотрансплантатов и образование хрящевой ткани в зоне имплантации коллагеновой мембраны (Рис.7 ж,з,и). Ближайший результат лечения расценен как хороший.
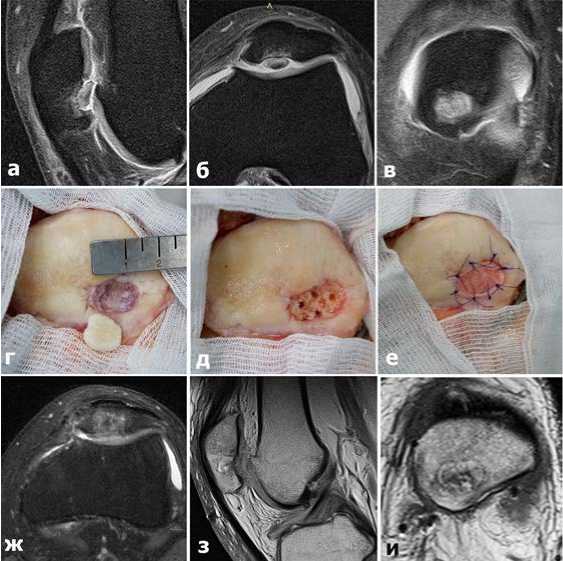
Рис.7. МРТ (а,б,в) картина рассекающего остеохондрита надколенника у больного Ф., г,д,е – основные этапы операции (разъяснения в тексте), ж,з,и – МРТ картина качества регенерации КХД через 4 месяца после операции.
Анализ результатов лечения в сроки до 2-х лет произведен у всех 31 пациентов, перенесших гибридную костно-хрящевую трансплантацию. Ближайший срок оценки ранних результатов лечения считали 3 месяца со дня операции. Как правило, у большинства пациентов к этому сроку происходило восстановление функции оперированного КС. Ближайший срок оценки отдаленных исходов лечения считали 12 месяцев со дня операции. Как правило, к этому сроку наступала полная или частичная регенерация зоны пластики КХД.
Клинико-функциональные результаты лечения были разделены нами на 3 группы (хорошие, удовлетворительные, плохие) и оценивались по следующим критериям: восстановление амплитуды движений в КС; разница в силе и тонусе ЧГМБ между оперированной и здоровой конечностью; степень гипотрофии ЧГМБ; восстановление трудоспособности за максимально короткий срок; уровень физической активности по ICRS; интенсивность боли по визуально-аналоговой шкале (ВАШ); восстановление функции коленного сустава по шкале WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index).
Для инструментальной оценки характера регенерации хрящевой ткани использовали МРТ, а для оценки ремоделирования костной ткани – МСКТ, с последующей оценкой минеральной плотности костных тканей.
Анализ клинического материала показал, что у 26 пациентов по совокупности описанных выше признаков отмечены хорошие результаты лечения, у 4-х больных реабилитационный период осложнился тугоподвижностью КС, что потребовало интенсивного лечения с последующим восстановлением амплитуды движений в КС. У одного пациента послеоперационный период осложнился рецидивирующими синовитами. Важно отметить, что во всех случаях отмечена качественная консолидация имплантированных спонгиозных ауто транслантатов и регенерация хрящевой поверхности зона пластики КХД.
Обсуждение. Анализируя технологию «Гибридной костнохрящевой трансплантации» хотим отметить, что с ее помощью возможно восстановление обширных по площади поражения (≤ 7-8 см²) КХД мыщелков бедренной и большеберцовой костей, межмыщелковой борозды, надколенника, таранной кости. Это именно те локализации, при поражениях которых мы с успехом применили данную методику.
Разработанный отечественными учеными биокомпозитный материал на основе кальций фосфатной биокерамики, обладающей остеокондуктивными свойствами, позволил нам существенно упростить технику и время выполнения операции, не опасаться проблемы дефицита костных аутотрансплантатов. В настоящее время мы разрабатываем артроскопическую технику этой операции и надеемся представить её в ближайшем будущем. Анализ исходов лечения больных после «гибридной костно-хрящевой трансплантации» позволяет нам рекомендовать эту методику к широкому применению в клинической практике.
Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Сиротин И.В., Гордиенко Д.И., Храменкова И.В., Шпак М.А. Гибридная костно-хрящевая трансплантация – инновационная методика оперативного лечения рассекающего остеохондрита коленного сустава // Кафедра травматологии и ортопедии. 2020. № 1. С. 59 — 66. [Lazishvili G.D., Egiazaryan K.A., Ratyev A.P., Sirotin I.V., Gordienko D.I., Chramenkova I.V., Shpak M.A. Hybrid bone and cartilage transplantation - an innovative technique for surgical treatment of osteochondritis dissecans of the knee joint. Department of Traumatology and Orthopedics. 2020, No. 1, pp. 59 — 66 (in Russian)]
Список литературы Гибридная костно-хрящевая трансплантация - инновационная методика оперативного лечения рассекающего остеохондрита коленного сустава
- König F. Ueber freie Körper in den Gelenken. Dtsch Z Chir. 1888,27:90-109.
- Авакян А.П. Рассекающий остеохондрит мыщелков бедренной кости у детей и подростков (диагностика и лечение). Дисс. канд. мед. наук. Москва, 2015. 140 с.
- Гаркави А.В., Блоков М.Ю. Артроскопическая хондропластика локальных хрящевых дефектов коленного сустава с использованием коллагеновой мембраны CHONDRO - GIDE // Кафедра травматологии и ортопедии. 2015. №3 (15). С.4 - 7.
- Герасименко М.А. Внутрисуставные хондральные и остеохондральные повреждения коленного сустава у пациентов молодого возраста // Новости хирургии. 2010. Том 18. №2. C.137 - 141.
- Котельников Г.П., Ларцев Ю.В., Кудашев Д.С., Зуев - Ратников С.Д., Шорин И.С. Мозаичная хондропластика в лечении больных с деструктивно-дистрофическими и посттравматическими поражениями гиалинового хряща в коленном суставе - экспериментальные и клинические аспекты // Фундаментальные исследования. Медицинские науки. 2013. №9. С.252 - 255.
- Howard J.S., Mattacola C.G., Romine S.E., Lattermann C. Continuous passive motion, early weight bearing, and active motion following knee articular cartilage repair: evidence for clinical practice. cartilage, 2010, Vol.1, pp. 276-286.
- Juneau C., Paine R., Chicas E., Gardner E., Bailey L., McDermott J. Current concepts in treatment of patellofemoral osteochondritis dissecans. Int J Sports Phys I her, 2016, Vol.11, pp. 903-925.
- Kim S.H., Ha C.W, Park Y.B. Intra-articular injection of mesenchymal stem cells for clinical outcomes and cartilage repair in osteoarthritis of the knee: a meta-analysis of randomized controlled trials. Archives of Orthopadic and Trauma Surgery, 2019, Vol.139, pp. 971 - 980.
- Kon E., Filardo G., Brittberg M., Busacca M. et al. Multilayer biomaterial for osteochondral regeneration shows superiority vs microfractures for the treatment of osteochondral lesions in a multicentre randomized trial at 2 years. Knee Surgery Sports Traumatology Arthroscopy, 2018, Vol. 26, pp. 2704 - 2715.
- Bertone A., Orban J., Grande D. Articular cartilage and subchondral bone repair using a biodegradable polymer matrix and instrumentation system. Tranactions of the Orthopaedic Reseach Society, 2005, Poster 1803, Washington.
- Hunziker E.B. Biologic repair of articular cartilage. Defect models in experimental animals and matrix requirements. Clin. Orthop, 1999, Vol.367 (suppl. 1), pp. 135-146.
- Маланин Д.А., Писарев В.Б., Новочадов В.В. Восстановление повреждений хряща в коленном суставе. Экспериментальные и клинические аспекты. М.: Волгоградское научное издательство, 2010. 455 с.
- Chambers H.G., Shea K.G., Carey J.L. AAOS Clinical practice guideline: diagnosis and treatment of osteochondritis dissecans. J Am Acad Orthop Surg, 2011, vol.19, pp. 307-314.
- Kocher M.S., Tucker R., Ganley T.J., Flynn J.M. Management of osteochondritis dissecans of the knee: current concepts review. Am J Sports Med, 2006, vol.34, pp. 1181-1191.
- Kessler J., Nikizad H., Shea K.G., Jacobs J.C. Jr. et al. The demographics and epidemiology of osteochondritis dissecans of the knee in children and adolescents. Am J Sports Med, 2014, vol.42, pp. 320-26.
- Маланин Д.А., Новочадов В.В., Тетерин О.Г. и др. Инновационные технологии в восстановлении коленного сустава при его повреждениях и заболеваниях // Вестн. Волгогр. Гос. Мед. Ун-та. 2009. № 2. С.7-13.
- Hoemann C.D., Hurtig M., Rossomach E. et al. Chitosan-glycerol phosphate blood implants improve hyaline cartilage repair in ovine microfracture defects. J. Bone Jt. Surg. (Am.), 2005, № 87, pp. 2671-2686.
- Horwitz E.M., Gordon P.L., Koo W.K. et al. Isolated allogenic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta. Proc Natl Acad Sci USA, 2002, vol.99, pp. 8932- 8937.
- Gao L., Orth P., Cucchiarini M., Madry H. Autologous Matrix-Induced Chondrogenesis: A Systematic Review of the Clinical Evidence. Am J Sports Med, 2019, vol.47, № 1, pp. 222-231
- Benthien J.P., Behrens P. Autologous Matrix-Induced Chondrogenesis (AMIC) combining Microfracturing and a Collagen I/III Matrix for Articular Cartilage Resurfacing. Cartilage, 2010, №1, vol.1, рр. 65-68.
- Girolamo L., Schönhuber H.I., Vigano M. et al. Autologous Matrix-Induced Chondrogenesis (AMIC) and AMIC Enhanced by Autologous Concentrated Bone Marrow Aspirate (BMAC) Allow for Stable Clinical and Functional Improvements at up to 9 Years Follow-Up: Results from a Randomized Controlled Study. Journal of Clinical Medicine, 2019, vol.8, №3, рр.392-405.
- Егиазарян К.А., Лазишвили Г.Д., Гордиенко Д.И., Храменкова Т.В., Шпак М.А. Способ хирургического лечения костно-хрящевых дефектов мыщелков бедренной кости, пат. 2692228 Рос. Федерация. №2692228С1, заявл. 14.02.19, опубл. 21.06.19, Бюл. № 18. 2 с.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Шпак М.А., Маглаперидзе И.Г. Гибридная костно-хрящевая трансплантация - новый способ хирургического лечения рассекающего остеохондрита коленного сустава // Georgian Medical News. 2019. №10 (295). pp.7-13.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., Бут-Гусаим А.Б., Чуловская И.Г., Сиротин И.В., Шпак М.А. Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава. // Хирургическая практика. 2019. №4 (40). С.10-18.


