Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава
Автор: Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Гордиенко Д.И., Буг-гусаим А.Б., Чуловская И.Г., Сиротин И.В., Шпак М.А.
Журнал: Хирургическая практика @spractice
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Статья посвящена актуальному направлению современной ортопедии - хирургическому лечения рассекающего остеохондрита коленного сустава. Это заболевание составляет до 2 % от всех заболеваний коленного сустава и встречается приблизительно у 30 пациентов на 100 тыс. человек. Материалы и методы: Авторами статьи разработана методика «Гибридной костно-хрящевой трансплантации», основанной на удалении патологической субхондральной кости, её замещении спонгиозной ауто костью и имплантации коллагеновой матрицы. Такая методика операции применена у 27 больных. В статье представлены показания и техника операции, критерии оценки исходов лечения.Результаты: исходы лечения в сроки до 2-х лет изучены у всех 27 больных. Хорошие результаты лечения отмечены у 22-х больных. Во всех случаях достигнута качественная консолидация костной ткани и регенерация хрящевой поверхности костно-хрящевых дефектов.Заключение: Анализ исходов лечения больных после «гибридной костно-хрящевой трансплантации» позволяет авторам статьи рекомендовать эту методику к широкому применению в клинической практике.
Локальные дефекты хряща, коленный сустав, рассекающий остеохондрит, болезнь кёнига, костно-хрящевой дефект, коллагеновая матрица, мозаичная пластика
Короткий адрес: https://sciup.org/142224488
IDR: 142224488 | УДК: 617.3 | DOI: 10.17238/issn2223-2427.2019.4.10-17
Текст научной статьи Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава
Введение. Хирургическое лечение локальных костнохрящевых дефектов (КХД) коленного сустава (КС) является актуальной проблемой современной ортопедии. К разновидностям КХД относится и рассекающий остеохондрит (РО), нередко именуемый в литературе как болезнь Кёнига,
Это заболевание составляет до 2 % от всех заболеваний КС и наиболее часто встречается в возрастных группах 1113 и 20-40 лет [1,2,3]. По некоторым данным РО встречается приблизительно у 30 пациентов на 100 тыс. населения [4].
В 80-85 % случаев очаг РО локализуется в области медиального мыщелка бедра, в 10-20 % - в области латерального мыщелка бедра, до 4 % - на суставной поверхности надколенника и в 0,5-0,7 % - в области межмыщелковой борозды бедренной кости [4]. В 14-24 % случаев болезнь Кёнига поражает оба КС [2,5,6].
Этиология поражения хряща при этом заболевании до сих пор остается не до конца понятной. Очевидно, что при рассекающем остеохондрите речь идет о некрозе участка субхондральной кости с распространением на хрящевую ткань. По мере прогрессирования процесса может наступать отделение некротизированного субхондрального фрагмента. К возможным причинам развития РО отнят: травму и отек костного мозга, с последующей ишемией субхондральной кости; нарушения процессов оссификации; конституциональные и генетические факторы; болезнь перегрузки и др. [7,8,9,10,11,12,13].
Несмотря на разнообразие методик хирургического лечения РО, до сих пор отсутствуют четкие рекомендации в отношении выбора способа хирургической коррекции КХД, особенно у пациентов с дефицитом костной ткани в зоне поражения; не определены показания и не изучены результаты использования биотехнологий для восстановления костной и хрящевой тканей; много путаницы в вопросах реабилитации больных, особенно в отношении сроков начала нагрузки на оперированную конечность и др. Эти и многие другие факторы определяют высокую актуальность данной проблемы.
Цель исследования: разработать современную, высоко эффективную методику хирургического лечения обширных костно-хрящевых дефектов мыщелков бедренной кости, направленную на полное восстановление функции коленного сустава.
Материалы и методы: За период с 2005 по 2019 гг. в ГКБ № 1 им. Н.И.Пирогова (клиническая база кафедры травматологии, ортопедии и ВПХ РНИМУ им. Н.И.Пирогова) было оперировано 86 больных с болезнью Кенига мыщелков бедренной кости и межмыщелковой борозды. Всем этим больным применены современные, наиболее доступные для широкой клинической практики методики хирургической коррекции локальных КХД: технология индуцированного матрицей аутохондрогенеза AMIC (autologous matrix-indused chondrogenesis) и костно-хрящевая трансплантация в различных комбинациях (ауто, алло, комбинированная), часто обозначаемая в литературе как «мозаичная пластика». Технология AMIC основана на формировании отверстий в субхондральной кости (обеспечивающих транспорт костного мозга на поверхность КХД) и репаративной способности стромальных клеток костного мозга, поступающего через сформированные отверстия. Образующийся в результате этого суперсгусток костного мозга стабилизируется коллагеновой матрицей, имплантируемой на КХД [14].
Подавляющее большинство – 71 больной (82,6%) находились в наиболее активном и трудоспособном возрасте от 21 года до 50 лет, что, несомненно, носит социальную направленность. Давность заболевания оценивалась со слов больных во время сбора анамнеза, а именно с момента появления первых жалоб до постановки диагноза.
Наиболее часто встречались КХД размером 4-6 см² (15,3%). Костно-хрящевая трансплантация в различных вариантах была применена у 22 больных, а технология AMIC у 64 пациентов.
Анализ отдаленных исходов выявил ряд специфических недостатков и осложнений у каждой их этих методик. Основным недостатком костно-хрящевой трансплантации следует считать дефицит пластического материала при больших по площади КХД, а к осложнениям мы отнесли в первую очередь лизис костно-хрящевых трансплантатов (наиболее часто алло).
Много споров в отношении необходимости и целесообразности выполнения костной пластики у больных с болезнью Кенига и о том, какой пластический материал применять для этого. Анализ исходов применения технологии AMIC без костной пластики показал высокие риски прогрессирующего разрушения субхондральной кости в зоне имплантации коллагеновой матрицы. Доказано разрушение коллагеновой матрицы при ее имплантации на биокомпозитную кость. Выявлены случаи лизиса нестабильной аутологичной костной ткани. Мы осознали, что коллагеновая матрица может быть имплантирована только на здоровую, кровоснабжаемую и стабильную костную основу.
Изучив исходы таких операций и оценив все риски применения каждой их этих технологий, мы пришли к пониманию необходимости разработки современной методики восстановления костно-хрящевых дефектов у больных с болезнью Кенига, исключающей большинство из описанных выше проблем и позволяющей одномоментно восстановить костную и хрящевую ткани.
В 2017 году в клинике была разработана методика «Гибридной костно-хрящевой трансплантации» (Патент № 2692228). Она основана на удалении патологически-из-мененной субхондральной кости, имплантации в эту зону цилиндрических спонгиозных ауто трансплантатов (взятых из боковых отделов мыщелков бедренной или большеберцовой костей) и имплантации коллагеновой матрицы [15].
Операцию считали показанной при полнослойных костно-хрящевых дефектах с поражением (или дефицитом) субхондральной кости (стадия 4 ICRS) площадью 5-7 см². Обязательными условиями для успешного выполнения операции считали: наличие неповрежденного, окружающего дефект гиалинового хряща, жизнеспособной субхондральной кости и нормальной механической оси нижней конечности. При изменениях последней первым этапом операции должна быть коррегирующая остеотомия.
К противопоказаниям к операции отнесли: наличие множественных локальных повреждений хряща, в том числе «целующихся повреждений»; распространенный остеоартроз КС; системные аутоиммунные заболевания; нестабильность КС, обусловленную повреждением связок и менисков; вальгусную или варусную деформацию голени, требующую выполнения коррегирующих операций; аллергию на коллаген.
Методика «Гибридной костно-хрящевой трансплантации» позволила выполнять полноценную пластику обширных по площади поражения (5-8 см²) КХД мыщелков бедренной кости, не опасаясь дефицита пластического материала у 27 больных. Для выполнения основных этапов операции требуются всего лишь два инструмента (Рисунок 1) . Эти инструменты позволяли легко произвести забор цилиндрических костных трансплантатов, гарантированно исключив их разрушение при заборе и последующем выделении. Цилиндрическая полая фреза имеет на своем конце алмазное покрытие, что позволяет без трудностей произвести выпиливание цилиндрического костного столбика. Для предотвращения ожога костной ткани и максимального сохранения её структуры, необходимо в процессе выпиливания костного столбика охлаждать фрезу, орошая её физиологическим раствором. Основной конструктивной особенностью экстрактора для забора костных трансплантатов является наличие на его внутренней поверхности 3-х выступов-зубцов, гарантирующих отсутствие «эффекта проскальзывания» инструмента и разрушение костного столбика при его выделении. Шкалы делений на обоих инструментах облегчают контроль за глубиной их погружения в кость.

Рисунок 1. Основные инструменты для выполнения «гибридной костнохрящевой трансплантации» а-алмазная фреза; б-экстрактор
Представляем клиническое наблюдение с последовательным описанием основных этапов и исходов такой операции.
Клиническое наблюдение: Пациент И., 22 лет, с длительным (более 1,5 лет) анамнезом, обратился в клинику с жалобами на боли в правом коленном суставе, ограничения физических нагрузок, рецидивирующие синовиты. МРТ позволила диагностировать рассекающий остеохондрит медиального мыщелка правой бедренной кости (Рисунок 2)
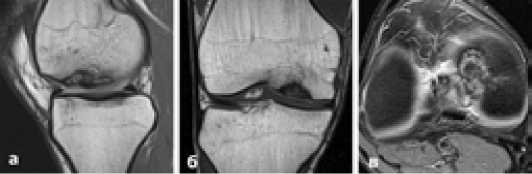
Рисунок 2. МРТ картина болезни Кенига медиального мыщелка правой бедренной кости у больного И.: а-сагитальная, б-аксиальная, в-коронарная проекции.
В плановом порядке под эпидуральной анестезией больному выполнена артротомия коленного сустава. На контактной поверхности медиального мыщелка бедренной кости обнаружена отделившаяся практически полностью от своего ложа крупная хрящевая пластина. Последняя удалена., после чего образовался обширный дефект хряща с неровными краями. Дно дефекта было представлено склерозированной, нежизнеспособной субхондральной костью. После моделирования дефекта специальным шаблоном (максимально приближающимся по форме и размеру к дефекту хряща) размеры дефекта хряща составили 2,5х3 см. (Рисунок 3)
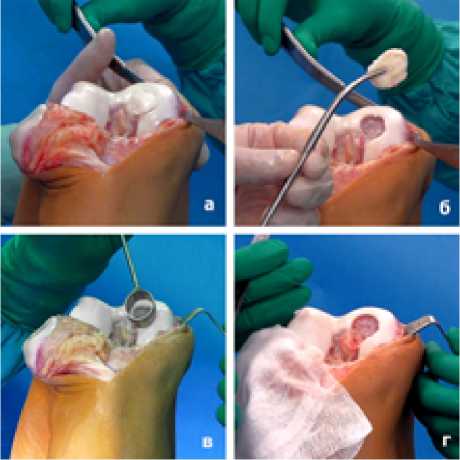
Рисунок 3. Этапы моделирования дефекта хряща: а- болезнь Кёнига медиального мыщелка бедра; б-удаленная хрящевая пластина; в-моделирование дефекта овальным шаблоном; г-дефект хряща после моделирования и санации.
Полой алмазной цилиндрической фрезой диаметром 13 мм, из эпицентра пораженного мыщелка выделено и удалено 3 спонгиозных костных столбика-реципиента длиной 20 мм. Последние были представлены нежизнеспособной склерозированной субхондральной костью. После извлечения склерозированной кости, в мыщелке бедра образовалось 3 цилиндрических дефекта диаметром 13 мм и глубиной 20 мм. Между этими дефектами сохранены костные стенки толщиной 1,5-2 мм (для обеспечения большей стабильности имплантируемых в последующем костных трансплантатов). (Рисунок 4)
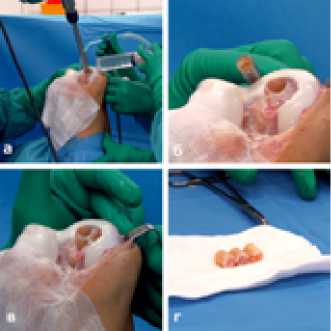
Рисунок 4. а-выпиливание измененной субхондральной кости цилиндрической алмазной фрезой; б-цилиндрический дефект после удаления нежизнеспособной субхондральной кости экстрактором; в- в результате удаления субхондральной кости в эпицентре КХД образовалось 3 дефекта кости цилиндрической формы; г-удаленная субхондральная кость.
Из боковых, неконтактных отделов обоих мыщелков бедренной кости произведен забор аутологичных цилиндрических спонгиозных костных столбиков диаметром 14 мм и длиной 20 мм в количестве 3 штук: два - из латерального мыщелка, один - из медиального мыщелка. (Рисунок 5)
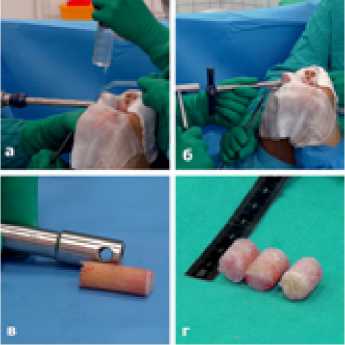
Рисунок 5. Этапы забора спонгиозных костных столбиков-трансплантатов из бокового отдела латерально мыщелка бедренной кости. а-выпиливание трансплантата алмазной фрезой; б-выделение костного трансплантата экстракторорм; в-цилиндрический костный ауто трансплантат; г-подготовленные к имплантации 3 костных ауто транспланатата.
После моделирования, эти столбики-трансплантаты были имплантированы в цилиндрические дефекты в медиальном мыщелке и фиксированы методом плотного заклинивания (за счет разницы в диаметре 1 мм). В результате этого достигнуто практически полное замещение патологически измененной субхондральной кости в зоне дефекта, восстановление конгруэнтности суставной поверхности мыщелка, получена стабильная костная основа для последующей имплантации коллагеновой матрицы. Спицей, диаметром 2,4 мм со сверлом на конце, имплантированные столбики-трансплантаты и подлежащая субхондральная кость рассверлены на общую глубину 30 мм. Эта манипуляция позволили обеспечить транспорт костного мозга и локализацию его сгустка на поверхности имплантированных костных столбиков. (Рисунок 6)
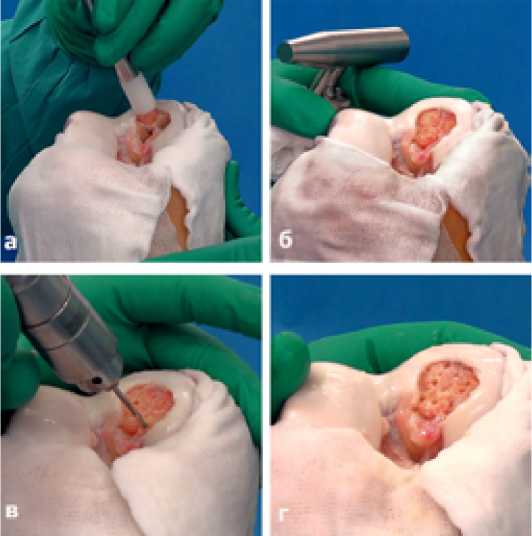
Рисунок 6. а-имплантация костного трансплантата; б- имплантировано 3 костных трансплантата; в-рассверливание трансплантатов и субхондраль-нойкости; г-костные трансплантаты после рассверливания.
С помощью овального шаблона произведено моделирование коллагеновой матрицы точно по форме и размеру КХД. Матрица уложена пористой поверхностью на костную основу дефекта и подшита к окружающему гиалиновому хрящу рассасывающимися нитями толщиной 6,0. Достигнуто полноценное замещение дефекта хряща коллагеновой матрицей. Прочность фиксации матрицы проверена многократным сгибанием-разгибанием голени. (Рисунок 7)
Хотим отметить, что моделирование матрицы можно производить стерильным аллюминиевым шаблоном, а ее фиксация может быть осуществлена также с помощью фибринового клея.
Все 3 донорских отверстия обоих мыщелков бедренной кости заполнены аллогенными спонгиозными циллиндриче-скими трансплантатами и фиксированы методом плотного заклинивания. В качестве донорского материала использовались лиофилизироаванные мыщелки большеберцовых костей. (Рисунок 8).
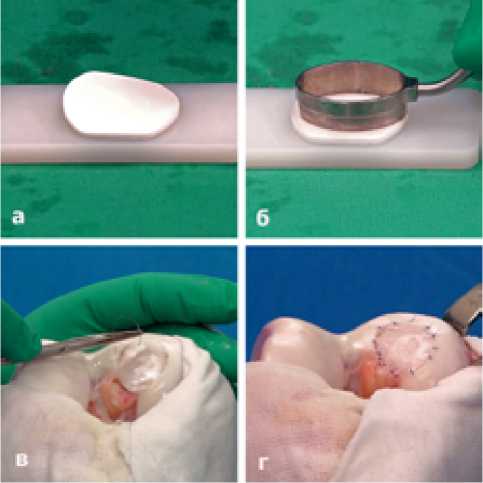
Рисунок 7. а-коллагеновая матрица; б-моделирование матрицы по формы КХД овальным шаблоном; в-подшивание матрицы; г-результат подшивания матрицы.
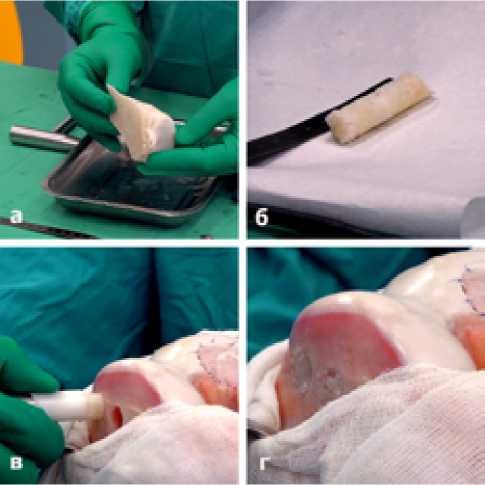
Рисунок 8. а-лиофилизированный мыщелок большеберцовой кости; б-циллиндрический спонгиозный алло трансплантат; в-имплантация алло трансплантата; г-оба донорских отверстия латерального мыщелка бедра заполнены алло трансплантатами.
Ближайшие исход лечения оценен в срок 6 месяцев после операции. МРТ показала качественную консолидацию костных трансплантатов с сохранением конгруэнтности суставной поверхности мыщелка и образование хрящевого регенерата в зоне имплантации матрицы. Также определена хорошая остеоинтеграция костных алло трансплантатов в донорских боковых отверстиях мыщелков бедра. (Рисунок 9)
Отмечено полное восстановление амплитуды движений в КС, тонуса и силы мышц оперированной конечности. Больной жалоб не предъявлял. Ближайшие результаты операции расценены как хорошие.
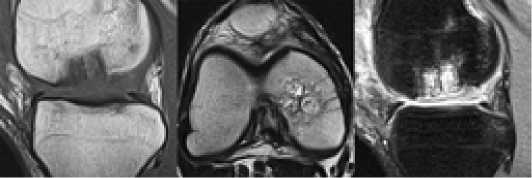
Рисунок 9. МРТ картина через 6 месяцев после операции.
В последнее время для заполнения донорских отверстий мы чаще используем цилиндрические столбики из спрессованной силикокальцийфосфатной био керамики (производство Россия), обладающей остеокондуктивными свойствами. Такой пластический материал мы использовали у 14 больных (Рисунок 10).
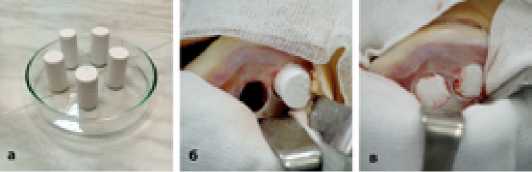
Рисунок 10. а - цилиндрические биокомпозитные столбики; б - имплантация биокомпозитного столбика в донорское отверстие; в - оба донорских отверстия латерального мыщелка бедра заполнены биокомпозитными имплантатами.
Анализ исходов лечения в сроки до 2-лет произведен у всех 27 пациентов, перенесших «гибридную костно-хрящевую трансплантацию». Ближайший срок оценки ранних исходов лечения считали 6 месяцев со дня операции. Как правило, у большинства пациентов к этому сроку происходило восстановление функции оперированного КС. Ближайший срок оценки отдаленных исходов лечения считали 12 месяцев со дня операции. Как правило, к этому сроку наступала полная или частичная регенерация зоны пластики КХД.
Клинико-функциональные результаты лечения были разделены нами на 3 группы (хорошие, удовлетворительные, плохие) и оценивались по следующим критериям: восстановление амплитуды движений в КС; разница в силе и тонусе четырехглавой мышцы бедра (ЧГМБ) между оперированной и здоровой конечностью; степень гипотрофии ЧГМБ; восста- новление трудоспособности за максимально короткий срок; уровень физической активности по ICRS; интенсивность боли по визуально-аналоговой шкале (ВАШ); восстановление функции коленного сустава по шкале WOMAC (Western Ontario and McMaster Universities Osteoarthritis Index) [4].
Для инструментальной оценки характера регенерации хрящевой ткани использовали магнитно-резонансную томографию, а для оценки ремоделирования костной ткани - компьютерную томографию с последующей оценкой минеральной плотности костных тканей.
Анализ исходов лечения показал, что у 22 больных по совокупности описанных выше признаков отмечены хорошие результаты лечения, у 4 больных реабилитационный период осложнился тугоподвижностью КС, что потребовало интенсивного восстановительного лечения с последующим восстановлением амплитуды движений в КС. У одного пациента послеоперационный период осложнился рецидивирующими синовитами. Важно отметить, что во всех случаях отмечена качественная консолидация имплантированных спонгиоз-ных ауто транслантатов и регенерация хрящевой поверхности зона пластики костно-хрящевых дефектов.
Обсуждение. Анализируя технологию «Гибридной костно-хрящевой трансплантации» хотим отметить, что с ее помощью возможно восстановление обширных по площади поражения (≤ 7-8 см²) КХД мыщелков бедренной и большеберцовой костей, межмыщелковой борозды, надколенника, таранной кости. Это именно те локализации, при поражениях которых мы с успехом применили данную методику. Мы также использовали эту технологию и при локальных формах асептического некроза мыщелков бедренной кости. Разработанный отечественными учеными биокомпозитный материал на основе кальций фосфатной биокерамики, обладающей остеокондуктив-ными свойствами, позволил нам существенно упростить технику и время выполнения операции, не опасаться проблемы дефицита пластического материала, рисков разрушения донорских костных алло тканей, существенно снизить бюджет операции. В настоящее время мы разрабатываем артроскопическую технику этой операции и надеемся представить её в ближайшее время. Анализ исходов лечения больных после «гибридной костно-хрящевой трансплантации» позволяет нам рекомендовать эту методику к широкому применению в клинической практике специализированных стационаров.
Список литературы Гибридная костно-хрящевая трансплантация - инновационная технология для хирургического лечения обширных костно-хрящевых дефектов коленного сустава
- Егиазарян К.А., Лазишвили Г.Д., Храменкова И.В., Шпак М.А., Бадриев Д.А. Алгоритм хирургического лечения больных с рассекающим остеохондритом коленного сустава // Вестник РГМУ. 2018. №2. С.77-83.
- Маланин Д.А., Новочадов В.В., Тетерин О.Г. и др. Инновационные технологии в восстановлении коленного сустава при его повреждениях и заболеваниях // Вестн. Волгогр. Гос. Мед. Унта. 2009. № 2. С.7-13.
- Hunziker E.B. Biologic repair of articular cartilage. Defect models in experimental animals and matrix requirements. Clin. Orthop., 1999, Vol.367 (suppl. 1), рр. 135-146.
- Маланин Д.А., Писарев В.Б., Новочадов В.В. Восстановление повреждений хряща в коленном суставе. Экспериментальные и клинические аспекты. М.: Волгоградское научное издательство, 2010. 455 с.
- Hoemann C.D., Hurtig M., Rossomach E. et al. Chitosan-glycerol phosphate blood implants improve hyaline cartilage repair in ovine microfracture defects. J. Bone Jt. Surg. (Am.), 2005, № 87, рр. 2671-2686.
- Horwitz E.M., Gordon P.L., Koo W.K. et al. Isolated allogenic bone marrow-derived mesenchymal cells engraft and stimulate growth in children with osteogenesis imperfecta. Proc. Natl. Acad. Sci. USA, 2002, vol. 99, рр. 8932-8937.
- Гаркави А.В., Блоков М.Ю. Артроскопическая хондропластика локальных хрящевых дефектов коленного сустава с использованием коллагеновой мембраны Chondro-Gide // Кафедра травматологии и ортопедии. 2015. №3 (15). С.4 - 7.
- Герасименко М.А. Внутрисуставные хондральные и остеохондральные повреждения коленного сустава у пациентов молодого возраста // Новости хирургии. 2010. Том 18. №2. С.137 - 141.
- Котельников Г.П., Ларцев Ю.В., Кудашев Д.С., Зуев - Ратников С.Д., Шорин И.С. Мозаичная хондропластика в лечении больных с деструктивно-дистрофическими и посттравматическими поражениями гиалинового хряща в коленном суставе - экспериментальные и клинические аспекты // Фундаментальные исследования. Медицинские науки. 2013. №9. С.252 - 255.
- Howard J.S., Mattacola C.G., Romine S.E., Lattermann C. Continuous passive motion, early weight bearing, and active motion following knee articular cartilage repair: evidence for clinical practice. cartilage, 2010, Vol.1, рр.276-286.
- Juneau C., Paine R., Chicas E., Gardner E., Bailey L., McDermott J. Current concepts in treatment of patellofemoral osteochondritis dissecans. Int J Sports Phys Ther, 2016, Vol.11, рр. 903-925.
- Kim S.H., Ha C.W., Park Y.B. Intra-articular injection of mesenchymal stem cells for clinical outcomes and cartilage repair in osteoarthritis of the knee: a meta-analysis of randomized controlled trials. Archives of Orthopadic and Trauma Surgery, 2019, Vol.139, рр. 971 - 980.
- Kon E., Filardo G., Brittberg M., Busacca M. et al. Multilayer biomaterial for osteochondral regeneration shows superiority vs microfractures for the treatment of osteochondral lesions in a multicentre randomized trial at 2 years. Knee Surgery Sports Traumatology Arthroscopy, 2018, Vol. 26, рр. 2704 - 2715.
- Лазишвили Г.Д., Егиазарян К.А., Ратьев А.П., Шпак М.А., Маглаперидзе В.Г. Гибридная костно-хрящевая трансплантация - новый способ хирургического лечения рассекающего остеохондрита коленного сустава // Georgian Medical News. 2019. №10. pp. 7-13.
- Егиазарян К.А., Лазишвили Г.Д., Гордиенко Д.И., Храменкова Т.В., Шпак М.А. Способ хирургического лечения костно-хрящевых дефектов мыщелков бедренной кости; пат. 2692228 Рос. Федерация.


