Гидроботанические исследования охраняемой акватории Западного Крыма (Черное море)
Автор: Евстигнеева И.К., Танковская И.Н.
Журнал: Фиторазнообразие Восточной Европы @phytodiveuro
Статья в выпуске: 4 т.15, 2021 года.
Бесплатный доступ
Крым - мировой центр разнообразия дикорастущих растений. Вдоль его берегов располагаются объекты заповедного фонда. С увеличением антропогенного влияния на охраняемые морские объекты происходит сокращение их биоразнообразия. Возникает необходимость составления прогнозов воздействия на береговую зону. Прогнозы должны базироваться на результатах многолетних наблюдений. В акватории памятника природы «Прибрежный аквальный комплекс у мыса Лукулл» такие наблюдения проводились эпизодически, в середине ХХ века. К настоящему времени сведения о флористическом составе памятника немногочисленны. Целью работы стало изучение состава, структуры и пространственной изменчивости макрофлоры памятника в современных условиях. Гидроботанические исследования проводили летом 2020 года. Пробы отбирал дайвер на трех трансектах на глубине 0.5, 1, 3, 5 и 10 м. Сформирован список из 61 вида Chlorophyta, Ochrophyta, Rhodophyta. Четверть видов имеет природоохранный статус. Основу флоры составляет ограниченное число надвидовых таксонов. Среди отделов таксономическим лидером является Rhodophyta. Таксономическая структура Ochrophyta выглядит наиболее упрощенной. Константное ядро флоры включает 44% видов. Максимум большинства таксономических параметров фитобентоса приурочен к мысу Вай-Вай, минимум - мысу Тюбек. Спустя полвека видовое разнообразие Chlorophyta увеличилось, Rhodophyta и фитоценона уменьшилось. Экологическая трансформация фитоценона сопровождалась возрастанием видовой насыщенности экогрупп Chlorophytа и Rhodophyta, особенно мезосапробной и солоноватоводно-морской. Chlorophytа пополнился солоноватоводными и полисапробными видами, у Ochrophyta снизилось разнообразие морской, коротковегетирующей и олигосапробной групп, что свидетельствовало об ухудшении экологической обстановки в районе исследований.
Черное море, севастополь, особо охраняемые природные территории, макрофитобентос, видовой состав, встречаемость, изменчивость
Короткий адрес: https://sciup.org/148323688
IDR: 148323688 | УДК: 582.271/275:502.7(262.5) | DOI: 10.24412/2072-8816-2021-15-4-16-33
Текст научной статьи Гидроботанические исследования охраняемой акватории Западного Крыма (Черное море)
Морские экосистемы с их видовым и экологическим разнообразием в отдельных регионах нуждаются в обеспечении сохранности и защиты (Coad et al., 2019; Öztürk et al., 2017). Одним из эффективных инструментов защиты является выделение охраняемых районов Мирового океана. Такие территории помимо прямого назначения становятся полигонами для мониторинга, результаты которого должны быть приняты за основу при усовершенствовании природоохранных мероприятий ( Fernández et al., 2015).
Крымский полуостров выделен Всемирным фондом дикой природы (WWF) и Международным союзом охраны природы (IUCN) в качестве мирового центра разнообразия дикорастущих растений (Johnson, 1995). Вдоль или вблизи морских берегов полуострова располагаются объекты природно-заповедного фонда и структурные элементы экологических сетей (Sadogursky et al., 2019). С увеличением антропогенного влияния на охраняемые морские объекты происходит сокращение их ландшафтного и биологического разнообразия. Этот факт редко учитывается разработчиками и реализаторами проектов по освоению и благоустройству прибрежной зоны моря. Поэтому возникает необходимость составления прогнозов воздействия на такую зону при принятии управленческих решений (Goryachkin et al., 2020). В большинстве случаев прогнозы должны базироваться на результатах многолетних наблюдений, которыми охвачены далеко не все участки прибрежья. К ним относятся мысы Лукулл, Тюбек и Вай-Вай с прилегающей акваторией. Это уникальные объекты природного фонда, которые находятся в зоне взаимодействия моря и суши и относятся к памятнику природы регионального значения «Прибрежный аквальный комплекс у мыса Лукулл» (Goryachkin (Ed.), 2015). Он был организован в 1972 г. решением Крымского облисполкома от 22.02.1972 г. № 97, а позже был внесен в перечень особо охраняемых природных территорий регионального значения, расположенных в г. Севастополе. Памятник природы является полигоном для изучения гидрологических и геолого-морфологических процессов, а его экологическая ценность обусловлена высокой степенью сохранности морских биоценозов. Сведения о флористическом составе как элементе биоразнообразия охраняемой акватории крайне скудны, к тому же часть их относится к прошлому веку (Kalugina-Gutnik et al., 1967; Milchakova, 2003; Milchakova et al., 2019). В связи с этим целью работы стало изучение видового состава, таксономической структуры, встречаемости видов, качественного сходства и изменчивости бентосной макрофлоры на трех ключевых участках гидрологического памятника природы в современных условиях.
Материал и методы исследования
Гидрологический памятник природы регионального значения «Прибрежный акваль-ный комплекс у мыса Лукулл» (ПАК) расположен в северо-восточной части г. Севастополя. Общая протяженность береговой линии составляет 3448.6 м, ширина акватории – 300 м. Площадь охраняемой территории достигает 128.6 га, из них 88% приходится на морскую часть (Cadastral…, 2021). Восточная граница памятника природы совпадает с административной границей г. Севастополя, а южная проходит в 600 м от пляжа поселка Андреевки. Справа от мыса Лукулл находится мыс Тюбек, слева – мыс Вай-Вай. Граница ПАК и координаты трансект представлены на рисунке 1.
Побережье охраняемой территории представляет зону перехода морфоструктур горной части к морфоструктурам шельфа равнинно-платформенных областей. В прибрежной акватории сосредоточено нагромождение плит и глыб конгломерата, образующих выступы дна и отдельные банки. Аквальные ландшафты представлены подводными пологими склонами, образованными гравийно-галечниковыми отложениями с отдельно стоящими валунами.
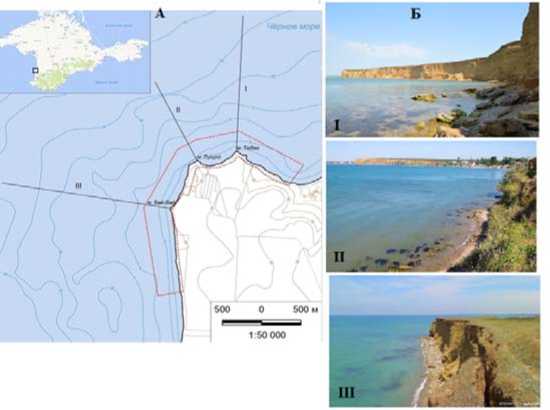
Рис. 1. Район исследования: А. Гидроботанические трансекты и граница ПАК;
Б. I – мыс Тюбек (северная широта 44°50.483′, восточная долгота 033°33.642′), II – мыс Лукулл (северная широта 44°50.411′, восточная долгота 033°33.274′), III – мыс Вай-Вай (северная широта 44°50.061′, восточная долгота 033°32.996′)
Fig. 1. Study area: A. Hydrobotanical transects and NAC boundary;
Б. I - Cape Tyubek (northern latitude 44°50.483′, eastern longitude 033°33.642′), II - Cape Lukull (northern latitude 44°50.411′, eastern longitude 033°33.274′), III - Cape Wai-Wai (northern latitude 44°50.061′, eastern longitude 033°32.996′)
Гидролого-гидрохимические исследования прибрежной акватории г. Севастополя выявили высокую обеспеченность среды кислородом, низкие значения БПК 5 , окисляе-мости, концентрации минеральных форм азота и фосфора (Ryabushko et al., 2020). Концентрации биогенных веществ типичны для незагрязненных прибрежных вод, что согласуется со значениями индекса эвтрофикации (E-TRIX = 1.44 – 2.20), свидетельствующими, что воды акватории обладают низким трофическим уровнем. Во время исследований не было установлено влияние пресных вод рек Бельбек и Кача на распределение солености. Вместе с тем известно, что на побережье от мыса Лукулл до мыса Сарыч функционируют 35 выпусков сточных вод различной степени очистки, а русла рек, расположенных на охраняемых территориях, зачастую принимают сточные воды организованных и неорганизованных источников (Gruzinov et al., 2019). В непосредственной близости от района исследования находятся канализационно-очистные сооружения (КОС «Маргопуло») и аварийные выпуски поселка Качи. В августе 2020 г., в районе мыса Лукулл было зарегистрировано существенное превышение предельно допустимой концентрации по БПК 5 (D'yakov et al., 2020). В это время воды рек Бельбек и Кача отличались высоким уровнем загрязнения металлами и нефтепродуктами. В поселке Андреевка (мыс Вай-Вай) в апреле 2017 г. запустили новые КОС, которые обеспечивали очистку стоков согласно требованиям природоохранного законодательства и минимизировали негативную нагрузку на окружающую среду посредством прекращения сброса загрязняющих веществ в Черное море. В поселках Песчаное и Угловое (мыс Тюбек) очистных сооружений нет, а трубы, выводящие стоки без очистки, часто прорываются. Очевидно, что дальнейшее наращивание объемов загрязнения может негативно сказаться на качестве среды обитания гидробионтов.
Гидроботанические исследования проводили в июле 2020 г. с помощью легководолазного снаряжения и с применением маломерного судна. При отборе проб применяли метод трансект (разрезов), заложенных от границ буферной зоны памятника до нижней границы обитания водорослей. На глубинах 0.5, 1, 3, 5 и 10 м закладывали по четыре учетных рамки размером 25 х 25 см (Kalugina, 1969). Всего на трансектах были собраны 56 количественных и 20 качественных проб.
Видовой состав макрофитобентоса определяли с помощью базового определителя А.Д. Зиновой и с учетом современных таксономических ревизий (Zinova, 1967; Guiry et Guiry, 2021). При описании таксономической структуры привлекали сведения о пропорциях флоры. Для фитоиндикации среды рассчитывали коэффициент Ченея, а для определения принадлежности флоры к конкретной географической зоне – коэффициент Фельдманна (Cheney, 1977; Feldmann, 1937). Экологический состав идентифицировали в соответствии с классификацией водорослей, созданной с учетом таких показателей, как сапробность, встречаемость в Черном море, сроки вегетации и галобность видов (Kalugina-Gutnik, 1975). Для сравнения флоры на разных участках акватории применяли коэффициенты общности видов по Жаккару (K j , %) и их встречаемости (R, %) (Mirkin et al., 1989). На базе данных о величине R рассчитывали индексы гомотонности фитоценона (J) и распределяли виды на группы постоянства (постоянные, добавочные, случайные) (Mirkin et al., 1989; Dajo, 1975).
Для выявления вариабельности характеристик сообщества вычисляли их среднее значение с доверительным интервалом и коэффициент вариации (С v , %). С учетом величины С v определяли степень изменчивости признаков по шкале Г.Н. Зайцева (верхне-и нижненормальная, значительная, большая, очень большая, аномально высокая) (Zaitsev, 1990).
Результаты исследования и обсуждение
Во флоре ПАК обнаружен 61 вид макроводорослей 42 родов, 22 семейств, 16 порядков, 4 классов отделов Chlorophyta (Ch), Ochrophyta (Och), Rhodophyta (Rh). 57% видового состава приходится на Rh, 25% – на Ch и оставшееся – на Och. Видовое соотношение отделов на исследованной акватории совпадает с таковым во всем Черном море и свидетельствует о трехкратном преимуществе Rh (1Ch : 1Och : 3Rh). Приводим список видов, обнаруженных летом 2020 г. (табл. 1).
Таблица 1. Аннотированный список видов водорослей Table 1. An annotated list of algae species
|
№ |
Таксон |
Охранный документ |
Мыс |
R,% |
||
|
Вай-Вай |
Лукулл |
Тюбек |
||||
|
CHLOROPHYTA Rchb. Ulvophyceae Mattox et K.D. Stewart Cladophorales Haeckel Cladophoraceae Wille Chaetomorpha Kütz. |
||||||
|
1 |
Chaetomorpha linum (O.F. Müll.) Kütz. |
+ |
+ |
+ |
100 |
|
|
2 |
Chaetomorpha aërea (Dillwyn) Kütz. |
+ |
33 |
|||
|
Cladophora Kütz. |
||||||
|
3 |
Cladophora laetevirens (Dillwyn) Kütz. |
+ |
+ |
+ |
100 |
|
|
4 |
Cladophora albida (Nees) Kütz. |
+ |
+ |
+ |
100 |
|
|
5 |
Cladophora dalmatica Kütz. |
КкУ* (3)** |
+ |
+ |
+ |
100 |
|
6 |
Cladophora liniformis Kütz. |
+ |
+ |
67 |
||
|
7 |
Cladophora sericea (Huds.) Kütz. |
+ |
+ |
67 |
||
Продолжение таблицы 1
Продолжение таблицы 1
|
№ |
Таксон |
Охранный документ |
Мыс |
R,% |
||
|
Вай-Вай |
Лукулл |
Тюбек |
||||
|
Fucales Bory Sargassaceae Kütz. Gongolaria Boehmer |
||||||
|
20 |
Gongolaria barbata (Stackh.) Kuntze |
КкК (2), RDL, RDB |
+ |
+ |
+ |
100 |
|
21 |
Ericaria crinita (Duby) Molinari et Guiry |
КкК (2), RDL, RDB |
+ |
+ |
+ |
100 |
|
Sphacelariales Mig. Sphacelariaceae Decne. Sphacelaria Lyngb. |
||||||
|
22 |
Sphacelaria cirrosa (Roth) C. Agardh |
+ |
+ |
+ |
100 |
|
|
Cladostephaceae Oltm. Cladostephus C. Agardh |
||||||
|
23 |
Cladostephus spongiosus (Huds.) C. Agardh |
КкУ (3) КкК (3) |
+ |
+ |
+ |
100 |
|
Tilopteridales Bessey Cutleriaceae J.W. Griffith et A. Henfrey Zanardinia Nardo ex Zanard. |
||||||
|
24 |
Zanardinia typus (Nardo) P.C. Silva in Greuter |
+ |
+ |
67 |
||
|
Sporochnales Sauvageau Sporochnaceae Grev. Nereia Zanard. |
||||||
|
25. |
Nereia filiformis (J. Agardh) Zanard. |
КкК (2), КкС (3) |
+ |
33 |
||
|
Dictyotales Bory Dictyotaceae J.V. Lamour. ex Dumortier Dictyota J.V. Lamour. |
||||||
|
26 |
Dictyota fasciola (Roth) J.V. Lamour. |
+ |
33 |
|||
|
RHODOPHYTA Wettst. Florideophyceae Cronquist Acrochaetiales Feldmann Acrochaetiaceae Fritsch ex W.R. Taylor Grania (Rosenvinge) Kylin |
||||||
|
27 |
Grania efflorescens (J. Agardh) Kylin |
+ |
33 |
|||
|
Acrochaetium Näg |
||||||
|
28 |
Acrochaetium secundatum (Lyngb.) Näg. in Näg. et Cramer |
+ |
33 |
|||
|
Rhod Rhod |
ochortonaceae ochorton Näg |
|||||
|
29 |
Rhodochorton purpureum (Light.) Rosenv. |
КкУ (3) |
+ |
33 |
||
Продолжение таблицы 1
Продолжение таблицы 1
|
№ |
Таксон |
Охранный документ |
Мыс |
R,% |
||
|
Вай-Вай |
Лукулл |
Тюбек |
||||
|
Gelidiales Kylin Gelidiaceae Kütz |
||||||
|
Gelidium J.V. Lamour. |
||||||
|
58 |
Gelidium crinale (Hare ex Turner) Gaillon |
+ |
+ |
+ |
100 |
|
|
59 |
Gelidium spinosum (S.G. Gmel.) P.C. Silva |
RDL |
+ |
+ |
67 |
|
|
Parviphycus Santelices |
||||||
|
60 |
Parviphycus antipae (Celan) B. Santelices |
+ |
33 |
|||
|
Compsopogonophyceae G.W. Saund |
ers et Hommersand |
|||||
|
Erythropeltales Garbary, G.I. Hansen et Scagel |
||||||
|
Erythrotrichiaceae G.M. |
Smith |
|||||
|
Erythrotrichia Aresch. |
||||||
|
61 |
Erythrotrichia carnea (Dillw.) J. Agardh |
+ |
+ |
67 |
||
Примечание : * здесь и в таблице 2: КкРФ – Красная книга РФ, КкУ – Красная книга Украины, КкК – Красная книга Крыма, КкС – Красная книга Севастополя, RDL – Black Sea Red Data List, RDB – Black Sea Red Data Book. ** категория природоохранного статуса: 2 – сокращающиеся в численности, 3 – редкие, 5 – восстанавливаемые и восстанавливающиеся
Note : * here and in table 2: Red Data Book of the Russian Federation, Red Data Book of Ukraine, Red Data Book of Crimea, Red Data Book of Sevastopol, RDL - Black Sea Red Data List, RDB - Black Sea Red Data Book. ** category of conservation status: 2 – decreasing in numbers, 3 – rare, 5 – restorable and recoverable
Каждый четвертый вид имел природоохранный статус. Их основная часть (53%) относилась к Rh, меньше всего таких видов было среди Ch (13%). Наибольшее число видов упоминается в списках КкК и КкУ (табл. 2). Часть таксонов включена в международные охраняемые списки RDL и RDB, а также в КкС и КкРФ (Red…, 2015; Red…, 2008; Red…, 2018; Red…, 2009; Black…, 1997; Black…, 1999). Природоохранный статус большинства видов относится ко второй и третьей категориям.
Таблица 2. Флористический состав охраняемого фитокомплекса ПАК Table 2. Floristic composition of the protected phytocomplex NAC
|
Охранный документ |
Отдел |
Число охраняемых видов |
||
|
Ch |
Och |
Rh |
||
|
КкК |
1 * |
5 |
4 |
10 |
|
КкС |
- |
2 |
1 |
3 |
|
КкРФ |
- |
1 |
1 |
2 |
|
КкУ |
2 |
2 |
4 |
8 |
|
RDL |
1 |
2 |
2 |
5 |
|
RDB |
- |
2 |
1 |
3 |
Примечание : * – абсолютное число видов. Note : * – absolute number of species
Сопоставление пропорций таксонов у всего фитоценона и отделов показало, что они совпадают на уровне количественного соотношения порядков и семейств (табл. 3).
Таблица 3. Таксономическая характеристика макрофитобентоса ПАК Table 3. Taxonomic characteristics of NAC macrophytobenthos
|
Отдел |
Количество таксонов |
Пропорции таксонов |
|||||||
|
п:с:р:в |
в/р |
в/с |
в/п |
с/п |
|||||
|
* п |
с |
р |
в |
||||||
|
Ch |
3 |
3 |
6 |
15 |
1:1:2:5 |
2.5 |
5.0 |
5.0 |
1.0 |
|
Och |
6 |
8 |
11 |
11 |
1:1:2:2 |
1.0 |
1.4 |
1.8 |
1.3 |
|
Rh |
7 |
11 |
25 |
35 |
1:1:3:5 |
1.4 |
3.2 |
5.0 |
1.6 |
|
Ценоз |
16 |
22 |
42 |
61 |
1:1:3:4 |
1.4 |
2.8 |
3.8 |
1.4 |
Примечание : * – п, с, р, в – порядок, семейство, род, вид
Note : * o, f, g, s – order, family, genus, species
Кроме того, сходство распространяется на надвидовые таксоны у Ch и Och, а также у Rh и всего сообщества. У Ch выявлена высокая видовая насыщенность родов, семейств и порядков. Для Rh характерно большое численное значение пропорций в/п и с/п. Среди отделов таксономическая структура Och является наиболее упрощенной.
В таблице 4 представлены данные о ранговом распределении таксонов макрофитобентоса ПАК. Основу таксономического разнообразия составляет ограниченное число надвидовых таксонов, в большинстве своем относящихся к Ch и Rh.
Таблица 4. Ранговое распределение таксонов в макрофитобентосе ПАК Table 4. Rank distribution of taxa in NAC macrophytobenthos
|
Таксоны |
||||||
|
с высоким разнообразием видов |
с высоким разнообразием родов |
|||||
|
ранг |
порядки |
семейства |
роды |
ранг |
порядки |
семейства |
|
I |
Ceramiales (21) |
Rhodomelaceae (14) |
Ulva (5) Cladophora (5) |
I |
Ceramiales (13) |
Rhodomelaceae (7) |
|
II |
Cladophorales (8) Ulvales (6) |
Ulvaceae (5) Ceramiaceae (7) |
Ceramium (3) Polysiphonia (3) |
II |
Cladophorales (3) Corallinales (4) Acrochaetiales (3) |
Ceramiaceae (5) |
|
III |
Ectocarpales (4) Corallinales (4) |
Chordariaceae (3) Corallinaceae (3) |
все остальные |
III |
все остальные |
Cladophoraceae (3) Corallinaceae (3) |
Примечание : в скобках число видов или родов
Note : the number of species or genus in parentheses
Значение коэффициента Фельдманна показывает, что макрофитобентос ПАК занимает промежуточное положение между растительностью субтропической и тропической зон (3.2), а, судя по величине индекса Ченея (5.8), среда обитания водорослей яв- ляется средне загрязненной. Необходимо учесть, что полученное значение индекса Ченея близко к крайнему, после которого можно говорить о неблагополучии экологической обстановки в данном районе. Среди обследованных участков последнее обстоятельство наиболее характерно для прибрежья мыса Тюбек.
Качественная характеристика макрофитобентоса может быть дополнена сведениями о встречаемости видов и степени сходства их комплексов на исследованных участках. Установлено, что встречаемость видов в акватории трех мысов изменяется от 33 до 100% и в среднем составляет 70%. В зависимости от величины коэффициента R виды были распределены на две группы постоянства. Виды с максимально высокой встречаемостью (100%) объединены в константную группу (ядро флоры) (рис. 2).
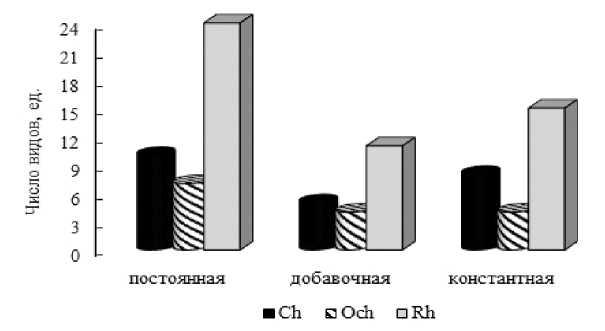
Рис. 2. Флористический состав групп постоянства Fig. 2. Floristic composition of constancy groups
Постоянные виды с R выше 50% доминируют в каждом отделе. Количественное соотношение постоянной и добавочной групп выглядит как 2 постоянных вида : 1 добавочный. 44% видов с максимально высокой встречаемостью образуют константное ядро бентосной флоры. К ним относятся 8 видов зеленых, 4 вида бурых и 15 видов красных водорослей (рис. 2). По абсолютному числу константных видов отделы располагаются в порядке: Rh>Ch>Och. По относительному вкладу в формирование ядра флоры расположение отделов меняется на Ch>Rh>Och. Константные виды относятся к 12 экологическим группам из 13, известных для черноморского фитобентоса. Среди них разнообразнее всего представлены морская, ведущая, однолетняя, олигосапробная группы (55 – 70% видов). Преимущество однолетников над многолетниками выражено незначительно.
Величина коэффициента Жаккара варьирует от 55 до 66%. Его средняя величина свидетельствует о том, что видовой состав на участках различается на 40%. Качественная неоднородность особенно характерна видам Och, большинство которых проявляет высокую требовательность к условиям обитания (K j = 47%). Их различие наиболее проявляется при сопоставлении видовых списков в районе мысов Вай-Вай и Лукулл (58%), Вай-Вай и Тюбек (56%).
Видовое сходство Rh выше, чем у Och (среднее для участков значение K j = 58%), что наиболее заметно при попарном сравнении видов мыса Лукулл с видами на других участках (более 60%). На 50% не совпадает видовой состав у мысов Вай-Вай и Тюбек, что связано с различием условий обитания водорослей. Ch, по сравнению с Rh и Och, на всей акватории ПАК качественно более однороден. Значения коэффициента Жаккара для зеленых водорослей изменяются от 53 до 75%, достигая в среднем 65%. Скорее всего это связано с высокой экологической толерантностью большинства видов Ch. Среди них много общих видов обнаружено как на смежных участках (мыс Тюбек и мыс Лукулл), так и на разобщенных (мысы Вай-Вай и Тюбек).
Сходство видовой структуры отделов увеличивается в ряду: Ch > Rh > Och (65 – 58 – 47%). Родовое сходство макрофитобентоса мысов Вай-Вай и Тюбек составляет 60%, Вай-Вай и Лукулл – 66%, Тюбек и Лукулл – 73%. Значения индексов гомотонности структуры (J) свидетельствуют о том, что фитобентос на разных участках ПАК проявляет качественную неоднородность состава.
Исследования показали, что количественный максимум большинства параметров таксономической структуры приурочен к акватории мыса Вай-Вай, минимум – мыса Тюбек. Низкие показатели фиторазнообразия у мыса Тюбек и частично у мыса Лукулл могут быть обусловлены следующими причинами. Известно, что активизация оползневых процессов на участке от мыса Лукулл до мыса Тюбек, орографические и гидродинамические особенности района приводят к накоплению глинистых отложений, затрудняющих функционирование макроводорослей. Ниже 5 м формируется слабонаклонная аккумулятивная равнина, сложенная песчаным грунтом, препятствующим закреплению пропагул водорослей. У мыса Тюбек обрывы отступают от уреза воды, образуя песчано-галечные пляжи, активно посещаемые отдыхающими.
Наименьшей пространственной однородностью отличается таксономический состав Och, наибольшей – Rh и весь фитоценон (табл. 5).
Таблица 5. Параметры пространственной изменчивости таксономической структуры
Table 5. Parameters of the spatial variability of the taxonomic structure
|
Таксоны |
Параметры изменчивости |
|||
|
min/max |
* x ср. ± σ |
C v , %** |
тип |
|
|
Chlorophyta |
||||
|
Порядки |
2/3 |
2.33±0.65 |
25 |
«верхняя» норма |
|
Семейства |
2/3 |
2.67±0.65 |
22 |
«нижняя» норма |
|
Роды |
4/5 |
4.67±0.65 |
12 |
-"- |
|
Виды |
10/12 |
11.00±1.13 |
9 |
-"- |
|
Ochrophyta |
||||
|
Порядки |
3/5 |
4.33±1.31 |
27 |
«верхняя» норма |
|
Семейства |
4/7 |
6.00±1.96 |
29 |
-"- |
|
Роды |
5/9 |
7.33±2.36 |
28 |
-"- |
|
Виды |
5/9 |
7.33±2.36 |
28 |
-"- |
|
Rhodophyta |
||||
|
Порядки |
5/7 |
5.67±1.31 |
20 |
«нижняя» норма |
|
Семейства |
8/11 |
9.00±1.96 |
19 |
-"- |
|
Роды |
16/21 |
18.67±2.85 |
13 |
-"- |
|
Виды |
21/29 |
25±4.53 |
16 |
-"- |
|
Фитоценон |
||||
|
Порядки |
10/14 |
12.33±2.36 |
17 |
«нижняя» норма |
|
Семейства |
14/21 |
17.67±3.97 |
20 |
-"- |
|
Роды |
25/35 |
30.67±5.81 |
17 |
-"- |
|
Виды |
36/50 |
43.33±7.95 |
16 |
-"- |
Примечание : *х ср ± σ – среднее с доверительным интервалом, **C v – коэффициент вариации
Note: *х ср ± σ – mean with confidence interval, ** C v – coefficient of variation
Пространственная изменчивость родового коэффициента у Ch по шкале Г.Н. Зайцева находится между «небольшой» и «нижненормальной», а у Och и всего сообщества она вовсе отсутствует. Таким образом, видовой состав макрофитобентоса ПАК в количест- венном отношении однообразен и слабо меняется от участка к участку. Более выраженной является его качественная неоднородность, подтверждаемая значениями индексов гомотонности и коэффициента Жаккара.
Полученные авторами данные были сопоставлены с результатами подобных исследований ПАК у мыса Лукулл прошлых лет. В работе (Milchakova, 2003) представлены списки макрофитов для шести охраняемых объектов, среди которых и ПАК у мыса Лукулл. К сожалению, неизвестно к каким годам или году, сезонам или сезону, координатам и диапазону глубин относятся интересующие нас сведения. Это снижает степень корректности сравнительной процедуры, но позволяет уточнить имеющиеся списки видов. Сравнение таких списков, преобразованных с учетом современных таксономических ревизий, показало, что в июле 2020 г. в фитоценоне было зарегистрировано больше видов зеленых (на 6 видов), меньше красных (на 3 вида), бурых (на 12 видов) водорослей и их общего числа (на 9 видов). Не зная исходных условий проведения более ранних исследований, трудно судить о причинах такой трансформации видового состава. Доля общих видов для каждого отдела в сравниваемые периоды составляла 41 – 45%, а для всего сообщества – 44%. Родовое сходство отделов и всего фитоценона превышало видовое. У Ch, Rh и Och роды совпадали, соответственно, на 83%, 50% и 47%. Для всего фитоценона этот показатель равнялся 51%. 56% видов, среди которых преобладали красные водоросли, проявляли 100%-ную встречаемость в сравниваемые периоды. Вклад таких видов в состав каждого отдела был примерно одинаковым. Видовое соотношение отделов не совпадало (1Ch : 1Och : 3Rh – в 2020 г. и 1Ch : 3Och : 4Rh – в 1964 – 1989 гг.), но всегда свидетельствовало о преимущественном положении Rh и подчиненном – Ch.
В сравниваемые периоды произошла экологическая трансформация фитоценона. Увеличилась видовая представленность всех 12 экологических групп Ch и прежде всего редкой, однолетней, мезосапробной, солоноватоводно-морской и морской. Среди зеленых водорослей добавились по одному представителю солоноватоводной и полисапробной групп, являющихся индикаторами высокой степени распреснения и загрязнения окружающей среды. Среди красных водорослей возросло участие морских, сопутствующих, редких, однолетних и мезосапробных видов. Среди бурых водорослей стало существенно меньше морских, коротковегетирующих и особенно олигосапробных видов, что могло быть связано с наметившимся ухудшением экологической обстановки в акватории ПАК. В более поздней работе, опубликованной в 2019 г., для акватории «Прибрежного аквального комплекса у мыса Лукулл» приводятся сведения о количестве видов в фитоценозе с доминированием видов Ericaria и Gongolaria летом 2008 – 2017 гг. (Milchakova et al., 2019). Сравнение с нашими результатами показало совпадение числа видов зеленых водорослей и примерно одинаковый уровень показателя у других отделов. Общее число видов в 2020 г. стало больше на 4 таксона.
Обобщение имеющихся данных показало, что на текущий момент бентосная флора аквального комплекса у мыса Лукулл состоит из 93 видов (16 видов Ch, 25 – Och и 52 – Rh), а ее таксономическим лидером является Rhodophyta. Таким образом, было расширено и уточнено представление о современном фиторазнообразии охраняемой акватории, а полученные данные смогут стать базой для дальнейших мониторинговых мероприятий. Фитоиндикация экологического состояния среды, результаты которой подтверждены гидролого-гидрохимическими исследованиями, приводят к выводу о том, что антропогенный пресс в его разных формах остается реальной угрозой для природного биоразнообразия даже охраняемой территории.
Выводы
-
1. В бентосной флоре прибрежно-аквального комплекса у мыса Лукулл летом 2020 г. обнаружен 61 вид 43 родов, 22 семейств, 16 порядков, 4 классов Chlorophyta, Ochrophyta и Rhodophyta. С учетом ранее полученных данных флора охранной зоны включает 93 вида.
-
2. Четверть зарегистрированных видов имеет природоохранный статус второй и третьей категорий. Большинство видов занесено в Красные книги Крыма и Украины, часть видов включена в международные охраняемые списки Black Sea Red Data List и Black Sea Red Data Book, а также в Красные книги Севастополя и РФ.
-
3. Основу таксономического разнообразия флоры охраняемой акватории составляет ограниченное число надвидовых таксонов. У Chlorophyta отмечена высокая видовая насыщенность надвидовых таксонов, у Rhodophyta – порядков и семейств. Среди отделов таксономическая структура Ochrophyta является наиболее упрощенной.
-
4. Средняя встречаемость видов в акватории мысов достигает 70%. Доминирует группа постоянных видов (R более 50%), разнообразие которой вдвое выше, чем добавочной. Константное ядро флоры включает 44% видов.
-
5. Степень сходства видового состава ценоза на трех участках превышает 50%. Качественная неоднородность видовых комплексов отделов уменьшается в ряду Och > Rh > Ch. Неоднородность структуры фитобентоса ПАК подтверждена индексами гомотон-ности.
-
6. Количественный максимум большинства таксономических параметров фитобентоса приурочен к мысу Вай-Вай, минимум – к мысу Тюбек. Таксономический состав Rhodophyta, фитоценона и родовой коэффициент в пространстве меняются слабо, у Ochrophyta такой процесс протекает интенсивнее, но без превышения биологической нормы.
-
7. Сравнение списков видов показало, что спустя более полувека увеличилось видовое разнообразие зеленых водорослей и уменьшилось – красных и всего фитоценона. Доля общих и константных видов в отделах в сравниваемые периоды составляет примерно 50%. Видовое соотношение отделов изменилось, но неизменно отражает лидирующее положение Rhodophyta и подчиненное – Chlorophyta.
-
8. Экологическая трансформация фитоценона сопровождалась увеличением видовой насыщенности всех экогрупп Chlorophytа и Rhodophyta и среди них мезосапробной и солоноватоводно-морской, успешно развивающихся в условиях со средней степенью распреснения и загрязнения. Состав Chlorophytа пополнился видами солоноватоводной и полисапробной групп, что также свидетельствовало о наметившейся тенденции ухудшения экологической обстановки в акватории памятника природы. Возможно, по этой же причине разнообразие Ochrophyta снизилось за счет морских, коротковегети-рующих и особенно олигосапробных видов.
Работа выполнена в рамках государственного задания ФИЦ ИнБЮМ по теме «Исследование механизмов управления продукционными процессами в биотехнологических комплексах с целью разработки научных основ получения биологически активных веществ и технических продуктов морского генезиса» (№ гос. регистрации 121030300149-0).
Список литературы Гидроботанические исследования охраняемой акватории Западного Крыма (Черное море)
- Black Sea Red Data Book. 1999. New York. 413 p.
- Black Sea Red Data List. 1997. [online] Available at: http://www.grid.unep.ch/bsein/redbook/about/datalist.htm [Дата обращения 22.03.2021]
- [Cadastral...] Кадастровый отчет по ООПТ гидрологический памятник природы регионального значения «Прибрежный аквальный комплекс у мыса Лукулл». http://oopt.aari.ru/ooptШрибрежный-аквальный-комплекс-у-мыса-Лукулл [Дата обращения 20.05.2021].
- Cheney D.T. 1977. R + C/P anew and improved ratio for comparing seeweed floros. — Journal Phycology. 13(2): 12.
- Coad L., Watson J.E., Geldmann J., Burgess N.D., Leverington F., Hockings M., Knights K., Marco M. 2019. Widespread shortfalls in protected area resourcing undermine efforts to conserve biodiversity. — Frontiers in Ecology and the Environment. 17(5): 259-264. https://doi.org/10.1002/fee.2042
- [Dajo] Дажо Р. 1975. Основы экологии. М. Прогресс. 245 с.
- [D'yakov et al.] Дьяков Н.Н., Мальченко Ю.А., Липченко А.Е., Боброва С.А., Тимошенко Т.Ю. 2020. Гидролого-гидрохимические характеристики прибрежных вод Крыма и необходимые мероприятия по снижению уровня загрязнения рекреационных зон. — Труды ГОИН. 221: 163-194.
- Feldmann J. 1937. Recherches sur la Végétation Marine de la Méditerranée - La Côte des Albères. — Revue Algology. 10: 1-339.
- Fernández C.G., Paulo D., Serrâo E.A., Engelen A.H. 2016. Limited differences in fish and benthic communities and possible cascading effects inside and outside a protected marine area in Sagres (SW Portugal) — Journal Marine Environmental Research. 114: 12-23. https://doi.org/10.1016/j.marenvres.2015.12.003
- [Goryachkin et al.] Горячкин Ю.Н., Федоров А.П., Долотов В.В., Удовик В.Ф. 2020. Природные условия и антропогенное изменение береговой зоны в районе пос. Кача. — Экологическая безопасность прибрежной и шельфовой зон моря. 4: 5-21. doi:10.22449/2413-5577-2020-4-5-21
- [Goryachkin] Горячкин Ю.Н. (Ред.) 2015. Современное состояние береговой зоны Крыма. Севастополь. 252 с.
- [Gruzinov et al.] Грузинов В.М., Дьяков Н.Н., Мезенцева И.В., Мальченко Ю.А., Жо-хова Н.В., Коршенко А.Н. 2019. Источники загрязнения прибрежных вод Севастопольского района. — Океанология. 59(4): 579-590. https://doi.org/10.31857/S0030-1574594579-590
- Guiry M.D., Guiry G.M. 2021. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. Available at: http: // www.algaebase.org. [Date accessed 20.09 2021].
- Johnson N.C. 1995. Biodiversity in the balance: Approaches to Setting Geographic Conservation Priorities. Biodiversity Support Program: Washington. 116 p.
- [Kalugina] Калугина А. А. 1969. Исследование донной растительности Черного моря с применением легководолазной техники. — В кн.: Морские подводные исследования. М. С. 105-113.
- [Kalugina-Gutnik] Калугина-Гутник А.А. 1975. Фитобентос Черного моря. Киев. 248 с.
- [Kalugina-Gutnik et al.] Калугина-Гутник А.А., Куликова, Н.М., Лачко О.А. 1967. Качественный состав и количественное распределение фитобентоса в Каркинитском заливе. — В кн.: Донные биоценозы и биология бентосных организмов Черного моря. Киев. С. 112-130.
- [Milchakova] Мильчакова Н.А. 2003. Макрофитобентос. — В кн.: Современное состояние биоразнообразия прибрежных вод Крыма (Черноморский сектор) / под ред. Еремеева В.Н., Гаевской А.В. Севастополь. С. 152-208.
- [Milchakova et al.] Мильчакова Н.А., Александров В.В., Рябогина В.Г. 2019. Состояние ключевых фитоценозов морских охраняемых акваторий и проблемы их сохранения (юго-западный Крым, Черное море). — Биология растений и садоводство: теория, инновации. 149: 113-123. https://doi.org/10.36305/0201-7997-2019-149-113-123
- [Mirkin et al.] Миркин Б.М., Розенберг Г.С., Наумова Л.Г. 1989. Словарь понятий и терминов современной фитоценологии. М. 223 с.
- Oztürk B., Fach B., Keskin C., Arkin S., Topaloglu B., Oztürk A. 2017. Prospects for Marine Protected Areas in the Turkish Black Sea — In: Management of Marine Protected Areas. P. 247-262. DOI: 10.1002/9781119075806.ch13
- [Red.] Красная книга города Севастополя. 2018. Калининград, Севастополь. 432 с.
- [Red.] Красная книга Республики Крым. Растения, водоросли и грибы. 2015. Симферополь. 480 с.
- [Red.] Красная книга Российской Федерации (растения и грибы). 2008. М. 885 с.
- [Red.] Червона книга Украши. Рослинний свт 2009. Кшв. 912 с.
- [Ryabushko et al.] Рябушко В.И., Щуров С.В., Ковригина Н.П., Лисицкая Е.В., Поспелова Н.В. 2020. Комплексные исследования экологического состояния прибрежной акватории Севастополя (Западный Крым, Черное море). — Экологическая безопасность прибрежной и шельфовой зон моря. 1: 103-118. DOI: 10.22449/2413-5577-2020-1-103118
- [Sadogursky et al.] Садогурский С.Е., Белич Т.В., Садогурская С.А. 2019. Макрофиты прибрежно-морских акваторий природных заповедников Крымского полуострова (Чёрное и Азовское моря). — Algologia. 29(3): 322-351. https://doi.org/10.15407/alg29.03.322
- [Zaitsev] Зайцев Г.Н. 1990. Математика в экспериментальной ботанике. М. 296 с.
- [Zinova] Зинова А.Д. 1967. Определитель зеленых, бурых и красных водорослей южных морей СССР. М.; Л. 397 с.


