Гидротермальный синтез нанодисперсной "железной слюдки" из желтого железоокисного пигмента
Автор: Жеребцов Дмитрий Анатольевич, Мирасов Вадим Шафикович, Клещев Дмитрий Георгиевич, Зарипова Лилия Наильевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.11, 2019 года.
Бесплатный доступ
Изучено влияние температуры предварительной термообработки на воздухе желтого железоокисного пигмента (фаза a-FeОOН) в интервале температур t от 150 до 200 °С на дисперсный состав «железной слюдки» (фаза a-Fe2O3 с пластинчатой формой кристаллов), которая образуется при гидротермальной обработке (230±5 °С) образцов желтого железоокисного пигмента в водном растворе гидроксида калия с концентрацией 3,5 моль/л. Установлено, что с увеличением температуры предварительной термообработки от 150 до 200 °С размер областей когерентного рассеяния, рассчитанный из данных рентгенофазового анализа и средний размер кристаллов d «железной слюдки» (в плоскости пластины), наблюдаемый с помощью растрового электронного микроскопа, уменьшаются по сравнению с образцами, не прошедшими предварительную термообработку, соответственно в ~ 2 и ~ 20 раз. Существенное изменение формы кристаллов исходной (a-FeOОН - игольчатая форма кристаллов) и образующейся фаз (a-Fe2O3 - пластинчатая форма кристаллов) при фазовом превращении свидетельствует о том, что превращение a-FeOОН ® a-Fe2O3 протекает по механизму «растворение - осаждение» путем растворения кристаллов неравновесной в данных термодинамических условиях фазы (a-FeOОН), образования зародышей и роста кристаллов равновесной фазы (a-Fe2O3). Сделан вывод об образовании зародышей a-Fe2O3 на поверхности кристаллов желтого железоокисного пигмента в процессе предварительной термообработки. Количество образовавшихся зародышей тем больше, чем выше температура t и продолжительность t предварительной термообработки. Эти параметры ( t и t) позволяют целенаправленно варьировать количество зародышей α-Fe2O3 и, как следствие, дисперсный состав «железной слюдки».
"железная слюдка", гетит, гидротермальная обработка
Короткий адрес: https://sciup.org/147233125
IDR: 147233125 | УДК: 544.77+538.9+661.872:536.5 | DOI: 10.14529/chem190205
Текст научной статьи Гидротермальный синтез нанодисперсной "железной слюдки" из желтого железоокисного пигмента
Нанодисперсные оксиды 3 d -металлов широко используются в различных областях науки и техники [1–3]. В частности, оксиды железа(III) нашли применение в качестве сорбентов тяжелых металлов, компонентов магнитных жидкостей, катализаторов химических реакций, неорганических пигментов, полирующих средств, компонентов керамики и др. [3–6]. Кроме того, оксид же-леза(Ш) a -модификации с пластинчатым габитусом кристаллов, известный под названием «железная слюдка» (ЖС), применяется в качестве термостойкого пигмента в грунтовках и красках для защиты от коррозии металлических конструкций [4]. Различают природную и синтетическую ЖС. Природная ЖС характеризуется высокой полидисперсностью. Синтетическая ЖС более однородна по дисперсному составу и обладает более высокими функциональными свойствами. Известно, что физико-химические свойства дисперсных материалов в значительной степени зависят от среднего размера кристаллов d [1, 4]. Особый интерес представляют нанодисперсные образцы ЖС, которые могут использоваться в лакокрасочных рецептурах с низкой вязкостью связующего. Поэтому поиск методов, позволяющих целенаправленно варьировать дисперсный состав ЖС, представляет собой важную научную и практическую задачу.
В последние двадцать лет большое развитие получил гидротермальный способ получения нанодисперсных оксидов 3d-металлов [1, 2, 7–9], в том числе его модификации с наложением внешних воздействий (ультразвук, микроволновое излучение) [10–14], позволяющий: а) существенно сократить продолжительность синтеза; б) получать высокодисперсные материалы с узким распределением частиц по размерам. Известно [3, 8], что нанодисперсные оксигидроксиды желе-за(Ш), например у- и З-FeOOH, при термообработке в растворах могут испытывать превращения в фазы a-FeOOH или a-Fe2O3, причем кинетика превращений, средний размер и морфология кристаллов формирующихся фаз зависят от температуры, фазового и дисперсного состава FeOOH и ионного состава раствора. По данным [15, 16], при гидротермальной обработке (ГТО) а- и y-FeOOH в растворах NaOH с концентрацией ~ 5 моль/дм3 образуется микродисперсная ЖС со средним размером кристаллов d в плоскости пластины 3–10 мкм.
В работах [17, 18] рассмотрены основные закономерности способа получения нанодисперс-ной ЖС с величиной d ~ 100 нм, включающие стадии окисления водного раствора сульфата же-леза(II) пероксидом водорода с получением нанодисперсных образцов FeOOH, отмывки осадка от сульфата калия, последующей ГТО FeOOH в растворе КОН, отмывки ЖС от водорастворимых солей и сушки пигмента. Однако из-за низкой скорости фильтрации суспензии FeOOH, применения в качестве окисляющего агента пероксида водорода, а также необходимости утилизировать образующийся на стадии окисления водный раствор сульфата щелочного металла данный способ характеризуется низкой рентабельностью.
Известно, что фазы a -FeOOH и a -Fe2O3 имеют близкие структурные мотивы, причем при термообработке на воздухе фаза a -FeOOH при температурах выше 200 °С испытывает превращение в фазу a -Fe2O3 [19]. Можно ожидать, что предварительная термообработка a -FeOOH в интервале 150-200 ° С может инициировать формирование зародышей фазы a -Fe2O3, и, как следствие, приведет к уменьшению размера кристаллов ЖС. Проверка данной гипотезы и составило задачу данной работы.
Объекты и методы исследования
В качестве исходного образца a -FeOOH использовали желтый железоокисный пигмент марки Ж-1 по ГОСТ 18172-80 «Пигмент желтый железоокисный» производства ОАО «Сумыхим-пром» (Украина). Навески образца в количестве 25 г подвергли изотермической термообработке на воздухе в течение 1 часа при температурах 150, 175 и 200 °С (тигли с образцами ставили в разогретый до заданной температуры сушильный шкаф). Далее исходный (Ж-1 исх ) и подвергнутые термообработке образцы (Ж-1 t , t – температура термообработки) репульпировали в водном растворе КОН с концентрацией 3,5 моль/л и получали суспензии с концентрацией твердой фазы ~ 50 г/л в пересчете на Fe2O3. Суспензии загружали в стальные автоклавы емкостью 70 мл, футерованные изнутри фторопластом (коэффициент заполнения автоклава 0,8). Автоклавы помещали в предварительно нагретый термошкаф типа СНОЛ. ГТО проводили при температуре 230 ± 5 °С в течение 4 ч. Время нагрева автоклавов до заданной температуры не превышало 0,5 ч. Образцы отмывали водой от щелочи и высушивали до постоянной массы при 105 °С.
Состав образцов определяли из данных термогравиметрии и масс-спектроскопии (синхронный термический анализатор Netzsch STA 449C Jupiter, совмещённый с квадрупольным масс-спектрометром QMS 403C Aeolos для анализа выделяющихся газов; запись термоаналитических кривых проводили в интервале температур 20–1000 °С в корундовых тиглях со скоростью нагрева 10 K/мин в токе воздуха 20 мл/мин), а их фазовый состав – методом рентгенофазового анализа (РФА) на дифрактометре Rigaku Ultima IV. Размер областей когерентного рассеивания (ОКР) α-FeOOH и α-Fe 2 O 3 рассчитывали по формуле Дебая, исходя из физического уширения рефлексов. Элементный (метод рентгенофлуоресцентного спектрального анализа – РСА) и дисперсный (метод растровой электронной микроскопии – РЭМ) составы образцов определяли на растровом электронном микроскопе JEOL JSM-7001F, оборудованном рентгенофлуоресцентным энергодисперсионным спектрометром Oxford INCA X-max 80.
Результаты и их обсуждение
По данным РФА (рис. 1, а) и РЭМ (рис. 2, а) образец Ж-1исх является однофазным (фаза a -FeOOH) с характерными для этой фазы кристаллами игольчатой формы размером 600–1000 нм в длину и 60–120 нм в поперечнике, размер ОКР – 30–34 нм. Образец содержит примесь серы в количестве 0,38 масс. % (см. таблицу), являющуюся следствием получения желтого железоокисного пигмента из раствора FeSO4. По данным термогравиметрии изменение (уменьшение) массы
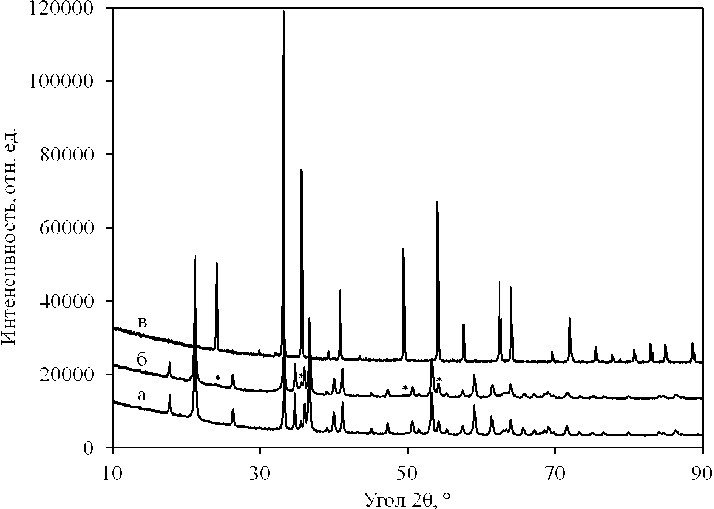
Рис. 1. Рентгенограммы образцов Ж-1 исх (а) и Ж-1 200 (б), а также «железной слюдки», полученной при ГТО образца Ж-1 исх (в). Звездочками обозначены слабые рефлексы, соответствующие наноразмерным зародышевым кристаллам α -Fe 2 O 3

Рис. 2. Морфология образцов гетита Ж-1исх (а) и Ж-1200 (б) и «железной слюдки», полученной после ГТО образцов Ж-1исх (в) и Ж-1200 (г)
образца Ж-1исх происходит в несколько этапов в широком температурном интервале от 60 до 1000 °С (рис. 3). Относительное общее уменьшение массы образца в этом температурном интервале составляет 12,31 %. Теоретическое значение для стехиометрического FeOOH равно 10,14 %, что согласуется с экспериментом при учете потерь адсорбированной воды ниже 203 °С и SO 3 выше 632 °С. На кривой дифференциального термического анализа (ДТА) фиксируются два эндоэффекта и три ступени потери массы с началом превращения при температурах 203, 289 и 632 °С.
Примеси в образцах Ж-1исх, Ж-1200 и ЖС по данным РСА
|
Образец |
Содержание примесных элементов, % масс. |
|
|
S |
K |
|
|
Ж-1 исх |
0,38 |
0 |
|
Ж-1 200 |
0,40 |
0 |
|
ЖС (Ж-1 исх ) |
0 |
0,07 |
|
ЖС (Ж-1 200 ) |
0 |
0,08 |
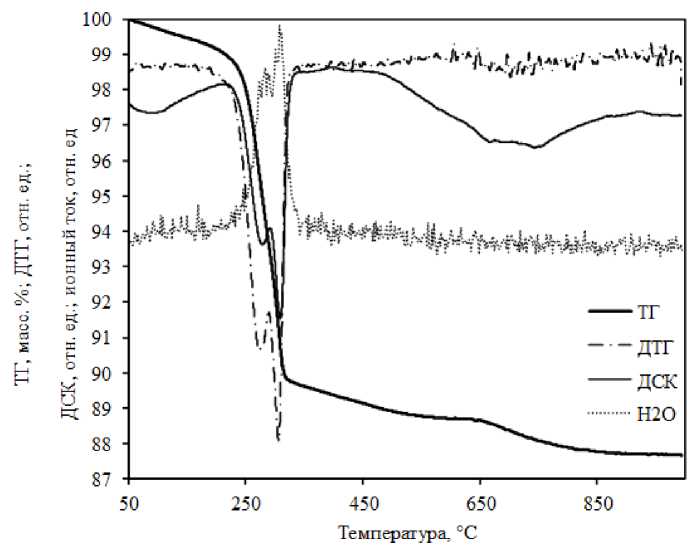
Рис. 3. Термогравиметрические и масс-спектрометрические данные процесса термолиза образца Ж-1исх: ТГ – уменьшение массы образца, ДТГ – скорость уменьшения массы, ДСК – тепловой поток; H2O – кривая ионного тока воды
Масс-спектрометрические исследования состава газовой фазы показали, что первый и второй эндоэффекты обусловлены дегидратацией (рис. 3), а третий – процессом разложения сульфат-ионов. По данным РФА, образец Ж-1 исх , прокаленный при температурах выше 300 °С, испытывает превращение в a -Fe2O3. Из сопоставления полученных данных с литературными [8] можно заключить, что при первом и втором эндоэффектах удаляется конституционная вода (ОН-группы), а при температурах ниже 200 °С – физически адсорбированная вода. Тогда эмпирическую формулу образца Ж-1 исх можно представить в виде (Fe 2 O 3 .H 2 О). n H 2 O. y SO 3 , а его термические превращения при термообработке – в виде следующей схемы:
20 - 200 о С 200 - 350 о С к
(Fe 2 O 3' H 2 O) ' n Н 2 О У SO 3---------- > (Fe 2 O 3' H 2 O) ' y SO 3----------- >
> 630 о С „
Fe2O3.ySO3----------> Fe2O3, где n и y – содержание в образце адсорбированной воды и оксида серы, в пересчете на Fe2O3. Из данных термогравиметрии определены величины n и у: n = 0,14 и у = 0,024. Наличие двух ступеней потери массы в диапазоне температур 200–350 °С и заметной потери массы (1 масс. %) в диапазоне 350-630 °С свидетельствует о сложном трехэтапном превращении a-FeOOH в a-Fe2O3.
Рентгенограммы образцов Ж-1 150 и Ж-1 175 по сравнению с Ж-1 исх не имеют существенных отличий, а на рентгенограмме образца Ж-1 200 наблюдаются дополнительные слабые рефлексы при углах дифракции, соответствующих наиболее интенсивным пикам фазы α-Fe2O3 (рис. 1). Размер ОКР фазы α -FeOOH практически не зависит от температуры термообработки: 30–34 нм (Ж-1исх) и 31-33 нм (Ж-1200). Методами РЭМ и РСА также не выявлено существенных отличий в элементном составе и морфологии кристаллов α -FeOOH образцов Ж-1t, подвергнутых предварительной термообработке (рис. 2, б). Средний размер игольчатых кристаллов α -FeOOH образца Ж-1 200 по данным электронной микроскопии составляет ∼ 700 нм в длину и ∼ 100 нм в поперечнике.
По данным РФА все образцы, подвергнутые ГТО в растворе КОН, испытали превращение в α -Fe2O3 (рис. 1, в) с пластинчатым габитусом кристаллов. При этом средний размер ОКР и кристаллов в значительной степени зависят от температуры предварительной термообработки образца гетита. В частности, при ГТО образцов Ж-1 исх и Ж-1 150 образуется ЖС с размером ОКР ∼ 65 нм и линейным размером кристаллов 1-2 мкм в плоскости пластины (рис. 2, в). При увеличении температуры предварительной термообработки уменьшается как размер ОКР (50 и 33 нм у образцов ЖС, полученных из Ж-1 175 и Ж-1 200 , соответственно), так и средний размер кристаллов ЖС – до 70–150 нм в плоскости пластины у образца ЖC, полученного из Ж-1 200 (рис. 2, г).
Согласно общепринятым представлениям превращения неравновесных оксигидроксидов железа (III) в растворах реализуются по механизму «растворения – осаждения» (РОМ), путем растворения кристаллов неравновесной в данных термодинамических условиях фазы, образования зародышей и роста кристаллов равновесной фазы. Этим, в частности объясняются существенные различия в морфологии и линейном размере кристаллов α-FeOOH и α-Fe2O3. Лимитирующей стадией превращений, протекающих по механизму РОМ, как правило, выступает стадия образования зародышей новой фазы [20]. Можно допустить, что в процессе предварительной термообработки на воздухе образца Ж-1 исх в результате частичной дегидратации на поверхности кристаллов α-FeOOH появляются наноразмерные зародыши фазы α-Fe 2 O 3 . В пользу такого предположения свидетельствует наличие слабых рефлексов этой фазы на рентгенограмме Ж-1 200 , а также изменение массы образца Ж-1 исх при температуре выше 200 °С, соответствующее началу термолиза α-FeOOH (рис. 3). Естественно, что количество зародышей фазы α-Fe2O3 тем больше, чем выше температура t и продолжительность τ предварительной термообработки. При фиксированном дисперсном составе α-FeOOH эти параметры (t и τ ) позволяют целенаправленно варьировать количество зародышей α-Fe 2 O 3 и дисперсный состав ЖС.
Выводы
Установлена зависимость дисперсного состава «железной слюдки», образующейся при гидротермальной обработке желтого железоокисного пигмента в водном растворе КОН, от температуры предварительной термообработки (интервал 150–200 °С) пигмента на воздухе. С увеличением температуры термообработки вплоть до 200 °С средний размер кристаллов «железной слюдки» по сравнению с образцом, не подвергнутым термообработке, уменьшается в ∼ 20 раз, что объясняется образованием зародышей α -Fe 2 O 3 на поверхности кристаллов фазы α-FeOOH в процессе термообработки.
Статья выполнена при поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и Министерства образования и науки РФ в рамках ГЗ № 4.5749.2017/7.8. Рентгенофазовый анализ, а также электронномикроскопические исследования проведены в научно-образовательном центре «Нанотехнологии» ЮУрГУ.
Список литературы Гидротермальный синтез нанодисперсной "железной слюдки" из желтого железоокисного пигмента
- Наноматериалы. Классификация, особенности свойств, применение и технологии получения / Б.М. Балоян, А.Г. Колмаков, М.И. Алымов, А.М. Кротов. - М.: АгроПрессДизайн, 2007. - 102 с.
- Алымов, М.И. Методы получения и физико-механические свойства объемных нанокристаллических материалов / М.И. Алымов, В.А. Зеленский. - М.: МИФИ, 2005. - 52 с.
- Cornell, R.M. The iron oxides. Structure, properties, reactions, occurrences and uses / R.M. Cornell, U. Schwertmann. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA, 2003. - 694 p.
- Яковлев, А.Д. Химия и технология лакокрасочных покрытий / А.Д. Яковлев. - СПб.: ХИМИЗДАТ, 2008. - 448 с.
- Magnetic nanocomposites for sorbents and glue layers / K. Kekalo, V. Agabekov, G. Zhavnerko // J. Magn. Mag. Mat. - 2007. - V. 311, Is. 1. - P. 63-67. DOI: 10.1016/j.jmmm.2006.10.1159
- Некоторые аспекты выбора состава железооксидных каталитических систем для дегидрирования углеводородов / А.А. Емекеев, О.И. Ахмеров, Г.И. Федоров, Х.Э. Харлампиди // Вестник Казанского технологического университета. - 2008. - № 2. - С. 61-63.
- Byrappa, K. Hydrothermal technology for nanotechnology / K. Byrappa, T. Adschiri // Progress in Crystal Growth and Characterization of Material. - 2007. - V. 53, № 2. - P. 117-120.
- Клещев, Д.Г. Получение нанокристаллических оксидов Ti, Mn, Co, Fe и Zn в водных растворах при термообработке / Д.Г. Клещев // Неорганические материалы. - 2005. - Т. 41, № 1. - С. 46-53.
- Гидpотеpмальный синтез нанокpисталлического анатаза из водных раствоpов сульфата титанила для фотокаталитических пpименений / В.Д. Максимов, А.С. Шапорев, В.К. Иванов и др. // Химическая технология. - 2009. - Т. 10, № 2. - С. 70-75.
- Зима, Т.М. Гидротермальный синтез наноструктурированного материала на основе TiO2 в присутствии хитозана / Т.М. Зима, Н.И. Бакланова, А.В. Уткин // Неорганические материалы. - 2012. - Т. 48, № 8. - С. 935-940.
- Гидротермально-микроволновой и гидротермально-ультразвуковой синтез нанокристаллических диоксидов титана, циркония, гафния / П.Е. Мескин, А.И. Гаврилов, В.Д. Максимов и др. // Журнал неорганической химии. - 2007. - Т. 52, № 11. - С. 1755-1764.
- Гидротермально-микроволновой синтез нанокристаллического диоксида церия, допированного гадолинием, в присутствии гексаметилентетрамина / Е.А. Долгополова, О.С. Иванова, В.К. Иванов и др. // Журнал неорганической химии. - 2012. - Т. 57, № 10. - С. 1387-1390.
- Максимов, В.Д. Синтез высокодисперсных порошков цирконата и гафната бария гидротермально-микроволновым методом / В.Д. Максимов, П.Е. Мескин, Б.Р. Чурагулов // Неорганические материалы. - 2007. - Т. 43, № 9. - С. 1102-1108.
- Максимов, В.Д. Гидротермально-микроволновой синтез высокодисперсных порошков простых и сложных оксидов циркония и гафния / В.Д. Максимов, П.Е. Мескин, Б.Р. Чурагулов // Поверхность. Рентгеновские, синхротронные и нейтронные исследования. - 2008. - № 2. - С. 76-82.
- Толчев, А.В. Кристаллохимический аспект фазообразования в системе g-FeOOH - H2O - NaOH / А.В. Толчев, Р.Р. Багаутдинова, Д.Г. Клещев // Журнал прикладной химии. - 2001. - Т. 74, № 3. - С. 353-356.
- Толчев, А.В. Гидротермальный синтез антикоррозионного пигмента «железная слюдка». / А.В. Толчев, Р.Р. Багаутдинова, Д.Г. Клещев // Лакокрасочные материалы и их применение. - 2001. - № 1. - С. 13-15.
- Гидротермальный метод получения нанодисперсной «железной слюдки» / В.Ш. Мирасов, Д.А. Жеребцов, Д.Г. Клещев, Г.Г. Михайлов // Известия вузов. Серия «Химия и химическая технология». - 2014. - Т. 57, № 2. - С. 33-38.
- Гидротермальный синтез нанодисперсного α-Fe2O3 с пластинчатой формой кристаллов / В.Ш. Мирасов, Д.А. Жеребцов, Д.Г. Клещев и др. // Журнал неорганической химии. - 2014. - Т. 59, № 6. - С. 1-8.
- DOI: 10.7868/S0044457X14060142
- A kinetic study of the thermal decomposition of iron(III) hydroxide oxides. Part 1. a-FeOOH in banded iron formations / N. Koga, Sh. Takamoto, S. Okada, H. Tanaka // Thermochimica Acta. - 1995. - V. 254, № 1. - P. 193-206.
- Современная кристаллография (в четырех томах). Т. 3. Образование кристаллов / А.А. Чернов, Е.И. Гиваргизов, Х.С. Багдасаров и др. - М.: Наука, 1980. - 408 с.


