Гифальная единица роста Neurospora crassa как информационно-энергетический модуль
Автор: Потапова Татьяна Васильевна
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Материалы лекций и устных докладов
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
Рост и формообразование - важнейшие функции живых систем, в понимании механизмов управления которыми со стороны генома и со стороны окружающей среды до сих пор остается много не ясного. Удобным модельным объектом для экспериментальных исследований в этой области является мицелиальный гриб Neurospora crassa, гифы которого образуют при росте на твердых подложках двумерные деревья с постоянным отношением суммарной длины ветвей к числу верхушек. Верхушечный рост N. crassa на протяжении последних десятилетий является предметом пристального внимания теоретиков и экспериментаторов, во многом благодаря большому значению мицелиальных грибов для современной биотехнологии, а также значительным успехам в изучении генетических особенностей этого объекта. Получены количественные оценки роста и развития отдельных гиф, проведен сравнительный анализ роли различных внутриклеточных структур в верхушечном росте, накоплен большой объем данных о молекулярно-генетических аспектах верхушечного роста, охарактеризована динамика межклеточных электрических токов в области растущих гифальных верхушек. Растущая верхушка грибной гифы - уникальное образование, в котором разделение между соседними клетками функций генерации мембранных потенциалов и потребления мощности для накопления субстратов создает чрезвычайно сильную (по клеточным масштабам) электрическую поляризацию на участке, сопоставимом по размерам с постоянной длиной эквивалентного электрического кабеля (несколько сотен микрон), объединяя группу электрически связанных клеток в информационно - энергетический модуль.
Энергетический модуль, верхушечный рост
Короткий адрес: https://sciup.org/146116180
IDR: 146116180 | УДК: 577.3;
Текст научной статьи Гифальная единица роста Neurospora crassa как информационно-энергетический модуль
Благодаря наличию клеточной стенки грибы могут создавать и поддерживать высокое внутриклеточное давление. А то, что они выделяют на растущем кончике гифы новую стенку и переваривающие ферменты, позволяет им проходить насквозь твердые субстраты по каналам, образующимся в перевариваемом веществе. Многие грибы паразитируют на растениях и животных, однако наряду с этим они выполняют чрезвычайно важную в экологическом плане функцию редуцентов, так как выделяют ферменты (лигнин, пероксидазу и целлюлазу), переваривающие растительные остатки. Кроме того, многие растения вступают в симбиоз с мицелиальными грибами, образуя микоризы.
Основной механизм, с помощью которого нейроспора осваивает и использует ресурсы окружающей среды, – поляризованный верхушечный рост. Подобный механизм используют корневые волоски и пыльцевые трубки растений, прорастающие споры морских водорослей и другие организмы. Характерная черта такого роста – наличие у продольно ориентированной биологической структуры особой «верхушечной» зоны, где откладывается новая биомасса, продвигая «верхушку» все вперед и вперед. Рост и развитие определяются генетическими программами. Но как на языке генома сформулированы правила организованного поведения конкретных молекул и внутриклеточных структур?
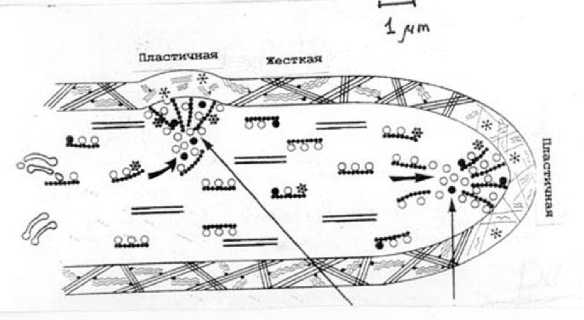
Рис. 1. Схема процессов в клеточной стенке грибной гифы при верхушечном роста и ветвлении
Гифа удлиняется за счет выстраивания клеточной стенки из полисахаридов, главным образом, из хитина и β -глюканов (рис. 1). Это явление впервые было описано более ста лет назад и подтверждено позже авторадиографическими исследованиями на микроскопическом уровне с использованием меченых тритием предшественников синтеза полисахаридов: N-ацетилглюкозамина и глюкозы, а также описанием эффекта «взрыва» верхушек растущей гифы под действием антибиотиков никомицина и эхинокандина, которые являются специфическими блокаторами синтезов соответственно хитина и глюкана [4]. На рис. 1 разнообразные микровезикулы (обозначены светлыми и темными кружками и звездочками) образуются в аппарате Гольджи и транспортируются к местам агрегации везикул либо в верхушке, либо в точке ветвления. Микровезикулы связаны либо с микрофиламентами (точечные линии), либо с микротрубочками (прямые линии). Пластичные участки стенки состоят из хитина (прямые линии) и глюкана (волнистые линии). В твердых участках стенки эти молекулы кристаллизуются благодаря ковалентным связям (обозначены темными точками) В местах боковых ветвлений размягчение стенки создается с помощью ферментов лизиса (обозначены звездочками).
Гифы Neurospora crassa активно осваивают поверхность субстрата путем верхушечного роста (ВР), удлиняясь на концах ветвей с высокой скоростью (20 – 40 мкм/мин при 24ºC). Удлиняющаяся гифа время от времени образует поперечные перегородки (септы), которые делят гифу на компартменты длиной 50 – 100 мкм, а также дает боковые ветви, каждая из которых в свою очередь удлиняется путем ВР, образует внутри септы и ветвится. [1, 5 – 7]. Все это создает при росте на плоской поверхности картину двумерного гифального дерева (рис. 2: справа интактная гифа; слева – верхушка изолирована от мицелия в точке, указанной стрелкой. Темные участки в начале роста – прирост в течение 10 мин непосредственно перед изоляцией. Следующий прирост зарегистрирован через 40 мин.). Характерной чертой гифального дерева является постоянство отношения суммарной длины всех ветвей к числу всех верхушек. Это отношение называется гифальной единицей роста (HGU [6; 8; 9]) и составляет для N. crassa около 350 мкм.
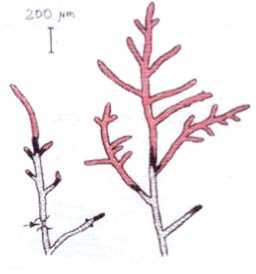
Рис. 2. Рост и развитие гифальных верхушек N. crassa
Верхушка растущей грибной гифы – не просто высокоструктурированное образование: в ходе роста все структуры находятся в непрерывной динамике, меняя место, интенсивность работы, связь с соседями. На кончике непрерывно выделяется клеточная стенка и ферменты, переваривающие окружающий субстрат. В этой области возникают химические и физические сигналы, управляющие ростом и развитием. Метаболическая активность, биофизические свойства, распределение органелл – все это градуально меняется вдоль оси от апикуса к более дистальным частям гифы. Ключевыми при этом являются структурно-функциональные градиенты на участке 100 – 300 мкм от апикуса. Рост грибной гифы можно сравнить с проталкиванием живого вещества вперед по туннелю, который сама же гифа себе и строит. Стенка этого туннеля состоит из хитина и должна выдерживать давление до 18 атмосфер.
К сожалению, до сих пор сохраняется аномальная ситуация, когда происходит чрезвычайно быстрое накопление молекулярно-биологических данных на фоне очень медленного развития представлений об организации активности конкретных молекул в клетке. Принципиальную трудность в исследовании системных межклеточных взаимодействий при ВР N. crassa представляет быстрая динамика событий и наличие хитиновой стенки, являющейся серьезным барьером для многих химических агентов на пути к плазматической мембране, а также трудно преодолимым механическим препятствием для стеклянных микроэлектродов. Тем не менее использование микроэлектродной техники позволило получить важные первичные данные о закономерностях кооперативных взаимодействий между клетками растущей гифальной верхушки.
Электрическая связь в гифах нейроспоры. Гифа N. crassa представляет собой ветвящиеся цепочки клеток длиной 50-100 мкм, которые электрически связаны друг с другом через септальные поры – каналы в межклеточных перегородках [10; 11].
Электрическая связь между живыми клетками распространена достаточно широко. Один из ее видов – передача электрических импульсов по нервным волокнам, а также в мышцах или сердце. Но между живыми клетками бывает и неимпульсная электрическая связь. Во многих тканях и органах, в развивающихся зародышах, в клеточных культурах соседние клетки сообщаются друг с другом посредством
Вестник ТвГУ, серия «Биология и экология», вып. 9, 2008 мельчайших канальцев, хорошо изолированных от наружной среды, но свободно пропускающих из клетки в клетку ионы и мелкие молекулы. Наличие между клетками таких канальцев легко обнаружить с помощью специальных флуоресцентных красителей или электрических измерений.
Электрическая связь между электроневозбудимыми клетками была открыта почти случайно в 1963 г. в лаборатории Вернера Левенштейна (W. R. Loewenstein, США) в ходе исследований свойств ядерной мембраны клеток слюной железы личинки дрозофилы с помощью двух микроэлектродов, через один из которых пропускались тестирующие импульсы электрического тока. При последовательном перемещении электродов из клетки в клетку оказалось, что импульсы регистрируются, когда электроды расположены в соседних клетках. Это открытие поколебало уверенность в том, что клетка является единицей жизни. Наличие прямого диффузионного обмена между клетками позволяет им, сохраняя индивидуальную неприкосновенность наследственных молекул, решать часть жизненных проблем, объединяя низкомолекулярные ресурсы и распределяя обязанности между соседями.
Межклеточные канальцы, по которым клетки свободно обмениваются ионами и мелкими молекулами, у разных организмов совсем не похожи друг на друга: у растений это плазмадесмы, у животных – щелевые контакты, у грибов – септальные поры. Однако электрические свойства всех многоклеточных систем, связанных внутри себя такими контактами, описываются одними и теми же кабельными уравнениями, разработанными когда-то для описания электрических процессов в телеграфных кабелях, проложенных по дну Мирового океана. Важная характеристика такого кабеля – пространственная константа, λ . Это расстояние вдоль кабеля, на котором приложенный в точке электрический потенциал затухает в «е» раз. Величина λ у нейроспоры составляет несколько сотен микрон, как и у многих других организмов [10; 11].
Все типы межклеточных канальцев, обеспечивающих электрическую связь, способны становиться непроницаемыми. И это очень важное свойство, так как при случайных повреждениях одной из клеток оно защищает соседей от катастрофических потерь ионов и мелких молекул. Как и у животных, проводимость межклеточных каналов у нейроспоры нарушается под действием сильной деполяризации или при механическом повреждении одной из клеток [10]. При изучении нарушений электрической связи в гифах нейроспоры обнаружено интересное явление. Если с помощью тонкой иголочки слегка повредить одну из клеток гриба, ее содержимое под давлением выбрасывается наружу и на месте бывшей клетки остается «тень»: пустое место внутри хитиновой стенки, общей с соседними клетками. Септальные поры по обе стороны «тени» мгновенно замыкаются, и электрическая связь в этом месте гифы прерывается. Однако через 15 – 20 мин из обеих септальных пор, примыкающих к «тени», появляются ростки, движущиеся навстречу друг другу, и через 1,5 – 2 ч электрическая связь на этом участке гифы полностью восстанавливается [12].
Какие именно задачи решают группы клеток, обобществившие свои низкомолекулярные ресурсы, исследовать довольно трудно по чисто техническим причинам. Сложно регистрировать в группе живых клеток одновременно динамику обмена через межклеточные каналы и функциональные характеристики отдельных клеток, составляющих связанную группу. Величина кабельной постоянной λ у всех многоклеточных объектов лежит в пределах от нескольких десятков до нескольких сотен микрон, т. е. электрическая связь эффективна для ограниченного количества клеток. Например, в гифах N. crassa, где длина клетки составляет 50 – 100 мкм, такая функционально связанная группа должна состоять из 4 – 6 клеток. Оказалось, что именно такое число клеток на верхушке растущей грибной гифы эффективно функционирует как единая группа, способная успешно решать задачу энергетической кооперации.
Идея передачи мощности от клетки к клетке посредством электрической связи родилась у В.П. Скулачева, директора научно-исследовательского института физикохимической биологии (НИИ ФХБ) им. А.Н. Белозерского МГУ.
Связь электрических свойств клеток N. crassa с энергетикой. В 1978 г. Нобелевский комитет удостоил премии английского биохимика Питера Митчелла (P. Mitchell), гениально предсказавшего возможность аккумулирования в живой клетке энергии в форме мембранного потенциала. Первые публикации Митчелла на эту тему появились еще в начале 1960-х гг., но были встречены научным миром с большим недоверием. Однако российские ученые физик Е.А. Либерман и биохимик В.П. Скулачев сразу поверили в идеи Митчелла. И не просто поверили, но приложили большие усилия для обоснования и развития его представлений о связи энергетики живой клетки с электрическими процессами в клеточных мембранах (см.: [13]).
Благодаря энтузиазму и настойчивости В.П. Скулачева, специалисты возглавляемого им НИИ ФХБ им. А.Н. Белозерского при МГУ и специалисты Института теоретической и экспериментальной биофизики (ИТЭБ) РАН, преодолев массу технических трудностей, продемонстрировали увеличение мембранных потенциалов клеток сине-зеленой водоросли за счет энергии света, которую захватывают в этих клетках фотосинтезирующие молекулы. Очень важно, что увеличение мембранного потенциала регистрировалось не только в месте локального освещения многоклеточного волокна водоросли, но и в его не освещенных участках. Таким образом была доказана принципиальная возможность передачи электрической мощности вдоль многоклеточной цепочки за счет электрической связи между клетками.
Во всех живых клетках ионный транспорт через плазматические мембраны – необходимое звено в поддержании ионно-осмотического гомеостаза, передаче информации, энергетическом обеспечении клеточного обмена веществ, накоплении субстратов и удалении продуктов распада. В стационарных условиях все ионные потоки уравновешены между собой и согласованы с энергетическим статусом клетки. Разные виды ионного транспорта, необходимые для выполнения определенных клеточных функций, осуществляются с помощью разнообразных внутримембранных белков: первичных ионных насосов (например, H+АТФаз, которые переносят через мембрану протоны за счет энергии АТФ), вторичных транспортеров (например, переносчиков сахаров и аминокислот, движущей силой для которых служит трансмембранный электрохимический градиент протонов), белков, формирующих ионные каналы в мембранах, и т. д. Благодаря активности таких белков через клеточные мембраны могут проходить значительные по величине и строго контролируемые ионные потоки (порядка 106 – 107 ионов/клетку в секунду), которые часто можно обнаружить в виде электрических токов величиной от нескольких пикоампер до нескольких наноампер на клетку. Представлениями о том, что H+-ATФаза грибных мембран работает как генератор трансмембранного электрического тока, мы обязаны исследованиям Клиффорда Слэймана (C.L. Slayman, Йельский университет, США) [14]. Основные принципы мембранного транспорта у грибов следуют хемиосмотической схеме Митчелла. Исследования на нейроспоре продемонстрировали силу хемиосмотической логики в освещении вопросов физиологии и энергетики клеточных мембран.
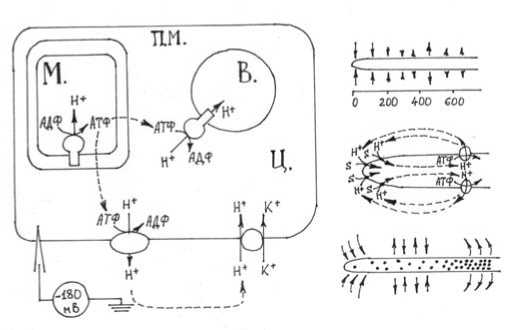
Рис. 3. Связь мембранных транспортных процессов у N. crassa с энергетикой
Слева : Роль протонных АТФаз у нейроспоры. Митохондрии (М) с помощью О2 расщепляют глюкозу и аккумулируют освободившийся при этом избыток энергии в молекулах АТФ. АТФ выходит в цитоплазму (Ц) и поддерживает работу протонных АТФаз в вакуолярных и клеточных мембранах (ПМ), благодаря которой протоны выкачиваются из цитоплазмы либо внутрь вакуолей (В), либо в наружную среду. Протоны возвращаются в цитоплазму из среды в ходе различных транспортных процессов, например, через транспортный белок, который обеспечивает накопление клеткой ионов калия.
Справа : Около концов растущих грибных гиф замечены циркулирующие продольные электрические токи, характер которых заставляет предполагать, что в самых молодых растущих клетках преимущественно активны вторичные транспортеры, а входящий через эти молекулы поток протонов возвращается в окружающую среду с помощью протонных насосов, расположенных на расстоянии нескольких клеток от растущей верхушки. Электрические токи входят в гифу в зоне верхушки и выходят дальше по стволу. Токи возникают из-за пространственного разделения протонных насосов и систем сопряженного с протоном транспорта аминокислот. Разделение в пространстве насосов (светлые кружки) и вторичных транспортеров (точки) не является совершенным, но в верхушке насосов меньше [15].
За счет высокой скорости срабатывания каждой молекулы протонного насоса и высокой концентрации этих молекул в мембране через мембрану грибной клетки переносится мощный поток протонов, что соответствует заметному электрическому току. Плотность АТФазных молекул в плазматических мембранах клеток нейроспоры составляет 2 – 3 х 1011 /см2, следовательно, для поддержания электрического тока величиной 10 микроА/см2 (соответствует переносу 6,2 х 1013 ионов /см2 х с) каждая молекула фермента (через которую при гидролизе 1 молекулы АТФ перекачивается 1 протон) должна работать со скоростью 200 – 300 оборотов / с. Этот электрический ток создает и поддерживает высокую трансмембранную разность потенциалов (в среднем – 180 мВ), которую можно зарегистрировать в эксперименте с помощью внутриклеточного микроэлектрода [14].
Специальные внутримембранные белки – вторичные транспортеры, пропуская внутрь клетки протоны по их электрохимическому градиенту, используют освобождающуюся при этом энергию для транспорта в клетку против градиента концентраций молекул субстрата (аминокислоты, сахара, нуклеотида) или ионов (калия, фосфата и др.). При высокой концентрации белков-транспортеров и высокой скорости оборота каждой такой молекулы их суммарная активность создает электрический ток, обратный насосному и сравнимый с ним по величине.
В электрофизиологических экспериментах с использованием внутриклеточных микроэлектродов оказалось, что верхушечные клетки нейроспоры поддерживают высокие значения мембранного потенциала только при наличии электрической связи с более взрослыми клетками. При этом межклеточный ток в гифальной верхушке вовсе не составляет часть обычного насосного тока, а практически равен ему [11; 16; 17].
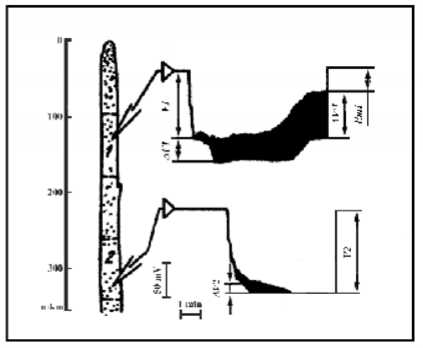
Рис. 4. Схема микроэлектродных измерений в апикальной части гифы
Представлены результаты измерений на интактной гифе с помощью стеклянных микроэлектродов мембранных потенциалов и входных сопротивлений 2-й и 4-й клеток от верхушки, а также электрической связи между ними и спонтанного нарушения этой связи с соответствующими изменениями мембранных потенциалов и входных сопротивлений (об этом подробнее см.: [11, 16. 17]). Вертикальная шкала слева – расстояние от растущей верхушки.
Единая энергетическая система группы клеток. В 1970-х гг. сотрудниками Пущинского Института биофизики РАН К.Б. Асланиди и А.Н. Панфиловым была разработана оригинальная математическая модель, связывающая энергетику и ионноосмотический гомеостаз животной клетки [18]. В модели мембранный потенциал присутствует как гомеостазируемый параметр, т. е.учитывается тот факт, что при ухудшении энергообеспечения клетки в последнюю очередь снимается энергообеспечение ионных насосов плазматических мембран, так как у них константа связывания с АТФ ниже, чем у конкурентных внутриклеточных потребителей энергии. Анализ модели привел к выводу, что если часть электрически связанных клеток окажется неспособной поддерживать свой ионный гомеостаз, то их «проблемы» могут быть решены соседними клетками, которым, однако, придется тратить на «помощь соседям» собственные ресурсы АТФ. На первых порах идея подобной энергетической кооперации с большим трудом утверждалась в среде специалистов. Выводы, сделанные на основе моделирования, подтвердились в экспериментах на культивируемых клетках млекопитающих [19].
В результате экспериментальных исследований, проведенных объединенными усилиями специалистов НИИФХБ им. А.Н. Белозерского МГУ, Пущинского ИТЭБ РАН и Ленинградского Института цитологии РАН, оказалось, что в популяции клеток, во многих (до половины!) из которых полностью блокированы ионные насосы ( Na+ ,K+-ATФазы), могут длительное время устойчиво поддерживаться в пределах нормы такие существенные показатели ионно-осмотического гомеостаза, как мембранные потенциалы и внутриклеточное содержание ионов Na+ и K+. Необходимым условием поддержания этих показателей служит наличие между клетками каналов, пропускающих значительные ионные потоки. Межклеточные взаимодействия в такой ситуации носят характер энергетической кооперации между клетками, при которой 200
«экспорт» энергии из клеток с активными насосами сопоставим с суммарным клеточным энергопроизводством.
Особое значение имеет тот факт, что во всей популяции, представляющей собой сообщество клеток с активными и неактивными ионными насосами, поддерживаются не среднеарифметические значения между параметрами активных и неактивных клеток, а именно значения, присущие активным клеткам. Это свойство получило название «эффекта лидера». Очевидно, что клетки-«лидеры» становятся при этом донорами энергии для соседних клеток, так как их энергозатраты на работу ионных насосов заведомо превышают расход на поддержание транспортных потоков через собственную плазматическую мембрану. Основной задачей этих клеток будет поддержание межклеточных ионных потоков, обеспечивающих нормальную жизнедеятельность соседей. Сдвиг параметров ионно-осмотического гомеостаза происходит только после того, как исчерпываются резервы увеличения мощности насосов.
В рамках изложенных выше представлений понятен смысл отсутствия ионных насосов в гифальной верхушке нейроспоры. В любой клетке ресурсы ATФ расходуются примерно поровну тремя типами потребителей: механизмами биосинтезов, цитоскелетными механизмами, механизмами мембранного транспорта. Распределение ресурсов происходит на конкурентной основе, причем у ионных насосов плазматических мембран, как правило, есть большое преимущество перед конкурентами, а именно самая низкая константа связывания с ATФ. В отличие от биосинтеза и активности цитоскелетных структур, которые потребляют непосредственно АТФ, работа систем транспорта субстратов поддерживается электрохимической разностью потенциалов через мембрану, генераторы которой (в случае нейроспоры это протонные насосы) могут располагаться на расстоянии нескольких сотен микрон от зоны транспорта. Это означает, что на работу транспортных белков можно в принципе расходовать ресурсы ATФ не той клетки, через мембрану которой идет поток субстратов, а нескольких соседних клеток на расстоянии, сопоставимом с величиной кабельной постоянной λ . То есть в гифах N. crassa более взрослые клетки могут давать энергетическую «субсидию» более молодым, растущим. Таков в общих чертах смысл энергетической кооперации при росте гифы [20; 21].
Математические модели гифальной верхушки. Эксперименты с мини-деревом. Принимая во внимание, что в плазматических мембранах N. crassa активно работают протонные насосы, которые поддерживают высокий уровень мембранного потенциала и таким образом обеспечивают энергией работу вторичных транспортных систем плазматических мембран, верхушечная часть гифы может быть представлена как «полубесконечный» (т. е. электрически замкнутый на одном конце) электрический кабель с неоднородным распределением источников тока – протонных насосов плазматических мембран. В такой системе через септальные поры между верхушечными клетками гифы, лишенными протонных насосов, и более взрослыми клетками с нормально функционирующими насосами должен распространяться электрический ток, что подтверждается в эксперименте.
Оригинальное теоретическое решение было получено В.В. Смоляниновым (ИМАШ РАН) для математического описания электрической гетерогенности гифальной верхушки на базе наиболее простой модели распределения источников тока, представленной смещенной функцией Хевисайда [22]. Эта функция постоянного скачка имеет только один подгоночный параметр – величину смещения постоянной плотности тока относительно верхушки гифы. Оказалось, что такой упрощенный подход хорошо согласуется с экспериментальными данными. Именно в этом варианте был получен простой критерий оценки критической длины апикального сегмента, на которой плотность источника тока равна нулю: эта длина оказалась равной примерно половине λ.
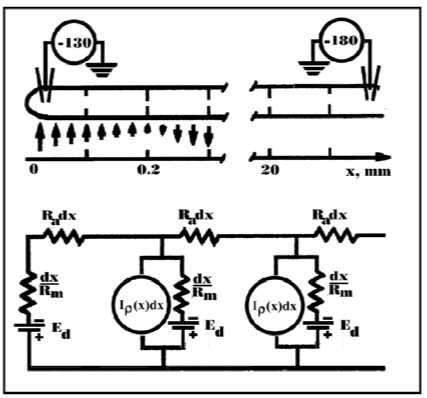
Рис. 5. Рассмотрение электрических свойств верхушки гифы в представлениях кабельной теории
Вверху – схема микроэлектродных измерений мембранного потенциала. Стрелки указывают направление пересекающих мембрану электрических токов, которые создаются благодаря разности потенциалов между апикальной и дистальной частями гифы. Горизонтальная шкала – расстояние от верхушки гифы.
Внизу - эквивалентная электрическая схема апикальной части гифы.
В НИИФХБ им. А.Н.Белозерского МГУ была проведена целая серия исследований на оригинальной экспериментальной модели гифального мини-дерева (см. рис. 2). В ходе экспериментов тонкой иголочкой повреждали одну из клеток гифы, вызывая электрическую изоляцию ее верхушки от материнской гифы на заданном расстоянии. Оказалось, что группа верхушечных клеток размером меньше λ после такой операции прекращает рост и восстанавливает его лишь через 30 – 40 мин, не сохранив предыдущую полярность. Верхушечная группа из 4 – 6 клеток оказалась минимальной ростовой единицей мицелия: при изоляции от мицелия такой фрагмент (длиной 300 – 400 мкм) продолжает рост (хотя и с меньшей скоростью) и развивается со временем в нормальное гифальное дерево. Группы клеток размером больше λ также продолжают рост в прежнем направлении. При этом скорость тем выше, чем длиннее изолированный верхушечный фрагмент [23].
По математическим расчетам для эквивалентного электрического кабеля при изменении его длины в диапазоне от 400 до 1000 мкм должна расти плотность электрического тока через лишенный источников энергии конец кабеля длиной 200 мкм. Для реальной гифы это означает, что при увеличении длины изолированного фрагмента увеличивается число активных протонных насосов, работающих на одну и ту же нагрузку (верхушечные 200 мкм), достигая насыщения при длине 1000 мкм. Если интенсивность входящего через плазматическую мембрану N. crassa электрического тока отражает интенсивность поступления субстратов из внешней среды, а скорость роста зависит напрямую от поступления субстратов из внешней среды через мембрану в зоне растяжения верхушки, увеличение скорости роста при увеличении длины фрагмента выглядит вполне естественно. Однако в экспериментах скорость роста отнюдь не достигала предела при длине 1000 мкм: она была вполовину ниже нормальной, свойственной целой гифе.
Более того, в математической модели при имитации с помощью компьютера ситуации с увеличением длины фрагмента плотность тока через верхушечный участок возрастала во много раз сильнее, чем скорость роста. Пришлось предположить, что «специализация» верхушечных мембран по транспорту субстратов из свежей среды, не только призвана «обслуживать» рост, но и нацелена на перенос субстратов в дистальные клетки гифы для запасания впрок. Это вносит некоторые коррективы в трактовку содержания энергетической кооперации. Вместо трогательной «заботы» взрослых о молодежи, это явление стало больше походить на «эксплуатацию детского труда».
Хемиосмотическая логика Митчелла постулирует универсальный характер использования живой клеткой электрических кабельных свойств для разделения в пространстве молекулярных и ионных процессов, связанных с извлечением энергии из внешних или внутренних источников и дальнейшим их использованием. В многоклеточных системах возможна энергетическая кооперация между клетками, которая заключается в разделении труда по генерации мембранного потенциала одними клетками и использования энергии трансмембранного электрохимического градиента тех или иных ионов соседними. Принципиально важно то, что электрическая связь между клетками вовсе не служит механизмом усреднения ионных концентраций и мембранных потенциалов в группе клеток. Законы поддержания ионно-осмотического гомеостаза таковы, что, пока хватает энергоресурсов, клетка-генератор будет увеличивать обороты своих ионных насосов, невзирая на то что тратит колоссальные количества АТФ на поддержание не только своего собственного ионного баланса, но и членов своей группы.
Пока не удается связать в стройную систему строгие количественные представления об электрических кабельных свойствах растущей верхушки гифы с морфологическими характеристиками роста (постоянство отношения суммарной длины ветвей к числу верхушек, иерархия скоростей у ветвей разного порядка и т. д.). Интересные перспективы открывает новый подход: объединение усилий специалистов по сложным техническим системам и биологов (см.: [4; 24]). Первые из них полагают, что по количеству запрограммированных деталей биологические системы не сложнее чем например, современный авиалайнер, и предлагают использовать известные в технике принципы управления для анализа взаимодействий между деталями биологических систем. Совместные группы техников и биологов уже добились определенных успехов. Можно попытаться применить такой подход и к анализу электрической гетерогенности гифальной верхушки нейроспоры.
Где и как записаны в геноме законы, в соответствии с которыми молекулы и внутриклеточные структуры в процессе поляризованного верхушечного роста неуклонно располагаются в определенном порядке внутри трубки с жесткими стенками и стабильным диаметром? Где и как установлен порядок ветвления, создающий форму гифального дерева с постоянным соотношением между суммарной длиной ветвей и числом верхушек? И почему это соотношение равно величине минимального ростового модуля и сопоставимо с кабельной постоянной? Где и как заложена программа, освобождающая вновь образующиеся клетки от обязанности генерировать мембранный потенциал и связанная с этим сильная электрическая поляризация гифальной верхушки? Вероятно, на эти вопросы со временем ответит компьютерная биология, переживающая сегодня бурное развитие.
Человечество не так давно научилось использовать электричество для своих нужд. Представления, которые вошли в современную биологию благодаря Митчеллу и его сторонникам, свидетельствуют, что системы живых организмов освоили электричество гораздо раньше человека.
Растущая верхушка грибной гифы – уникальное образование, в котором разделение между соседними клетками функций генерации мембранных потенциалов и потребления мощности для накопления субстратов создает чрезвычайно сильную (по клеточным масштабам) электрическую поляризацию на участке, сопоставимом по размерам с постоянной длины эквивалентного электрического кабеля (несколько сотен микрон), объединяя группу электрически связанных клеток в единый информационно – энергетический модуль.
The filamentous fungus Neurospora crassa is a popular experimental model organism. The defining characteristic of filamentous fungi is the development of hyphae, tipgrowing tubular branching structure. Tip growth of N. crassa has been studied intensively for over some ten years. It is clear now that the tip-growing hyphae can use the byosynthetic resources of many tens and hundreds of microns of hyphal trunk to drive forward the apex. Cell-wall biosynthesis and cell extension are located at the apical region and the membrane and enzymes required to expend the apex are packaged in microvesicles that are then translocated through the hypha to apex via actin microfilaments and microtubules. Electrophysiological studies of N. crassa indicate a number of membrane polarization and electrical currents at the growing apex. Some theories based on the mathematical modelling and computer simulation approaches attempt to account for the various aspects of tip growth. The genome sequence of N. crassa was recently reported. Thus, the next few years should clarify this problem and integrate the whole basis of physilogical, cytological and molecular biology details into a generally accepted picture of hyphal tip growth .


