Гигантская гастроинтестинальная стромальная опухоль желудка
Автор: Фдоров Н.М., Франк Е.М., Емельянова О.Ю.
Журнал: Тюменский медицинский журнал @tmjournal
Рубрика: Обмен опытом
Статья в выпуске: 1 (86) т.25, 2023 года.
Бесплатный доступ
В статье рассматриваются особенности клинического случая лечения гигантской гастроинтестинальной стромальной опухоли (ГИСО) желудка, вопросы этиологии, место в общей структуре онкологической заболеваемости и специфика лечения данной патологии. В статье приводятся клинический пример.
Гастроинтестинальный стромальные опухоли, опухоль желудка, хирургическое лечение, иматиниб
Короткий адрес: https://sciup.org/140303391
IDR: 140303391
Текст научной статьи Гигантская гастроинтестинальная стромальная опухоль желудка
Частота развития данной патологии несколько выше у мужчин. Средний возраст составляет от 60 до 65 лет с вариабельным диапазоном [1]. ГИСО ЖКТ обычно представлены в виде резко очерченной подслизистой или подсерозной массы. В 70% случаев цитоморфологическая картина представлена веретенообразной, в 20% – эпителиоидной, в 10% – смешанной структурой [8]. В отечественной литературе описаны следующие варианты гистологических структур ГИСО: пучковые, альвеолярные, палисадообразные, диффузные, в виде клеточных гнезд, трабекулярные, миксоидные и ряд других [9]. Примерно у 30% ГИСО развиваются метастазы. Чаще всего метастазы локализуются в печени – 65%, по брюшине – 21% и значительно реже в костях, легких и лимфатических узлах [10].
Как правило, заболевание носит спорадический характер. До 85% ГИСО имеют мутации в гене KIT и 3-18% в гене PDGFRA, в 10% случаев выявлены активирующие мутации BRAF, RAS, SDH, NF1 и другие [4]. Примерно 5% ГИСО включены в такие генетические синдромы как: синдром Карни-Стратакиса, триада Карнея, нейрофиброматоз 1-го типа, первичный семейный синдром ГИСО. Стоит отметить, что по гистологическим, фенотипическим и имму-номорфологическим признакам спорадические случаи и случаи вышеуказанных синдромов не отличаются [3, 11].
Основанный на морфологии диагноз с ИГХ тестированием в сочетании с генетической оценкой молекулярных маркеров в настоящее время считается золотым стандартом для диагностики ГИСО. Данные методы исследования помогают различать геномные подтипы опухоли, имеющие решающее значение для прогноза и терапии [8]. Существует несколько белков, проявляющих различную чувствительность и специфичность при диагностике ГИСО. Наиболее важными ИГХ маркерами ГИСО являются белки гена c-kit и аноктамин 1.
Базовым специфическим диагностическим критерием ГИСО является экспрессированный KIT белок CD117, представляющий собой трансмембранную рецепторную тирозинкиназу [5, 6], до выявления которого, CD34 – антиген гемопоэтических клеток-предшественников, считался лучшим маркером, но имел низкую чувствительность и специфичность в отношении ГИСО. Повышение экспрессии СD117 является результатом активирующих мутаций в генах KIT и PDGFRA [5]. По данным исследований, примерно 95% ГИСО экспрессируют CD117. Кроме того, такие опухоли как лейомиомы, лейомиосаркомы и шванномы были почти повсеместно отрицательными для CD117, что указывает на то, что данный маркер является высокочувствительным и специфичным маркером для ГИСО. Однако иногда он может экспрессироваться в других опухолях, таких как меланомы, аденоиднокистозный рак, карциномы клеток Меркеля, саркомы Капоши, липосаркомы или даже лейомиосаркомы. В 2004 году был обнаружен новый маркер – аноктамин 1, также известный под названием DOG1. С точки зрения структуры это трансмембранный белок, выполняющий функцию кальций зависимого хлоридного канала [9]. DOG1 считается чувствительным и специфичным маркером ГИСО независимо от экспрессии CD117 и не зависит от статуса мутации KIT или альфа рецептора тромбоцитарного фактора роста (PDGFRΑ). Было обнаружено, что DOG1 экспрессируется в 136 из 139 (97,8%) оцениваемых ГИСО [12]. Другими маркерами, которые помогают иммунофенотипировать и дифференцировать ГИСО от других опухолей желудочно-кишечного тракта мезенхимального происхождения, являются, S-100 протеин, гладкомышечный актин (SMA) и десмин [13].
Молекулярно-генетическое исследование на наличие мутаций в генах с-KIT (экзоны 9,11,13,17) и PDGFRΑ (экзоны 12,14,18), может подтвердить диагноз ГИСО, если он сомнителен (особенно у редких CD117 / DOG1 ИГХ отрицательных ГИСО). Анализ мутационного статуса имеет прогностическую ценность для определения чувствительности к молекулярно-таргетной терапии, а также предиктивное значение [1, 4].
Согласно рекомендациям Российского общества клинической онкологии 2020 г. [4] выделяют четыре прогностические группы ГИСО – высокий, промежуточный, низкий и очень низкий риск рецидива по данным значения частоты митоза, размера и локализации опухоли. Мутационный статус также обладает прогностическим значением: пациенты с точечными мутациями, дупликациями в 11 экзоне гена KIT и гене PDGFRA (кроме D842V) лучше отвечают на лечение и обладают благоприятным прогнозом. Стоит отметить, что разрыв опухоли является дополнительным неблагоприятным прогностическим фактором и должен быть зарегистрирован, независимо от того, произошло ли это до или во время операции [1, 14].
Основным методом достижения ремиссии локализованных и местно-распространенных ГИСО является хирургическое лечение [4]. Идентификация основного патогенетического механизма, ответственного за развитие ГИСО,- гиперактивации c-KIT рецептора, а также результаты предклинических исследований послужили основанием для клинического изучения эффективности препарата STI-571 (иматиниб) при данном заболевании. Иматиниб избирательно ингибирует определенные тиро-зинкиназы, включая KIT, PDGFRα и другие. Конкурируя с АТФ за АТФ-связывающий домен рецептора с-KIT, пре- парат предотвращает фосфорилирование тирозиновых остатков внутриклеточных белков, тем самым, блокируя передачу сигнала к ядру клетки [13, 15]. До создания иматиниба 5-летняя выживаемость радикально оперированных больных варьировала от 42 до 54%, при субрадикальной операции – 9% [6]. Результаты первого успешного опыта применения иматиниба, который ранее использовался в лечении пациентов с хроническим миелоидным лейкозом как ингибитор тирозинкиназной активности гена BCR-ABL, в качестве монотерапии ГИСО были опубликованы в 2001 году и показали чрезвычайно высокую эффективность данного препарата. На сегодняшний день по данным Российского общества клинической онкологии 2021 г. при промежуточном и высоком риске прогрессирования показана адъювантная терапия имати-нибом в течение 3 лет. У пациентов, у которых заболевание рецидивировало, рецидив был в течение 2 лет после прекращения терапии иматинибом [14, 16].
Успех адъювантоной терапии иматинибом в лечении ГИСО вызвал интерес к его периоперационной эффективности при сомнительной резектабельности опухоли и местно-распространенном процессе. По данным обзора литературы Jens Jakob, Peter Hohenberger [17] предоперационное лечение иматинибом является обоснованием для достижения девитализации и уменьшения размеров опухоли при местнораспространенном ГИСО. Неоадъювантная терапия иматинибом обеспечивает менее инвазивную и органосохраняющую операцию, предотвращает разрыв опухоли во время обширных резекционных процедур и улучшает качество периоперационного лечения. Данное лечение безопасно и эффективно, если проводится в течение 6-12 месяцев. Прогрессирование заболевания во время предоперационного лечения было редким событием, и частичный ответ был достигнут у 40-80% всех пациентов [15, 17].
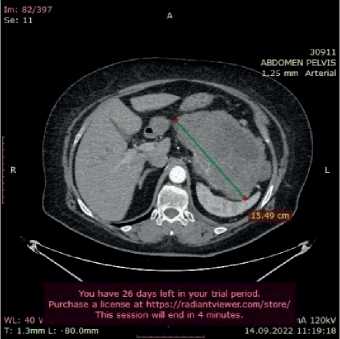
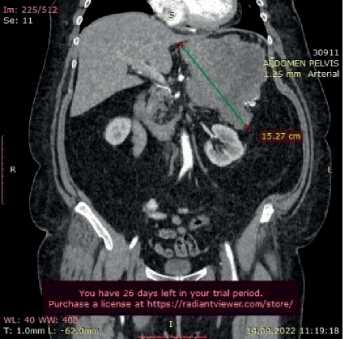
Рисунок 1 – Клиническое наблюдение
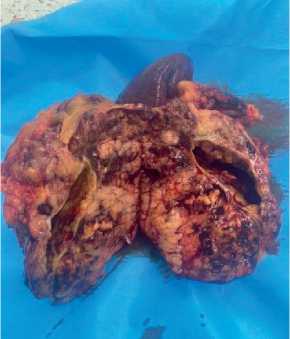
стохимического исследования отмечается экспрессия опухолевыми клетками маркеров: CD117, DOG1, SMA. Индекс пролиферативной активности Ki67-3%.
Список литературы Гигантская гастроинтестинальная стромальная опухоль желудка
- Gastrointestinal stromal tumours: Еsmo-euracan-genturis Clinical Practice Guideline for diagnosis, treatment and follow-up // ESMO URL: https://www.esmo.org/guidelines/guidelines-by-topic/sarcoma-and-gist/gastrointestinal-stromaltumours.
- Чарышкин А. Л. и др. Хирургическое лечение гигантской гастроинтестинальной стромальной опухоли кардиального отдела желудка. Вестник хирургии имени И. И. Грекова. 2019; 178 (4): С. 61-63.
- Gheorghe G. et al. Gastrointestinal Stromal Tumors – A Mini Review. // Journal of Personalized Medicine. 2021; 11 (8): р. 694.
- Гастроинтестинальные стромальные опухоли. Клинические рекомендации М.: ОНС «Ассоциация онкологов России».2020.
- Мазуренко Н. Н. и др. Молекулярная гетерогенность и анализ отдаленной выживаемости пациентов с гастроинтестинальными стромальными опухолями. //Успехи молекулярной онкологи 2022. № 9 (2): С. 43-57.
- Гарин А. М. Базин И. С. Справочник по лекарственной терапии солидных опухолей. М.: «ЛЕКСРУС», 2015. 529 с.
- Михеева Е. Г. Изучение роли fgfr-сигнального пути в патогенезе гастроинтестинальных стромальных опухолей: дис. канд. мед. наук: Казань, 2021. 132 с.
- The GIST of Advances in Treatment of Advanced Gastrointestinal Stromal Tumor // American Society of Clinical Oncology Educational Book URL: https://ascopubs.org/doi/10.1200/EDBK_351231?url_ver = Z39.882003&rfr_id = ori: rid: crossref.org&rfr_dat = cr_pub%3dpubmed&expanded = undefined
- Халиков Д. Д., Ахметзянов Ф. Ш., Петров С. В. Клинико-морфологическая характеристика гастроинтестинальных стромальных опухолей. //Архив патологии. 2017. 79 (4): 48-55.
- Polyanskiy M. B. et al. Gastrointestinal stromal tumors in elderly patients // Научные результаты биомедицинских исследований. 2022. № 8 (1). С. 91-105.
- Заболеваемость и смертность от злокачественных новообразований в Тюменской области в 2008-2018 гг. Коллективная монография / Под редакцией Н. М. Фёдорова, П. Б. Зотова. Тюмень: Вектор Бук, 2021. 163 с.
- Clinical Diagnosis of Gastrointestinal Stromal Tumor (GIST): From the Molecular Genetic Point of View // National Library of Medicine URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6563074/
- Гастроинтестинальные стромальные опухоли: новая нозологическая единица и современные возможности лечения // Интернет-портал российского общества клинической онкологии URL: https://rosoncoweb.ru/library/congress/ru/07/13.php.
- Никулин М. П. и др. Практические рекомендации по лекарственному лечению гастроинтестинальных стромальных опухолей. Злокачественные опухоли: Практические рекомендации RUSSCO #3s2, 2021 том 11. 29.
- Gastrointestinal stromal tumours: advances in surgical and pharmacological management options // National Library of Medicine URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6006032.
- Efficacy and Tolerability of 5-Year Adjuvant Imatinib Treatment
- for Patients With Resected Intermediate- or High-Risk Primary Gastrointestinal Stromal Tumor // National Library of Medicine URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6440723.
- Neoadjuvant Therapy to Downstage the Extent of Resection of Gastrointestinal Stromal Tumors // National Library of Medicine URL: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6257203.


