Гигиенические требования в отношении безопасности для населения канцерогенных факторов биологической природы (обзор)
Автор: Чехомов С.Ю., Елисеев Ю.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Гигиена
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Цель: идентифицировать основные триггерные механизмы канцерогенных факторов биологической природы и разработать на их основе профилактические мероприятия по предупреждению развития онкозаболеваемости населения. Методика написания обзора. Проанализировано 50 научных работ, размещенных в базах данных Web of Science, Scopus, PubMed, CyberLeninka, eLibrary.ru. Электронный поиск проводили с использованием комбинации ключевых слов: «carcinogenic factors of biological nature», «viruses», «bacteria», «trematodes», «preventive work», «sanitary service», «oncological morbidity». Глубина поиска в электронных базах данных и списках цитирований составила более чем 10-летний период с 2013 до середины 2024 г.
Канцерогенные факторы биологической природы, вирусы, бактерии, трематоды, онкологическая заболеваемость
Короткий адрес: https://sciup.org/149146945
IDR: 149146945 | УДК: 614.3/.7(470+571) | DOI: 10.15275/ssmj2003301
Текст обзорной статьи Гигиенические требования в отношении безопасности для населения канцерогенных факторов биологической природы (обзор)
EDN: MSRCYX
количество возрастет до 35 млн [3, 4]. Негативная тенденция ежегодной регистрации ЗНО до 600 тыс. новых случаев в год отмечается и на территории Российской Федерации [5, 6]. При этом кумулятивный риск заболеть раком (в результате комбинированного воздействия нескольких агентов-стрессоров) составляет 23%, то есть почти у каждого пятого россиянина ежегодно может появиться злокачественная опухоль (ЗО) [7]. Вместе с этим, по данным экспертов МАИР, только одно прекращение контактов человека с канцерогенами приводит к снижению на 70% заболеваемости людей от ЗНО [6]. Учитывая вероятность зарождения у человека ЗНО под влиянием канцерогенных факторов, для обеспечения безопасности жизнедеятельности населения санитарно-гигиенической службе на государственном уровне необходимо организовать разъяснительную профилактическую работу.
Цель представленного обзора — идентифицировать основные триггерные механизмы канцерогенных факторов биологической природы и разработать на их основе профилактические мероприятия
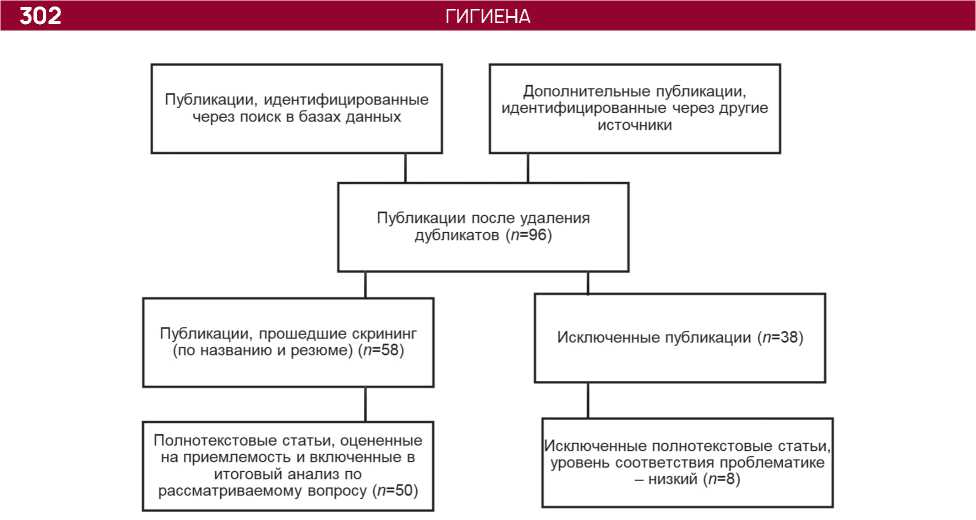
Рис. 1. Блок-схема дизайна систематического обзора по PRISMA
по предупреждению развития онкозаболеваемости населения.
Методика написания обзора. Проанализировано 158 научных работ, размещенных в базах данных Web of Science, Scopus, PubMed, CyberLeninka, eLibrary.ru. Электронный поиск проводили с использованием комбинации ключевых слов: «carcinogenic factors of biological nature», «viruses», «bacteria», «trematodes», «preventive work», «sanitary service», «oncological morbidity». Поисковый запрос был определен с помощью стратегии интерактивного поиска, основанного на использовании релевантной выборки достоверных данных аналитических исследований. Глубина поиска в электронных базах данных и списках цитирований составила более чем 10-летний период с 2013 до середины 2024 г. Критериями включения в обзор явились работы, освещающие в качестве канцерогенных факторов биологической природы только объекты, признанные по данным экспертов МАИР. Критериями невключения в обзор были работы, не относящееся по проблематике к биологическим факторам, представляющим канцерогенную опасность для населения объектов окружающей среды, а также изданные ранее 2013 г. Отбор источников осуществлялся в соответствии с критериями PRISMA (Preferred reporting items for systematic reviews and meta-analyses — «Предпочтительные элементы отчетности для систематических обзоров и метаанализов»; рис. 1).
Вирусы. Основными этиологическими агентами опухолевых новообразований человека среди биологических канцерогенных факторов являются вирусы. Так, среди биологических канцерогенных факторов раздела СанПиН 1.2.3685–21 наиболее широко представлены вирусы, к которым относятся: вирусы гепатитов B, C (HСV — hepatitis С virus, HВV — hepatitis В virus), папилломы человека (ВПЧ), Эпштейна — Барр (ВЭБ), герпес-вирус, Т-лимфотропный вирус (human T-lymphotropic virus, HTLV), иммунодефицита человека 1-го типа (human immunodeficiency virus, ВИЧ, HIV). Согласно современным данным, представленные в санитарном стандарте вирусы являются этиологическими агентами приблизительно 15% опухолевых новообразований человека [8], а сами биологические канцерогенные факторы за счет инфекционного генеза обусловливают развитие до 18% ЗНО [9].
HСV, относящиеся к экзогенным онкогенным вирусам, не только вызывают острые гепатиты, переходящие в хронические, но и являются причиной развития рака печени. Для развития воспалительного процесса, переходящего в хроническую инфекцию, необходимы: высокий уровень вирусемии, расстройство системы гемостаза, развитие острой печеночной недостаточности. Общепризнано, что хронические вирусные инфекции, вызванные вирусами HСV и HВV, остаются доминирующими факторами риска в развитии гепатоцеллюлярной карциномы (ГЦК). По имеющимся данным, только на хроническую инфекцию, вызванную HBV, приходится более 50% случаев заболеваемости ГЦК. В 2019 г. от HВV умерли примерно 820 тыс. человек, главным образом в результате цирроза печени и ГЦК. Наличие HВV в организме человека также повышает риск развития любого вида рака, но особенно неходжкинских лимфом и рака щитовидной железы в два раза, а ГЦК — в 2,5 раза [11, 12].
Вирус папилломы человека. Является причиной развития онкозаболеваний, прежде всего женской половой сферы (цервикально-интраэпителиальной неоплазмы, рака шейки матки), а также редкого заболевания кожи — дисплазии Левандовского. При этом на долю ЗО, ассоциированных с ВПЧ, приходится 5% от структуры всех видов рака, 75% из них локализованы в половой сфере и 25% — вне ее. К последним относятся следующие заболевания: орофарингеальный рак, затрагивающий полость рта, язык и глотку, рак гортани, а также ЗО анального канала и рак полового члена. Однако не все типы штаммов ВПЧ могут относиться к биологическим канцерогенным факторам, а только разновидности, принадлежащие к так называемым типам высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68. Среди них максимальной онкогенной активностью обладают ВПЧ 16-го и 18-го типов, в 95% случаев вызывающие ЗО шейки матки [12–14].
Вирус Эпштейна — Барр. Одно из самых распространенных человеческих вирусов, в результате чего относится и к крайне значимым с точки зрения биологических канцерогенных факторов. Широкое распространение ВЭБ в окружающей среде и, как следствие, инфицирование последним человека, чаще всего приводит к развитию неонкологического инфекционного мононуклеоза. Однако ВЭБ может спровоцировать и онкологические заболевания: рак носоглотки (назофарингеальную карциному), лимфоэпителиальноподобные карциномы, поражающие желудок, пищевод, миндалины, слюнные железы, тимус и другие, а также различные лимфомы, в том числе ЗО В-клеточных лимфоцитов, развивающуюся в лимфатической системе и кроветворных органах, так называемую лимфому Беркитта [15–17].
Герпес-вирус , находящийся в функционально активном состоянии при длительной персистенции в клетках организма человека, создает оптимальные условия для запуска и продвижения факторов возникновения ЗНО. В патогенезе развития опухолей, обусловленных наличием вируса герпеса, значительную роль играют иммунные, гормональные и генетические факторы дисбаланса гомеостаза организма человека. Так, клетками-мишенями для вируса герпеса оказались В-лимфоциты человека. При этом инфицирование иммунных клеток герпесвирусом вызывает резкое увеличение уровня роста хромосомных аберраций, с транслокацией участков хромосом, что свидетельствует о наличии канцерогенной опасности [18]. Электронно-микроскопическими исследованиями удалось доказать связь между наличием герпесвирусной инфекции и развитием ряда опухолей человека: рака шейки матки, назофарингеального рака, лимфомы Беркитта. Стало также известно, что ЗО вызывает в основном вирус герпеса человека 8-го типа, а их развитие происходит на фоне наличия тяжелого иммунодефицита. Так, последнее обусловливает развитие саркомы Капо-ши — ЗО легких у больных, страдающих состоянием иммунодефицита человека [8, 19].
Т-лимфотропный вирус человека. Представитель рода дельта-ретровирусов ( Deltaretrovirus ). HTLV-1 является Т-лимфотропным вирусом человека 1-го типа, способным вызывать через несколько десятилетий после заражения редкие виды рака — Т-клеточный лейкоз и Т-клеточную лимфому, развивающиеся примерно у 5% инфицированных. Патогенез развития рака связан с внедрением вируса HTLV-1 в Т-клетки, перестраивающиеся, вопреки логике, на продукцию белков, усиливающих пролиферацию вируса и осуществляющих блокировку защитных, преимущественно CD4+- и CD25+-Т-регуляторных иммунных клеток, что в итоге и обусловливает иммуносупрессию, благоприятствующую развитию злокачественного перерождения клеток [20].
Вирус иммунодефицита человека. Относится к одному из двух похожих типов ретровирусов (ВИЧ-1 и ВИЧ-2). Оба представителя ВИЧ ослабляют Т-клеточный иммунитет, не обладая геномной онкогенной активностью, они встраивают участок вирусной ДНК в геном организма инфицированного, разрушают СD4+-лимфоциты, способствуют развитию опасных оппортунистических инфекций и впоследствии ведут к риску роста раковых образований. При этом тип ВИЧ-1 является не только повсеместно распространенным, но и обладает большей вирулентностью и инфекционной патогенностью. Вместе с тем ВИЧ-инфицированные больные, по сравнению с общей популяцией пациентов, имеют более высокий уровень онкозаболеваемости, а также показатели смертности [21].
В настоящее время в связи с высокой частотой встречаемости у больных СПИДом ряда онкологических заболеваний (саркомы Капоши, лимфомы и рака шейки матки) данные заболевания носят название СПИД-ассоциированные онкологические заболевания. У ВИЧ-инфицированных с большой вероятностью могут развиться и другие вида рака: легких, ротовой полости, анального канала, яичек, кожи (включая плоскоклеточную карциному и злокачественную меланому) [22].
Трематоды. На основании эпидемиологических исследований, проведенных МАИР ВОЗ в ЮгоВосточной Азии, показана связь между инвазией Opisthorchis viverrini и Clonorchis sinensis с холанги-окарциномой (ХК), позволившая включить данные печеночные трематоды в реестр биологических канцерогенов. Трематоды ( trematoda — сосальщики, имеющие присоски) — подкласс плоских червей, ведущих облигатно эндопаразитический образ жизни [32–34]. Заражение человека трематодами происходит при употреблении сырой рыбы, ракообразных или водных растений, не прошедших термическую обработку и содержащих личинки паразита. Хронические инвазии, сопровождаемые частыми повторными заражениями O. viverrini и C. sinensis , приводят к хроническому воспалению с фиброзом желчных протоков и повреждением печеночной паренхимы, а затем развитием смертельной формы рака — ХК. Для эндемичных регионов Западной Сибири Российской Федерации актуальным является распространение хронической инвазии печеночного трематодоза, вызванного Opisthorchis felineus . Многочисленные экспериментальные и клинические данные, полученные в исследованиях трематоды O. felineus , свидетельствуют о наличии у паразита канцерогенного потенциала [35, 36].
Шистосомы. Одними из самых опасных 12 видов трематод, паразитирующих в пищеварительном тракте человека, являются шистосомы, признанные
МАИР канцерогенами 1-й группы. Данные гельминты в регионах с высоким эндемичным фоном являются ответственными за способность к развитию онкогенеза. Заболеваемость шистосомозом ежегодно уносит на планете до полумиллиона человеческих жизней. Заражение гельминтозом связано с проникновением через кожу и слизистые в кровеносные сосуды человека личинок (церкариев) паразита Schistosoma haematobium , находящихся в пресной воде. Наиболее типичные симптомы заболевания: дерматит, лихорадка, недомогание, миалгия, боль в животе, геморрагическая диарея, гематурия. По данным ВОЗ, в настоящее время на планете в профилактике и лечении шистосомоза нуждается более 250 млн человек [37]. Переход шистосоматоза в хроническую стадию способствует развитию таких ЗНО, как плоскоклеточный рак мочевого пузыря, ХК и ГЦК [38–41].
Канцерогены. Санитарно-гигиенические аспекты организации профилактической работы в отношении обеспечения канцерогенной безопасности для человека факторов биологической природы. В настоящее время перечисленные в СанПиН 1.2.3685–21 и представленные в данном обзоре факторы биологической природы (вирусы, бактерии и паразиты) признаны МАИР канцерогенами 1-й группы, ответственными за онкогенез, способствующий развитию ряда ЗНО [3, 42].
Основные триггерные механизмы формирования ЗНО, обусловленные некоторыми канцерогенными факторами биологической природы, а также мероприятия по профилактике и коррекции развития онкозаболеваемости населения, выявленные в результате анализа литературы, представлены в таблице.
Заключение. Проведенный анализ научной литературы показал, что в патогенезе формирования ЗНО, обусловленных канцерогенными факторами биологической природы, лежат способности инфекционных патогенов вызывать воспалительные реакции, переходящие в хронические инфекции, провоцирующие развитие онкологических заболеваний среди заразившегося населения. Профилактические мероприятия при отсутствии специфической вакцинации
Триггерные механизмы формирования злокачественных новообразований, обусловленные некоторыми канцерогенными факторами биологической природы и пути профилактики и коррекции развития онкозаболеваемости
|
Канцерогенные факторы биологической природы |
Авторы, название статьи, страна, год, ссылка |
Триггерные механизмы онкогенеза |
Профилактика и коррекция развития онкозаболеваемости населения |
|
|
эпидемиологические и патофизиологические механизмы |
развитие воспаления, переходящего в хроническую инфекцию, провоцирующую формирование ЗНО |
|||
Вирусы
|
HВV |
Шерифова А. И., Парсада-нян А. М. Обзор предикторов развития рака печени. Россия, 2023 [11] |
Гемоконтактная инфекция. Высокий уровень вирусемии, с расстройствами гемостаза и острой печеночной недостаточностью |
Острый HВV, переходящий в хроническую инфекцию, сопровождаемую циррозом печени и формированием ГЦК |
Вакцинация против HВV |
|
HСV |
Крючок И. А., Ульянченко Е. О., Кадникова Т. В. и др. Лим- фома и гапатит С. Россия, 2016 [12] |
Гемоконтактная инфекция. Накопление вируса в гепатоцитах, сопровождаемое воспалением, замещением соединительной тканью и потерей функциональной активности |
Острый HСV, переходящий в хроническую инфекцию, сопровождаемую циррозом печени с последующим формированием Неходжкинской лимфомы и ГЦК |
Специфической профилактики нет. Информирование о путях заражения, использование эффективного специфического лечения |
Бактерии
Окончание табл.
|
Канцерогенные факторы биологической природы |
Триггерные механизмы онкогенеза |
|||
|
Авторы, название статьи, страна, год, ссылка |
эпидемиологические и патофизиологические механизмы |
развитие воспаления, переходящего в хроническую инфекцию, провоцирующую формирование ЗНО |
Профилактика и коррекция развития онкозаболеваемости населения |
|
|
Трематоды |
||||
|
Печеночный трематодоз, вызванный O. felineus Шистосомоз, вызванный S. haematobium |
Омарова Х. Г., Алешина Н. И., По-нежева Ж. Б. Риски онкологической патологии при па-разитозах в настоящее время. Россия, 2020 [34] Колмаков А. Ю., Старцев В. Ю. Плоскоклеточная метаплазия как проявление мочеполового шистосомоза и его осложнений. Россия, 2016. [41] |
Заражение человека личинками плоских червей (трематод) происходит при употреблении водной сырой животной или растительной пищи Личинки гельминта (церка-рии), находящиеся в пресной воде, проникают через кожу, слизистые в кровеносные сосуды человека |
Хроническое воспаление с фиброзом желчных протоков, повреждением печеночной паренхимы и формированием ХК Острые воспаления (дерматиты, гастриты, циститы, холециститы) при шистосо-матозе переходят в хроническую стадию повреждения внутренних органов с конечным формированием плоскоклеточного рака мочевого пузыря, ХК и ГЦК |
Специфической профилактики нет. Комплекс санитарно-гигиенических и противоэпидемических мероприятий по предупреждению заражения |
могут быть представлены в виде комплекса противоэпидемических действий, направленных на обеспечение санитарно-эпидемиологического благополучия населения. Осуществляемые мероприятия должны включать следующее: лабораторную диагностику по выявлению возбудителей биологической природы (вирусов, бактерий, трематод), обладающих установленными МАИР ВОЗ канцерогенными факторами, выполнение санитарно-гигиенических требований по предупреждению их дальнейшего распространения, а также проведение работ по профилактическому воспитанию населения.
Финансирование. Исследование не имело спонсорской поддержки.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Гигиенические требования в отношении безопасности для населения канцерогенных факторов биологической природы (обзор)
- Hygienic standards and requirements for ensuring the safety and (or) harmlessness for humans of habitat factors. Sanitary rules and norms of SanPiN 1.2.3685–21. Moscow, 2021; 988 p. (In Russ.) Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания: санитарные правила и нормы СанПиН 1.2.3685–21. М., 2021; 988 с.
- Kaprin AD, Abuzarova GR, Nevzorova DV, et al. New WHO guidelines for cancer pain in adults and adolescents. Research and Practical Medicine Journal (Issled. prakt. med.). 2021; 8 (2): 90–108. (In Russ.) Каприн А. Д., Абузарова Г. Р., Невзорова Д. В. и др. Новые клинические рекомендации Всемирной организации здравоохранения по терапии онкологической боли у взрослых и подростков. Research and Practical Medicine Journal (Issled. prakt. med.). 2021; 8 (2): 90–108. DOI: 10.17709 / 2410‑1893‑2021‑8‑2‑9
- Cronin KA, Scott S, Firth AU, et al. Annual report to the nation on the status of cancer, part 1: National cancer statistics. Cancer. 2022; 128 (24): 4251–84. DOI: 10.1002 / cncr. 34479.
- Siegel RL, Miller KD, Wagle NS, et al. Cancer statistics, 2023. CA Cancer J Clin. 2023; 73 (1): 17–48. DOI: 10.3322/caac.21763
- Onishchenko G.G. The role of the State sanitary and epidemiological service of Russia in protecting public health. Healthcare of the Russian Federation. 2013; (2): 3–9. (In Russ.) Онищенко Г. Г. Роль государственной санитарно-эпидемиологической службы России в защите здоровья населения. Здравоохранение Российской Федерации. 2013; (2): 3–9.
- Gurvich VB, Kuzmin SV, Kuzmina EA, et al. On the issue of updating the main provisions of SanPiN 1.2.2353–08 “Carcinogenic factors and basic requirements for the prevention of carcinogenic hazards”. Occupational Medicine and Industrial Ecology. 2018; (11): 46–51. (In Russ.) Гурвич В. Б., Кузьмин С. В., Кузьмина Е. А. и др. К вопросу актуализации основных положений СанПин 1.2.2353–08 «Канцерогенные факторы и основные требования к профилактике канцерогенной опасности». Медицина труда и промышленная экология. 2018; (11): 46–51. DOI: 10.31089 / 1026‑9428‑2018‑11‑46‑51
- Leshchenko YaA, Lisovtsov AA. Mortality as an indicator of the sanitary and epidemiological status of the region’s population. Hygiene and Sanitation. 2021; 100 (12): 1495–501. (In Russ.) Лещенко Я. А., Лисовцов А. А. Смертность как индикатор санитарно-эпидемиологического статуса населения региона. Гигиена и санитария. 2021; 100 (12): 1495–501. DOI: 10.47470 / 0016‑9900‑2021‑100‑12‑1495‑1501
- Matusevich VA, Stukolova IV. The role of viruses in carcinogenesis. URL: https://omr.by / news / stati / rol-virusov-vkantserogeneze (20 Feb 2024). (In Russ.) Матусевич В. А., Стуколова И. В. Роль вирусов в канцерогенезе. URL: https://omr. by / news / stati / rol-virusov-v-kantserogeneze (дата обращения: 20.02.2024).
- Chubenko VA. Virus-associated tumors from the point of view of a clinician: From epidemiology to treatment. Practical Oncology. 2018; 19 (4): 311–23. (In Russ.) Чубенко В. А. Вирус- ассоциированные опухоли с точки зрения клинициста: от эпидемиологии до лечения. Практическая онкология. 2018; 19 (4): 311–23.
- Nyberg AH, Sadikova E, Cheetham C, et al. Increased cancer rates in patients with chronic hepatitis C. Liver Int. 2020; 40 (3): 685–93. DOI: 10.1111/liv.14305
- Sherifova AI, Parsadanyan AM. Review of predictors of liver cancer development. Creative surgery and oncology. 2023; 13 (3): 229–37. (In Russ.) Шерифова А. И., Парсаданян А. М. Обзор предикторов развития рака печени. Креативная хирургия и онкология. 2023; 13 (3): 229–37. DOI: 10.24060 / 2076‑3093‑2023‑13‑3‑229‑237
- Kryachok IA, Ulyanchenko EO, Kadnikova TV, et al. Lymphoma and hepatitis C. Clinical Oncology. 2016; (3): 67–71. (In Russ.) Крючок И. А., Ульянченко Е. О., Кадникова Т. В. и др. Лимфома и гапатит С. Клиническая онкология. 2016; (3): 67–71.
- Allison R, Nong X, Moorman A, et al. Increased incidence of cancer and cancer-related mortality among persons with chronic hepatitis C infection. J Hepatol. 2015; 63 (4): 822–8. DOI: 10.1016 / j.jhep.2015.04.021
- Volgareva GM. Papillomaviral carcinogenesis. Major achievements and certain challenges. Part 2. HPV-associated cancers in Russia. Preventive HPV vaccines. Rossiyskiy bioterapevticheskiy zhurnal = Russian Journal of Biotherapy. 2020; 19 (2): 31–8. (In Russ.) Волгарева Г. М. Папилломавирусный канцерогенез. Основные достижения и некоторые проблемы. Часть 2. ВПЧ-ассоциированные формы рака в России. Профилактические ВПЧ-вакцины. Российский биотерапевтический журнал. 2020; 19 (2): 31–8.
- Khlanta DA, Khlanta NA, Fedoskova TG, et al. Modern ideas about the Epstein — Barr virus and its role in the development of malignant processes. Russian Medical Inquiry. 2020; 4 (3): 148–54. (In Russ.) Хланта Д. А., Хланта Н. А., Федоскова Т. Г. и др. Современные представления о вирусе Эпштейна — Барр и его роли в развитии злокачественных процессов. РМЖ. Медицинское обозрение. 2020; 4 (3): 148–54. DOI: 10.32364 / 2587‑6821‑2020‑4‑3‑148‑154
- Shestakova IV, Yushchuk ND. Role of Epstein — Barr virus in tumorigenesis. Russian Biomedical Bulletin n. a. Academician I. P. Pavlov. 2014; (3): 75–85. (In Russ.) Шестакова И. В., Ющук Н. Д. Роль вируса Эпштейна — Барр в онкогенезе. Российский медико-биологический вестник имени академика И. П. Павлова. 2014; (3): 75–85.
- Shannon-Lowe C, Rickinson AB, Bell AI. Epstein — Barr virus-associated lymphomas. Philos Trans R Soc Lond B Biol Sci. 2017; 372 (1732): 20160271. DOI: 10.1098 / rstb. 2016.0271
- Isakov VA. Human herpesvirus infections: A guide for doctors. 2nd ed., Revised and add. St. Petersburg: SpetsLit, 2013; 670 р. (In Russ.) Исаков В. А. Герпесвирусные инфекции человека: руководство для врачей. 2‑е изд., перераб. и доп. СПб.: СпецЛит, 2013; 670 с.
- Aliyeva EI, Antonova AO, Verkhovskaya MD. Viral carcinogenesis. Review of the literature on the issue. Bulletin of Chelyabinsk State University. Education and Health Care. 2021; 4 (16): 60–6. (In Russ.) Алиева Е. И, Антонова А. О., Верховская М. Д. Вирусный канцерогенез. Обзор литературы по проблеме. Вестник Челябинского государственного университета. Образование и здравоохранение. 2021; 4 (16): 60–6. DOI: 10.24411 / 2409‑4102‑2021‑10409
- Tan BJ, Sugata K, Reda O, et al. HTLV-1 infection promotes excessive T cell activation and transformation into adult T cell leukemia / lymphoma. J Clin Invest. 2021; 131 (24): e150472. DOI: 10.1172 / JCI150472
- DeMichele A, Cristofanilli M, Brufsky A, et al. Comparative effectiveness of firstline palbociclib plus letrozole versus letrozole alone for HR+ / HER2– metastatic breast cancer in US real-world clinical practice. Breast Cancer Res. 2021; 23 (1): 37. DOI:10.1186 / s13058‑021‑01409‑8
- Nekrasova AV, Rassokhin VV, Falaleeva NA, et al. Malignant neoplasms in HIV-infected patients in Russia: history for a period of 20 years. Modern Oncology. 2021; 23 (4): 593–7. (In Russ.) Некрасова А. В., Рассохин В. В., Фалалеева Н. А. и др. Злокачественные новообразования у ВИЧ-инфицированных пациентов в России: история сроком в 20 лет. Современная онкология. 2021; 23 (4): 593–7. DOI: 10.26442 / 18151434.2021.4.201291
- Fedichkina TP, Solenova LG, Zykova IE. On the issue of regulation of Helicobacter pylori in drinking water. Hygiene and Sanitation. 2014; 6: 42–6. (In Russ.) Федичкина Т. П., Соленова Л. Г., Зыкова И. Е. К вопросу о нормировании Нelicobacter pylori в питьевой воде. Гигиена и санитария. 2014; 6: 42–6.
- Osadchuk AM, Davydkin IL, Gritsenko TA, Osadchuk MA. General and particular issues of etiopathogenesis of peptic ulcer and stomach cancer: The current state of the problem. Therapeutic Archive. 2020; 92 (2): 97–103. (In Russ.) Осадчук А. М., Давыдкин И. Л., Гриценко Т. А., Осадчук М. А. Общие и частные вопросы этиопатогенеза язвенной болезни и рака желудка: современное состояние проблемы. Терапевтический архив. 2020; 92 (2): 97–103. DOI: 10.26442 / 00403660.2020.02.000485
- Ansari S, Yamaoka Y. Helicobacter pylori virulence factors exploiting gastric colonization and its pathogenicity. Toxins (Basel). 2019; 11 (11): е677. DOI: 10.3390 / toxins11110677
- Minaga K, Watanabe T, Kamata K, et al. Nucleotidebinding oligomerization domain 1 and Helicobacter pylori infection: A review. World J Gastroenterol. 2018; 24 (16): 1725–33. DOI: 10.3748 / wjg.v24.i16.1725
- Grohmann E, Christie PJ, Waksman G, et al. Type IV secretion in gramnegative and gram-positive bacteria. Mol Microbiol. 2018; 107 (4): 455–71. DOI: 10.1111 / mmi.13896
- Hu Z, Zhang Y, Li Z, et al. Effect of Helicobacter pylori infection on chronic periodontitis by the change of microecology and inflammation. Oncotarget. 2016; 7 (41): 66700–12. DOI: 10.18632 / oncotarget.11449
- Guraya SY, Ahmad AA, El-Ageery SM, et al. The correlation of Helicobacter pylori with the development of cholelithiasis and cholecystitis: The results of a prospective clinical study in Saudi Arabia. Eur Rev Med Pharmacol Sci. 2015; 19 (20): 3873–80.
- Yang F, Xu Y-L, Zhu R-F. Helicobacter pylori infection and the risk of colorectal carcinoma: A systematic review and meta-analysis. Minerva Med. 2019; 110 (5): 464–70. DOI: 10.23736 / S0026-4806.19.05942-1
- Ryoo SK, Kim TJ, Kim ER, et al. Helicobacter pylori infection and the development of advanced colorectal neoplasia. J Clin Gastroenterol. 2020; 54 (8): 696–700. DOI: 10.1097 / MCG.0000000000001273
- Toledo R, Fried B, eds. Digenetic trematodes. Advances in experimental medicine and biology. Vol. 766. New-York: Springer, 2014; 474 p.
- Pupacdi B, Loffredo CA, Budhu A, et al.; TIGERLC Consortium. The landscape of etiological patterns of hepatocellular carcinoma and intrahepatic cholangiocarcinoma in Thailand. Int J Cancer. 2024; 155 (8): 1387–99. DOI: 10.1002/ijc.35034
- Omarova HG, Aleshina NI, Ponezheva JB. Risks of oncological pathology in parasitosis at present. Therapeutic Archive. 2020; 92 (11): 82–5. (In Russ.) Омарова Х. Г., Алешина Н. И., Понежева Ж. Б. Риски онкологической патологии при паразитозах в настоящее время. Терапевтический архив. 2020; 92 (11): 82–5. DOI: 10.26442 / 00403660.2020.11.000710
- Prokhorov BB. Incidence of population. Infectious diseases: biohelminthiasis. Opisthorchiasis. In the e-version of the atlas: Environment and health of the population of Russia. URL: http://www.sci.aha.ru / ATL / ra55g.htm (4 Mar 2024). (In Russ.) Прохоров Б. Б. Заболеваемость населения. Инфекционные болезни: биогельминтозы. Описторхоз. В эл. Версии атласа: Окружающая среда и здоровье населения России. URL: http://www.sci.aha.ru / ATL / ra55g.htm (дата обращения: 04.03.2024).
- Fedorova OS, Kovshirina YuV, Kovshirina AE, et al. Analysis of the incidence of Opisthorchis felineus invasion and malignant neoplasms of the hepatobiliary system in the Russian Federation. Bulletin of Siberian Medicine. 2016; 15 (5): 67–78. (In Russ.) Федорова О. С., Ковширина Ю. В., Ковширина А. Е. и др. Анализ заболеваемости инвазией Opisthorchis felineus и злокачественными новообразованиями гепатобилиарной системы в Российской Федерации. Бюллетень сибирской медицины. 2016; 15 (5): 67–78.
- Kokaliaris C, Garba A, Matuska M, et al. Effect of preventive chemotherapy with praziquantel on schistosomiasis among school-aged children in sub-Saharan Africa: A spatiotemporal modelling study. Lancet Infect Dis. 2022; 22 (1): 136–49. DOI: 10.1016 / S1473-3099(21)00090-6 [Erratum in: Lancet Infect Dis. 2022; 22 (1): e1].
- Schistosomiasis. WHO recommendations. URL: http://www.who.int / mediacentre / factsheets / fs115 / en (4 Mar 2024).
- Startsev VYu, Kolmakov AYu. Ecological and diagnostic aspects of genitourinary schistosomiasis as a precancerous disease (literature review). Human ecology. 2016; (1): 50–6. (In Russ.) Старцев В. Ю., Колмаков А. Ю. Эколого-диагностические аспекты мочеполового шистосомоза как предракового заболевания (обзор литературы). Экология человека. 2016; (1): 50–6.
- Asfandiyarov FR, Startsev VYu, Kolmakov AYu. Possibilities of diagnosis and treatment of genitourinary schistosomatosis in modern conditions. Herald of Urology. 2018; 6 (3): 5–11. (In Russ.) Асфандияров Ф. Р., Старцев В. Ю., Колмаков А. Ю. Возможности диагностики и лечения мочеполового шистосоматоза в современных условиях. Вестник урологии. 2018; 6 (3): 5–11. DOI: 10.21886 / 2308‑6424‑2017‑6‑3‑5‑11
- Kolmakov AYu, Startsev VYu. Squamous cell metaplasia as a manifestation of genitourinary schistosomiasis and its complications. Oncourology. 2016; 12 (2): 58–63. (In Russ.) Колмаков А. Ю., Старцев В. Ю. Плоскоклеточная метаплазия как проявление мочеполового шистосомоза и его осложнений. Онкоурология. 2016; 12 (2): 58–63. DOI: 10.17650 / 1726‑9776‑2016‑12‑2‑58‑63
- Olsson A, Schubauer-Berigan M, Schüz J. Strategies of the International Agency for Research on Cancer (IARC / WHO) to reduce the occupational cancer burden. Med Truda i Prom Ekol. 2021; 61 (3): 140–54. DOI: 10.31089 / 1026‑9428‑2021‑61‑3‑140‑154
- Coussens LM, Zitvoge L, Paluska K. Neutralizing tumorpromoting chronic inflammation: A magic bullet. Science. 2013; 339 (6117): 286–91. DOI: 10.1126 / science.1232227
- Mazurenko NN, Tsyganova IМ. Molecular features and genetic markers of gastrointestinal stromal tumors. Advances in Molecular Oncology. 2015; 2 (2): 29–40. (In Russ.) Мазуренко Н. Н., Цыганова И. В. Молекулярно-генетические особенности и маркеры гастроинтестинальных стромальных опухолей. Успехи молекулярной онкологии. 2015; 2 (2): 29–40. DOI: 10.17650 / 2313-805X.2015.2.2.29-40
- Fulbright LE, Ellermann M, Arthur JC. The microbiome and the hallmarks of cancer. PLoS Pathog. 2017; 13 (9): e1006480. DOI: 10.1371 / journal.ppat
- Champer M, Wong A, Champer J, et al. The role of the vaginal microbiome in gynaecological cancer. BJOG. 2018; 125 (3): 309–15. DOI: 10.1111 / 1471-0528.14631
- Garrett WS. Cancer and the microbiota. Science. 2015; 348 (6230): 80–6. DOI: 10.1126 / science.aaa4972
- Boronina LG, Samatova EV, Kukushkina MP, et al. Colonization of rectal mucosa by microbes with antibiotic resistance markers in children with hematological malignancies. Russian Journal of Woman and Child Health. 2021; 4 (1): 90–7. (In Russ.) Боронина Л. Г., Саматова Е. В., Кукушкина М. П. и др. Колонизация слизистой оболочки прямой кишки микро- организмами с маркерами резистентности у детей с онкогематологическими заболеваниями. РМЖ. Мать и дитя. 2021; 4 (1): 90–7. DOI: 10.32364 / 2618‑8430‑2021‑4‑1‑90‑97
- Makimbetov EK, Salihar RI, Tumanbaev AM, et al. Epidemiology of cancer in the world. Modern Problems of Science and Education. 2020; (2). (In Russ.) Макимбетов Э. К., Салихар Р. И., Туманбаев А. М. и др. Эпидемиология рака в мире. Современные проблемы науки и образования. 2020; (2). DOI: 10.17513 / spno.29718
- Leung JM, Graham AL, Knowles SCL. Parasitemicrobiot interactions with the vertebrate gut: Synthesis through an ecological lens. Front Microbiol. 2018; (9): 843. DOI: 10.3389 / fmicb. 2018.0084317-20


