Гиперселекция пациентов при назначении анти-EGFR-антител. Первые результаты отечественного исследования
Автор: Антонова Т.Г., Бяхова М.М., Покатаев И.А., Семенова А.Б., Большакова Е.А., Стативко О.А., Носова М.В., Лебедева А.А., Кузьмина Е.С., Лядова М.А., Макиев Г.Г., Кравчук Д.А., Евдокимов В.И., Иванов Н.А., Кавун А.И., Белова Е.В., Веселовский Е.М., Милейко В.А., Трякин А.А., Федянин М.Ю., Галкин В.Н.
Журнал: Злокачественные опухоли @malignanttumors
Статья в выпуске: 3S1 т.15, 2025 года.
Бесплатный доступ
Появление новых таргетных препаратов, поставили перед нами новую проблему правильного их назначения. Селекция пациентов и рациональное использование таргетных агентов, не только позволит добиться высоких результатов в терапии, но предотвратит чрезмерного, и самое главное, не обоснованного назначения препаратов.
Колоректальный рак, ингибиторы EGFR, мутации
Короткий адрес: https://sciup.org/140312889
IDR: 140312889 | DOI: 10.18027/2224-5057-2025-15-3s1-4-10
Текст научной статьи Гиперселекция пациентов при назначении анти-EGFR-антител. Первые результаты отечественного исследования
Одну из лидирующих позиций по распространенности среди онкологических заболеваний, занимает колоректальный рак, в настоящее время он находится на 3 месте среди всех онкологических заболеваний, и несмотря на успехи в диагностике, около 26% случаев приходится на IV cтадию заболевания [1]. Разработка новых препаратов, позволила повысить эффективность химиотерапии, за последнее десятилетие были достигнуты значительные улучшения в показателях ответа на лечение, выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) [2].
Однако, несмотря на успехи в разработке новых таргет-ных препаратов, сложная молекулярная гетерогенность данного заболевания до конца не изучена и на сегодняш- ний день у нас не хватает данных о прогностических биомаркерах, которые позволили бы проводить селекцию пациентов для подбора оптимального таргетного агента [3]. Персонализация терапии представляет особый интерес для повышения эффективности лечения и достижения лучших результатов [4]. Поиску генов резистентности посвящено исследование третьей фазы PRIME. Для оценки эффективности химиотерапии по схеме FOLFOX в комбинации с панитумумабом и без него. В исследовании была показана эффективность только в группе с диким статусом гена RAS [8], что и послужило началом поиска и других генов, и проведение тем самым селекции пациентов для поиска оптимального пациента, наиболее чувствительного к терапии ингибиторами EGFR. Данные которые доступны нам сейчас, убеждают нас в поиске все новых мутаций и оценке влияния каждой из них на результаты терапии.
Существующие в настоящее время рекомендации, требуют обязательного определения мутации в гене RAS, BRAF, HER 2 neu и MSI, но уже сейчас есть понимание в необходимости проведения более расширенного поиска мутаций, потенциально отвечающих за резистентность к терапии ингибиторами EGFR.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Наше исследование состоит из 2 этапов. Целью первого этапа являлась ретроспективная оценка встречаемости альтераций, ассоциированных с резистентностью, в образцах пациентов, получавших анти-EGFR терапию при левостороннем раке толстой кишки с диким типом генов RAS и BRAF по результатам ПЦР, определение частоты ложноотрицательных результатов классических мутаций и встречаемость редких мутаций в реальной клинической практике. А также оценка времени до прогрессирования и общей выживаемости в группах в зависимости от результатов NGS диагностики. Во второй части исследования, мы попытаемся проспективно оценить пользу от применения гиперселекции перед назначением таргетной терапии и оценить в последующем время до прогрессирования и общую выживаемость.
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективную часть исследования включались пациенты с морфологическим подтвержденным левосторонним КРР, проходившихлечение на базе ГБУЗ «ГКОБ № 1 ДЗМ» г. Москвы, в период с 2019 г. по 2022 г. Все пациенты получали химиотерапию в режиме FOLFIRI/FOLFOX и имели отрицательный статус генов RAS и BRAF по данным ПЦР диагностики. Гистологические блоки пациентов, ретроспективно были протестированы методом высокопроизводительного секвенирования (Соло-тест Атлас) по ТУ 21.20.23-002-91709359-2018, в вариантах исполнения «Соло-тест Атлас 48-а», «Соло-тест Атлас 48-б». ATLAS-48i. ООО «ОнкоАтлас», Россия. Диагностическая панель включала 38 генов (AKT1, AKT2, AKT3, ALK, ARAF, BRAF, EGFR, ERBB2, ERBB3, ERBB4, ESR1, FGFR1, FGFR2, FGFR3, FGFR4, H3F3A, HIST1H3B, HIST1H3C, HRAS, IDH1, IDH2, KIT, KRAS, MET, NRAS, POLE, PDGFRA, PIK3CA, PTEN, RAC1, RAF1, RIT1, ROS1, STK11, TP53), а также микро-сателлитную нестабильность (MSI).
Проспективная часть исследования стартовала в 02.2024 г. и окончание набора планируется в 12.2026, всего планируется включить 355 пациентов, с метастатическим колоректальным раком левосторонней локализации. У всех пациентов до рандомизации будет определен мутационный статус методом ПЦР. В последующем пациенты методом случайной рандомизации будут разделены на 2 группы:
группа А в которой ингибиторы EGFR (панитумумаб/цетук-симаб) будут назначены в соответствии с отрицательным результатом ПЦР, а NGS будет выполнено ретроспективно, и группа В, в которой сразу после рандомизации будет выполнено NGS тестирование и добавление таргетного препарата будет исходить из результатов тестирования. В случае обнаружение патогенной мутации, к стандартной схеме химиотерапии будет добавлен бевацизумаб, в случае сохранения «дикого» статуса по результатам NGS пациенты будут получать ингибиторы EGFR (рис. 1).
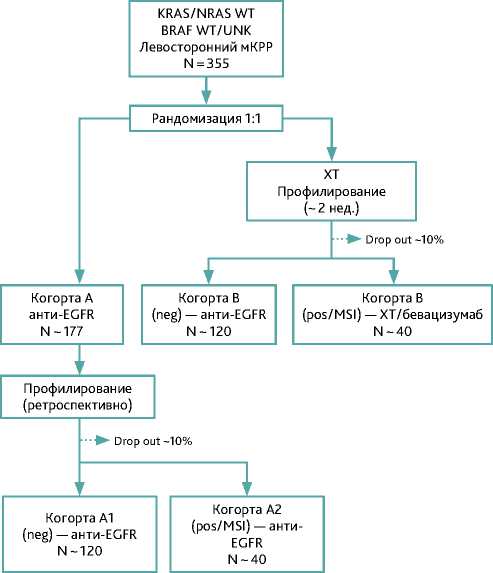
Рисунок 1. Дизайн исследования
В настоящее время идет активный набор в проспективную часть исследования и оценка предварительных результатов по времени до прогрессирования, планируется не ранее 02.2026 г.
РЕЗУЛЬТАТЫ
В настоящее время мы обладаем результатами по ретроспективной части исследования.
В рамках исследования было проанализировано 111 образцов с использованием NGS. На момент включения в данное исследование образцы имели отрицательный статус генов RAS и BRAF, по результатам ПЦР. После проведения NGC тестирования, пациенты были разделены на 2 группы: когорта wt — пациенты без каких-либо патогенных мутаций и когорта mut — пациенты с различными мутациями (табл. 1).
Таблица 1. Характеристика пациентов в когорте дикого типа и когорте с мутациями
|
Группа wt (n = 72) |
Группа mut (n = 39) |
P |
|
|
Мужской пол, n (%) Женский пол, n (%) |
41 (56,94%) 31 (43,06%) |
21 (53,85%) 18 (46,15%) |
0,873 — Хи 2 |
|
Возраст: Медиана (мин-макс) |
62 (32–81) |
64 (33–86) |
0,6359 (T-тест) |
|
Метастазы на момент установления диагноза, n (%) |
46 (63,89%) |
27 (69,23%) |
0,680 — Хи 2 |
|
Метастазы в печени, n (%) |
57 (79,17%) |
25 (64,10%) |
0,085 — Хи 2 |
|
Метастазы по брюшине, n (%) |
9 (12,50%) |
9 (23,08%) |
0,149 — Хи 2 |
|
Неудаленная первичная опухоль, n (%) |
19 (26,39%) |
12 (30,77%) |
0,623 — Хи 2 |
|
Число органов с метастазами: 1, n (%) 2 или более 1, n (%) |
42 (58,33%) 30 (41,67%) |
20 (51,28%) 19 (48,72%) |
0,475 — Хи 2 |
|
ECOG n (%): 0 1 2 |
3 (4,17%) 57 (80,56%) 11 (15,28%) |
1 (2,56%) 28 (71,79%) 10 (25,64%) |
0,545 — Хи 2 |
|
Радикальное хирургическое лечение при метастатическом процессе |
38 (55,07%) |
21 (53,85%) |
0,902 — Хи 2 |
|
Анти-EGFR-терапия: 1 линия 2 линия |
65 (90,2%) 7 (9,7%) |
34 (87,1%) 5 (12,8%) |
Таблица 2. Часто встречаемости патогенных мутаций
|
Altered gene |
N (%) |
|
RAS |
27 (69,21%) |
|
BRAF |
3 (7,68%) |
|
ERBB |
4 ( 10,24%) |
|
PIK3CA |
2 (5,12%) |
|
PTEN |
2 (5,12%) |
|
MSI |
1 ( 2,56%) |
Когорты в обеих группах существенно не отличались по факторам неблагоприятного прогноза. Медиана возраста составила 62 (33–82) года в когорте дикого типа и 64 (35– 88) в когорте с мутациями (р = 0,63). У 57 (79%) пациентов в когорте дикого типа и 27 (69,2%) пациентов в когорте с мутациями выявлены метастазы в печени (р = 0,68). Первичная опухоль на момент начала терапии не была удалена у 19 (26,39%) и 12 (30,77%) пациентов в когортах дикого и мутантного типов (р = 0,63). Общее состояние пациентов оценивалось как ECOG 2 у 11 (15,28%) и 10 (25,6%) пациентов когорт дикого и мутантного типов соответственно. Остальные пациенты имели удовлетворительное общее
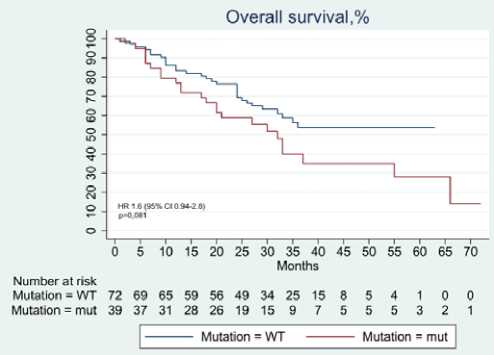
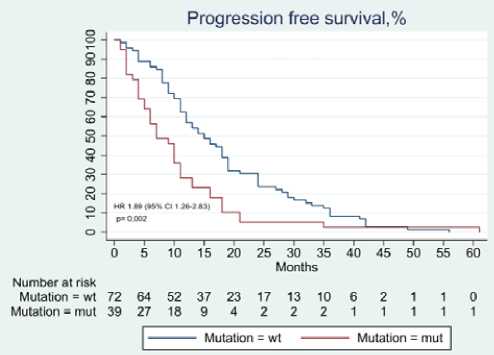
Рисунок 2. Выживаемость без прогрессирования (внизу) и общая выживаемость (вверху) от начала терапии анти-EGFR моноклональными антителами в двух когортах пациентов, разделенных по мутационному профилю опухоли состояние (ECOG 0–1) на момент начала лечения (р = 0,54). Большинство пациентов (90,2% и в 87,1% в когортах дикого и мутантного типов) получали химиотерапию в сочетании с анти-EGFR препаратом (цетуксимабом или панитумума-бом) в первой линии лечения.
Группа пациентов с мутациями составила 39 человек (35,13% от всех пациентов, табл. 2). Наиболее частой мутацией по результатам NGS-анализа стала мутация в гене KRAS, которая была выявлена у 24 пациентов (61,53%) При этом классические варианты KRAS были обнаружены в 19 образцах (79% от всех KRAS-положительных образцов), добавочные — в 5 (20,8%). У 3 (7,68%) пациентов обнаружены мутации в гене NRAS, BRAF —у 3 пациентов (7,68%) вариант BRAF I класса. Патогенный вариант PTEN выявлен у 2 пациентов (5,12%) и 1 (2,56%) MSI-положительный образец.
У еще 2 (5,12%) пациентов были выявлены активирующие варианты в 21 экзоне PIK3CA; Активирующий вариант в гене ERBB2/ERBB3 у 4 пациентов (10,24%). Таким образом, дополнительно к RAS/BRAF пациентам, NGS-тестирование позволяет дополнительно выявить 9% пациентов, для которых анти-EGFR терапия потенциально неэффективна.
В дальнейшем проведен анализ отдаленных результатов лечения в двух когортах на фоне терапии, включавшей анти-EGFR препарат (рис. 2).
Медиана времени до прогрессирования в когорте без мутаций составила 15 месяцев (95% ДИ 11,0–18,0) в когорте мутаций — 7 месяцев (95% ДИ 5,0–10,0) HR 1,88, (95% ДИ 1,25–2,81, p = 0,002). Медиана общей выживаемости в когорте без мутаций не достигнута, нижняя граница 95% ДИ также не достигнута, в когорте мутаций медиана составила 32 месяца (95% ДИ 25,0–39,0), HR 1,6 (95% ДИ 0,9–2,7, p = 0,091). Выявленная разница по времени до прогрессирования между двумя когортами в 8 месяцев бесспорно подтверждает необходимость расширенного генетического профилирования.
После получения данных результатов в ретроспективной части, в феврале 2024г стартовала 2 часть исследования. Критериями включения в исследования в исследование являлись пациенты с метастатическим левосторонним колоректальным раком (МКРР), с отсутствием мутаций в генах KRAS/NRAS/BRAF по результатам ПЦР исследования, с удовлетворительным соматическим статусом ECOG 0–2 и нормальной функцией показателей внутренних органов. На сентябрь 2025г в проспективной части исследования принимают участие 170 пациентов, из онкологических центров города Москвы: ГБУЗ ГКОБ им С.С. Юдина, ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; ГБУЗ ММКЦ «Коммунарка» ДЗМ; ГБУЗ МГОБ № 62 ДЗМ. Методом случайной рандомизации пациенты разделены на 2 группы. В настоящее время в группе А— 86 пациентов, в группе В — 58 пациентов и 22 — в группе С (рис. 3).
Набор пациентов продолжается. Получены предварительные результаты по расширенной NGS диагностике, однако первая оценка результатов эффективности терапии
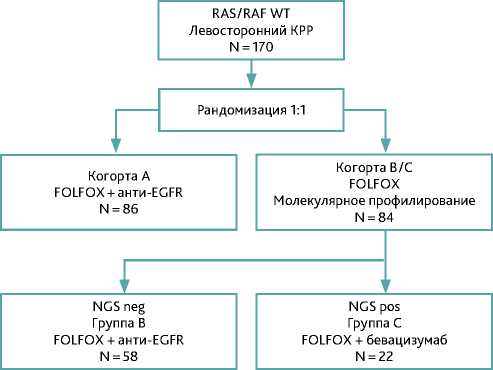
Рисунок 3. Проспективная часть в зависимости расширенного профилирования планируется в первом квартале 2026 г.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На сегодняшний день любой специалист начинает подбор и выбор терапии на основании молекулярно-генетического профилирования в зависимости от выявленных активирующих соматических мутаций генов KRAS, NRAS, BRAF с целью определения подгруппы пациентов, для которых может быть целесообразным добавление к стандартной химиотерапии анти-EGFR моноклональных антител (цетуксимаб и панитумумаб) [5,6]. Однако, данные литературы свидетельствуют о том, что и другие биомаркеры могут обусловливать потенциальную неэффективность терапии.
Многочисленные исследования доказали улучшение отдаленных результатов лечения у пациентов с метастатическим КРР без мутаций в генах RAS и BRAF за счет добавления анти-EGFR моноклональных антител к стандартной химиотерапии при локализации первичной опухоли в левых отделах толстой кишки [9–11]. Так, в рандомизированном исследовании III фазы «Цетуксимаб в сочетании с иринотеканом в терапии первой линии при метастатическом колоректальном раке (CRYSTAL)» сравнивали эффективность и безопасность цетуксимаба в первой линии в сочетании с FOLFIRI по сравнению с монотерапией FOLFIRI; критерии включения не учитывали мутационный статус KRAS/RAS, а были ориентированы на экспрессию EGFR [6]. Ретроспективный анализ пациентов с опухолями экзона 2 KRAS показал, что добавление цетуксимаба к FOLFIRI значительно улучшило выживаемость без прогрессирования (ВБП), общую выживаемость (ОВ) и общую частоту ответа (ЧОО) [7]. Открытие мутантного KRAS в качестве предиктора привело к изменению подходов к терапии и побудило исследователей к поиску новых мутаций. В дальнейшем в исследовании TAILOR было показано, что пациенты с опухолями BRAF wt получают более высокую пользу от лечения ингибиторами EGFR, чем пациенты с BRAF-мутированными опухолями [12]. Объединенный анализ рандомизированных исследований CRYSTAL и OPUS также подтвердил плохую прогностическую роль BRAF V600Е, которая связана с повышенной смертностью от рака толстой кишки. [13]. Несмотря на значительный прогресс в обнаружении предикторов резистентности, в настоящее время мы не обладаем достаточными знаниями в понимании развития механизмов резистентности и требуется поиск новых биомаркеров. Сигнальный путь PIK3CA/AKT/mTOR связан с несколькими генами, включая EGFR. Примерно 10–20% КРР содержат активирующие мутации PIK3CA, которые в основном происходят в экзонах 9 и 20 и ответственны за отсутствие ответа на анти-EGFR терапию [14,15]. Также мутация PIK3CA связана с более высокой смертностью от рака толстой кишки по сравнению с пациентами с опухолями дикого типа [16].
Сигнальный путь PIK3CA также может быть активирован потерей PTEN, которая обнаруживается в 30% случаев КРР и связана с отсутствием объективного ответа опухоли и ухудшением ОВ у пациентов с опухолями KRAS wt, получавших лечение с ингибиторами EGFR [17]. Не так давно были опубликованы данные о других потенциально важных биомаркерах, которые могут обусловливать неэффективность таргетной терапии анти-EGFR моноклональными антителами. В ретроспективно выполненном поданализе рандомизированного исследования VALENTINO использование расширенного геномного профилирования опухолей пациентов с метастатическим колоректальным раком без мутаций RAS/BRAF, устойчивых к анти-EGFR терапии моноклональными антителами, позволило выявить дополнительные драйверные альтерации, такие как HER2/MET амплификации, ALK/ROS1/NTRK1–3/RET перестройки, мутации в генах ERBB2, PIK3CA, PTEN, AKT1, а также мутации в генах RAS с низким уровнем VAF [18]. У пациентов, ответивших на лечение анти-EGFR моноклональными антителами, не были выявлены альтерации в вышеперечисленных генах. PARADIGM было одним из первых рандомизированных проспективных исследований III фазы, сравнившем в первой линии химиотерапию с бевацизумабом и панитумумабом у пациентов с метастатическим колоректальным раком и диким типом генов RAS [20]. В биомаркерном анализе PARADIGM оценивалась связь между альтерациями генов в циркулирующей опухолевой ДНК (цДНК) и результатами эффективности, при этом основное внимание уделялось широкой панели изменений генов, связанных с устойчивостью к анти-EGFR моноклональным антителам, включая мутации KRAS, NRAS, PTEN и внеклеточного домена EGFR, амплификации HER2 и MET, а также перестроек ALK, RET и NTRK1. Последующий поданализ продемонстрировал преимущество панитумумаба над бевацизумабом по общей выживаемости только в когорте пациентов, не имевших других мутаций резистентности [21].
В ретроспективной части нашего исследования оценена частота мутаций резистентности к анти-EGFR терапии у пациентов с метастатическим КРР и диким типом генов RAS по данным стандартного ПЦР-теста, получавшим химиотерапию в сочетании с анти-EGFR терапией. Мы выявили, что опухоли 36,9% пациентов имели мутации, потенциально ответственные за устойчивость к анти-EGFR терапии. Среди данных мутаций превалировали мутации KRAS, NRAS и BRAF. Причем классические мутации, обычно входящие в ПЦР-панель были выявлены в 59% случаев. Все случаи выявления классических мутаций были повторно оценены методом ПЦР. Для 16 (51,6%) RAS/BRAF p. V600E-положительных пациентов (12 KRAS + , 2 NRAS + , 2 BRAF +) при повторном анализе наблюдалось 100% совпадение ПЦР и NGS, что возможно, могло быть связано с лабораторными ошибками на момент диагностики. Остальные 41% мутаций включали неклассические мутации KRAS, BRAF, а также мутации в генах PTEN, PI3KCA, ERBB2, ERBB3. У этих пациентов показано, что безрецидивная выживаемость хуже, чем у пациентов с отсутствием мутаций. Это также подтверждается данными мировой литературы.
В своей работе нам удалось продемонстрировать негативное прогностическое значение мутаций, выявляемых методом NGS у пациентов с метастатическим колоректальным раком, получавших режимы химиотерапии с анти-EGFR препаратами, кроме того, дополнительно были выявлено 16 (14%) случаев ложноотрицательных ответов. Несомненным преимуществом проспективной части исследования будет изучение предиктивного значения NGS-основанной тест-системы в отношении эффективности анти-EGFR терапии перед выбором таргетного агента. Наличие случайной рандомизации и группы контроля позволит сделать суждение о предиктивной роли отдельных мутаций в отношении терапии EGFR-ингибиторами, персонализировать терапию и избежать чрезмерного и необоснованного назначения препаратов.


