Гиперспектральная визуализация патологий кожи в видимой области
Автор: Братченко Иван Алексеевич, Алонова Марина Васильевна, Мякинин Олег Олегович, Морятов Александр Александрович, Козлов Сергей Васильевич, Захаров Валерий Павлович
Журнал: Компьютерная оптика @computer-optics
Рубрика: Обработка изображений: Восстановление изображений, выявление признаков, распознавание образов
Статья в выпуске: 2 т.40, 2016 года.
Бесплатный доступ
Представлены данные анализа гиперспектральных изображений онкопатологий кожи человека. Изображения содержали данные спектров обратного рассеяния нормальной кожи и патологий. На основании данных о содержании основных хромофоров кожи предложен метод диагностики злокачественных пигментных образований кожи.
Гиперспектральная визуализация, спектроскопия обратного рассеяния, меланома, невус
Короткий адрес: https://sciup.org/14059459
IDR: 14059459 | DOI: 10.18287/2412-6179-2016-40-2-240-248
Текст научной статьи Гиперспектральная визуализация патологий кожи в видимой области
Рак кожи является одной из наиболее распространённых форм рака в мире. Кожа является одним из ведущих органов человека по локализации раковых опухолей в общей структуре онкологической заболеваемости для обоих полов в России [1]. Существует три основных типа рака кожи: базальноклеточный рак, плоскоклеточный рак и злокачественная меланома. Среди всех раков кожи злокачественная меланома кожи является наиболее опасным видом рака, так как в подавляющем большинстве случаев приводит к гибели пациентов, особенно при обнаружении патологии на поздней стадии. При этом заболеваемость и смертность от меланомы кожи увеличивается в большинстве стран по всему миру [2]. Принимая во внимание низкую (около 50 %) диагностическую точность пигментных опухолей на ранней стадии врачами общей практики, требуется создание новых методов контроля опухолей. Трудности диагностики меланом врачами общей практики связаны со сложностью в интерпретации клинических признаков опухоли и невозможностью отличить меланому от доброкачественных пигментных образований (таких как невус) на ранней стадии развития. Также при подозрении на наличие меланомы медицинский персонал лишён возможности использования инвазивных методов исследования, таких как биопсия с гистологическим или цитологическим исследованием, в связи с повышенным риском прогрессирования поражений. В этой связи оптические методы имеют огромный потенциал для неинвазивного выявления и определения конкретного типа опухолевых образований в тканях кожи с применением инструментальных методов.
Перспективными методами оптического неинвазивного анализа онкологических патологий кожи являются спектроскопия комбинационного рассеяния [3], флуоресцентная спектроскопия [4] и методы визуализации, включая оптическую когерентную томографию [5]. Данные методы использовались для мониторинга рака кожи как в in vivo, так и в ex vivo условиях [6, 7]. Диагностика злокачественной мела- номы кожи с применением оптических методов позволяла добиться точности 85 % и более. Однако точность диагностики значительно снижалась в массовых скрининговых исследованиях [8]. Увеличение точности диагностики возможно с использованием комбинаций оптических методов. Комплексные методы диагностики помогают сканировать большие участки ткани, используя аутофлуоресцентный отклик среды или анализ обратно рассеянного излучения для больших площадей биоткани. Более точный анализ, включающий съёмку спектра комбинационного рассеяния или снятие томограммы подозрительного участка, проводится позже лишь для областей кожи с подозрением на наличие онкологии [9]. Альтернативой такому подходу может стать использование гиперспектральной съёмки, которая позволяет одновременно регистрировать изображение зоны патологии и получать спектральные данные исследуемого участка кожи. Изображение образования позволяет судить о его морфологии и установить стадию развития образования, в то время как данные спектрального анализа позволяют делать выводы о химическом составе исследуемой области биоткани. Гиперспектральное изображение – особый вид регистрации спектральной информации об объекте, а именно об интенсивности отражённого света на разных длинах волн в каждой точке поверхности образца. Гиперспектральное изображение представляет собой трёхмерный массив данных M×N×K, состоящий из последовательности K изображений размером M×N, каждое из которых соответствует интенсивности отражённого сигнала в спектральной полосе λK±Δλ в каждой точке поверхности исследуемого объекта. Применимость методов мульти- и гиперспектральной съёмки для анализа раковых образований в видимом и ближнем инфракрасном диапазоне была продемонстрирована во многих исследованиях [10, 11]. Однако в целом точность диагностики различных раковых патологий с использованием гиперспектральных методов регистрации спектров обратного рассеяния по-прежнему остаётся под вопросом.
В настоящем исследовании гиперспектральная визуализация используется для демонстрации возможности дифференциации злокачественных меланом кожи при исследовании обратного рассеяния только в видимой области спектра. В отличие от существующих методик диагностики меланоцитарных опухолей кожи, которые используют данные о спектре обратного рассеяния в видимой и ИК-областях (смотри, например, работу [11]), предлагается использовать данные спектров обратного рассеяния в сравнительно небольшой полосе видимого спектра 520–670 нм. Такой подход позволяет упростить систему регистрации гиперспектральных изображений, что в конечном итоге позволит снизить стоимость используемого в скрининговых обследованиях оборудования. В работе представлены данные анализа коэффициентов обратного рассеяния и оптической плотности для дифференциации злокачественных меланом кожи от доброкачественных невусов.
Материалы и методы
Для регистрации гиперспектральных изображений тканей кожи использовалась гиперспектральная камера производства Научно-технического центра уникального приборостроения РАН (г. Москва). Подробное описание гиперспектральной камеры можно найти в работе [12]. Схема регистрации гиперспектральных изображений приведена на рис. 1, также здесь схематично представлено устройство камеры.
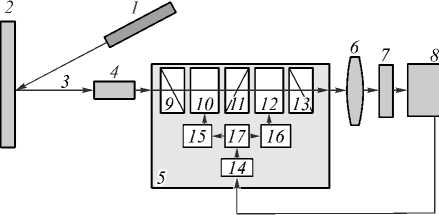
Рис. 1. Схема проведения эксперимента по регистрации гиперспектральных изображений кожи:
1 – широкополосный LED-источник, 2 – образец, 3 – рассеянное назад излучение, попавшее в коллиматор, 4 – коллиматор, 5 – перестраиваемый монохроматор, 6 – объектив, 7 – цифровая камера, 8 – компьютер, 9, 11, 13 – поляризаторы, 10, 12 – акустооптические ячейки, 14 – контроллер, 15, 16 – ВЧ-усилители, 17 – ВЧ-генератор
Излучение широкополосного источника 1 падает на объект исследования 2. Рассеянное назад поле излучения 3 проходит через коллиматор 4 и попадает в аку-стооптический перестраиваемый монохроматор 5, управляемый внешним компьютером 8. Выбор полосы пропускания монохроматора регулируется программно с использованием ПК. По команде пользователя, задающего с персонального компьютера 8 длину волны фильтрации λ, плата контроллера 14 задаёт режим работы высокочастотного генератора 17 и усилителей 15 и 16. Генератор 17 и усилители 15, 16 создают управляющий высокочастотный сигнал, подаваемый на аку-стооптические ячейки 10 и 12, генерирующие звуко- вые волны определённой частоты. При прохождении акустической волны через акустооптическую ячейку (нелинейный кристалл) её оптические свойства меняются таким образом, что происходит фильтрация длин волн излучения и матрицы приёмника (цифровой камеры 7) достигает только излучение на длине волны λ. При этом излучение с длинами волн, отличными от λ, изменяет направление своего распространения и не достигает приёмного устройства.
Исследуемый образец располагался на расстоянии около 1 м от входного коллиматора камеры. Размер регистрируемой области составлял не более 7×7 см. Ширина полосы пропускания при регистрации изображения объекта для выделенной длины волны λ составляла в среднем 2,3 нм. Применение перестраиваемого акустооптического монохроматора позволило получить наборы спектральных изображений в произвольных участках рабочего диапазона гиперспектральной камеры (450–750 нм). Размер изображений составлял 1360×1024 пикселя. Освещение образцов производилось белой LED-лампой мощностью 30 Вт, лампа располагалась на расстоянии 1 м от образца исследований. Форма спектра использованной LED лампы в области 450–750 нм приведена на рис. 2.
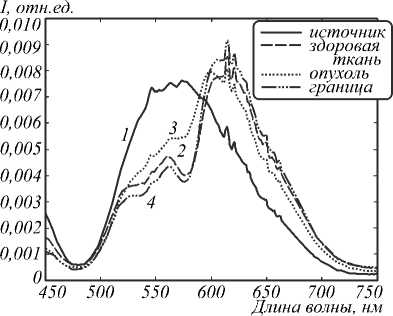
Рис. 2. Нормированная спектральная плотность мощности обратного рассеяния тканей кожи: 1 – меланома, 2 – здоровая кожа, 3 – граница нормальной кожи и меланомы, 4 – спектр LED-лампы
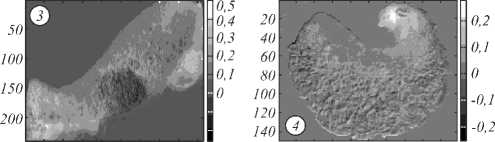
В ходе проведения исследований были зарегистрированы гиперспектральные изображения четырёх образцов ex vivo тканей кожи человека. Образцы биотканей были получены после удаления у пациентов в Самарском областном клиническом онкологическом диспансере. Регистрация гиперспектральных изображений производилась не позднее чем через 24 часа после удаления образований, при этом образцы тканей хранились при температуре +2 – +6 Сº. Образцы образований забирались у пациентов с европейским типом кожи. Каждый образец содержал участок образования и здоровой кожи. Окончательный диагноз по каждому исследованному образцу ставился на основании гистологического исследования. Проведение исследования было одобрено этическим комитетом Самарского государственного медицинского университета. Гистологические секции исследованных образцов представлены на рис. 3.
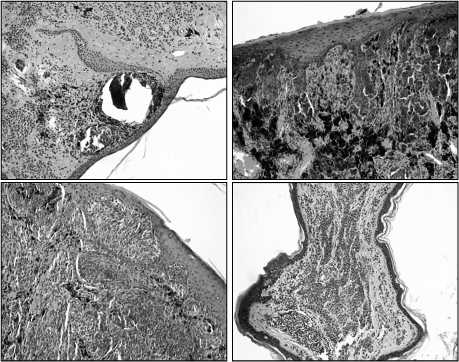
Рис. 3. Гистологические секции исследованных образцов
(увеличение 100×)
Образец №1 – беспигментная эпителиодноклеточ-ная меланома кожи затылочной области с умеренно-выраженной лимфоцитарной инфильтрацией, II уровень инвазивного роста на фоне смешанного невуса. Образец №2 – пигментная меланома кожи поясничной области со слабой митотической активностью, II стадия инвазивного роста. Образец №3 – узловая форма пигментной эпителиодноклеточной меланомы левого плеча с густой лимфоидной инфильтрацией, III стадия инвазивного роста. Образец №4 – папиллярный невус левого плеча.
Для получения количественных оценок о спектре обратного рассеяния различных тканей кожи человека использовались данные об оптической плотности биотканей OD. Оптическая плотность в каждой точке изображения образца ( x, y ) на выделенной длине волны λ определялась как:
OD ( x , y , X ) = 1g I 0 ( x , y , X ) , (1) I ( x , У , X )
где I 0 (x,y, λ) – интенсивность обратного рассеяния от белого эталонного рассеивателя (молочной пластины Ф0-1), I(x,y, λ) – интенсивность обратного рассеяния от измеряемого образца.
Результаты исследования
В видимой области спектра (400–800 нм) основными хромофорами биологических тканей являются гемоглобин и меланин, так как белки и жиры поглощают излучение в более коротковолновой области, а вода – в более длинноволновой. Наличие подобного окна прозрачности биологических тканей определяет применение оптического излучения видимого диапазона для исследования внутренней структуры тонкого поверхностного слоя ткани глубиной до нескольких миллиметров [13]. При этом зависимость коэффициента экстинкции меланина имеет ниспадающую форму в области 450 –750 нм, а форма зависимости коэффициента экстинкции гемоглобина от длины волны в той же спектральной области имеет два локальных максимума вблизи с областями 530 нм и 570 нм. Причём при переходе в более длинноволновую область (600–800 нм) значение коэффициента экстинкции гемоглобина значительно уменьшается и становится на несколько порядков меньше, чем значения коэффициента экстинкции меланина в этой же области.
На рис. 2 представлены нормированные графики спектральной плотности мощности источника излучения и обратного рассеяния тканей кожи. Видно, что по сравнению с тканями нормальной кожи онкологическое образование имеет выраженные особенности в спектре обратного рассеяния как в общей области поглощения гемоглобина и меланина (530 –570 нм), так и в области, где основным поглотителем является только меланин (600 –700 нм). Это связано с тем, что при росте и развитии образования происходит увеличение капиллярной сети в области развития патологии, обусловленное увеличением метаболической активности, так как разрастающемуся образованию требуется больше питания, чем нормальной ткани. Кроме того, использование данных об интенсивности обратного рассеяния в области 600 –700 нм позволяет оценить количество пигментов в исследуемых тканях, так как интенсивность обратного рассеяния в этой спектральной области будет зависеть от концентрации меланина в ткани. Оценка содержания пигментов также может оказаться полезной при дифференциации пигментных образований, таких как меланомы и невусы, вследствие того, что при развитии данных образований происходит не только увеличение капиллярной сети, но изменение в окраске образования. Следовательно, при развитии образований кожи происходят и изменения в концентрации меланина.
Таким образом, для того чтобы уверенно отличать область патологии от нормальной ткани и один тип образования от другого по спектру обратного рассеяния в видимой области, требуется использовать данные о содержании гемоглобина и меланина в тканях. В настоящей работе для дифференциации тканей кожи рассматривались несколько индексов, использующих спектральную информацию в области 500 – 700 нм. Первый индекс – NB (narrow band) использует данные о разностях оптической плотности в области поглощения меланина и гемоглобина:
NB = OD (650) - OD (545)
OD (650) + OD (545)
.
Пример использования данного индекса для визуализации четырёх исследованных образцов представлен на рис. 4. Видно , что использование данных о разнице обратного рассеяния в узких полосах, где поглощают и гемоглобин, и меланин OD(545), и области, где поглощает только меланин OD(650), не даёт уверенно судить о типе исследованного образования. Значения индекса NB лежат в пределах от 0 до 1 как для меланом, так и для невуса. Однако индекс NB позволяет уверенно дифференцировать образования и нормальную кожу, так как значения индекса NB нормальной кожи лежат ниже 0. Таким образом, использование данных о рассеянии тканями в узких полосах может быть использовано для наглядной визуализации топологии кожи и образований, как это демонстрирует рис. 4. Однако индекс
NB непригоден для дифференциации одного типа образований от других.

Рис. 4. Использование индекса NB для визуализации тканей кожи (изображения 5×5 см), 1,2,3 – меланомы, 4 – невус
Для того чтобы провести дифференциацию одного образования от другого, требуется использование интегральных данных об обратном рассеянии тканями в выделенных областях поглощения гемоглобина и меланина. Для этого возможно использование интегральных данных о рассеянии тканями излучения в областях 500 –600 нм и 600– 700 нм.
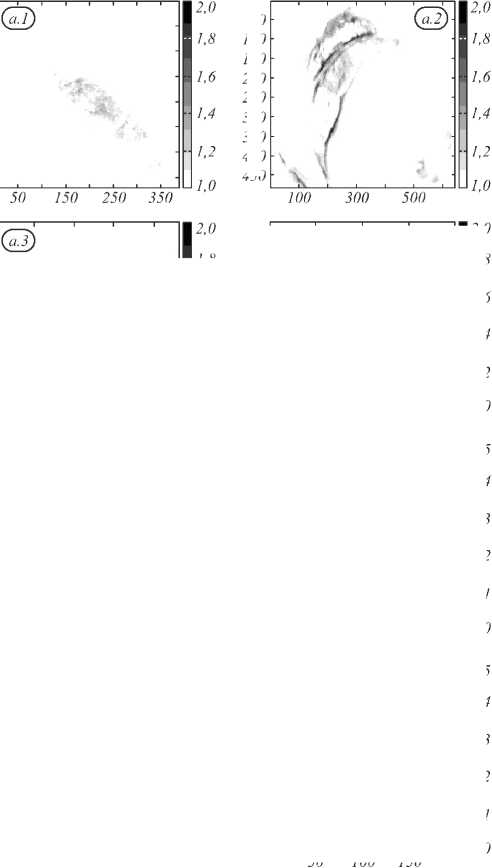
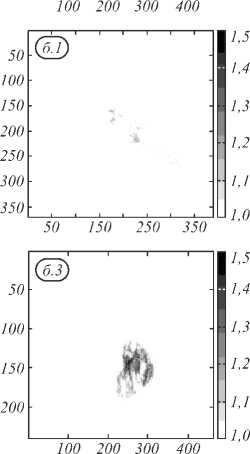
Пример использования интегральных индексов WB (wide band) в областях 520 –600 нм и 600– 650 нм приведён на рис. 5. Индекс WB рассчитывался как:
λ 2
WB ( x , y ) λ 1 , λ 2 = 1 ∫ OD ( x , y , λ ) d λ . (3) λ 2 -λ 1 λ 1
На рис. 5 а приведены значения индекса WB 520,600 , а на рис. 5 б приведены значения индекса WB 600,650 . Рис. 5 содержит пороговые значения индексов WB для оценки возможности выделения только зоны патологии и дифференциации меланом от невусов на основании значения индекса. Видно, что с использованием данных индексов невозможно отличить меланомы от невуса. Также изображения образцов №2 и №3 на рис. 5 а показывают, что индекс WB 520,600 даёт ложноположительные результаты о наличии опухоли в областях нормальной ткани. Поэтому использование индекса WB 520,600 , одновременно показывающего информацию о коэффициентах экстинкции гемоглобина и меланина, нецелесообразно вследствие перекрытия линий поглощения меланина и гемоглобина в области 520–600 нм. Индекс WB 600,650 оказывается более информативен при разделении пигментных образований и кожи, так как несёт информацию только об изменении количества меланина в исследуемой ткани. Однако данный индекс оказывается неинформативным при разделении меланом и невусов, так как для этих образований характерно увеличение количества меланина по сравнению с нормальной кожей.
Чтобы перейти от рассмотрения индексов, учитывающих только содержание меланина или смешанную зависимость гемоглобина и меланина, требуется ввести индексы, показывающие разницу между содержанием гемоглобина и меланина в тка- нях. Одним из таких индексов может быть индекс ND (normalized difference), записывающийся в следующем виде:
ND ( x , y ) λ 1, λ 2
WB ( x , y ) λ 1, λ 2 max( WB ( x , y ) λ 1, λ 2 ) .
50-
100-
150'
350-


200-
1.2
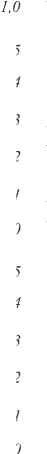
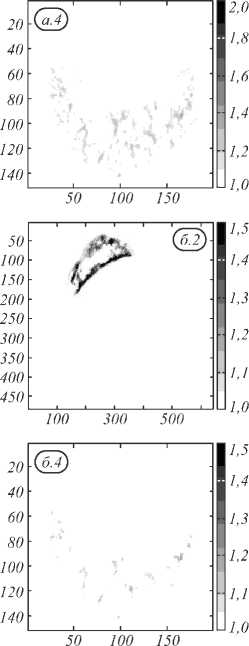
Рис. 5. Использование индекса WB для визуализации тканей кожи (изображения 5×5 см):
1,2,3 – меланомы, 4 – невус, а – область 520 – 600 нм, б – область 600 – 650 нм
На рис. 6 представлена разница индексов ΔND = ND 530,600 – ND 600,670 . Индекс ΔND представляет собой интегральную нормализованную на максимум разницу в содержании гемоглобина и меланина в исследуемой ткани.
Использование индекса ΔND для разделения меланом и невусов снова не даёт положительных результатов. Рис. 6 показывает, что как для меланом, так и для невуса характерны области со значениями индекса ΔND от 0 до 0,2. Таким образом, использование нормированных характеристик содержания гемоглобина и меланина в тканях не может быть устойчивым критерием для определения наличия в коже меланомы и дифференциации злокачественных меланом от доброкачественных образований кожи.

50 150 250 350 100 300 500
50 150 250 350 450 20 60 100 140 180
Рис. 6. Использование индекса ∆ND для визуализации тканей кожи (изображения 5×5 см), 1,2,3 – меланомы, 4 – невус
Для создания устойчивого критерия разделения пигментных образований кожи требуется ввести индекс, учитывающий ненормированную разницу меланина и гемоглобина в ткани, но также учитывающий, что коэффициент экстинкции меланина в областях 500–600 нм и 600–700 нм будет убывать, причём можно считать этот спад квазилинейным [13]. Тогда можно ввести следующий индекс:
D = WB ( x , y ) 530,600 - WB ( x , y ) 600,6 7 0 + OD (670) - OD (600) . (5)
Здесь разница индексов WB 530,600 – WB 600,670 выражает разницу в концентрации меланина и гемоглобина в области 530–600 нм. Добавка OD(670)-OD(600) позволяет точно определить вклад в общую долю рассеянного обратно тканью излучения меланина, так как изначально концентрация меланина определяется исходя из спектра отражения в области 600–670 нм. Далее, учитывая, что коэффициент экстинкции меланина линейно убывает с нарастанием длины волны, для определения вклада меланина в области 530–600 нм требуется ввести добавку, выражающуюся в виде разности оптических плотностей.
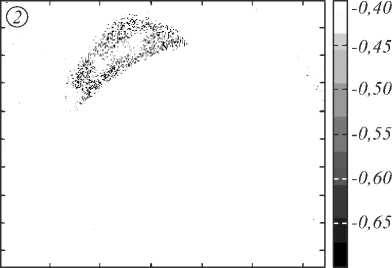
Рис. 7 показывает значения индекса D для измеренных образцов тканей кожи. На рис. 7 представлены только значения индекса D, соответствующие злокачественной меланоме. Т.е. на рисунке введён порог, отделяющий злокачественную меланому от других тканей кожи. Для индекса D этот порог равняется -0,4. Значения, лежащие ниже данного порога, соответствуют меланоме, выше – нормальной коже и невусу. Причём для невуса характерные значения индекса D лежат в пределах от 0 до –0,4, а для нормальной кожи характерны значения выше 0.
Анализ рис. 7 позволяет сказать, что индекс D способен отделять злокачественную меланому от невуса, так как для 4-го образца на рис. 7 (невуса) видны лишь несколько всплесков, которые могут быть объяснены наличием шумов в спектре регистрируемого гиперспектрального изображения. Для всех образцов меланомы наблюдается значение индекса D в пределах от –0,4 до –0,7. Единственный образец, для которого меланома слабо визуализируется, – это образец №1. Однако такая слабая визуализация данного образца с использованием индекса D объясняется типом образо- вания. Согласно проведенной гистологии данный образец содержит переходную стадию образования, где меланома только начинает развиваться из невуса. Именно поэтому область образца №1, соответствующая образованию, содержит не только ткани меланомы, но и ткани невуса, которые отсекает пороговое значение индекса D, выбранное для построения рис. 7.
100 200 300 400 500 600
-0,40
-0,40
-0,45
-0,50
-0,55
-0,60
-0,65
50 100 150 200 250 300 350
-0,45
-0,50
-0,55
-0,60
-0,65
-0,40
-0,45
-0,50
-0,55
-0,60
-0,65
Рис. 7. Использование индекса D для визуализации тканей кожи (изображения 5×5 см), 1,2,3 – меланомы, 4 – невус
Рассматривая все перечисленные индексы, использованные для анализа тканей кожи, можно за-
100 150
ключить, что все они, включая даже простейший индекс NB, позволяют визуализировать кожные образования с помощью гиперспектральной камеры. Однако для дифференциации пигментных образований, таких как меланома и невус, с успехом может использоваться лишь индекс D, основанный на подсчёте разницы в концентрации гемоглобина и меланина между различными типами пигментных образований.
Сравнивая представленный метод с разработанными ранее методиками инструментальной детекции меланом [10, 14– 16], можно заключить, что разработанный метод вполне может конкурировать не только с другими гиперспектральными методами анализа биотканей, но и с такими видами оптического анализа биотканей, как анализ автофлуоресцентного отклика и спектроскопия комбинационного рассеяния. Рассматривая результаты работы [11], можно констатировать, что авторы в качестве диагностического параметра, позволяющего отличить меланому от невуса, предлагают использовать параметр Р = OD(650) + OD(950) -OD(540), обуславливая выбор длин волн спектрами поглощения хромофоров. Предложенный индекс D позволяет добиться таких же результатов по разделению меланом и невусов, хотя для уверенного сравнения результатов предложенной методики с данными других исследований требуется провести более массовые исследования по регистрации и анализу гиперспектральных изображений образований кожи. При этом важно отметить, что в предложенном подходе используется информация только видимого диапазона.
Заключение
Разработанный метод дифференциации пигментных образований кожи человека может стать удобным средством массового скрининга, так как позволяет быстро и с помощью относительно недорогого оборудования выявлять наличие злокачественных меланом. Регистрация гиперспектрального изображения биоткани происходит в течение 15–20 секунд, поэтому предложенная методика диагностики меланомы может применяться непосредственно в клиниках. Кроме того, в предложенном подходе в качестве источника излучения используется только LED-осветитель белого света. Всё это делает использованную в исследовании систему надёжным, быстрым и недорогим способом массового контроля пигментных образований кожи у населения.
Сравнение результатов, полученных с использованием экспериментальной установки, описанной в данной работе, с существующими методами контроля меланом гиперспектральными методами [11] позволяет сказать, что разработанный подход даёт возможность обнаруживать злокачественные меланомы и использует для этого спектральный отклик кожи только в видимой области спектра. Рассмотрение схожих подходов диагностики меланомы, использующих информацию об обратном рассеянии тканей кожи в видимой области спектра [14], также свиде- тельствует в пользу предложенной экспериментальной методики. В работе [14] авторам удалось применить гиперспектральную съёмку в видимой области лишь для ex vivo диагностики пигментных образований кожи, в то время как предложенный метод диагностики меланоцитарных образований позволят с успехом работать и с живыми объектами, включая пациентов клиник. Кроме того, предложенный метод может стать частью более сложной системы оптического контроля биотканей за счёт совмещения результатов исследования с данными, полученными другими оптическими средствами контроля [9, 15].
Дальнейшее развитие предложенной системы возможно в нескольких направлениях. Первое – проведение массовых in vivo и ex vivo исследований как с образцами образований кожи, так и с образцами других тканей человека для установления точных диагностических возможностей предлагаемой методики, а также для сравнения точности предлагаемой методики дифференциации онкологических образований с данными диагностической точности других оптических методов контроля онкологических образований. Второе направление развития предлагаемой методики – создание автоматического алгоритма контроля онкологических образований, который бы позволял определять присутствие и тип онкологического образования на основе данных спектров обратного рассеяния с использованием оборудования, описанного в данной статье. Таким образом, предлагаемый подход к проведению массового онкологического скрининга позволит существенно увеличить точность диагностики онкологических патологий на приёме у врачей первого звена.
Работа выполнена при поддержке Минобрнауки РФ и гранта РФФИ № 15-32-51170.
Список литературы Гиперспектральная визуализация патологий кожи в видимой области
- Злокачественные опухоли в России в 2013 г. (Заболеваемость и смертность)/А.Д. Карпин, В.В. Старинский, Г.В. Петрова. -М.: Министерство образования и науки РФ, 2015. -250 с.
- Boyle, P. World Cancer Report 2008/P. Boyle, B. Levin. -Lyon: International Agency for Research on Cancer, 2008. -ISBN 978-92-832-0423-7.
- Lui, H. Real-time Raman spectroscopy for in vivo skin cancer diagnosis/H. Lui, J. Zhao, D. McLean, H. Zeng//Cancer Research. -2012. -Vol. 72(10). -P. 2491-2500. -DOI: DOI: 10.1158/0008-5472
- Borisova, E.G. Endogenous and Exogenous Fluorescence Skin Cancer Diagnostics for Clinical Applications/E.G. Borisova, L.P. Angelova, E.P. Pavlova//IEEE Journal of Selected Topics in Quantuum Electronics. -2014. -Vol. 20(2). -7100412. -DOI: DOI: 10.1109/JSTQE.2013.2280503
- Vakoc, B.J. Cancer imaging by optical coherence tomography: preclinical progress and clinical potential/B.J. Vakoc//Nature Reviews Cancer. -2012. -Vol. 12. -P. 363-368.
- Zhao, J. Real-time Raman spectroscopy for noninvasive in vivo skin analysis and diagnosis/J. Zhao, H. Lui, D.I. McLean, H. Zeng//New Developments in Biomedical Engineering. -2010. -Vol. 24. -P. 455-474.
- Zakharov, V.P. Combined Raman spectroscopy and autofluoresence imaging method for in vivo skin tumor diagnosis/V.P. Zakharov, I.A. Bratchenko, O.O. Myakinin, D.N. Artemyev, Y.A. Khristoforova, S.V. Kozlov, A.A. Moryatov//Proceedings of SPIE: The International Society for Optical Engineering. -2014. -Vol. 9198. -919804. -DOI: DOI: 10.1117/12.2186095
- Fenn, M.B. Raman spectroscopy for clinical oncology/M.B. Fenn//Advances in Optical Technologies. -2011. -Vol. 201. -213783.
- Zakharov, V.P. Comparative analysis of combined spectral and optical tomography methods for detection of skin and lung cancers/V.P. Zakharov, I.A. Bratchenko, D.N. Artemyev, O.O. Myakinin, D.V. Kornilin, S.V. Kozlov, A.A. Moryatov//Journal of Biomedical Optics. -2015. -Vol. 20(2). -025003. -DOI: DOI: 10.1117/1.JBO.20.2.025003
- Lu, G. Medical hyperspectral imaging: a review/G. Lu, B. Fei//Journal of Biomedical Optics. -2014. -Vol. 19(1). -010901.
- Diebele, I. Clinical evaluation of melanomas and common nevi by spectral imaging/I. Diebele, I. Kuzmina, A. Lihachev, J. Kapostinsh, A. Derjabo, L. Valeine, J. Spigulis//Biomedical Optics Express. -2012. -Vol. 3(3). -P. 467-472.
- Machihin, A. Double-AOTF-based aberration-free spectral imaging endoscopic system for biomedical applications/A. Machihin, V. Pozhar//Journal of Innovative Optical Health Sciences. -2015. -Vol. 8(3). -1541009. - DOI: 10.1142/S1793545815410096
- Zonios, G. Skin melanin, hemoglobin, and light scattering properties can be quantitatively assessed in vivo using diffuse reflectance spectroscopy/G. Zonios, J. Bykowski, N. Kollias//Journal of Investigative Dermatology. -2001. -Vol. 117(6). -P. 1452-1457.
- Dicker, D.T. Differentiation of normal skin and melanoma using high resolution hyperspectral imaging/D.T. Dicker, J. Lerner, P. Van Belle, S.F. Barth, D. Guerry 4th, M. Herlyn, D.E. Elder, W.S. El-Deiry//Cancer Biology & Therapy. -2006. -Vol. 5(8). -P. 1033-1038.
- Huang, Z. Raman Spectroscopy in Combination with Background Near-infrared Autofluorescence Enhances the In Vivo Assessment of Malignant Tissues/Z. Huang, H. Lui, D.I. McLean, M. Korbelik, H. Zeng//Photochemistry and Photobiology. -2005. -Vol. 81(5). -P. 1219-1226. -DOI: 10.1562/2005-02-24-RA-449.


