Гиперспектральный in vivo анализ хромофоров нормальной кожи и визуализация онкологических патологий
Автор: Шерендак Виолетта Павловна, Братченко Иван Алексеевич, Мякинин Олег Олегович, Вольхин Павел Николаевич, Христофорова Юлия Александровна, Морятов Александр Александрович, Мачихин Александр Сергеевич, Пожар Витольд Эдуардович, Козлов Сергей Васильевич, Захаров Валерий Павлович
Журнал: Компьютерная оптика @computer-optics
Рубрика: Обработка изображений, распознавание образов
Статья в выпуске: 4 т.43, 2019 года.
Бесплатный доступ
В работе представлены результаты тестирования методов бесконтактной диагностики новообразований кожи, основанные на регистрации снимков, полученных с помощью гиперспектральной камеры с акустооптическим перестраиваемым фильтром. Для идентификации онкологических патологий предложен интегральный спектральный индекс по множеству концентрических областей вокруг источника роста новообразования исследуемой биоткани. Введенный индекс позволяет, наряду с изменением спектральных свойств ткани, косвенно учесть классические дерматоскопические параметры ABCD: асимметрию, неровность границ, цветовое разнообразие, диаметр новообразования. Приведены результаты разделимости обучающей выборки, и показана возможность применения предложенных подходов в клинической практике.
Гиперспектральная визуализация, хромофоры, меланин, гемоглобин, онкопатология, меланома, базально-клеточный рак, акустооптический видеоспектрометр, оптическая плотность, хромофорный индекс, классификация
Короткий адрес: https://sciup.org/140246499
IDR: 140246499 | DOI: 10.18287/2412-6179-2019-43-4-661-670
Текст научной статьи Гиперспектральный in vivo анализ хромофоров нормальной кожи и визуализация онкологических патологий
Рак является одним из наиболее опасных и ежегодно прогрессирующих по количеству больных заболеваний. По данным Международного агентства по исследованию рака, за 2012 год было выявлено около 14,1 миллиона новых случаев рака во всем мире, а имеющиеся оценки позволяют заявить, что прогнозируется существенное увеличение (до 19,3 миллиона) новых случаев рака в год к 2025 году в связи с ростом численности населения и повышением его среднего возраста. Рак кожи является одним из наиболее распространённых форм рака [1]. Например, базальноклеточный рак кожи является наиболее часто встречающимся типом рака в мире и составляет около 75% из всех немеланомных злокачественных образований кожи. Меланома, напротив, имеет наименьший показатель заболеваемости в мире (9%), но занимает первое место по смертности (75 %) среди всех форм рака кожи [2, 3].
Аналогичные тенденции по увеличению заболеваемостью раком наблюдаются и в России. Например, по данным Московского научно-исследовательского онкологического института имени П.А. Герцена, заболеваемость населения России злокачественными новообразованиями в 2015 году составила 589341 случай [4]. Одной из главных локализаций в общей (оба пола) структуре онкологической заболеваемости является кожа (14,2%) – второе место среди всех онкологических патологий у женщин и 3 место у мужчин [4]. Прирост заболеваемости злокачественными новообразованиями кожи с 2005 по 2015 года составляет 31,47 %, в том числе прирост по меланоме – 34,84%.
Учитывая поверхностную локализацию опухоли на коже, наиболее удобным способом её раннего выявления является профилактический осмотр. При раннем обнаружении опухоли пациент имеет более высокие шансы на выздоровление [5]. Однако визуального осмотра для выявления меланомы на ранней стадии обычно бывает недостаточно – точность диагностики пигментных опухолей кожи на ранней стадии (особенно непрофильными специалистами) не превышает 50% [5] по причине видимой схожести меланомы с невусом.
Различные виды биопсии тканей кожи, как правило, не применяются, поскольку могут привести к негативным последствиям из-за «агрессивного» поведения и высоких рисков метастазирования злокачественного образования [6]. В связи с этим исследования многих научных групп направлены на разработку именно неинвазивных методов первичной диагностики различных типов онкологических патологий кожи. Диагностическая эффективность таких методов, как компьютерная томография и магнитно-резонансная томография из-за недостаточного пространственного разрешения резко падает для опухолей малого диаметра (менее 1,5 мм), характерных для ранних стадий меланомы [7]. В таких случаях более точную оценку злокачественности образований кожи возможно получить с примением оптических методов диагности- ки, таких как: цифровая дерматоскопия [8], Рамановская спектроскопия [9, 10] и гиперспектральная визуализация [11].
Цифровая дерматоскопия является одним из наиболее широко используемых клинических методов диагностики. Основой цифровой дерматоскопии является анализ увеличенного RGB-изображения исследуемой опухоли на предмет асимметричности и неоднородности ее свойств, рассматриваемых в виде ABCD-признаков [15]: асимметрия (assymetry – A), неровность границ (border – B), характер многообразия цветов и их распределение (color – C) и диаметр новообразования (diameter – D). Гиперспектральная визуализация (ГСВ, Hyperspectral imaging) позволяет исследовать как форму опухоли, так и её компонентный состав и его распределение, используя особенности в спектрах поглощения различных хромофоров. Несмотря на то, что ГСВ сравнительно недавно стала использоваться в медицинских исследованиях, она уже нашла широкое применение в различных прикладных областях медицины [12]. Одни из лучших результатов по применению ГСВ для диагностики рака кожи были получены Nagaoka с соавторами [13, 14]: чувствительность определения меланомы от других форм рака составила 90% при специфичности 84%. Такая высокая точность диагностики онкопатологий кожи мотивирует разработку новых подходов для in vivo диагностики злокачественных новообразований кожи с использованием ГСВ.
Фактически ГСВ выглядит естественным обобщением цифровой дерматоскопии, в которой используются три спектральных канала. В случае ГСВ, наряду со стандартными ABCD-признаками, осуществляется как детальный спектральный анализ («расширение» признака C), так и возможна оценка неоднородности и асимметрии/неоднородности пространственного распределения различных хромофоров опухоли.
В качестве основного количественного диагностического признака предлагается использовать интегральный индекс оптической плотности, введенный в работе [5] и вычисляемый в видимом диапазоне длин волн (450–750 нм) по областям преимущественного поглощения меланина и гемоглобина – двух основных хромофоров кожи, количественное изменение которых говорит о большом риске малигнизации ткани [16] и приводит к изменению цвета кожи, формы образований, появлению атипичных сосудистых и пигментных паттернов [17]. В настоящем исследовании данный подход используется для дифференциации различных злокачественных новообразований кожи от доброкачественных. В группе злокачественных образований исследовались меланома (Malignant Melanoma – MM) и базально-клеточный рак (Basal Cell Carcinoma – BCC), в группе доброкачественных заболеваний (Benign – BN) – кератомы, гемангиомы и невусы. В работе проведён качественный анализ изменений значений спектральных индексов оптической плотности и их распределения для различных тканей кожи и вариантах выделения области патологии. В качестве быстрой оцен- ки неоднородности и формы новообразования используются данные об изменении предложенного интегрального индекса по набору рассматриваемых муль-тимасштабных концентрических областей исследуемой биоткани. Результаты проведенного анализа позволяют производить классификацию злокачественных и доброкачественных образований, одновременно используя спектральные признаки (малигнизации ткани), атипичные паттерны и пространственные дерматоскопические признаки.
Система регистрации спектральных изображений
Для регистрации спектральных изображений использовался акустооптический (АО) видеоспектрометр, структурная схема которого представлена на рис. 1.
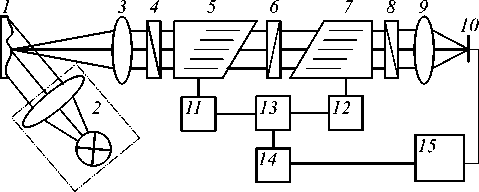
Рис. 1. Схема проведения эксперимента по регистрации спектральных изображений кожи.
1 – исследуемый образец, 2 – широкополосный светодиодный источник, 3 – входной телеобъектив, 5, 7 – АО-ячейки, 4, 6, 8 – поляризаторы, 9 – объектив, 10 – монохромная видеокамера, 11, 12 – ВЧ-усилители, 13 – ВЧ-генератор, 14 – контроллер, 15 – компьютер Отраженное и рассеянное исследуемым образцом 1 широкополосное излучение светодиодного источника 2 преобразуется входным телеобъективом 3 в коллимированный пучок и направляется на перестраиваемый акустооптический монохроматор, состоящий из двух АО-ячеек 5 и 7 и трёх поляризаторов: входного 4, промежуточного 6 и выходного 8. Особенностью АО-монохроматора является двойная последовательная фильтрация. Она обеспечивает практически полную компенсацию пространственных и спектральных искажений изображения, вызываемых дифракцией Брэгга в одиночной анизотропной АО-ячейке, и, как следствие, измерение спектров в отдельных точках изображения [18]. В предлагаемой схеме в двух идентичных АО-ячейках 5 и 7 последовательно происходит дифракция обыкновенной и необыкновенной волн. Вторая ячейка 7 повернута вокруг первой АО-ячейки 5 в плоскости дифракции на 180°, то есть световая волна идет в ней в этой плоскости в обратном направлении по сравнению с первой АО-ячейкой. Плоскость поляризации поляризатора 6 ортогональна плоскости поляризации ориентированных одинаково поляризаторов 4 и 8. В АО-ячейке 5 оптическое излучение, длина волны λ которого соответствует условию синхронизма, дифрагирует на динамической решётке, создаваемой акустической волной заданной частоты f. В результате дифракции излучение меняет свою линейную поляризацию с обык- новенной на необыкновенную, выделяемую поляризатором 6. Аналогично происходит повторная дифракция в АО-ячейке 7, что повышает контраст выделенной спектральной составляющей при полной компенсации как линейной, так и нелинейной дисторсии. Далее с помощью объектива 9 отфильтрованное излучение с длиной волны λ фокусируется на матрице монохромной видеокамеры 10. Изменяя частоту f акустической волны, пьезоэлектрически возбуждаемой в АО-ячейках 5 и 7 высокочастотными (ВЧ) электрическими сигналами, вырабатываемыми ВЧ-генератором 8 и ВЧ-усилителями 11 и 12 по командам персонального компьютера 15 через контроллер 14, можно перестраивать период дифракционной решетки одновременно в обеих АО-ячейках и получать изображение объекта 1 на произвольной задаваемой длине волны λ в диапазоне 440–750 нм с достаточно высоким спектральным (δλ=2,5 нм при λ=633 нм) и пространственным (0,14 мм) разрешением.
Образцы тканей кожи
Регистрация гиперспектральных изображений производилась в Самарском областном клиническом онкологическом диспансере. В эксперименте участвовали 15 человек, из которых 9 женщин, 6 мужчин. Получены информационные согласия каждого испытуемого. Проведение исследования было одобрено этическим комитетом Самарского государственного медицинского университета. Предварительный диагноз каждого из исследованных образований кожи и описание их локализации сведены в табл. 1. Окончательный диагноз по каждому исследованному образцу ставился на основании гистологического исследования.
Анализ гиперспектральных изображений.Расчет оптической плотности
Методика исследования и примеры спектров ГСВ новообразований кожи в видимой области спектра описаны в работе [5]. Результаты ранее представленной работы были дополнены предобработкой изображений для компенсации непроизвольных движений пациента (что является критически важным при проведении in vivo исследований в отличие от ex vivo ) и последующим двухэтапным анализом с дифференциацией злокачественных опухолей. Алгоритм предварительной обработки in vivo гиперспектральных изображений биотканей состоит из компенсации артефактов движения и оценки распределения яркости источника 1 0 ( x , y , X ) Более подробное описание предобработки и стабилизации гиперспектральных изображений можно найти в работе [19]. Последующий анализ образцов тканей кожи включал оценки содержания хромофоров: гемоглобина (Hb) и меланина (M). В каждой точке изображения образца ( x , y ) рассчитывалась оптическая плотность биоткани (Optical Density – OD) на выделенной длине волны λ:
OD ( x , y , X ) = lg I о ( x , y , X ) , (1)
I ( x , У , X )
где I 0 ( x , y ,λ) – интенсивность обратного рассеяния от белого эталонного рассеивателя (молочной пластины Ф0-1), I ( x , y , λ ) – интенсивность обратного рассеяния от измеряемого образца.
Злокачественные новообразования, в частности меланома, имеют выраженные особенности в спектре обратного рассеяния в области поглощения гемоглобина и меланина (530–570 нм), и в области с единственным основным поглотителем – меланином (600–700 нм) [19]. Следовательно, можно провести дифференциацию опухолей по оценке средних значений концентрации основных хромофоров кожи, используя интегральные индексы I для выбранных диапазонов длин волн; для гемоглобина - индекс H ( Xe [530; 570]), для меланина -индекс М ( Xe [600; 670]):
. X 2
I i ( x , y ) =-------J OD ( x , y , X ) d X . (2)
X 2 -X i X 1
Результаты исследований.Выбор области вычисления
На первом этапе анализа индексы (2) рассчитывались для всей поверхности патологии, а участок здоровой кожи такой же площади выделялся в пределах 2–4 см от области патологии. Это позволяет представить каждое новообразование в виде точки на фазовой плоскости (рис. 2), оси которой представляют значение нормированного индекса, пропорционального концентрации определенного хромофора в измеряемом образце ткани кожи.
Анализ рис. 2 позволяет произвести разделение различных классов образований с применением линейного дискриминантного анализа. После проведения анализа распределения концентраций меланина и гемоглобина для 15 исследованных образцов было установлено, что точность разделения доброкачественных и злокачественных образований составляет 90%. Такие же показатели точности (см. рис. 2) наблюдаются при дифференциации меланомы от доброкачественных образований.
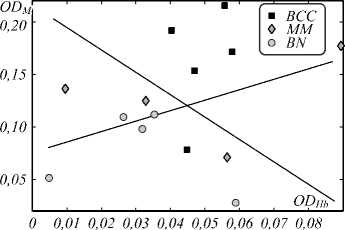
Рис. 2. Фазовая плоскость индексов оптической плотности распределения хромофоров в исследованных образцах кожи
Оценка влияния величины площади исследования на точность классификации новообразований
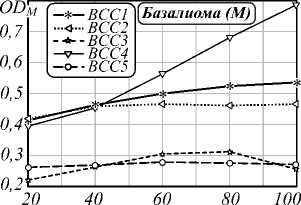
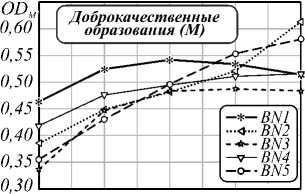
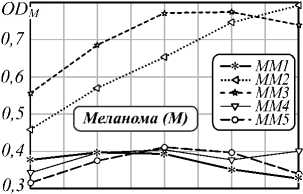
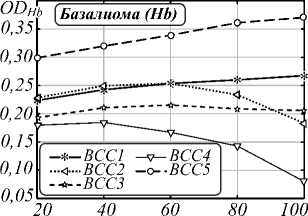
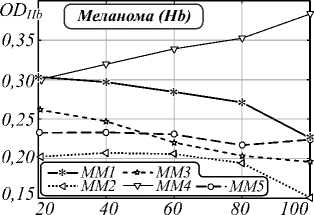
На втором этапе исследования была проведена оценка влияния распределения плотности хромофоров (гемоглобина и меланина) и точности выделения границы области патологии на установление типа кожных образований. Чаще всего меланома разраста- ется лучеобразно от своего «центра» на фоне уже существующего пигментного невуса. Для проведения анализа «центр» каждого образования выбирался равноудаленно от краев образования. Четыре концентрические области, используемые в анализе, строились следующим образом: вокруг «центра» образова- ния описывалась окружность возрастающего диаметра, пока края образования не окажутся внутри образованного «круга». Графики зависимости математического ожидания индексов меланина и гемоглобина от выбранной площади представлены на рис. 3, 5.
а)
Диаметр окружности, %
40 60 80 100
Диаметр окружности, %
б)
20 в)
40 60 80 100
Диаметр окружности. %
Табл. 1. Статистика по исследованным пациентам
|
№ |
Пол |
Локализация |
Предварительный диагноз |
Гистологическое заключение |
|
1 (BCC1) |
ж |
голова |
гемангиома |
базально-клеточный рак |
|
2 (BCC2) |
м |
грудная клетка |
базалиома |
базально-клеточный рак |
|
3 (BCC3) |
ж |
плечо |
базалиома, меланома |
базально-клеточный рак |
|
4 (BCC4) |
ж |
голова |
базалиома, меланома |
базально-клеточный рак |
|
5 (BCC5) |
м |
спина |
меланома |
базально-клеточный рак |
|
6 (BN1) |
ж |
лобковая область |
кератома |
кератома |
|
7 (BN2) |
ж |
спина |
пигментный невус |
смешанный невус |
|
8 (BN3) |
ж |
шея – надключичная область |
меланома |
кавернозная гемангиома |
|
9 (BN4) |
ж |
подмышечная впадина |
невус |
смешанный невус |
|
10 (BN5) |
м |
правое бедро |
гемангиома |
гемангиома |
|
11 (MM1) |
ж |
спина |
меланома |
пигментная меланома |
|
12 (MM2) |
м |
левая поясничная область |
меланома |
пигментная меланома, II уровень инвазии |
|
13 (MM3) |
ж |
нога |
меланома |
эпителиоидная меланома, II уровень инвазии |
|
14 (MM4) |
м |
рука |
меланома |
беспигментная меланома, III уровень инвазии |
|
15 (MM5) |
м |
грудная клетка |
меланома |
пигментная меланома, III уровень инвазии |
Pис. 3. Зависимость индекса меланина кожных патологий от выбора диаметра образования: базалиом (a), доброкачественных новообразований (б) и меланом (в)
В табл. 2 показан относительный показатель вариативности индекса для каждого образца δ=1–Min/Max, где Min и Max – это минимальное и максимальное значение индекса для одного исследуемого образования.
Данный показатель позволяет оценить, насколько сильно индекс изменялся в пределах своего диапазона, ограниченного его максимальным значением. Из табл. 2 легко заметить, что этот показатель больше у меланом-ных образцов в отличие от образцов с доброкачественными образованиями, если в качестве основного классифицирующего индекса выбрать гемоглобин. При этом индекс меланина является неинформативным для данного случая. Вышеизложенное полностью коррелирует с нашими прошлыми исследованиями с помощью спектроскопии обратного рассеяния [16].
Для наглядности на рис. 4 приведены RGB-изображения патологий кожи, которым соответствуют значения графиков BCC4 и BCC5 ( a , б ), BN3 и BN4 ( в , г ), MM2 и MM4 ( д , е ).
Табл. 2. Показатели вариативности индексов меланина δ (M) и гемоглобина δ (Hb)
|
δ(M) |
δ(Hb) |
|
|
BCC1 |
0,23 |
0,16 |
|
BCC2 |
0,10 |
0,28 |
|
BCC3 |
0,29 |
0,10 |
|
BCC4 |
0,50 |
0,57 |
|
BCC5 |
0,06 |
0,19 |
|
BN1 |
0,14 |
0,10 |
|
BN2 |
0,37 |
0,16 |
|
BN3 |
0,31 |
0,08 |
|
BN4 |
0,19 |
0,11 |
|
BN5 |
0,39 |
0,09 |
|
MM1 |
0,18 |
0,25 |
|
MM2 |
0,42 |
0,27 |
|
MM3 |
0,28 |
0,25 |
|
MM4 |
0,15 |
0,22 |
|
MM5 |
0,23 |
0,07 |
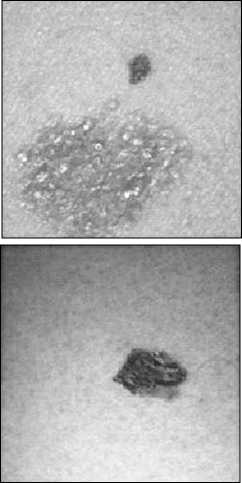
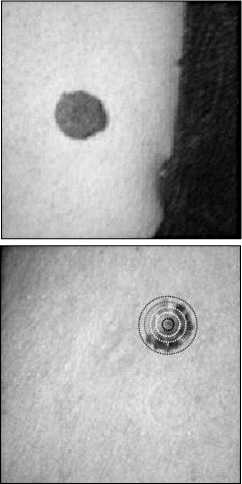
Рис. 4. Изображения патологий кожи: базально-клеточный рак (а, б), доброкачественные новообразования (в, г), меланома (д, е). На рисунке (е) показаны концентрические области
а)
Диаметр окружности, %
б)

Диаметр окружности, %
Рис. 5. Зависимость индекса гемоглобина в новообразованиях от изменения диаметра исследуемой области
в)
Диаметр окружности, %
Большой разброс в получаемых значениях индексов для различных оцениваемых диаметров является следствием более интенсивной пигментации в центре опухоли, предположительно включающей струпное образование и неровные границы (рис. 4б). Показатель вариативности δ(M) BN3 и BN4 (рис. 3б)– 0,31 и 0,19 соответственно, что характеризуется нечеткой морфологией и неоднородной пигментацией патологий. Таким образом резкие перепады значений индексов, возникают из-за неровностей границ исследуемого объекта, шелушения, секреции желез и развития раневого процесса. Следствием неровности границ является высокое значение вариативности рассчитываемых нормированных индексов.
На рис. 5 изображены графики зависимости содержания гемоглобина в образовании от диаметра исследуемой области. Значения вариативности индексов меланина δ(Hb) BCC2 и BCC1 (рис. 5 a ) составляет 0,28 и 0,16 соответственно. Разброс значений графика BCC2 характеризуется наличием неоднородной пигментации (рис. 6 a , б ). Вариативность BN2 и BN3 (рис. 5 б ) составляет 0,16 и 0,08 соответственно. Кератома BN1, изображенная на рис. 6 в , имеет эллипсоидную форму, а расчеты индексов выполнялись с помощью концентрических областей, поэтому вариативность δ(Hb) составляет 0,10. Вариативности MM2 и MM1 равны 0,27
и 0,25 соответственно. Данные значения показывают, что меланомы имеют наибольшее отклонение при расчете индекса Hb в силу неоднородной пигментации и нечетких контуров образования. Поэтому предложенные индексы могут использоваться в качестве аналога правила ABCD.
Введение граничного значения показателей вариативности для исследования гемоглобина на уровне 0,15 позволяет добиться в представленном подходе точности диагностики меланом и злокачественных образований на уровне 80 % по показателю чувствительность и 90– 100 % – специфичность. Рассматри- вая аналоги предложенного подхода, можно сказать, что наиболее часто сегодня используется мультис-пектральный анализ, причем часто используются дополнительные спектральные диапазоны. Например, в работах [20, 21] предлагается использовать область спектра до 1000 нм. Итоговая чувствительность и специфичность при разделении меланомы от невуса и базально-клеточного рака составила 97% и 96 % соответственно. Однако данный подход потребует дополнительный монохроматор для ближнего ИК-диапазона, что значительно усложняет конструкцию используемой гиперспектральной камеры. В работах [13, 14] предлагается индекс, описывающий неоднородность новообразования, что является по сути та- ким же аналогом цветового индекса в дерматоскопии, как и индексы, предложенные в данной работе. При этом чувствительность определения меланом составила 90 %, а специфичность – 84 % [14].
В работе [13] аналогичные результаты получены также на малом количестве образцов (в исследуемую когорту входило всего пять меланом). В работе [22] авторы показали чувствительность 90% и специфичность 86 % для определения меланом с использованием гиперспектральной камеры в видимом и ближнем ИК-диапазонах. В работах [23, 24] описан пространственный подход к оценке диагностических дерматоскопических признаков ABCD на основе свёрточных нейронный сетей. Авторами [23, 24] заявлены максимальные чувствительность и специфичность диагностики меланомы на уровне 90 % и 85 % соответственно. Отсюда следует, что предложенная методика анализа гиперспектральных изображений кожи в видимой области спектра является более простой и в то же время более точной альтернативой используемым подходам.
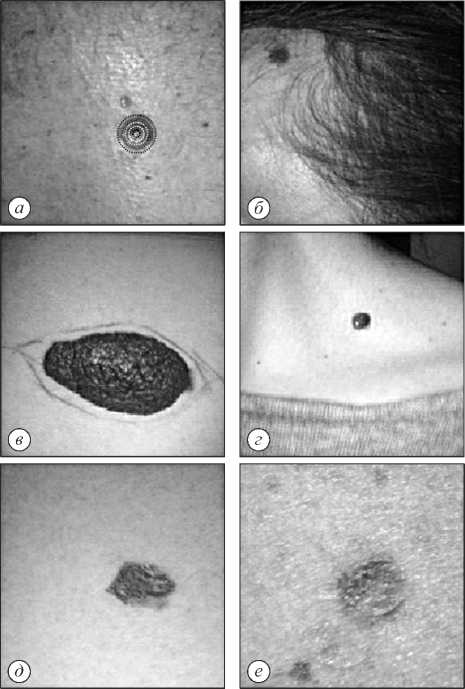
Рис. 6. Изображения кожных патологий: базально-клеточный рак кожи (a, б), доброкачественные образования (в, г), меланома (д, е). На рисунке (а) показаны концентрические области
Заключение
Изменение концентраций меланина и гемоглобина в новообразовании по сравнению со здоровой областью кожного покрова дает представление о степени злокачественности образования и его природе. Ис- пользование принципа пространственной вариативности данных веществ позволяет повысить надежность и точность диагностирования патологии, а их визуализация дает удобный инструмент пространственной локализации опухоли. Выбор видимого диапазона в качестве области исследования химического состава кожного покрова обусловлен тем обстоятельством, что именно в этом диапазоне (450–750 нм) основными поглотителями являются меланин и гемоглобин. Расширение же диапазона в ИК-область приводит к значительному усложнению установки без существенного повышения ее эффективности.
Следует отметить, что в предложенном подходе процесс обработки гиперспектральных данных производится в режиме реального времени и не требует вмешательства оператора. В целом, простота оборудования и быстрота обработки результатов позволяет адаптировать метод для использования в задачах массового скрининга онкопатологий кожи.
В дальнейших работах по развитию предлагаемого подхода планируется увеличение количества исследованных образцов тканей кожи для уточнения данных о чувствительности и специфичности метода. Кроме того, одно из основных преимуществ предлагаемого подхода состоит в возможности его быстрой реализации с помощью параллельной архитектуры вычислений: мультимасштабный метод вычисления интегральных признаков обладает естественным параллелизмом по данным. Кроме того, изменяя положения центра набора концентрических областей, потенциально можно в дальнейшем более точно вычислять такие клинические характеристики ABCD, как неоднородность формы и цветовых распределений, на микроконтроллерах как с последовательной, так и с параллельной архитектурой.
Работа выполнена при поддержке РФФИ в рамках проекта № 17-32-50045 мол_нр и гранта Президента Российской Федерации для государственной поддержки молодых российских ученых (проект МК-1888.2019.2).
Список литературы Гиперспектральный in vivo анализ хромофоров нормальной кожи и визуализация онкологических патологий
- Parkin, D.M. Global cancer statistics, 2002 / D.M. Parkin, F. Bray, J. Ferlay, P. Pisani // CA: A Cancer Journal for Clinicians. - 2005. - Vol. 5, Issue 2. - P. 74-108. - DOI: 10.3322/canjclin.55.2.74
- World cancer report 2008 / ed. by P. Boyle, D. Parkin. - Lyon: International Agency for Research on Cancer, 2008. - 511 p.
- Siegel, R. Cancer statistics, 2012 / R. Siegel, D. Naishadham, A. Jemal // CA Cancer J Clin. - 2012. - Vol. 62. - P. 10-29. - DOI: 10.3322/caac.20138
- Злокачественные новообразования в России в 2015 году (заболеваемость и смертность) / А.Д. Каприн, В.В. Старинский, Г.В. Петрова. - M.: МНИОИ им. П.А. Герцена - филиал ФГБУ "НМИРЦ" Минздрава России, 2017. - 250 c.
- Братченко, И.А. Гиперспектральная визуализация патологий кожи в видимой области / И.А. Братченко, М.В. Алонова, О.О. Мякинин, А.А. Морятов, С.В. Козлов, В.П. Захаров. // Компьютерная оптика. - 2016. - Т. 40, № 2. - С. 240-248. - DOI: 10.18287/2412-6179-2016-40-2-240-248
- Gross, P.E. Challenges to effective cancer control in China, India, and Russia / P.E. Gross, K. Strasser-Weippl, BL. Lee-Bychkovsky, [et al.] // The Lancet Oncology. - 2014. - Vol. 15. - P. 489-538. -
- DOI: 10.1016/S1470-2045(14)70029-4
- Majoie, С. Perineural tumor extension of facial malignant melanoma: CT and MRI / C. Majoie // Journal of Computer Assisted Tomography. - 1991. - Vol. 15. - P. 570-574.
- Argenziano, G. Dermoscopy of pigmented skin lesions - a valuable tool for early diagnosis of melanoma / G. Argenziano, H.P. Soyer // The Lancet Oncology. - 2001. - Vol. 2, Issue 7. - P. 443-449. -
- DOI: 10.1016/S1470-2045(00)00422-8
- Bratchenko, I.A. Combined Raman and autofluorescence ex vivo diagnostics of skin cancer in near-infrared and visible regions / I.A. Bratchenko, D.N. Artemyev, O.O. Myakinin, et al. // Journal of Biomedical Optics. - 2017. - Vol. 22, Issue 2. - 027005. -
- DOI: 10.1117/1.JBO.22.2.027005
- Lim, L. Clinical study of noninvasive in vivo melanoma and nonmelanoma skin cancers using multimodal spectral diagnosis / L. Lim, B. Nichols, M. Migden, et al. // Journal of Biomedical Optics. - 2014. - Vol. 19, Issue 11. - 117003. -
- DOI: 10.1117/1.JBO.19.11.117003
- Calin, M.A. Hyperspectral imaging in the medical field: Present and future / M.A. Calin, V. Sorin, D. Savastru, M. Dragos // Applied Spectroscopy Reviews. - 2014. - Vol. 49. - P. 435-447. -
- DOI: 10.1080/05704928.2013.838678
- Calin, M.A. Hyperspectral imaging-based wound analysis using mixture-tuned matched filtering classification method / M.A. Calin, T. Coman, S.V. Parasca, et al. // Journal of Biomedical Optics. - 2015. - Vol. 20, Issue 4. - 046004. -
- DOI: 10.1117/1.JBO.20.4.046004
- Nagaoka, T. A possible melanoma discrimination index based on hyperspectral data: A pilot study / T. Nagaoka, A. Nakamura, H. Okutani, et al. // Skin Research and Technology. - 2012. - Vol. 18. - P. 301-310. -
- DOI: 10.1111/j.1600-0846.2011.00571.x
- Nagaoka, T. Hyperspectroscopic screening of melanoma on acral volar skin / T. Nagaoka, A. Nakamura, H. Okutani, et al. // Skin Research and Technology. - 2013. - Vol. 19. - P. e290-e296. -
- DOI: 10.1111/j.1600-0846.2012.00642.x
- Abbasi, N.R. Early diagnosis of cutaneous melanoma: revisiting the ABCD criteria / N.R. Abbasi, H.M. Shaw, D.S. Rigel, et al. // Journal of the American Medical Association. - 2004. - Vol. 292, Issue 22. - P. 2771-2776. -
- DOI: 10.1001/jama.292.22.2771
- Zakharov, V.P. Comparative analysis of combined spectral and optical tomography methods for detection of skin and lung cancers / V.P. Zakharov, I.A. Bratchenko, D.N. Artemyev, et al. // Journal of Biomedical Optics. - 2015. - Vol. 20, Issue 2. - 025003. -
- DOI: 10.1117/1.JBO.20.2.025003
- Argenziano, G. Epiluminescence microscopy for the diagnosis of doubtful melanocytic skin lesions / G. Argenziano, G. Fabbrocini, P. Carli, V. De Giorgi, E. Sammarco, M. Delfino // Archives of Dermatology. - 1998. - Vol. 134. - P. 1563-1570. -
- DOI: 10.1001/archderm.134.12.1563
- Machikhin, A. Aberration analysis of AOTF-based spectral imaging systems / A. Machikhin, V. Batshev, V. Pozhar // Journal of the Optical Society of America A. - 2017. - Vol. 34, Issue 7. - P. 1109-1113. -
- DOI: 10.1364/JOSAA.34.001109
- Zherdeva, L.A. In vivo hyperspectral imaging and differentiation of skin cancer / L.A. Zherdeva, I.A. Bratchenko, O.O. Myakinin, et al. // Proceedings of SPIE. - 2016. - Vol. 10024. - 100244G. -
- DOI: 10.1117/12.2246433
- Lihachev, A. Autofluorescence imaging of basal cell carcinoma by smartphone RGB camera / A. Lihachev, A. Derjabo, I. Ferulova, et al. // Journal of Biomedical Optics. - 2015. - Vol. 20, Issue 12. - 120502. -
- DOI: 10.1117/1.JBO.20.12.120502
- Lihacova, L. Semi-automated non-invasive diagnostics method for melanoma differentiation from nevi and pigmented basal cell carcinomas / L. Lihacova, K. Bolocko, A. Lihachev. // Proceedings of SPIE. - 2017. - Vol. 10592. - 1059206. -
- DOI: 10.1117/12.2295773
- Neittaanmäki, N. Hyperspectral imaging in detecting dermal invasion in lentigo maligna melanoma / N. Neittaanmäki, M. Salmivuori, I. Pölönen, et al. // British Journal of Dermatology. - 2017. - Vol. 177. - P. 1742-1744. -
- DOI: 10.1111/bjd.15267
- Esteva, A. Dermatologist-level classification of skin cancer with deep neural networks / A. Esteva, B. Kuprel, R.A. Novoa, J. Ko, S.M. Swetter, H.M. Blau, S. Thrun // Nature. - 2017. - Vol. 542. - P. 115-118. -
- DOI: 10.1038/nature21056
- Li, Y. Skin lesion analysis towards melanoma detection using deep learning network / Y. Li, L. Shen // Sensors. - 2018. - Vol. 18. - 556. -
- DOI: 10.3390/s18020556


