Гипертрофия миокарда левого желудочка и хроническая болезнь почек
Автор: Барышева Ольга Юрьевна, Хейфец Людмила Михайловна, Михеева Юлия Сергеевна, Румянцев Александр Шаликович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 11 (105), 2009 года.
Бесплатный доступ
Хроническая болезнь почек, хроническая почечная недостаточность, додиализный период, гемодиализ, гипертрофия левого желудочка, индекс массы миокарда левого желудочка
Короткий адрес: https://sciup.org/14749527
IDR: 14749527
Текст статьи Гипертрофия миокарда левого желудочка и хроническая болезнь почек
Гипертрофия миокарда левого желудочка (ГЛЖ) представляет собой одну из серьезнейших кардиологических проблем в нефрологии у пациентов с хронической почечной недостаточностью (ХПН), что во многом обусловлено ее важной ролью в развитии внезапной смерти, нарушении коронарного кровообращения, систолической и диастолической дисфункции миокарда, аритмий и сердечной недостаточности [1], [2], [4], [8], [9].
Частота выявления гипертрофии миокарда левого желудочка при эхоКГ-исследовании, являющимся «золотым стандартом» диагностики ГЛЖ, отчетливо коррелирует с выраженностью ХПН. При выраженной и терминальной стадии ХПН частота ГЛЖ составляет 76–92 % [1]. У пациентов же, получающих лечение хроническим гемодиализом (ГД), встречается в 60–80 % случаев [10], [13].
Для оценки частоты и выявления факторов риска развития гипертрофии миокарда левого желудочка у больных с хронической почечной недостаточностью как в додиализном периоде, так и находящихся на хроническом ГД, предпринято настоящее исследование.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 65 больных с различной степенью выраженности ХПН в додиа-лизном периоде (стадии III, IV, V хронической болезни почек по классификации, рекомендованной К/DOQI) и 138 пациентов, получающих заместительную терапию методом хронического бикарбонатного ГД. Распределение больных в додиализном периоде ХПН в зависимости от ее выраженности представлено в табл. 1. В I группе средний возраст составил 45 ± 10 лет. Соотношение мужчин и женщин 32:33. Длительность заболевания колебалась от 0 до 30 лет, в среднем 11 лет, длительность ХПН – от 0 до 12 лет, в среднем 4 года. Средняя продолжительность артериальной гипертензии 8 лет. Во II группе средний возраст составил 47 ± 12 лет. Соотношение мужчин и женщин 68:70. Средняя продолжительность диализного лечения 63 месяца
(от 1 до 300 месяцев). Средняя продолжительность артериальной гипертензии 9 лет. Больные обеих групп регулярно получали антигипертензивную терапию. У больных II группы с учетом артериальной гипертензии проводилась коррекция программы ГД.
Ведущей причиной ХПН был хронический гломерулонефрит (80 %).
Всем пациентам выполнялось исследование общепринятых биохимических параметров. У больных на хроническом ГД исследование биохимических показателей проводилось до и после процедуры ГД.
Таблица 1
Распределение больных по выраженности ХПН в додиализном периоде
|
Стадия хронической болезни почек |
III КФ* 30–59 мл/мин/ 1,73 м2 |
IV КФ 15–29 мл/мин/ 1,73 м2 |
V КФ < 15 мл/мин/ 1,73 м2 |
|
Кол-во пациентов, абс. |
n = 30 |
n = 26 |
n = 10 |
|
Кол-во пациентов, % |
45 |
40 |
15 |
* КФ – клубочковая фильтрация, определенная по формуле Cockcroft-Gault.
Таблица 2
Распределение больных по возрасту при концентрической и эксцентрической
ГЛЖ
|
Возраст |
Концентрическая ГЛЖ |
Эксцентрическая ГЛЖ |
||
|
I группа n = 44 |
II группа n = 88 |
I группа n = 12 |
II группа n = 42 |
|
|
20–39 лет |
4 (9 %) |
18 (20 %) |
2 (17 %) |
14 (33 %) |
|
40–59 лет |
35 (80 %) |
55 (63 %) |
7 (58 %) |
19 (46 %) |
|
60 лет и старше |
5 (11 %) |
15 (17 %) |
3 (25 %) |
9 (21 %) |
Таблица 3
Влияние длительности заболевания, длительности ХПН на выраженность
ГЛЖ
|
Длительность |
Концентрическая ГЛЖ n = 44 |
Эксцентрическая ГЛЖ n = 12 |
|
заболевания до 1 года |
2 (5 %) |
1 (8%) |
|
1–5 лет |
5 (11 %) |
2 (16 %) |
|
5–10 лет |
11 (25 %) |
3 (25 %) |
|
10–15 лет |
18 (41 %) |
5 (43 %) |
|
> 15 лет |
8 (18 %) |
1 (8 %) |
|
ХПН до 1 года |
4 (9 %) |
1 (8 %) |
|
1–5 лет |
15 (34 %) |
4 (33 %) |
|
5–10 лет |
19 (43 %) |
5 (43 %) |
|
> 10 лет |
6 (14 %) |
2 (16 %) |
Всем больным выполнялось эхоКГ-исследо-вание. ГЛЖ определялась на основании расчета массы миокарда левого желудочка (ММЛЖ) по формуле R. Devereux [14], [15] и ее индексирования к площади поверхности тела – индекса ММЛЖ (ИММЛЖ). За уровень ГЛЖ в нашем исследовании был принят критерий ИММЛЖ, превышающий 130 г/м2 у мужчин и 110 г/м2 у женщин. ММЛЖ считалась нормальной при значениях менее 215 г. Относительная толщина стенки левого желудочка (ОТС) определялась следующим образом: ОТС = (ТМЖП + ТЗСЛЖ) / КДРЛЖ, где ТМЖП – толщина межжелудочковой перегородки, ТЗСЛЖ – толщина задней стенки левого желудочка, КДРЛЖ – конечный диастолический размер левого желудочка.
За повышение ОТС принимались значения 0,450 и более. Если ОТС превышала 0,450, то у данного пациента констатировали концентрический тип ГЛЖ, если меньше 0,450 – эксцентрический тип ГЛЖ.
Статистическую обработку проводили с использованием общепринятых методов параметрической и непараметрической статистики с помощью стандартного пакета программ прикладного статистического анализа (Statistica for Windows v. 5.0).
РЕЗУЛЬТАТЫ
ГЛЖ выявлена у 86 % обследованных пациентов I группы и 94 % пациентов II группы. В I группе концентрическая ГЛЖ констатирована у 44 (68 %) и эксцентрическая – у 12 (18 %) больных. Средний ИММЛЖ составил 157,46 ± 43,35 г/м2. Во II группе концентрическая ГЛЖ констатирована у 88 (67 %) и эксцентрическая – у 42 (32 %) больных. Средний ИММЛЖ составил 185,37 ± 48,46 г/м2.
У больных как в додиализной стадии ХПН, так и на хроническом ГД не выявлено зависимости между выраженностью ГЛЖ и возрастом. Так, среди больных I группы в возрасте от 40 до 60 лет ГЛЖ имела место при концентрической модели в 80 % случаев, при эксцентрической – в 58 %; среди больных II группы в возрасте от 40 до 60 лет ГЛЖ имело место при концентрической модели в 63 % случаев, при эксцентрической – в 46 % (табл. 2).
В I группе выявлена зависимость между длительностью заболевания, длительностью ХПН и выраженностью ГЛЖ (табл. 3).
В нашем исследовании подтверждена взаимосвязь между продолжительностью диализного лечения и прогрессированием ГЛЖ (табл. 4). Причем в течение первых 5 лет диализной терапии выраженность ГЛЖ увеличивается ( τ = 0,23, Р = 0,044), а после 5 лет лечения ГД – уменьшается ( τ = -0,24, Р = 0,005).
У больных II группы обнаружена обратная зависимость между ИММЛЖ и показателем КТ/V ( τ = -0,33, Р < 0,000). Следовательно, адекватность диализной терапии может служить дополнительным фактором ГЛЖ у наших больных.
Интересен тот факт, что в течение первых 5 лет диализного лечения адекватность диализа и недельная доза достоверно ниже, чем у пациентов, получающих ГД более 5 лет (Р < 0,001).
В обеих группах установлена статистически достоверная взаимосвязь между ИММЛЖ и систолическим артериальным давлением ( т = 0,5, Z = 5,15, Р < 0,0001), ИММЛЖ и диастолическим артериальным давлением ( т = 0,46, Z = 4,68, Р < 0,0001), что подтверждает роль артериальной гипертензии в формировании ГЛЖ.
Установлена статистически значимая зависимость между ММЛЖ и уровнем гемоглобина и количеством эритроцитов ( т = -0,21, Z = -2,08, Р = 0,037). Анемия, таким образом, также является важным фактором, способствующим развитию ГЛЖ. Тяжелая анемия с уровнем гемоглобина менее 85 г/л при эксцентрической ГЛЖ встречалась в 62 % случаев, а при концентрической ГЛЖ – в 45 % (табл. 5).
Величина ИММЛЖ соответствовала степени увеличения размеров полостей сердца ( т = 0,52, Z = 5,37, Р < 0,0001), а также толщине межжелудочковой перегородки ( т = 0,5, Z = 5,08, Р < 0,0001) и толщине задней стенки левого желудочка ( т = 0,54, Z = 5,53, Р < 0,0001). Увеличение ИММЛЖ сопровождалось увеличением ОТС (r = 0,28, P = 0,046), то есть у больных с концентрической ГЛЖ ИММЛЖ был выше, чем у пациентов с эксцентрической ГЛЖ.
При концентрической ГЛЖ достоверно больше толщина межжелудочковой перегородки (1,4 ± 0,027 и 1,09 ± 0,02 см, Р = 0,0001) и задней стенки левого желудочка (1,35 ± 0,022 и 1,09 ± 0,03 см, Р = 0,0001). При эксцентрической ГЛЖ достоверно больше диастоличеcкий размер левого желудочка (5,52 ± 0,09 и 5,02 ± 0,06 см, Р = 0,0001).
Факторами риска концентрической ГЛЖ являются систолическое и пульсовое артериальное давление, а у больных на хроническом гемодиализе также междиализные прибавки в весе (Р < 0,01).
Достоверные различия между концентрической и эксцентрической ГЛЖ представлены в табл. 6.
Не установлено зависимости между ИММЛЖ и показателями фосфорно-кальциевого обмена и уровнем паратиреоидного гормона. Однако получена отчетливая положительная корреляционная зависимость между толщиной межжелудочковой перегородки и толщиной задней стенки и уровнем фосфора и произведения «кальций х фосфор» ( т = 0,28, Z = 2,84, Р = 0,003).
Установлено, что при увеличении ИММЛЖ происходит достоверное снижение фракции выброса ( т = -0,37, Р = 0,002) и фракции укорочения ( т = -0,28, Z = -2,84, Р < 0,005). Таким образом, при ГЛЖ снижена сократительная способность миокарда. Причем при эксцентрической модели ГЛЖ фракция выброса достоверно ниже, чем при концентрической модели (60,9 ± 1,77 и 67,7 ± 1,25 % соответственно, Р = 0,002).
Таблица 4
Влияние длительности диализной терапии на выраженность ГЛЖ
|
Длительность ГД |
Концентрическая ГЛЖ n = 88 |
Эксцентрическая ГЛЖ n = 42 |
|
До 1 года |
16 (18 %) |
8 (19 %) |
|
1–5 лет |
41 (47 %) |
18 (43 %) |
|
5–10 лет |
15 (17 %) |
9 (21 %) |
|
10–15 лет |
10 (11 %) |
6 (15 %) |
|
Более 15 лет |
6 (7 %) |
1 (2 %) |
Таблица 5
Анемия при концентрической и эксцентрической ГЛЖ
|
Уровень гемоглобина, г/л |
Концентрическая ГЛЖ |
Эксцентрическая ГЛЖ |
||
|
n =44 |
n = 88 |
n = 12 |
n = 42 |
|
|
Менее 85 |
18 (41 %) |
40 (45 %) |
7 (58 %) |
26 (62 %) |
|
86–100 |
15 (34 %) |
37 (42 %) |
3 (25 %) |
8 (19 %) |
|
Более 100 |
11 (25 %) |
11 (13 %) |
2 (17 %) |
8 (19 %) |
Таблица 6
Достоверные различия между концентрической и эксцентрической ГЛЖ
|
Показатели |
Концентрическая ГЛЖ |
Эксцентрическая ГЛЖ |
Р |
|
Систолическое артериальное давление, мм рт. ст. |
148,64 ± 2,11 |
139,52 ± 3,52 |
0,02 |
|
Пульсовое давление, мм рт. ст. |
61,82 ± 1,33 |
55 ± 2,27 |
0,006 |
|
Междиализные прибавки в весе, кг |
3,02 ± 0,11 |
2,58 ± 0,09 |
0,01 |
|
Междиализные прибавки в весе, % массы тела |
4,73 ± 0,19 |
4,09 ± 0,22 |
0,04 |
|
ТМЖП*, см |
1,395 ± 0,03 |
1,09 ± 0,025 |
0,0001 |
|
ТЗСЛЖ**, см |
1,351 ± 0,02 |
1,088 ± 0,025 |
0,0001 |
|
Левый желудочек, см |
5,02 ± 0,06 |
5,52 ± 0,09 |
0,0001 |
|
Левое предсердие, см |
4,35 ± 0,06 |
4,12 ± 0,09 |
0,02 |
|
Фракция выброса, % |
67,71 ± 1,25 |
60,99 ± 1,77 |
0,002 |
|
Фракция укорочения, % |
38,7 ± 0,98 |
33,57 ± 1,3 |
0,002 |
|
ММЛЖ***, г |
394,62 ± 13,91 |
334,11 ± 16,09 |
0,009 |
|
ИММЛЖ****, г/м2 |
225,84 ± 7,71 |
188,79 ± 8,24 |
0,003 |
*ТМЖП – толщина межжелудочковой перегородки.
**ТЗСЛЖ – толщина задней стенки левого желудочка.
***ММЛЖ – масса миокарда левого желудочка.
****ИММЛЖ – индекс массы миокарда левого желудочка.
ОБСУЖДЕНИЕ
Частота выявления ГЛЖ на основании ИМ-МЛЖ методом эхоКГ (86–94 %) соответствует данным литературы [6], [12].
Наиболее распространенными видами ремоделирования миокарда были концентрическая ГЛЖ и эксцентрическая ГЛЖ с дилатацией левого желудочка.
В развитии ГЛЖ при ХПН играют роль различные факторы. Наряду с водно-электролитными, гормональными и метаболическими нарушениями, свойственными ХПН, сам по себе ГД с быстрым извлечением из сосудистого русла значительного объема жидкости вызывает ряд неблагоприятных функциональных и структурных сдвигов со стороны сердечно-сосудистой системы. Эти сдвиги возникают как в результате непосредственных перепадов гидродинамической нагрузки на сердце и стенку сосудов, так и в связи с опосредованными регуляторными воздействиями, к числу которых относятся активация симпатоадреналовой системы и неадекватно высокая в междиализный период активность ренин-ангиотензиновой системы. Для пациентов, длительно леченных хроническим ГД, характерна системная артериальная гипертензия вследствие перегрузки объемом, повышенной активности ренина, а также потери эластичности стенок крупных артерий. Последний фактор лежит преимущественно в основе эксцентрической модели ГЛЖ [1]. Обсуждается также влияние генетической предрасположенности [19]. Однако ключевую роль играют гемодинамические факторы, такие как перегрузка давлением и объемом, приводящие к формированию различных моделей гипертрофии [1], [20]. Перегрузка давлением приводит к развитию концентрической гипертрофии, которая характеризуется утолщением стенок левого желудочка без увеличения размеров его полости. Такая модель гипертрофии встречается у 67 % больных с ХПН, получающих лечение хроническим ГД, и сопровождается повышением общего периферического сопротивления и малоиз-мененным сердечным выбросом. Концентрическая модель гипертрофии вследствие перегрузки давлением возникает из-за артериальной гипертензии, присутствующей у большинства диализных пациентов [10], [12], [16] (см. рисунок).
Перегрузка объемом сопровождается эксцентрической моделью гипертрофии, для которой характерно увеличение размера полости левого желудочка без выраженного утолщения его стенок. Такая модель ГЛЖ встречается у 32 % больных с ХПН и ассоциируется с увеличением сердечного выброса при нормальном или умеренно повышенном общем периферическом сопротивлении [23].
Встречаются варианты комбинированного воздействия на миокард перегрузки давлением и объемом, или смешанной формы ГЛЖ [19].
В отличие от физиологической ГЛЖ (например, «атлетическое сердце»), патологические формы ГЛЖ сопровождаются интерстициальным фиброзом (см. рисунок).
Установлена достоверная взаимосвязь между ИММЛЖ и уровнем артериального давления, что позволяет отнести артериальную гипертензию к одному из существенных факторов, ускоряющих формирование ГЛЖ. Другим не менее значимым фактором развития ГЛЖ была анемия, что подтверждено результатами корреляционного анализа.
Анемия приводит к снижению вязкости крови и общего периферического сопротивления вследствие гипоксической вазодилатации. Данные эффекты вызывают увеличение ударного объема и повышение частоты сердечных сокращений, что сопровождается нарастанием минутного объема, возникновением перегрузки левого желудочка объемом и развитием его дилатации и/или гипертрофии [1], [4], [7], [24].
Полученные данные согласуются с представлением о том, что гипертензия и анемия, столь характерные для пациентов на хроническом ГД, являются ведущими механизмами развития гипертрофии сердечной мышцы.
Следует отметить увеличение левого предсердия, размер которого зависел от уровня артериального давления (r s = 0,41, P < 0,004). По данным корреляционного анализа, на размер левого предсердия также достоверно влияла выраженность ГЛЖ ( τ = 0,21, Z = 2,16, P < 0,03). Размер правого желудочка достоверно коррелировал с массой левого желудочка ( τ = 0,21, Z = 2,2, P < 0,03). Следовательно, процесс ремоделирования охватывает не только левый желудочек, но и левое предсердие и правый желудочек. Возможно, увеличенный ИММЛЖ может служить фактором, определяющим развитие перегрузки левого предсердия, что мы и наблюдали при вариантах ГЛЖ, при которых величина левого предсердия значительно превышала норму.
ГЛЖ приводила также к снижению сократительной способности миокарда, поскольку при данном патологическом состоянии происходит увеличение межуточного вещества и фиброзных изменений.
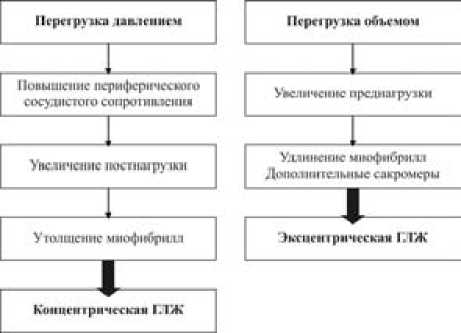
Схема возникновения вариантов ГЛЖ при ХПН
Основываясь на многочисленных исследованиях, можно рассматривать ГЛЖ как изначально компенсаторный структурный ответ на гемодинамическую перегрузку давлением и/или объемом [3]. Дальнейшее прогрессирование процесса сопровождается «перехлестом» компенсации. При этом развиваются нарушения систолической и диастолической функций сердца, а также коронарной гемодинамики и электрической активности сердца, что клинически проявляется признаками ишемической болезни сердца, сердечной недостаточности и тяжелыми нарушениями ритма [22].
Частота нарушений систолической функции левого желудочка при ХПН, по данным различных авторов, колеблется от 32 до 62 % [11]. Эти нарушения характеризуются снижением фракции изгнания и скорости циркулярного укорочения левого желудочка, а также изменениями отношения систолического давления в левом желудочке к его объему.
В развитии нарушений систолической функции левого желудочка у части больных с ХПН важная роль отводится ГЛЖ [1], [12], [17]. По мере развития гипертрофии нарушается систолическая функция левого желудочка, что сначала проявляется при физических нагрузках, а в последующем и в покое. При систолической дисфункции левого желудочка происходит снижение электрической активности и механические нарушения сокращения миокарда [13]. Наряду со снижением сократительной способности миокарда, в развитии систолических нарушений левого желудочка важную роль играют развивающиеся при его гипертрофии нарушения наполнения левого желудочка и изменения коронарного кровообращения [3], [5].
Особенностью нашего исследования было установление обратной взаимосвязи между ИММЛЖ и степенью адекватности ГД. Таким образом, качественный ГД позволил бы затормозить прогрессирование ГЛЖ. Однако эти предположения носят лишь гипотетический характер и требуют более детального изучения.
В нашем исследовании обнаружена взаимосвязь между продолжительностью диализного лечения и ГЛЖ. Причем в течение первых 5 лет диализной терапии выраженность ГЛЖ увеличивается, что обусловлено менее адекватным ГД, более значимой артериальной гипертензией и анемией. После 5 лет терапии ГД выраженность ГЛЖ уменьшается, что объясняется, во-первых, более адекватным ГД, во-вторых, относительно удовлетворительной коррекцией гипертензии и анемии. Данные литературы по этому вопросу противоречивы. Большинство авторов полагают, что частота ГЛЖ возрастает с увеличением продолжительности лечения ГД [1], [6], что связано с процессом увеличения межклеточного вещества миокарда, не связанным с артериальной гипертензией, но зависящим от длительности лечения ГД. Однако некоторые авторы считают, что в период гемодиализной терапии при удовлетворительной коррекции гипертензии, анемии и гипергидратации – основных факторов развития ГЛЖ – можно добиться снижения частоты и выраженности гипертрофии миокарда [5].
Важное место в генезе ГЛЖ отводится вторичному гиперпаратиреозу и нарушению фос-форно-кальциевого обмена [7], [18], [21]. Показано, что избыток паратиреоидного гормона приводит к увеличению поступления кальция внутрь кардиомиоцитов, что обусловливает сокращение сроков их жизни и способствует кальцинозу и фибротическим изменениям миокардиального матрикса [5], [19]. При успешной коррекции уровня паратиреоидного гормона у пациентов с вторичным гиперпаратиреозом при ХПН с помощью кальцитриола наблюдалось достоверное уменьшение индекса массы миокарда левого желудочка [21]. В нашем исследовании не обнаружена зависимость между ИМ-МЛЖ и паратиреоидным гормоном. Тем не менее выявлена взаимосвязь толщины межжелудочковой перегородки и задней стенки левого желудочка с уровнем фосфора и произведения «кальций х фосфор», что косвенно свидетельствует о роли кальций-фосфорного обмена в генезе ГЛЖ у диализных пациентов.
ЗАКЛЮЧЕНИЕ
Таким образом, ГЛЖ является наиболее распространенным осложнением хронической почечной недостаточности со стороны сердечнососудистой системы как у больных в додиализ-ном периоде, так и у больных, получающих лечение методом хронического ГД. Наиболее распространенными вариантами ремоделирования миокарда являются концентрическая ГЛЖ и эксцентрическая ГЛЖ и дилатация левого желудочка. Нами выявлены факторы риска развития гипертрофии миокарда и ее прогрессирования, что требует более тщательного контроля за артериальной гипертензией, анемией и фосфорно-кальциевым обменом уже на додиализном этапе, а также более тщательного контроля за адекватностью проводимого ГД.
Список литературы Гипертрофия миокарда левого желудочка и хроническая болезнь почек
- Волгина Г. В. Клиническая эпидемиология кардиоваскулярных нарушений при хронической почечной недостаточности (Обзор литературы)//Нефрология и диализ. 2000. Т. 2. № 1-2. С. 25-32.
- Дядык А. И., Багрий А. Э., Лебедь И. А. и др. Гипертрофия левого желудочка сердца у больных с хронической почечной недостаточностью//Кардиология. 1997. № 2. С. 76-82.
- Филатова Н. П., Савина Л. В., Малышева Н. В. и др. Гипертрофия миокарда левого желудочка у больных с артериальной гипертензией: клинические особенности и прогностическое значение//Кардиология. 1993. № 6. С. 34-38.
- Шутов А. М., Кондратьева Н. И., Куликова Е. С. и др. Реомоделирование сердца у больных с хронической почечной недостаточностью в стадии, не требующей диализа//Тер. арх. 2000. № 6. С. 46-49.
- Amann K., Mall G., Ritz E. Myocardial interstitial fibrosis in uremia: is it relevant?//Nephrol. Dial. Transplant. 1994. Vol. 9. P. 127-128.
- Amann K., Rychlik I., Miltenberger-Milteny G., Ritz E. Left ventricular hypertrophy in renal failure//Kidney Int. 1998. Vol. 54. Supp l. 68. P. S78-S85.
- Berweek S., Hennig L., Sternberg C. et al. Cardiac mortality prevention in uremic patients. Therapeutic strategies with particular attention to complete correction of renal anemia//Clin. Nephrol. 2000. Vol. 53. Suppl. 1. P. S80-S85.
- Buoncristiani U., Fagugli R., Ciao G. et al. Left ventricular hypertrophy in daily dialysis//Miner. Electrolyte Metab. 1999. Vol. 25. P. 90-94.
- Cannella G. Left ventricular hypertrophy in the dialysed patient. What can be done about it?//Nephrol. Dial. Transplant. 1996. Vol. 11. № 3. P. 418-420.
- Cannella G., Paoletti E., Ravera G. at al. Inadequate diagnosis and therapy of arterial hypertension as causes of left ventricular hypertrophy in uremic dialysis patients//Kidney Int. 2000. Vol. 58. № 1. P. 260-268.
- Covic A., Goldsmith D. J. A., Clayton P. et al. Long-term hemodialysis vs. renal transplantation: comparative influence on cardiac structure and function//Nephrol. Dial. Transplant. 1994. Vol. 9. P. 980-981.
- Covic A., Goldsmith D. J. A., Covic M. Reduced blood pressure diurnal variability as a risk factor for progressive left ventricular dilatation in hemodialysis patients//Am. J. Kidney Dis. 2000. Vol. 35. № 4. P. 617-623.
- Dahan M., Siohan P., Viron B. et al. Relationship between left ventricular hypertrophy, myocardial contractility, and load conditions in hemodialysis patients: an echocardiographic study//Am. J. Kidney Dis. 1997. Vol. 30. № 6. P. 780-785.
- Devereux R. B., Alonso D. R. Echocardiographic assessment of left ventricular hypertrophy: comparison to necropsy findings//Am. J. Cardiol. 1986. Vol. 57. P. 450-458.
- Devereux R. B., Reicheck N. Echocardiographic left ventricular mass in man//Am. J. Cardiol. 1977. Vol. 55. P. 613-618.
- Ertuk S., Estug A. E. Hypertension and left ventricular hypertrophy in hemodialysis patients//J. Hypertens. 1998. Vol. 15. № 3. P. 327.
- Foley R.N., Parfrey P. S., Kent G. M. et al. Serial change failure in end-stage renal disease//J. Am. Soc. Nephrol. 2000. Vol. 11. № 5. P. 912-916.
- Locatelli F., Manzom C., Del Vecchio L., Di Filippo S. Changes in the clinical condition of hemodialysis patients//J. Nephrol. 1999. Vol. 12. Suppl. 2. P. S82-S91.
- London J. M., Fabiani F. Left ventricular dysfunction in end-stage renal disease: Echocardiographic insights//Cardiac dysfunction in chronic uremia/Ed. P. S. Parfrey, J. D. Harnett. Boston, 1992. P. 117-137.
- Lopez-Gomez J. M., Verde E., Perez-Garcia R. Blood pressure, left ventricular hypertrophy and longterm prognosis in hemodialysis patients//Kidney Int. 1998. Vol. 68. Suppl. l. P. S92-S98.
- Massimetti C., Botti M., Capezzuto A. et al. Effects of pharmacological correction of secondary hyperparathyroidism on cardiac function in hemodialysis patients//Nephrol. Dial. Transplant. 1994. Vol. 9. P. 911-912.
- Parfrey P. S., Foley R.N., Harnett J. D. et al. Outcome and risk factors for left ventricular disorders in chronic uremia//Nephrol. Dial. Transplant. 1996. Vol. 11. № 7. P. 1277-1278.
- Rossi M. A., Carillo S. V. Cardiac hypertrophy due to pressure and volume overload: distinctly different biological phenomena?//Int. J. Cardiol. 1991. Vol. 31. P. 133-149.
- Savage T., Giles M., Tomson C. V., Raine A. E. Gender differences in mediators of left ventricular hypertrophy in dialysis patients//Clin. Nephrol. 1998. Vol. 49. № 2. P. 107-112.


