Гипотракционные технологии в резекционной хирургии желудка
Автор: Власов А.П., Власов П.А., Рубцов О.Ю.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4, 2017 года.
Бесплатный доступ
В эксперименте на 36 собаках и в клинике у 56 больных язвенной болезнью желудка и двенадцатиперстной кишки при резекции желудка применена гипотракционная технология (патент), заключающаяся в наложении дополнительных слизисто-подслизистых или серозно-мышечных швов в 1-2 см от линии анастомоза, благодаря которым происходит сближение анастомозированных отделов, что снижает нагрузку на основные швы соустья. В экспери- менте доказана эффективность разработанной технологии в условиях существенного натяжения (2,5-3,6 Н - 245-350 г) культи желудка и культи двенадца- типерстной кишки. Доказано, что уменьшение напряжения в основных швах по линии анастомоза способствует меньшим расстройствам трофики тканей регенерирующих структур, что установлено по повышению в них редокс-потенциала, снижению интенсивности липопероксидации и фосфолипазной ак- тивности. В клинике применение гипотракционных и эвертированного швов при резекции желудка позволили до минимума свести послеоперационные осложнения. Несостоятельности швов гастродуоденального анастомоза не было. Отмечено существенное уменьшение анастомозита до 1,8%, послеопера- ционного панкреатита - до 3,6%.
Резекция желудка, гипотракционные швы, регенерация, послеоперационные осложнения
Короткий адрес: https://sciup.org/142221827
IDR: 142221827 | УДК: 616.34
Текст научной статьи Гипотракционные технологии в резекционной хирургии желудка
Материал и методы
В основу работы положены результаты экспериментальных исследований и клинических наблюдений.
Экспериментальный раздел
Применялись следующие методики: макроскопия на аутопсии, световая микроскопия при окраске препаратов гематокси-лин-эозином, определение окислительно-восстановительного потенциала (редокс-потенциала) для изучения электрогенеза тканей, определение в тканях соустья содержания ТБК-активных продуктов и активности фосфолипазы А2, определение физической герметичности швов (пневмопрессия) и индекса стенозирования (степень сужения) анастомоза.
Клинический раздел
Результаты и их обсуждение
При макро- и микроскопической оценке состояния тканей по линии соустья выявлено, что заживление анастомоза происходило без осложнений по типу первичного натяжения с минимальными явлениями анастомозита.
Отметим, что ранний послеоперационный период у животных протекал тяжело. В трех случаях зарегистрирована несостоятельность швов. В остальных наблюдениях процесс репарации сопровождался выраженными воспалительными явлениями в тканях соустья (анастомозит), что существенно снижало его прочность. Сила биологической консолидации тканей в контрольных точках периода наблюдения была существенно (на 26,3-41,2%) ниже, чем в контроле. Наибольшие патоморфологические явления отмечены в области шовного материала, где были регистрированы язвенные процессы, с наложениями гноя и фибрина, что приводило к сужению просвета (существенный (на 42,3%) рост индекс стенозирования) в области соустья.
В третьей группе объем операции и технические приемы при ее выполнении были аналогичными второй группы. Однако после формирования гастродуоденального соустья с целью уменьшения напряжения в основных швах нами применен способ уменьшения натяжения швов анастомоза (патент № 2049429 от 10.12.1995), при котором на расстоянии более 1,0 см от края анастомозируемых отделов накладывались дополнительные узловые гипотракционные слизисто-подслизистые или серозно-мышечные швы, равномерно распределяя их по окружности, с помощью которых подтягивали и фиксировали отрезки друг к другу на расстоянии, позволяющем предотвратить натяжение основных швов анастомоза. Количество швов определяется диаметром анастомозируемых отделов, степенью натяжения при их сближении друг к другу. В наших опытах их было 4.
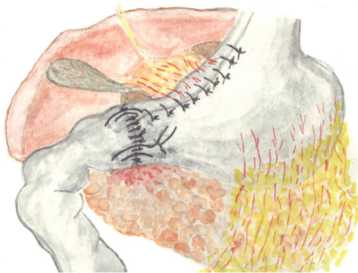
Рис. 1. Внешний вид гастродуоденального анастомоза с гипотракционными швами
В этой группе животных послеоперационный период протекал без осложнений и во многом соответствовал таковому контрольной (первой) группы. Отличия заключались лишь в том, что через 1-3 суток после операции происходило прорезывание дополнительных швов с одного из анастомозированных отделов с формированием точечного дефекта в области серозно-мышечной оболочки. Однако этот процесс существенно не влиял на заживление анастомоза, который в целом был аналогичен первой группы и сопровождался минимальными воспалительными явлениями по линии основных швов.
Таким образом, при помощи дополнительных гипотракци-онных швов достигается возможность приблизить и удержать анастомозируемые отделы при их натяжении. Удерживающую способность швы сохраняют 1-3 суток, затем прорезываются. Этого времени вполне достаточно для адаптация анастомозированных отделов к изменившимся условиям и «первичного склеивания» тканей по линии анастомоза, что в целом и обеспечивает надежность основных швов и благоприятное заживление анастомоза.
Нами установлено, что в основе патогенеза несостоятельности швов гастродуоденального соустья при натяжении анастомозируемых отделов лежат существенные нарушения трофики тканей, которые регистрируются уже незамедлительно после создания соустья. Так, редокс-потенциал в тканях гастродуоденального соустья после его формирования в контрольной группе падал до -42,3 1,3 мВ, тогда как при натяжении анастомозированных отделов (вторая группа) снижался на 34,0% до -56,7 1,5 мВ (р<0,05). Такого рода динамика отмечена и в раннем послеоперационном периоде (табл. 1).
Следует отметить, что вне зависимости от исследуемой группы в тканях гастродуоденального соустья в раннем послеоперационном периоде сохраняются выраженные нарушения трофики. Так, в контрольной группе редокс-потенциал через 1 и 3 суток после операции падал на 62,3 и 32,9% (р<0,05) соот- ветственно. При этом в тканях регистрировалась интенсификация перекисного окисления липидов, о чем свидетельствовал рост уровня ТБК-активных продуктов на 32,1 и 36,6% (р<0,05) соответственно. Отметим факт повышения и фосфолипазной активности на 150,9 и 135,3% (р<0,05) соответственно (табл. 1).
Таким образом, даже в неосложненных ситуациях в тканевых структурах кишечного анастомоза в самые ранние сроки создаются условия для угнетения репаративного процесса. Об этом свидетельствуют все регистрированные показатели. Отметим особую патофизиологическую значимость интенсификации перекисного окисления липидов и повышения фосфолипазной активности в силу того, что они обладают крайне нежелательным мембранодеструктивным действием, существенно снижая репаративный потенциал регенерирующих структур.
Подчеркнем, что при натяжении анастомозированных отделов регистрированные биохимические и биофизические показатели состояния тканевых структур гастродуоденального анастомоза претерпевали более значимые изменения. Так, редокс-потенциал через 1 и 3 суток после операции падал на 93,2 и 101,4% (р<0,05), уровень ТБК-активных продуктов повышался на 69,9 и 80,4% (р<0,05), фосфолипазная активность – на 272,4 и 330,2% соответственно. При этом их уровень был достоверно изменен по отношению к контролю в 1 и 3 сутки на 19,0 и 51,6%, 28,6 и 32,0%, 48,5 и 82,8% соответственно. Отметим и то, что при напряжении в швах в динамике отмечено ухудшение трофики тканей, что явилось важнейшим обстоятельством в возникновении несостоятельности швов анастомоза.
Таблица 1
Некоторые биохимические и биофизические показатели состояния тканевых структур гастродуоденального анастомоза (M±m)
|
Показатель |
Норма |
Группа |
Этапы послеоперационного наблюдения, сутки |
||
|
1 |
3 |
5 |
|||
|
Электрогенез тканей, мВ |
–35,3±1,1 |
I |
–57,3±1,2* |
–46,9±1,14* |
–36,7± 1,3 |
|
II |
–68,2±1,3* |
–71,1±1,4* |
– |
||
|
III |
–61,6±1,3*^ |
–48,7±1,5*^ |
–37,3±1,4 |
||
|
Содержание ТБК-активных продуктов, нмоль/г белка |
3,52±0,21 |
I |
4,65±0,23* |
4,81±0,22* |
3,77±0,27 |
|
II |
5,98±0,31* |
6,35±0,44* |
– |
||
|
III |
5,23±0,25*^ |
5,01±0,26*^ |
3,81±0,21 |
||
|
Активность фосфолипазы А2, мкмоль/с/г белка (*10-2) |
1,16±0,07 |
I |
2,91±0,12* |
2,73±0,15* |
1,28±0,14 |
|
II |
4,32±0,22* |
4,99±0,31* |
– |
||
|
III |
3,88±0,21*^ |
3,23± 0,19*^ |
1,45±0,16 |
||
Примечание: I – первая (контрольная) группа, II – вторая (опытная) группа; III – третья (опытная) группа; * – достоверность по отношению к норме при р<0,05; жирный шрифт – достоверность по отношению к контролю при р<0,05; ^ – достоверность по отношению к второй группе при р<0,05
рой группе, и во многом приближалось к контрольному уровню. Так, редокс-потенциал через 1 и 3 суток после операции был снижен по сравнению с нормой на 74,5 и 31,6% (р<0,05), уровень ТБК-активных продуктов повышался на 48,6 и 42,3% (р<0,05), фосфолипазная активность – на 234,5 и 178,4% (р<0,05) соответственно. При этом их уровень был достоверно изменен по отношению к контролю только в первые сутки на 7,5, 12,5 и 33,3% соответственно (активность фосфолипазы А2 была выше контроля и на 3-и сутки на 18,3% (р<0,05)). Отметим, что по сравнению с результатами второй группы зареги- стрированы достоверные положительные сдвиги исследованных показателей. Так, редокс-потенциал через 1 и 3 суток после операции был выше на 9,7 и 14,7% (р<0,05), содержание ТБК-активных продуктов ниже12,6 и 21,1% (р<0,05), фосфолипазная активность падала на 10,2 и 35,3% (р<0,05) соответственно (табл. 1).
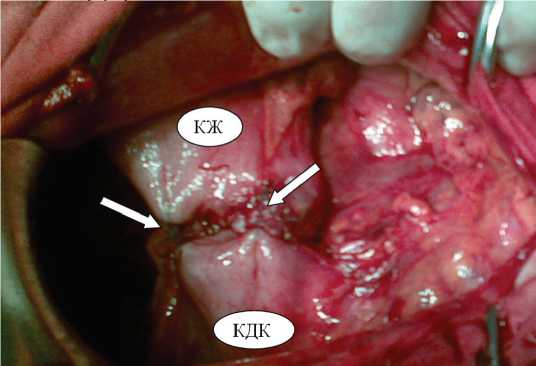
Рис. 2. Интраоперационное фото.
Таблица 2
|
Осложнения |
Способ формирования гастродуоденального анастомоза |
|||
|
Классический двухрядный Ламбера-Альберта (n=52) |
Однорядный эвертированный с гипотракционными швами (n=56) |
|||
|
Анастомозит |
9 |
17,3% |
1 |
1,8% |
|
Панкреатит |
6 |
11,5% |
2 |
3,6% |
|
Несостотель-ность швов |
4 |
7,7% |
– |
– |
|
Абсцесс брюшной полости |
1 |
1,9% |
– |
– |
|
Парез кишечника |
8 |
15,4% |
2 |
3,6% |
|
Нагноение раны |
3 |
5,8% |
2 |
3,6% |
|
Всего: |
31 |
59,6% |
7 |
12,5% |
Наиболее значимые результаты такого рода операций заключаются в развитии тяжелых осложнений, и в первую очередь, возникновения несостоятельности швов гастродуоденального анастомоза. При применении разработанной тех- нологии такого рода осложнений не было, тогда как при классическом двухрядном шве оно возникло у 4 больных (7,7%). Этим пациентам выполнены повторные операции, в том числе реконструктивные, после которых на фоне прогрессирующего перитонита 2 (3,9%) больных погибли.
При использовании разработанных технологий отмечено существенное уменьшение и других осложнений, в частности анастомозита (в первой группе 1,8%, во второй – 17,3%), послеоперационного панкреатита (в первой группе 3,6%, во второй – 11,5%), что, безусловно, связано с особенностью разработанных операций, в частности с щадящим отношением к анастомозируемым отделам и минимальной травматизацией поджелудочной железы при мобилизации двенадцатиперстной кишки.
Эндоскопический контроль в раннем послеоперационном периоде за течением репаративного процесса гастродуоденального анастомоза, формированного по разработанным технологиям, показал, что по линии швов отмечается быстрая регрессия воспалительного процесса и ускоренная эпителизация раневого дефекта слизистой оболочки, что вы-ступали профилактическими факторами возникновения анастомозита.
Список литературы Гипотракционные технологии в резекционной хирургии желудка
- Абдуллажанов Б.Р., Абдирайимов Б.А., Бозоров Н.Э., Ниша-нов М.Ф. Первичная резекция желудка при перфоративных язвах двенадцатиперстной кишки//Гастроэнтерология Санкт-Петербурга. 2011. № 2-3. С. 1-2
- Брехов Е.И., Мизин С.П., Репин И.Г., Шипова А.А. Обоснование способа восстановления непрерывности желудочно-кишечного тракта после резекции желудка//Хирургия. Журнал им. Н.И. Пирогова. 2013. № 6. С. 8-13
- Власов А.П., Кукош М.В., Сараев В.В., Степанов Ю.П. Резекционная хирургия желудка. Н. Новгород: Изд-во НГМА, 2005. 360 с
- Волостников Е.В., Линченко В.И., Шопен Г.Н. Ишемический некроз культи желудка после субтотальной дистальной резекции желудка Хирургия. Журнал им. Н.И. Пирогова. 2013. № 11. С. 61-62
- Зайцев О.В., Тарасенко С.В., Натальский А.А., Морозов К.С. Технические аспекты выполнения резекции желудка в условиях труд-ной дуоденальной язвы//Тихоокеанский медицинский журнал. 2011. № 3. С. 75-79
- Куликов Е.П., Мерцалов С.А. Применение резекции желудка с сохранением привратника у больных раком желудка//Онкология. Журнал им. П.А. Герцена. 2013. Т. 1. № 6. С. 18-21
- Лубянский В.Г., Насонов С.В. Острый панкреатит после резекции желудка при низкорасположенных дуоденальных язвах//Хирургия. Журнал им. Н.И. Пирогова. 2001. № 3. С. 8-11
- Сажин В.П., Наумов И.А., Климов Д.Е., Нуждихин А.В. Лапароскопическая резекция желудка по Бильрот-1//Хирургия. Журнал им. Н.И. Пирогова. 2005. № 1. С. 21-24
- Тарасенко С.В. Зайцев О.В., Копейкин А.А., Карюхин И.В. Способ оценки результатов оперативного лечения заболеваний желудка и двенадцатиперстной кишки.//Вестник новых медицинских технологий. -2009. -Т. XVI. -№ 2. -С. 169171
- Федосеев А.В., Лузгин Д.А. Качество жизни больных с осложненным течением язвенной болезни желудка и двенадцатиперстной кишки после резекции желудка. Паллиативная медицина и реабилитация. 2005. № 2. С. 28
- Шестопалов С.С., Совцов С.А., Михайлова С.А. Использование электростимуляции в профилактике моторно-эвакуаторных нарушений после гастрэктомии и субтотальной резекции желудка//Новые технологии в онкологической практике. Барнаул, 2005. С. 191-192
- Skarstein A. Hoisaeter P.A. Perforated peptic ulcer: a comparison of long term results following partial gastric resection or simple closure//British Journal of Surgery. -2005. -Т. 63. -№ 9 -С. 700-703


