Гистологические изменения печени крыс при воздействии пищевых консервантов на фоне хронического стресса
Автор: Каримов Д.О., Рябова Ю.В., Каримов Д.Д., Гизатуллина А.А., Смолянкин Д.А., Хмель А.О.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 3, 2025 года.
Бесплатный доступ
Последствия одновременного воздействия пищевых консервантов и хронического стресса на печень остаются малоизученными, хотя оба фактора широко распространены в современном мире. Цель. Определить характер и степень морфологических изменений в печени крыс после 28-дневного воздействия сорбиновой и бензойной кислот и выяснить, усиливает ли хронический психологический стресс токсический эффект указанных пищевых консервантов. Материалы и методы. Эксперимент проводился in vivo в течение 28 сут. Крысы-самцы (n=24) были разделены на 4 равные группы: контроль, хронический стресс, пищевые консерванты и совместное действие упомянутых факторов. После эвтаназии выполняли гистологическое исследование и морфометрию (оценивали площадь ядра и цитоплазмы гепатоцита, ядерно-цитоплазматическое отношение (ЯЦО), число двуи безъядерных клеток). Статистический анализ осуществляли методом Bootstrap с поправкой Холма – Бонферрони (р<0,05). Результаты. Хронический стресс снизил площадь ядра (-20 %, p<0,0001) и цитоплазмы (-16 %, p<0,0001), увеличив число двуядерных гепатоцитов (+71 %, p=0,006). Некротические изменения не зафиксированы. Консерванты вызывали умеренную гипертрофию гепатоцитов (площадь ядра +11 %, p=0,0004) без роста ЯЦО и в отсутствии цитолиза. При совместном действии факторов площадь цитоплазмы снижалась (-10 %, p=0,0060), ЯЦО возрастало (+18 %, p=0,0005) при сохраненной архитектуре и неизменном числе двуядерных клеток. Выводы. Хронический стресс модифицирует ранние гепатотоксические эффекты сорбиновой и бензойной кислот. Процесс сопровождается ростом ядерно-цитоплазматического индекса. Окончательные выводы о характере взаимодействия требуют разработки математических подходов к анализу токсического действия химического агента на фоне хронического психоэмоционального стресса.
Печень, гистология, хронический стресс, сорбиновая кислота, бензойная кислота, крысы, эксперимент, морфометрия
Короткий адрес: https://sciup.org/14133873
IDR: 14133873 | УДК: 615:9 | DOI: 10.34014/2227-1848-2025-3-154-164
Текст научной статьи Гистологические изменения печени крыс при воздействии пищевых консервантов на фоне хронического стресса
Введение. Хронический психологический стресс представляет собой распространенную проблему, имеющую далеко идущие последствия как на индивидуальном, так и на популяционном уровне [1–3].
Длительная активация систем реагирования на стресс создает постоянную нагрузку на адаптационные возможности организма, приводя к стойким биохимическим, физиологическим и часто структурным изменениям. Одной из основных мишеней хронического стресса является печень – центральный орган метабо- лизма и детоксикации. Активация гипоталамо-гипофизарно-надпочечниковой оси в условиях стресса приводит к повышению уровня циркулирующих глюкокортикоидов, которые преимущественно метаболизируются в печени путем окисления, восстановления и конъюгации. Хронический стресс нарушает микроциркуляцию в печени, что приводит к снижению перфузии тканей и регуляторных функций сосудов [4]. Эти гемодинамические нарушения способствуют гипоксии, активации купферовских клеток и усилению лейкоцитарной инфильтра- ции, усугубляя локальное воспаление и нарушая гомеостаз печени [5]. Более того, хронический стресс в настоящее время признан фактором, влияющим на прогрессирование гепатита, фиброза печени, цирроза и даже гепатоцеллюлярной карциномы [6].
Консерванты в пищевых продуктах, будучи необходимыми для продления срока годности и предотвращения микробной порчи, могут представлять токсикологическую опасность. Так, широко применяемый сорбат калия связан с окислительным повреждением благодаря своему прооксидантному потенциалу [7], а сорбиновая кислота может нарушать метаболизм липидов в печени [8]. Бензойная кислота при недоказанности ее способности вызывать окислительный стресс связана с метаболическими каскадами, сопровождающими окислительный дисбаланс; повышенный уровень бензойной кислоты в тканях ассоциирован с последствиями окислительного стресса, хотя прямых доказательств образования активных форм кислорода нет [9].
Мы предположили, что комбинированное воздействие сорбиновой и бензойной кислот в условиях хронического стресса вызовет более выраженные структурные изменения в печени, чем воздействие каждого из этих факторов по отдельности.
Цель исследования. Определить характер и степень морфологических изменений в печени крыс после 28-дневного воздействия сорбиновой и бензойной кислот и выяснить, усиливает ли хронический психологический стресс токсический эффект указанных пищевых консервантов.
Материалы и методы. Экспериментальное исследование было проведено на 24 аут-бредных половозрелых белых крысах-самцах (Rattus norvegicus) массой 190–210 г. На начало работы возраст животных составил 10– 12 нед. Крысы содержались в условиях специально оборудованного вивария без ограничения доступа к корму и питьевой воде, если иного не требовал экспериментальный протокол. Все процедуры по содержанию, кормлению, уходу и эвтаназии осуществлялись в соответствии с законодательством Российской Федерации об обращении с лабораторными животными, в т.ч. ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», а также Европейской конвенцией о защите позвоночных животных, используемых для экспериментальных и иных научных целей (ETS № 123) и Директивой 2010/63/EC Европейского парламента и Совета по защите животных, используемых в научных целях. Исследование одобрено локальным этическим комитетом ФБУН «Уфимский НИИ медицины труда и экологии человека» (протокол № 01-02 от 8 февраля 2024 г.).
Крысы случайным образом подразделялись на 4 группы по 6 особей в каждой.
Одна группа подвергалась воздействию стрессоров на протяжении всего эксперимента (ХС, хронический стресс) Другой группе ежедневно в одно и то же время внутрижелудочно вводили водные растворы пищевых консервантов – сорбиновой кислоты (500 мг/кг массы тела, 100 мг/мл) и бензойной кислоты (100 мг/кг массы тела, 20 мг/мл) (ПК, пищевые консерванты). Третья группа подвергалась комбинированному воздействию хронического стресса и пищевых консервантов (ПК+ХС). Последняя группа служила контролем (К): этим животным ежедневно внутрижелудочно вводили эквивалентный объем дистиллированной воды.
Дозы сорбиновой и бензойной кислот десятикратно превышали среднюю суточную норму потребления, установленную для взрослого человека перечнем пищевых продуктов, утвержденным Р2.1.10.3968-23, и ТР ТС 029/2012, утвержденным решением Совета Евразийской экономической комиссии от 20 июля 2012 г. № 58). Важно отметить, что данное исследование не ставило целью воспроизведение реальных моделей потребления сорбиновой или бензойной кислот какой-либо конкретной группой населения; интерес представляло выявление потенциального токсического влияния на печень в условиях хронического стресса при воздействии высоких доз этих широко используемых пищевых консервантов.
Для моделирования у крыс-самцов хронического стресса использовали протокол непредсказуемого умеренного стресса [10] с двумя-тремя случайно выбранными факторами в сутки: социальная изоляция, иммобилизация, воздействие шума, постоянное освещение в темное время суток и ограниченный доступ к пище и воде в течение ограниченного периода времени. Каждая комбинация стрессоров применялась в случайное время в течение дня, один и тот же стрессорный фактор не повторялся дважды в течение одного дня.
Признаки хронического стресса у животных подтверждались рядом поведенческих и физиологических признаков, включая снижение набора веса по сравнению с контрольной группой, изменения локомоторной активности и тенденцию к снижению исследовательского поведения [11, 12], что согласуется с изменениями, вызванными стрессом, описанными в смежных исследованиях [13]. Измерения биохимических маркеров стресса, таких как кортикостерон или кортизол, были намеренно исключены из исследования из-за существенного влияния циркадных ритмов и процедурных вмешательств, например забора крови из хвоста у опытных животных, на уровень гормонов, что снижает специфичность таких оценок [14, 15]. Более того, если у человека кортизол является основным гормоном стресса, то у крыс эту роль выполняет кортикостерон, что затрудняет прямое сравнение полученных результатов с клиническими данными, посвященными физиологии человека [16].
На 29-е сут эксперимента животных умерщвляли декапитацией по AVMA (2020). Брюшную полость вскрывали, печень извлекали в течение 2 мин после гибели крысы. Фрагмент органа фиксировали в 10 % нейтральном формалине (ООО «Биovitrum», Россия) 24 ч при 4 °С. После дегидратации в возрастающей серии изопропанола ткани заливали в парафин на гистопроцессоре Excelsior ES (Thermo Scientific, США). Срезы 5–7 мкм получали на микротоме HM 340E (Thermo Scientific) и окрашивали гематоксилином и эозином (BioVitrum, Россия).
Цифровые изображения (ув. ×200) регистрировали с помощью камеры Celena X (Logos Biosystems, Республика Корея). Анализ осуществлялся в QuPath v0.5.1 (Queen’s
University Belfast, Великобритания) оператором, «ослепленным» к групповой принадлежности образцов. Оценивали площадь ядра и цитоплазмы (мкм2), вычисляли ядерно-цито-плазматическое отношение, подсчитывали количество двуядерных и безъядерных гепатоцитов на 10 полей зрения.
Статистический анализ проводился с помощью пакета SciPy на языке Python 3.10 с при выполнении бутстрап-теста (10 000 ресэмплов) с поправкой Холма – Бонферрони на множественные сравнения. Подобная методология широко применяется в биомедицинских исследованиях [17–19]. Различия признавали достоверными при р<0,05.
Результаты и обсуждение. В ходе визуального осмотра печени крыс на этапе препарирования были установлены ее типичная анатомическая форма и размеры. У крыс опытных групп видимых патологических отклонений (изменения цвета капсулы, узловатость, очаги некроза, кровоизлияния) не обнаружено.
На рис. 1 представлены микрофотографии типичных фрагментов печени животных контрольной и опытных групп. При анализе гистологических срезов печени контрольной группы было установлено, что структура паренхимы соответствовала норме. У крыс, подвергшихся хроническому стрессу, наблюдались многочисленные мелкие незрелые гепатоциты с двойными ядрами, а также визуально обнаруживаемые безъядерные гепатоциты. В группе ПК печень сохраняла типичное радиальное расположение тяжей гепатоцитов относительно центральной вены, которая выглядела слегка полнокровной. Ядра гепатоцитов были четко очерченными и округлыми, а цитоплазма – однородной, без признаков дегенерации. Отмечались умеренная васкуляризация портальных трактов и единичные очаги лейкоцитарной инфильтрации без некроза и кровоизлияний. В группе ХС+ПК гистоархитектура печени оставалась интактной. Центральные вены и синусоиды были умеренно полнокровными, желчные протоки не были обструк-тированы. В полях зрения отмечались скопления мелких незрелых гепатоцитов наряду с участками, содержащими безъядерные гепатоциты. Признаков воспалительной инфильтрации, некроза или атипичной пролиферации клеток не обнаружено. Визуальное описательное сравнение не выявило выраженных морфологических различий между группами.
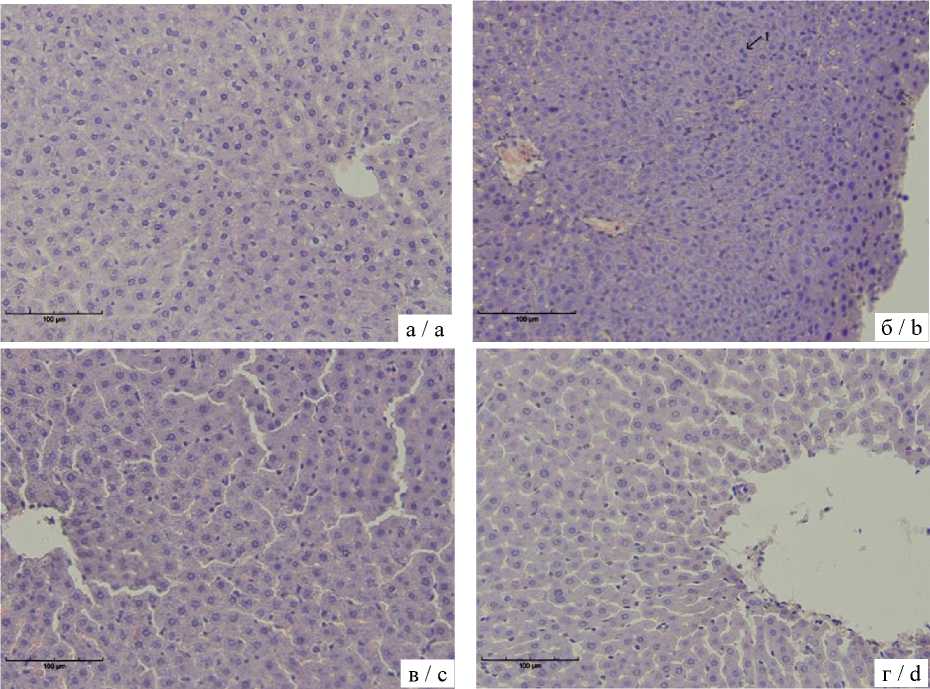
Рис. 1. Микрофотографии срезов ткани печени животных контрольной группы (а) и животных, подвергшихся хроническому стрессу (б), воздействию пищевых консервантов (в) или их комбинации (г).
Окраска гематоксилином и эозином; исходное увеличение ×200
Fig. 1. Micrographs of liver sections from control rats (a) and animals subjected to chronic stress (b), food preservatives (sorbic + benzoic acids) (c) or their combination (d).
H&E staining; original magnification ×200
Морфометрические показатели гепатоцитов представлены на рис. 2. Площадь ядер в контрольной группе составила 33,42±0,52 мкм2, в группе хронического стресса она достоверно снизилась до 26,53±0,54 мкм2, (p<0,0001), тогда как в группе, получавшей сорбиновую и бензойную кислоты, наблюдалось, напротив, увеличение до 37,12±0,80 мкм2 (p=0,0004). Примеча- тельно, что в группе комбинированного воздействия площадь ядра оставалась сопоставимой с контрольными значениями, хотя была выявлена тенденция к увеличению (35,25±0,78 мкм2, p=0,0542). Существенных различий между группами ПК и ПК+ХС не обнаружено (p=0,0971), тогда как статистически значимая разница наблюдалась между группами ХС и ПК+ХС (p<0,0001).
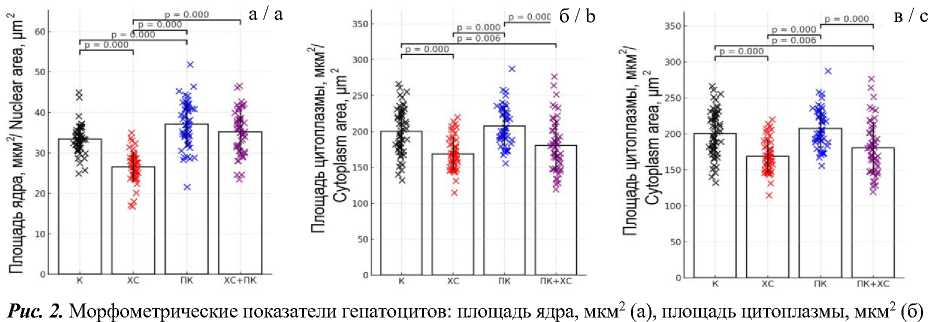
и ядерно-цитоплазматическое отношение, % (в). Столбцы отражают средние значения (Mean±SE), крестики – индивидуальные наблюдения. Горизонтальные линии указывают на статистически значимые различия, выявленные методом бутстрепа (10 000 перестановок, p<0,05)
Fig. 2. Morphometric parameters of hepatocytes: nuclear area, µm² (a), cytoplasm area, µm² (b), and nuclear-to-cytoplasmic ratio, % (c). Columns denote Mean±SE; coloured crosses represent individual observations. Horizontal lines indicate statistically significant differences detected by the bootstrap method (10,000 permutations; p<0.05)
Площадь цитоплазмы гепатоцитов в контрольной группе составляла 200,57±4,67 мкм2. В группе ХС этот показатель был значительно снижен (168,83±3,29 мкм2, p<0,0001). В группе ПК его значения не отличались от контрольных (207,96±3,93 мкм2, p=0,2285), тогда как в группе ПК+ХС они были значительно ниже (180,84±5,14 мкм2, p=0,0060). Существенная разница была обнаружена между группами ПК и ПК+ХС (p=0,0001), но не между группами ХС и ПК+ХС (p=0,0511).
В контрольной группе ЯЦО составляло 0,17±0,01, что значимо не отличалось от значений в группе ХС – 0,16±0,01 (р=0,102). В группе ПК показатель был несколько выше, но статистически незначимо (0,18±0,01, p=0,157). В группе ПК+ХС значения параметра были выше контроля (0,20±0,01, p=0,0005), а также отличались от группы ПК (р=0,029) и группы ХС (р<0,0001).
Количество двуядерных гепатоцитов было достоверно увеличено в группе, подвергнутой воздействию хронического стресса (15,90±1,67 против 9,30±1,14 в контроле, p=0,006), но не отличалось от контрольной группы ни в группе ПК (8,70±0,50, p=0,595), ни в группе ПК+ХС (9,00±0,70, p=0,822) (рис. 3 а). В группе ПК двуядерных гепатоцитов было меньше в сравнении с группой ХС
(р=0,001), равно как и в группе ПК+ХС (р=0,003). Количество безъядерных гепатоцитов в контроле составило 3,30±0,37 ед., в экспериментальных группах значения были сопоставимы: 3,00 ±0,39 в группах ХС и ПК (р=0,633 в сравнении с К) и 3,60 ±0,34 в группе ПК+ХС (р=0,521 в сравнении с К) (рис. 3 б).
В совокупности у крыс, подвергшихся воздействию хронического стресса, уменьшение площади ядра и цитоплазмы при росте числа двуядерных клеток отражает раннюю регенеративную реакцию на стресс‑индуциро-ванное повреждение, что согласуется с данными литературы. Xu и соавт. показали, что четырехнедельное воздействие хронического психологического стресса само по себе может инициировать воспалительный ответ и ухудшать функции печени у крыс, вплоть до некроза гепатоцитов [20]. Однако выявленные в нашем исследовании изменения носили скорее компенсаторный характер. Некроз не выявлен, но присутствуют двуядерные гепатоциты, что может отражать развитие компенсаторной регенерации или защитной реакции на стресс [21]. Двуядерные клетки, как известно, составляют основную пролиферативную популяцию при регенерации печени, в т.ч. после токсического повреждения [22].
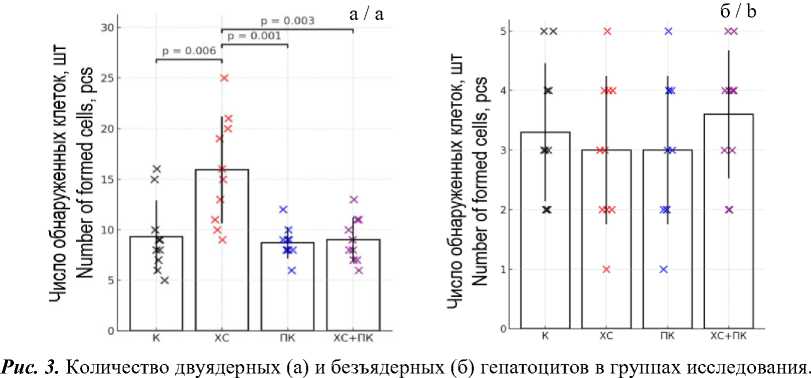
Столбцы отражают средние значения (Mean±SE), крестики – индивидуальные наблюдения. Горизонтальные линии указывают на статистически значимые различия, выявленные методом бутстрепа (10 000 перестановок, p<0,05)
Fig. 3. Counts of binucleated (a) and anucleated (b) hepatocytes in the study groups. Columns denote Mean±SE; coloured crosses represent individual observations. Horizontal lines indicate statistically significant differences detected by the bootstrap method (10,000 permutations; p < 0.05)
При воздействии консервантов наблюдались гипертрофия гепатоцитов без цитолиза и сниженное число двуядерных клеток, что указывает на функциональную перегрузку зрелых клеток при сохранении их структуры и согласуется с известными нам работами других исследовательских коллективов [7, 8].
В группе ПК+ХС сохранялась архитектоника и не изменялось число двуядерных клеток при значимом уменьшении цитоплазматической площади и росте ЯЦО. Это свидетельствует о раннем клеточном стрессе и энергетическом дефиците без явного цитолиза. Вероятно, хронизация стресса усиливает или трансформирует эффект пищевых консервантов на морфологическом уровне даже при отсутствии выраженной деструкции ткани. Для количественного уточнения типа взаимодействия (аддитивность, синергизм, антагонизм) необходим дальнейший математический анализ.
Заключение. Установлено, что хронический стресс вызывает уменьшение размеров гепатоцитов и компенсаторное увеличение числа двуядерных клеток без некротических изменений. Пероральное подострое поступление сорбиновой и бензойной кислот в изученных дозах приводит к умеренной гипертрофии гепатоцитов без признаков острой цитотоксичности. При сочетании стресса и консервантов наблюдается сокращение цитоплазматической площади и рост ядерно‑цитоплазмати-ческого отношения на фоне сохранной архитектоники, что, вероятно, отражает раннюю фазу клеточного стресса и потенциальную угрозу функциональной декомпенсации. Полученные данные свидетельствуют о способности хронического стресса модифицировать гепатотоксический эффект пищевых консервантов. Однако окончательные выводы о характере взаимодействия – аддитивном, синергичном или антагонистическом – требуют разработки математических подходов к анализу токсического действия химического агента на фоне стресса, что представляет собой перспективное направление дальнейших исследований.
Исследование было выполнено в рамках отраслевой научно-исследовательской программы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека на 2021–2025 гг.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Каримов Д.О., Рябова Ю.В.
Литературный поиск, участие в исследовании, обработка материала: Каримов Д.Д.,
Гизатуллина А.А., Смолянкин Д.А., Хмель А.О.
Статистическая обработка данных: Каримов Д.О.
Анализ и интерпретация данных: Каримов Д.О., Рябова Ю.В., Каримов Д.Д.
Написание и редактирование текста: Каримов Д.О., Рябова Ю.В.


