Гистологические тенденции и молекулярно-генетические особенности немелкоклеточного рака легкого в Ханты-Мансийском автономном округе - Югре
Автор: Мордовский А.А., Аксарин А.А., Парсаданян А.М., Троян П.П., Пахтусов А.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 3 т.23, 2024 года.
Бесплатный доступ
Цель исследования - изучить гистологическую структуру рака легкого, молекулярно-генетические, гендерные, демографические и анамнестические характеристики группы больных немелкоклеточным раком легкого в Ханты-Мансийском автономном округе (ХМАО) - Югре. материал и методы. Материалом для исследования стали 6 725 случаев рака легкого (РЛ), выявленных в 2001-2020 гг., и 266 случаев немелкоклеточного рака легкого (НМРЛ), диагностированных в 2020-2023 гг. Для анализа использовался непараметрический критерий Фишера и критерий 2 Пирсона. Рассчитывался относительный шанс развития события в основной группе по сравнению с группой контроля.
Рак легкого, заболеваемость, смертность, молекулярно-генетическая диагностика, табакокурение, онкоген
Короткий адрес: https://sciup.org/140305917
IDR: 140305917 | УДК: 616.24-006.6:577.21(571.122) | DOI: 10.21294/1814-4861-2024-23-3-115-123
Текст научной статьи Гистологические тенденции и молекулярно-генетические особенности немелкоклеточного рака легкого в Ханты-Мансийском автономном округе - Югре
Морфологическое разнообразие и механизмы канцерогенеза делают рак легкого (РЛ) одним из самых гетерогенных онкологических заболеваний, ассоциированным с высокой смертностью как среди мужчин, так и среди женщин. По-прежнему чаще всего выявляются местнораспространенные и запущенные формы РЛ, что определяет плохой прогноз и низкие показатели 5-летней выживаемости, которая при РЛ IIIA стадии составляет 36 %, при IIIB – 26 %, при IIIC – 13 %, при IVA – 10 %, при IVB – 0 % [1, 2]. В мире ежегодно растет число умерших от рака легкого, при сохранении текущей тенденции показатели смертности от РЛ могут увеличиться с 1,8 до 3,01 млн человек за период с 2020 по 2024 г. [3]. Наблюдения за динамикой стандартизованного показателя заболеваемости РЛ в ХМАО – Югре показали рост заболеваемости за период 2001–2020 гг., что превышает общероссийские показатели в целом, – 27,5 против 20,3 на 100 тыс. населения в 2020 г. [1, 4].
Рак легкого в клинической практике, в зависимости от гистологической структуры, принято подразделять на немелкоклеточный (80–85 %) и мелкоклеточный (10–15 %), которые существенно различаются между собой как тактикой лечения, так и показателями безрецидивной и общей выживаемости [5]. Наиболее частыми гистологическими подтипами немелкоклеточного рака легкого (НМРЛ) являются аденокарцинома (40 %), плоскоклеточная (20–30 %) и крупноклеточная карцинома легкого (9–19 % всех случаев РЛ). В настоящее время при НМРЛ активно применяется молекулярнонаправленная терапия, в связи с чем определение индивидуального молекулярно-генетического портрета НМРЛ дает существенную возможность повлиять на эффективность лечения. Несмотря на то, что генетические аберрации чаще наблюдаются при аденокарциноме легкого, в последние годы растет интерес и к молекулярному профилю других гистологических подтипов НМРЛ [6, 7]. Анализ отечественной литературы, посвященной проблеме РЛ, показал, что доминирующей гистологической формой НМРЛ в регионах Российской Федерации, в том числе и ХМАО – Югре, на протяжении многих лет остается плоскоклеточный рак [8–11].
По данным клинических и рандомизированных исследований, определение наиболее распространенных активирующих мутаций ( EGFR, BRAF, ex14 MET, G12C KRAS ), транслокаций ( ALK, ROS1, NTRK 1/2/3, RET ), амплификаций ( HER2 ), уровня экспрессии PD-L1 и назначение соответствующей молекулярно-направленной терапии обеспечивает увеличение общей выживаемости и выживаемости без прогрессирования, по сравнению со стандартными режимами химиотерапии [12–18]. Частота генетических изменений при НМРЛ варьирует от популяционных особенностей (расовая принадлежность, пол), региона проживания, статуса табакокурения, а также от гистотипа и степени дифференцировки опухоли: EGFR (10–30 %), ALK (3–7 %), ROS1 (1–2 %), BRAF (1–3 %), ERBB2 (1–4 %), KRAS (25–30 %), MET (2–4 %), RET (1–2 %), NTRK1/2/3 (<1 %), PD-L1 (<1 % – до 67 %, 1–49 % – до 22 %, ≥50 % – до 10 %) [19–23].
Цель исследования – изучить гистологическую структуру рака легкого, а также молекулярногенетические, гендерные, демографические и анамнестические характеристики группы больных НМРЛ в Ханты-Мансийском автономном округе – Югре.
Материал и методы
Материалом для исследования стали 6 725 случаев рака легкого, выявленных в 2001–2020 гг., и 266 случаев НМРЛ, диагностированных в 2020–2023 гг. в Ханты-Мансийском автономном округе Югре. Группе пациентов с НМРЛ проведены молекулярно-генетическое тестирование на наличие генетических аберраций EGFR, ALK, ROS1, BRAF, ERBB2 (HER2), KRAS, MET, RET, NTRK1/2/3 и определение экспрессии PD-L1. Все случаи подтверждены при патогистологическом исследовании как НМРЛ, стадия опухоли уста- новлена в соответствии с 8-м изданием классификации TNM. У 266 пациентов анализировали пол, возраст, анамнез курения, гистологический тип опухоли. Основную группу составили 106 больных со специфическими молекулярно-генетическими изменениями, группу контроля – 160 больных без молекулярно-генетических изменений.
Для статистического анализа использовались непараметрический критерий Фишера и критерий χ2 Пирсона. Рассчитывался относительный шанс развития события в основной группе по сравнению с группой контроля. В соответствии с тестом Бон-феррони поправка на множественные сравнения для 5 сравниваемых групп имеет значение 0,01. Статистически значимое различие показателей устанавливалось при р<0,01. Для расчета использовались программы STATISTICA 10 и MS EXСEL.
Результаты
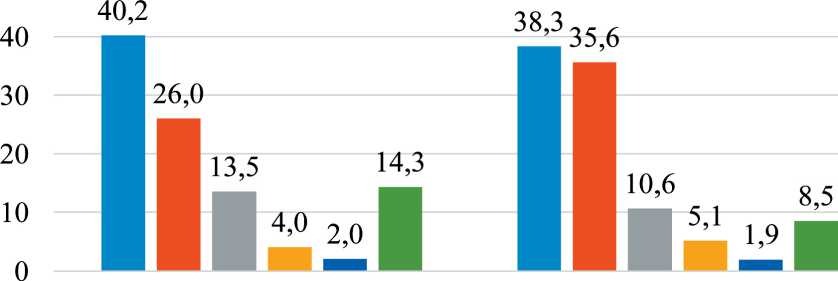
Проанализированы 6 725 случаев с морфологически подтвержденным диагнозом злокачественное новообразование легких за периоды 2001–2010 (n=2 836) и 2011–2020 гг. (n=3 889). Наиболее частой гистологической формой РЛ из числа выявленных опухолей был плоскоклеточный рак (как в первой – 40,2 %, так и во второй – 38,3 % половине исследуемого периода). Отмечается увеличение удельного веса аденокарциномы легкого, приближающегося к показателям плоскоклеточного рака (с 26 до 35,6 %), крупноклеточного рака (с 4,0 до 5,1 %) на фоне снижения удельного веса мелкоклеточного рака (с 13,5 до 10,6 %) и других гистологических подтипов рака легкого, включая БДУ (без дальнейшего уточнения) (с 14,3 до 8,5 %). Другие формы рака встречались гораздо реже (рис. 1).
В течение анализируемых 10-летних периодов наблюдалось увеличение удельного веса аденокарцином легкого, на фоне незначительного снижения
50 %
2001-2010 2011-2020
-
■ Плоскоклеточный/ squamous cell
-
■ Аденокарцинома/ adenocarcinoma
Мелкоклеточный/ small-cell
Крупноклеточный/ large cell
-
■ Диморфный/ dimorphic
-
■ Другие гистологические подтипы/ other histological subtypes
Рис. 1. Удельный вес морфологических типов опухолей рака легкого в Югре в 2001–2010 гг. (n=2 836) и 2011–2020 гг. (n=3 889). Примечание: диаграмма выполнена авторами Fig. 1. Percentage of morphological types of lung cancer tumors in Yugra for 2001–2010 years (n=2 836) and for 2011–2020 years (n=3 889). Note: created by the authors
Основная информация о 266 пациентах с НМРЛ
Basic parameters of 266 patients with Nsclc
Таблица 1/table 1
|
Клинико-патологические параметры/Clinico-pathological parameters |
Число случаев/Number of cases |
|
|
Пол/Sex |
Мужской/Male |
198 (74,0 %) |
|
Женский/Female |
68 (26,0 %) |
|
|
Аденокарцинома/Adenocarcinoma |
144 (54,1 %) |
|
|
Гистология/ Histology |
Плоскоклеточный/Squamous cell |
102 (38,4 %) |
|
Крупноклеточный/Large cell |
11 (4,1 %) |
|
|
Диморфный/Dimorphic |
7 (2,6 %) |
|
|
Недифференцированный/Undifferentiated |
2 (0,8 %) |
|
|
EGFR exon (19, 20, 21) |
41 (15,4 %) |
|
|
ALK |
14 (5,3 %) |
|
|
Мутация/ Транслокация/ |
ROS1 |
4 (1,5 %) |
|
ERBB2 (HER2) |
8 (3,0 %) |
|
|
Амплификация/ |
BRAF |
2 (0,8 %) |
|
Mutation/ |
KRAS (codons 12, 13, 61) |
36 (13,5 %) |
|
Translocation/ |
MET exon 14 |
1 (0,4 %) |
|
amplification |
RET |
– |
|
NTRK1/2/3 |
– |
|
|
Отсутствует (группа контроля)/None (control group) |
160 (60,1 %) |
|
|
Высокая/High: ≥50 % |
12 (4,5 %) |
|
|
Экспрессия/ |
Средняя/Medium: 1–49 % |
43(16,2 %) |
|
Expression PD-L1 |
Низкая/Low: <1 % |
168 (63,2 %) |
|
Не исследовалась/Not investigated |
43 (16,2 %) |
|
|
Возраст/Age |
≥48 лет/years |
244 (91,7 %) |
|
<48 лет/years |
22 (8,3 %) |
|
|
Курение в анамнезе/ Smoking anamnesis |
Никогда не курили/Never smoked |
77 (29,0 %) |
|
Курили ранее/Smoked before |
76 (28,6 %) |
|
|
Продолжают курить/They keep smoking |
113 (42,4 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
удельного веса плоскоклеточного и мелкоклеточного рака, что по большей части можно объяснить снижением распространенности табакокурения среди населения за последние 10 лет. Увеличение числа аденокарцином легкого дает возможность спрогнозировать ожидаемый рост опухолей с наличием специфических генетических изменений.
В группе пациентов с НМРЛ, у которых исследовался молекулярно-генетический профиль, лишь у 106 (39,8 %) имелись специфические генные изменения, а остальные были включены в группу контроля. Чаще всего среди пациентов выявлялись мужчины (74 %), курильщики (бывшие – 28,6 %, продолжающие курить – 42,4 %) и лица, заболевших в возрасте ≥48 лет (91,7 %). Удельный вес аденокарцином и плоскоклеточной карциномы равнялся 54,1 и 38,4 % соответственно, крупноклеточный, аденосквамозный и недифференцированный РЛ составил менее 8 % случаев.
В структуре всех случаев НМРЛ наибольший удельный вес наблюдался у пациентов с мутацией в гене EGFR (exon 19, 20, 21) – 15,4 % и в гене KRAS (кодоны 12, 13, 61) – 13,5 %. Генетические аберрации в генах ALK, ROS-1 HER2, BRAF и MET в 14 экзоне составили 5,3; 1,5; 3,0; 0,8 и 0,4 % слу- чаев соответственно. Низкий уровень экспрессии гена PD-L1 (<1 %) наблюдался значительно чаще (63,2 %) по сравнению со средним (1–49 %) и высоким (≥50 %) уровнем его экспрессии – 16,2 и 4,5 % соответственно (табл. 1).
Мутация в гене EGFR и транслокация ROS1 наблюдались преимущественно у женщин в отличие от мужчин, у которых генетические изменения чаще наблюдались в онкогенах KRAS, HER2, ALK, MET, BRAF (рис. 2). Отличительной особенностью некурящих пациентов с аденокарциномой легкого явилась высокая частота транслокации ROS1 среди женщин. Мутации в генах MET (14 экзон) и BRAF наблюдались исключительно у курящих мужчин при плоскоклеточном раке, аденокарциноме и крупноклеточном раке легкого соответственно.
Наибольшее число случаев генетических изменений выявлено в группе больных от 45 лет и старше. Изменения в генах EGFR, ALK, ROS1, KRAS наблюдались во всех возрастных группах, начиная с 25 лет. Максимальные значения наблюдались в возрастных группах с 55 до 69 лет. Молекулярногенетические изменения в генах ERBB2 (HER2), MET и BRAF наблюдались преимущественно в возрастной группе 45–74 года (рис. 3).
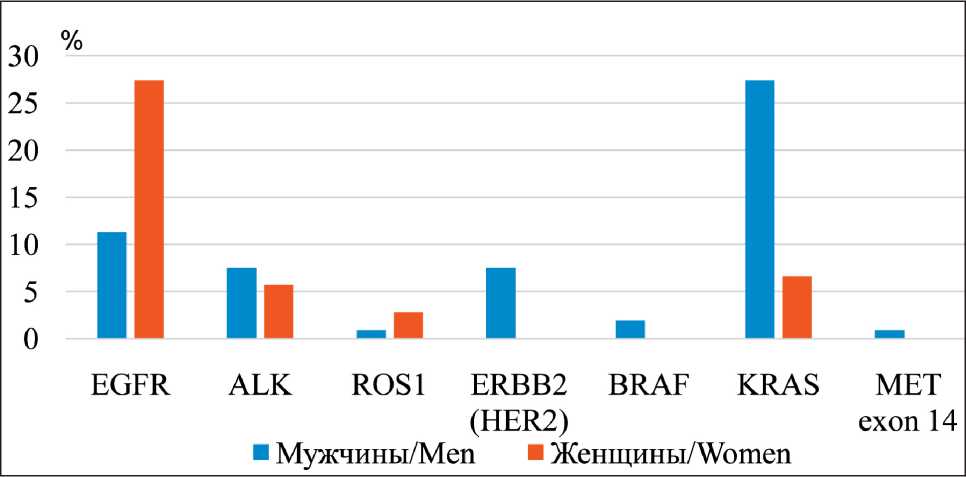
Рис. 2. Гендерные характеристики 106 пациентов с наличием генетических аберраций. Примечание: диаграмма выполнена авторами Fig. 2: Gender characteristics of 106 patients with the presence of genetic aberrations. Note: created by the authors
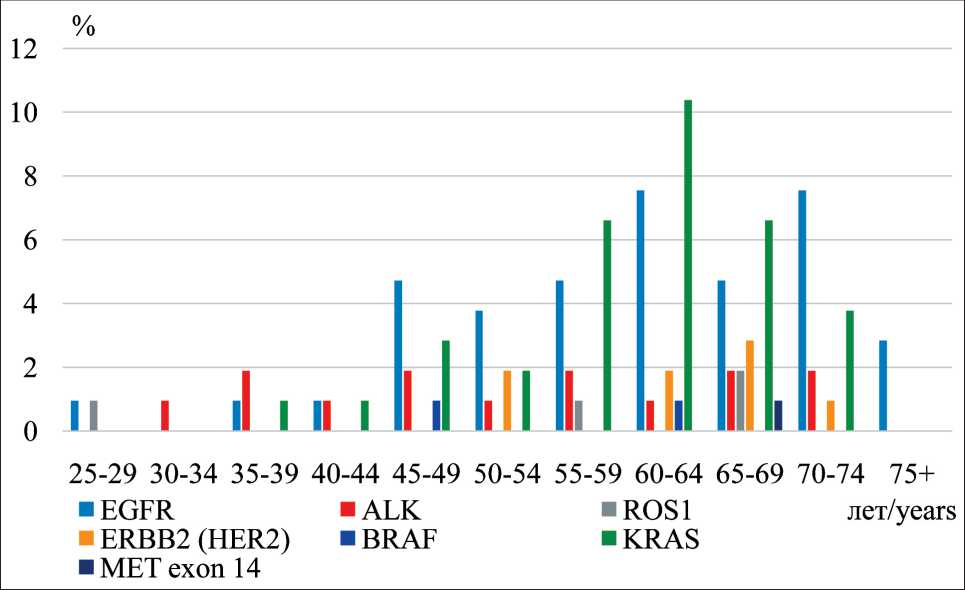
Таблица 2/table 2
Характеристика пациентов со специфическими молекулярно-генетическими изменениями по полу, возрасту
characteristics of patients with specific molecular genetic changes by sex, age
|
Группы сравнения/ Comparison groups |
Пол/Sex Мужской/Male Женский/Female |
Возраст/Age ≥48 лет/years |
||
|
1 |
Контрольная, нет мутации/ Control, no mutation (n=160) |
137 (85,6 %) |
23 (14,4 %) |
154 (96,2 %) |
|
2 |
EGFR del19 и L858R (n=39) |
11 (28,9 %) |
27 (71,1 %) |
33 (86,8 %) |
|
3 |
KRAS (n=36) |
29 (80,6 %) |
7 (19,4 %) |
31 (86,1 %) |
|
4 |
ALK (n=14) |
8 (57,1 %) |
6 (42,9 %) |
9 (64,3 %) |
|
5 |
HER2 (n=8) |
8 (100,0 %) |
0 (0,0 %) |
8 (100,0 %) |
|
ОШ/OR (95 % ДИ/CI) |
ОШ1–2=0,07 [0,03–0,16] ОШ1–2=14,62 [6,38–33,48] ОШ1–3=0,70 [0,27–1,77] ОШ1–3=1,44 [0,56–3,67] ОШ1–4=0,22 [0,07–0,70] ОШ1–4=4,47 [1,42–14,07] |
ОШ1–2=0,26 [0,07–0,89] ОШ1–3=0,24 [0,07–0,84] ОШ1–4=0,07 [0,02–0,27] |
||
|
χ2 Пирсона, р/Pearson's χ2, p |
р<0,001, при χ2=221,238 |
р<0,001, при χ2=316,298 |
||
|
Критерий Фишера, р/ Fisher's criterion, p |
р1–2<0,001 р1–3=0,447 p1–4=0,015 p1–5=0,6 |
р1–2=0,137 p1–3=0,354 p1–4=0,002 p1–5=1,0 |
||
Список литературы Гистологические тенденции и молекулярно-генетические особенности немелкоклеточного рака легкого в Ханты-Мансийском автономном округе - Югре
- Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2020 godu. Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2021. 239 s.
- Goldstraw P., Chansky K., Crowley J., Rami-Porta R., Asamura H., Eberhardt W.E., Nicholson A.G., Groome P., Mitchell A., Bolejack V.; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee, Advisory Boards, and Participating Institutions; International Association for the Study of Lung Cancer Staging and Prognostic Factors Committee Advisory Boards and Participating Institutions. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016; 11(1): 39-51. https://doi.org/10.1016/j.jtho.2015.09.009.
- GLOBOCAN 2020: estimated cancer incidence, mortality and prevalence worldwide in 2020 [Internet]. International Agency for Research on Cancer, World Health Organization, 2018. [cited 2024 Apr 1]. URL: http://globocan.iarc.fr.
- Mordovskii A.A., Aksarin A.A., Parsadanyan A.M., Ter-Ovanesov M.D., Troyan P.P. Epidemiologicheskaya kharakteristika zabolevaemosti i smertnosti ot raka legkogo v Khanty-Mansiiskom avtonomnom okruge - Yugre. Sibirskii onkologicheskii zhurnal. 2021; 20(4): 30-8. https://doi.org/10.21294/1814-4861-2021-20-4-30-38.
- Heighway J., Betticher D.C. Solid Tumour Section Mini Review Atlas of Genetics and Cytogenetics in Oncology and Haematology Lung tumors: an overview. Atlas Genet Cytogenet Oncol Haematol. 2004; 8(2).
- Smirnova E.A, Pavlovskaya A.I., Raikhlin N.T., Polotskii B.E., Sviridov S.V., Laktionov K.K., Gerasimov S.S. Morfologicheskie kriterii krupnokletochnogo raka legkogo: diagnostika i prognoz. Vestnik RONTs im. N.N. Blokhina RAMN. 2008; 19(3): 57-63.
- Zheng M. Classification and Pathology of Lung Cancer. Surg Oncol Clin N Am. 2016; 25(3): 447-68. https://doi.org/10.1016/j.soc.2016.02.003.
- Aksarin A.A., Ter-Ovanesov M.D., Mordovskii A.A. Aspekty khirurgicheskogo lecheniya nemelkokletochnogo raka legkogo. Khirurg. 2014; 7: 20-7.
- Aksenova I.A., Domozhirova A.S., Novikova T.S. Analiz vyzhivaemosti patsientov so zlokachestvennymi novoobrazovaniyami legkikh v Chelyabinskoi oblasti. Effektivnaya farmakoterapiya. 2019; 15(3): 18-22.
- Imyanitov E.N., Khanson K.P. Molekulyarnaya onkologiya: klinicheskie aspekty. SPb., 2007. 213 s.
- Merabishvili V.M., Barchuk A.S., Barchuk A.A., Atroshchenko A.V., Shcherbakov A.M., Tarkov S.A., Arsen'ev A.I., Demin E.V., Merabishvili E.N., Preis V.G., Kharitonov M.V., Chepik O.F. Zabolevaemost', diagnostika, dinamika gistologicheskoi struktury, effektivnost' lecheniya bol'nykh rakom legkogo razlichnykh vozrastno-polovykh grupp na sovremennom etape. Profilakticheskaya i klinicheskaya meditsina. 2015; 3(56): 88-97.
- Ettinger D.S., Wood D.E., Aisner D.L., Akerley W., Bauman J., Chirieac L.R., D’Amico T.A., DeCamp M.M., Dilling T.J., Dobelbower M., Doebele R.C., Govindan R., Gubens M.A., Hennon M., Horn L., Komaki R., Lackner R.P., Lanuti M., Leal T.A., Leisch L.J., Lilenbaum R., Lin J., Loo B.W. Jr, Martins R., Otterson G.A., Reckamp K., Riely G.J., Schild S.E., Shapiro T.A., Stevenson J., Swanson S.J., Tauer K., Yang S.C., Gregory K., Hughes M. Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2017; 15(4): 504-35. https://doi.org/10.6004/jnccn.2017.0050.
- Friedlaender A., Banna G., Patel S., Addeo A. Diagnosis and Treatment of ALK Aberrations in Metastatic NSCLC. Curr Treat Options Oncol. 2019; 20(10): 79. https://doi.org/10.1007/s11864-019-0675-9.
- Mok T.S., Wu Y.L., Thongprasert S., Yang C.H., Chu D.T., Saijo N., Sunpaweravong P., Han B., Margono B., Ichinose Y., Nishiwaki Y., Ohe Y., Yang J.J., Chewaskulyong B., Jiang H., Duffield E.L., Watkins C.L., Armour A.A., Fukuoka M. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med. 2009; 361(10): 947-57. https://doi.org/10.1056/NEJMoa0810699.
- Planchard D., Besse B., Groen H.J.M., Hashemi S.M.S., Mazieres J., Kim T.M., Quoix E., Souquet P.J., Barlesi F., Baik C., Villaruz L.C., Kelly R.J., Zhang S., Tan M., Gasal E., Santarpia L., Johnson B.E. Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022; 17(1): 103-15. https://doi.org/10.1016/j.jtho.2021.08.011.
- Wakelee H.A., Altorki N.K., Zhou C., Csőszi T., Vynnychenko I.O., Goloborodko O., Luft A., Akopov A., Martinez-Marti A., Kenmotsu H., Chen Y.M., Chella A., Sugawara S., Gitlitz B.J., Bennett E., Wu F., Yi J., Deng Y., McCleland M., Felip E. IMpower010: Primary results of a phase III global study of atezolizumab versus best supportive care after adjuvant chemotherapy in resected stage IB-IIIA non-small cell lung cancer (NSCLC). J Clin Oncol. 2021; 39(15sl). https://doi.org/10.1200/JCO.2021.39.15_suppl.8500.
- Wu Y.L., Tsuboi M., He J., John T., Grohe C., Majem M., Goldman J.W., Laktionov K., Kim S.W., Kato T., Vu H.V., Lu S., Lee K.Y., Akewanlop C., Yu C.J., de Marinis F., Bonanno L., Domine M., Shepherd F.A., Zeng L., Hodge R., Atasoy A., Rukazenkov Y., Herbst R.S.; ADAURA Investigators. Osimertinib in Resected EGFR-Mutated Non-Small-Cell Lung Cancer. N Engl J Med. 2020; 383(18): 1711-23. https://doi.org/10.1056/NEJMoa2027071.
- Zappa C., Mousa S.A. Non-small cell lung cancer: current treatment and future advances. Transl Lung Cancer Res. 2016; 5(3): 288-300. https://doi.org/10.21037/tlcr.2016.06.07.
- Shneider O.V., Kamilova T.A., Golota A.S., Sarana A.M., Shcherbak S.G. Biomarkery i targetnaya terapiya pri rake legkikh. Fizicheskaya i reabilitatsionnaya meditsina, meditsinskaya reabilitatsiya. 2021; 3(1): 74-94.
- Han B., Tjulandin S., Hagiwara K., Normanno N., Wulandari L., Laktionov K., Hudoyo A., He Y., Zhang Y.P., Wang M.Z., Liu C.Y., Ratcliffe M., McCormack R., Reck M. EGFR mutation prevalence in AsiaPacific and Russian patients with advanced NSCLC of adenocarcinoma and non-adenocarcinoma histology: The IGNITE study. Lung Cancer. 2017; 113: 37-44. https://doi.org/10.1016/j.lungcan.2017.08.021.
- Harrison P.T., Vyse S., Huang P.H. Rare epidermal growth factor receptor (EGFR) mutations in non-small cell lung cancer. Semin Cancer Biol. 2020; 61: 167-79. https://doi.org/10.1016/j.semcancer.2019.09.015.
- Imyanitov E.N., Demidova I.A., Gordiev M.G., Filipenko M.L., Kekeyeva T.V., Moliaka Y.K., Gervas P.A., Kozhemyako V.B., Vodolazhskiy D.I., Sergeyeva L.A., Fattakhova D.U., Iyevleva A.G., Mitiushkina N.V., Kuligina E.Sh., Barinov A.A., Mommaeva M.S., Aleksakhina S.N., Tsimafeyeu I.V., Tjulandin S.A. Distribution of EGFR Mutations in 10,607 Russian Patients with Lung Cancer. Mol Diagn Ther. 2016; 20(4): 401-6. https://doi.org/10.1007/s40291-016-0213-4.
- Pawelczyk K., Piotrowska A., Ciesielska U., Jablonska K., GletzelPlucinska N., Grzegrzolka J., Podhorska-Okolow M., Dziegiel P., Nowinska K. Role of PD-L1 Expression in Non-Small Cell Lung Cancer and Their Prognostic Significance according to Clinicopathological Factors and Diagnostic Markers. Int J Mol Sci. 2019; 20(4): 824. https://doi.org/10.3390/ijms20040824.


