Гистологическое строение проксимального метафизарного хряща плечевой кости у крыс после шестидесятидневного введения тартразина
Автор: Лузин Владислав Игоревич, Фастова Ольга Николаевна, Морозов Виталий Николаевич, Морозова Елена Николаевна, Заболотная Светлана Владимировна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Цель исследования. Установить, оказывает ли влияние 60-дневное введение тартразина в дозах 750 и 1500 мг/кг массы тела на гистологическое строение проксимального метафизарного хряща плечевой кости у половозрелых крыс. Материалы и методы. Исследование проведено на 90 белых крысах-самцах, распределенных на 3 группы: 1-я - контрольная, в которой животные ежедневно в течение 60 дней получали физиологический раствор через желудочный зонд; 2-ю и 3-ю группы составили крысы, которые на протяжении 60 дней получали внутрижелудочно 1 мл раствора тартразина в дозах 750 и 1500 мг/кг массы тела соответственно. Сроки периода реадаптации после окончания введения тартразина составляли 3, 10, 15, 24, 45 сут. Проксимальный метафиз плечевой кости подвергался обработке по стандартному гистологическому протоколу. Полученные срезы окрашивались гематоксилин-эозином и подвергались последующему гистоморфометрическому исследованию. Результаты. У животных 2-й группы на 3-й день периода реадаптации общая ширина проксимального метафизарного хряща плечевой кости была меньше значений контрольной группы на 8,59 %, ширина зон индифферентного, пролиферирующего и дефинитивного хряща - на 6,11, 8,85 и 7,15 % меньше, ширина зоны деструкции - на 11,55 %, а ширина зоны остеогенеза - на 9,92 %. Содержание первичной спонгиозы в зоне остеогенеза и количество клеток на поверхности трабекул были меньше значений контрольной группы на 8,45 и 8,42 %. В ходе периода реадаптации сходная динамика изменений гистоморфометрических параметров метафизарного хряща плечевой кости сохранялась с тенденцией к сглаживанию к 45-м сут эксперимента. У крыс 3-й группы в ходе всего периода реадаптации изучаемые параметры изменялись более значимо и их восстановление до контрольных величин происходило медленнее, чем во 2-й группе. Выводы. 60-дневное введение тартразина половозрелым крысам сопровождается угнетением костеобразовательной функции проксимального метафизарного хряща плечевой кости, что подтверждается снижением ширины всех его зон и объемных компонентов зоны остеогенеза. Более выраженные по амплитуде и длительности изменения изучаемых параметров зафиксированы у животных, получавших тартразин в дозе 1500 мг/кг массы тела.
Плечевая кость, метафизарный хрящ, тартразин, гистоморфометрия
Короткий адрес: https://sciup.org/14117549
IDR: 14117549 | УДК: 591.83:615.2 | DOI: 10.34014/2227-1848-2020-1-150-157
Текст научной статьи Гистологическое строение проксимального метафизарного хряща плечевой кости у крыс после шестидесятидневного введения тартразина
Введение. Одними из свойств живых организмов являются их рост и развитие. Рост сопровождается увеличением размеров и массы тела с сохранением общего плана строения, развитие - приобретением новых признаков и функциональностей [1] .
Рост организма в длину в детском и юношеском возрасте связан с активностью хондрогенных клеток метафизарного гиалинового хряща, расположенного на границе эпифизов и диафизов трубчатых костей. В 18–25 лет граница между эпифизами и диафизом исчезает из-за окостенения данного хряща [2, 3].
В связи с тем что метафизарный хрящ является активной динамичной зоной развивающейся кости, он чувствителен к воздействию различных экзо- и эндогенных факторов [4, 5].
В качестве химических факторов, оказывающих повседневное воздействие на организм человека, можно рассматривать пищевые добавки. Они входят в состав продуктов питания, используются в фармацевтической промышленности и косметологии [6].
Одной из таких пищевых добавок является синтетический азокраситель тартразин. Он используется для придания желто-оранже- вого цвета продуктам питания, различным лекарственным формам, косметическим средствам и т.д. [7].
В литературе имеются отрывочные сведения о влиянии тартразина на процессы роста и формообразования кости, химический состав и ультраструктуру, однако данные о воздействии данной пищевой добавки на гистологическое строение метафизарного хряща отсутствуют вовсе.
Цель исследования. Установить, оказывает ли влияние 60-дневное введение тартразина в дозах 750 и 1500 мг/кг массы тела на гистологическое строение проксимального метафизарного хряща плечевой кости у половозрелых крыс.
Материалы и методы. Для проведения эксперимента из вивария ГУ «Луганский государственный медицинский университет» было отобрано 90 белых крыс-самцов молодого возраста репродуктивного периода онтогенеза (210–340 г). Выбор животных данной возрастной категории обусловлен тем, что наиболее активные процессы роста и ремоделирования костей происходят именно в этот возрастной период. В течение 60-дневного введения тартразина животные набирали массу тела и переходили в зрелый возраст репродуктивного периода онтогенеза (260–360 г). При определении возраста крыс во внимание бралась возрастная периодизация лабораторных животных [8] .
Экспериментальные группы, 2-ю и 3-ю, составили животные, которым ежедневно в течение 60 дней при помощи зонда в желудок вводили 1 мл раствора тартразина в дозах 750 и 1500 мг/кг массы тела соответственно. Расчет дозы вводимого крысам тартразина производили с учётом рекомендаций Ю.Р. и Р.С. Рыболовлевых, которые при использовании веществ в эксперименте на животных рекомендуют учитывать константу биологической активности при дозировании веществ в работе с млекопитающими [9]. Формула расчёта дозировки лекарственных препаратов для крысы имеет следующий вид:
„ . r х Доза человека
Доза для крысы = ---------------, где r - коэффициент видовой выносливости для крысы, равный 3,62; R - коэффициент видовой выносливости для человека, равный 0,57.
Контрольную группу (1-й группу) сформировали из крыс, которым вводили эквивалентный по объему физиологический раствор. Обращение с лабораторными животными и все процедуры производили согласно существующим нормам и правилам [10].
После истечения 60 дней ежедневного введения тартразина животных выводили из эксперимента методом декапитации под эфирным наркозом. Выделяли плечевые кости, отделяли область их проксимального метафиза и подвергали ее стандартной гистологической обработке [11]. Полученные срезы проксимального метафизарного хряща окрашивали гематоксилин-эозином. Гистологическое и морфометрическое исследование срезов проводили с помощью морфометрического комплекса, в состав которого входили микроскоп Olympus СХ-41, цифровой фотоаппарат Olympus SP 500UZ, персональный компьютер с использованием лицензионной компьютерной программы Morpholog. Полученные ги-стоморфометрические параметры проксимального метафизарного хряща плечевой кости подвергали статистической обработке в программе Statistica 5.11 [12]. Достоверными считали различия при уровне значимости р<0,05.
Результаты. На 3-й день после окончания введения тартразина в дозировке 750 мг/кг общая ширина проксимального метафизарного хряща плечевой кости была меньше значений контрольной группы на 8,59 %; уменьшение происходило за счет равномерного сужения всех его зон: индифферентного, пролиферирующего и дефинитивного хряща на 6,11, 8,85 и 7,15 % соответственно, а зоны деструкции и остеогенеза на 11,55 и 9,92 % соответственно (по сравнению с данными контрольной группы).
При рассмотрении объемных компонентов зоны остеогенеза установлено, что содержание первичной спонгиозы снизилось на 8,45 %, количество клеток на поверхности трабекул - на 8,42 %, а содержание межклеточного вещества в метафизарном хряще по- высилось на 7,85 % по сравнению с показателями контрольной группы.
Гистоморфометрическое исследование проксимального метафизарного хряща плечевой кости в последующие сроки периода реадаптации показало, что его общая ширина оставалась меньше параметров контрольной группы на 10, 15, 24 и 45-й дни эксперимента на 8,55, 6,81, 5,00 и 2,43 %, а ширина зоны пролиферирующего хряща – на 10,21, 8,28, 6,73 и 4,53 %. Ширина зон индифферентного хряща, деструкции и остеогенеза была меньше соответственно на 7,19, 7,58 и 3,35 %; 7,72, 7,50 и 4,94 %; 8,79, 5,17 и 5,32 % на 10, 15 и 25-е сут эксперимента, а зоны дефинитивного хряща – на 7,34 и 5,05 % на 10-е и 15-е сут.
В группе животных, получавших тартразин в дозировке 750 мг/кг, зарегистрировано постепенное восстановление объемных компонентов в метафизарном хряще плечевой кости в ходе периода реадаптации. Объемное содержание первичной спонгиозы в зоне остеогенеза было меньше аналогичных значений контрольной группы на 10, 15 и 24-й дни наблюдения соответственно на 6,54, 7,62 и 4,55 %, а количество клеток на поверхности костных трабекул – на 10,52, 7,62 и 5,83 %.
На 3-й день после окончания введения тартразина в дозировке 1500 мг/кг общая ширина проксимального метафизарного хряща плечевой кости была меньше значений контрольной группы на 11,52 %; уменьшение происходило за счет сужения всех его зон. Также в эти сроки выявлено уменьшение ширины зон индифферентного, пролиферирующего и дефинитивного хряща, деструкции и остеогенеза на 8,68, 12,19, 10,57, 13,62 и
11,91 % соответственно.
Содержание межклеточного вещества в метафизарном хряще плечевой кости возрастало на 9,53 %, а содержание первичной спон-гиозы и количество клеток на поверхности трабекул в зоне остеогенеза снижалось на 9,84 и 9,49 % на 3-и сут после окончания 60-дневного введения тартразина.
У животных 3-й группы общая ширина проксимального метафизарного хряща плечевой кости уменьшалась по сравнению с пара- метрами контрольной группы на 10, 15, 24 и 45-й дни эксперимента на 10,17, 9,16, 6,52 и 2,56 %. В те же сроки ширина зоны пролиферирующего хряща была меньше на 10,39, 11,44, 7,79 и 3,76 %; индифферентного хряща – на 8,21, 8,65 и 3,82 %, дефинитивного хряща – на 9,83, 7,09 и 6,48 %, деструкции – на 9,79, 9,74 и 6,54 %, остеогенеза – на 9,67, 7,11 и 5,32 % на 10, 15 и 24-е сут (рис. 1).
Объемное содержание первичной спонги-озы в зоне остеогенеза на 10, 15 и 24-е сут уменьшилось по сравнению с группой без введения тартразина на 7,79, 8,65 и 5,71 %, количество клеток на поверхности трабекул – на 11,31, 8,10 и 6,42 %; на 10-е и 15-е сут объемное содержание межклеточного вещества в хряще увеличилось на 9,87 и 6,54 %.
Обсуждение. По данным El-Desoky et al. (2017), тартразин в тонкой кишке расщепляется под действием ферментов азоредуктаз кишечных микроорганизмов до ароматических аминов, вызывающих образование таких радикалов, как анион супероксид, перекись водорода, гидроксил радикал, инициирующих развитие оксидативного стресса [13]. Имеются сведения, что оксидативный стресс повышает риск развития остеоартроза из-за развития нестабильности генома, укорочения теломер хромосом, приводящих к старению хондроцитов суставного хряща [14] . Появление морфологических признаков старения в хондроцитах подтверждается повышением активности β-галактозидазы, усилением экспрессии p21 до уровней, сравнимых со стареющими клетками, TRF2, защищающего концы теломер, и SIRT1 и XRCC5, позволяющих клеткам справляться с неблагоприятными условиями роста [15] .
По данным J.M. Lean et al. (2005) и B.M. Savasky et al. (2018), оксидативный стресс активирует дифференцировку предшественников остекластов в зрелые остеокласты и индуцирует апоптоз остеобластов и остео-цитов, стимулируя процессы резорбции кости [16, 17]. Одним из механизмов стимуляции дифференцировки остеокластов является повышение экспрессии RANKL и снижение таковой остеопротегерина. Последний является рецептором для RANK, конкурируя с RANKL
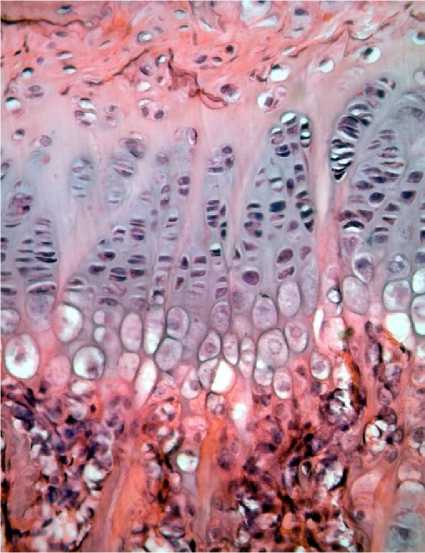
Рис. 1. Участок проксимального метафизарного хряща плечевой кости у животного контрольной группы (слева) и у крысы, получавшей тартразин в дозировке 1500 мг/кг массы тела (справа) (3-и сут эксперимента).
Окраска гематоксилин-эозин. Ув. ×40
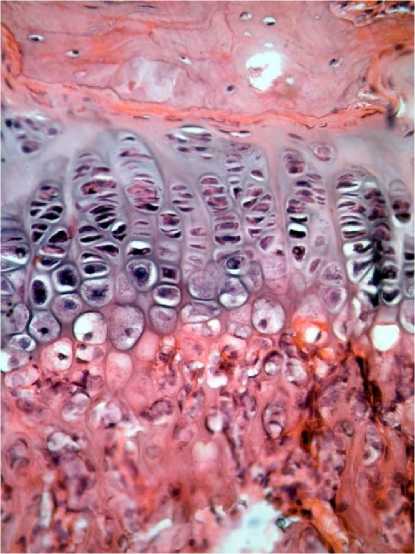
Fig. 1. The section of proximal metaphyseal cartilage of humerus in a rat from the control group (left) and in a rat under tartrazine, 1500 mg/kg body weight (right) (3rd day of the experiment).
Hematoxylin and eosin staining. Magnification ×40
Выводы:
Список литературы Гистологическое строение проксимального метафизарного хряща плечевой кости у крыс после шестидесятидневного введения тартразина
- Самусев Р.П., Зубарева Е.В., Рудаскова Е.С. Возрастная морфология. Часть I: учебное пособие. Волгоград; 2012. 176.
- Burdan F., Szumiio J., Korobowicz A., Farooquee R., Patel S., Patel A., Dave A., Szumiio M., Solecki M., Klepacz R., Dudka J. Morphology and physiology of the epiphyseal growth plate. Folia Histochem. Cytobiol. 2009; 47 (1): 5-16.
- Setiawati R., Rahardjo P. Bone Development and Growth. Osteogenesis and Bone Regeneration. URL: https://www.intechopen.com/books/osteogenesis-and-bone-regeneration/bone-development-and-growth (дата обращения: 11.11.2019). DOI: 10.5772/intechopen.82452
- Ковешников В.Г., Абакаров М.Х., Лузин В.И. Скелетные ткани: хрящевая ткань, костная ткань. Луганск: Издательство Луганского госмедуниверситета; 2000. 154.
- Mirtz T.A., Chandler J.P., Eyers C.M. The Effects of Physical Activity on the Epiphyseal Growth Plates: A Review of the Literature on Normal Physiology and Clinical Implications. Journal of Clinical Medicine Research. 2011; 3 (1): 1-7.
- Inetianbor J.E., Yakubu J.M., Ezeonu S. C. Effects of food additives and preservatives on man - a review. Asian Journal of Science and Technology. 2015; 6 (02): 1118-1135.
- Ventura-Camargo Bruna de Campos, Marin-Morales Maria Aparecida. Azo Dyes: Characterization and Toxicity - A Review. Textiles and Light Industrial Science and Technology (TLIST). 2013; 2 (2): 85-103.
- Западнюк И.П., Западнюк В.И., Захария Е.А., Западнюк Б.В. Лабораторные животные. Разведение, содержание, использование в эксперименте. 3-е изд., перераб. и доп. Киев; 1983. 383 с.
- Рыболовлев Ю.Р., Рыболовлев Р.С. Дозирование веществ для млекопитающих по константе биологической активности. Доклады АН СССР. 1979; 247 (6): 1513-1516.
- European convention for the protection of vertebrate animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. Strasbourg; 1986: 52.
- Саркисов Д.С., Перов Д.С. Микроскопическая техника. Москва: Медицина; 1996. 544.
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М.: Медиа Сфера; 2002. 312.
- El-Desoky G.E., Abdel-Ghaffar A., Al-Othman Z.A., Habila M.A. Curcumin protects against tartrazine-mediated oxidative stress and hepatotoxicity in male rats. European Review for Medical and Pharmacological Sciences. 2017; 21 (3): 635-645.
- Yudoh K., Nguyen T., Nakamura H., Hongo-Masuko K., Kato T., Nishioka K. Potential involvement of oxidative stress in cartilage senescence and development of osteoarthritis: oxidative stress induces chondrocyte telomere instability and downregulation of chondrocyte function. Arthritis Res. Ther. 2005; 7 (2): R380-R391.
- Brandl A., Hartmann A., Bechmann V., Graf B., Nerlich M., Angele P. Oxidative Stress Induces Senescence in Chondrocytes. Journal of Orthopaedic Research. 2011; 29 (7): 1114-1120.
- Savasky B.M., Mascotti D.P., Patel N., Rodriguez-Collazo E. Nutritional and Pharmacological Effects on Oxidative Stress in Soft Tissue and Bone Remodeling. Journal of Nutrition and Metabolism. 2018; Article ID 4183407: 9.
- Lean J.M., Jagger C.J., Kirstein B., Fuller K. Hydrogen peroxide is essential for estrogen deficiency bone loss and osteoclast formation. Endocrinology. 2005; 146 (2): 728-735.
- Fontani F., Marcucci G., Iantomasi T., Brandi M.L. Glutathione, N-acetylcysteine and lipoic acid down-regulate starvation-induced apoptosis, RANKL/OPG ratio and sclerostin in osteocytes: involvement of JNK and ERK1/2 signalling. Calcified Tissue International. 2015; 96 (4): 335-346.
- Kim J.H., Liu X., Wang J. Wnt signaling in bone formation and its therapeutic potential for bone diseases. Therapeutic Advances in Musculoskeletal Disease. 2013; 5 (1): 13-31.


