Гистоморфометрическая оценка большеберцового нерва и мелких мышц стопы после внутреннего невролиза и аутогенной пластики большеберцовой порции седалищного нерва крыс
Автор: Щудло Наталья Анатольевна, Кобызев Андрей Евгеньевич, Варсегова Татьяна Николаевна, Ступина Татьяна Анатольевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.28, 2022 года.
Бесплатный доступ
Введение. Преобразования нервов и мышц дистальных отделов конечностей при повреждениях нервов на уровне проксимальных сегментов критичны для восстановления функций, но недостаточно изучены на экспериментальных биологических моделях. Цель. Гистоморфометрическая оценка большеберцовых нервов и подошвенных межкостных мышц после внутреннего невролиза и аутогенной пластики большеберцовой порции седалищного нерва (СН) крыс. Материалы и методы. Исследование выполнено на 21 крысе Wistar мужского пола, возраст 8-10 месяцев. Серия 1 (внутренний невролиз СН) - n = 6. Серия 2 (аутогенная нейропластика СН) - n = 8. Контроль - 7 интактных крыс. Крысы эвтаназированы через 6 месяцев после операции, проведена световая микроскопия и гистоморфометрия поперечных полутонких срезов большеберцового нерва на уровне средней трети голени и парафиновых срезов подошвенных межкостных мышц стопы. Результаты. В серии 1 в большеберцовом нерве эндоневральные сосуды имели увеличенные диаметры и толщину стенки, но меньший просвет в сравнении с нормой, размерные характеристики популяции миелинизированных волокон увеличены за счёт декомпактизации миелина и отёка аксонов, около 10 % миелинизированных волокон деструктивно изменены. В серии 2 вдвое увеличена численная плотность эндоневральных сосудов большеберцового нерва в сравнении с интактным, численно-размерный состав регенерировавших миелинизированных волокон свидетельствовал об активной, но незавершённой регенерации. Индекс васкуляризации подошвенных межкостных мышц в серии 1 приближен к норме, в серии 2 уменьшен вдвое, медиана диаметров мышечных волокон уменьшена на 12,41 % (р = 0,000) и 20,96 % (р = 0,000) соответственно. Представительство мышечных волокон диаметром более 30 мкм в серии 2 по сравнению с серией 1 увеличено. Заключение. Внутренний невролиз и интерфасцикулярная аутопластика седалищного нерва вызывают разнонаправленные изменения эндоневральных сосудов большеберцового нерва, которые предопределяют разнонаправленный характер и выраженность денервационно-реиннервационных изменений нервов голени и мелких мышц стопы.
Седалищный нерв, внутренний невролиз, аутогенная пластика, большеберцовый нерв, межкостные мышцы стопы, гистоморфометрия
Короткий адрес: https://sciup.org/142236810
IDR: 142236810 | УДК: [617.586:616.833-089.853+616.833-089.844]-092.9 | DOI: 10.18019/1028-4427-2022-28-6-823-829
Текст научной статьи Гистоморфометрическая оценка большеберцового нерва и мелких мышц стопы после внутреннего невролиза и аутогенной пластики большеберцовой порции седалищного нерва крыс
Повреждения нервов конечностей встречаются у 2,8-10 % [1, 2] травматологических больных. Такие пациенты требуют более длительной госпитализации и реабилитации, чем при травмах без повреждений нервов [3], так как денервация мышц и покровных тканей вызывает потерю движений и расстройства чув-
ствительности [4], что значительно снижает качество жизни пациентов.
Степень повреждений нервов варьирует от незначительного сдавления до полного перерыва всех его структур [5], что определяет исходы и тактику лечения. Даже при полных анатомических перерывах периферических нервов нервные волокна могут спонтанно регенерировать через небольшой дефект или рубец [6], однако в большинстве случаев это не приводит к восстановлению функций. Поэтому при отсутствии признаков восстановления частично повреждённого нерва и при полных анатомических перерывах нервов показана хирургическая ревизия и реконструкция пучков нервных волокон с применением внутреннего невролиза и интерфасцикулярной аутопластики [7].
Внутренний невролиз применяется как подготовительный этап интерфасцикулярной аутопластики, а при сохранении непрерывности пучков нервных волокон выступает как самодостаточная операция [8, 9, 10]. Однако данные о влиянии внутреннего невролиза при компрессионной нейропатии на реиннервацию в эксперименте и клинике противоречивы [11-14], что актуализирует прицельное экспериментальное изучение влияния распучковывания интактного нерва на состояние его дистальных ветвей и иннервируемых мышц.
Большинство экспериментальных исследований нейрорегенерации выполнено на седалищном нерве крыс [15]. Их актуальность и клиническая релевантность определяется высокой частотой повреждений седалищного нерва при боевой травме [16], а также при ятрогенных повреждениях [17-20]. Однако в доступной литературе мы не встретили данных о влиянии внутреннего невролиза и интерфасцикулярной аутопластики седалищного нерва экспериментальных животных на состояние нервов голени и мелких мышц стопы. Поскольку медленный регенераторный рост аксонов, задерживая реиннервацию мышц, снижает эффективность восстановления функций [21], состояние дистальных отделов конечности при травмах нервов на уровне проксимальных сегментов особенно критично для восстановления функций.
Цель исследования – гистоморфометрическая оценка большеберцовых нервов и подошвенных межкостных мышц после внутреннего невролиза и аутогенной пластики большеберцовой порции седалищного нерва крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на 21 лабораторной крысе линии Wistar мужского пола в возрасте 8–10 месяцев (масса 360–420 г). Животные содержались в двухэтажных проволочных клетках с гладким днищем и подстилом из древесных стружек в контролируемых гигиенических условиях. Они имели свободный доступ к воде и стандартному корму. Эксперимент выполнен согласно Европейской Конвенцией по защите позвоночных животных, Директиве 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях, и СП 2.2.1.3218-14; ГОСТ 33217-2014; ГОСТ 33215-2014. Дизайн исследования одобрен этическим комитетом учреждения (протокол № 2 (57) от 17.05.18). 14 крыс составили две опытные серии. В опытных сериях перед операцией животным вводили внутримышечно гидрохлорид ксилазин и тиле-тамин/золазепам (0,8 мг и 0,4 мг на 100 г веса крысы соответственно) и состригали шёрстный покров в области правого бедра и голени. В операционной обрабатывали кожу йодно-спиртовой настойкой. В серии 1 («внутренний невролиз») остро-тупым способом через двуглавую мышцу бедра осуществляли внепроекцион-ный доступ к правому седалищному нерву на уровне средней трети бедра. Под операционным микроскопом (OPMI-6, Germany) с помощью острого сосудистого зонда и ножниц для иридэктомии выполняли выделение большеберцовой порции седалищного нерва путём эпифасцикулярной продольной эпиневротомии на протяжении 2 см, после чего рану послойно ушивали. В серии 2 после аналогичного доступа к нерву и его распучковывания резецировали участок большеберцовой порции длиной 6 мм, затем с применением микрохирургической техники (увеличение операционного микроскопа 8-16×, шовный материал калибра 9-0) резецированный участок вшивали in situ. Серию контро- ля составили 7 интактных крыс (возрастной диапазон 16-18 месяцев – соответственно возрасту оперированных крыс на момент эвтаназии – через 6 месяцев после операции).
Большеберцовые нервы иссекали, подвергали аль-дегидно-осмиевой фиксации и заключали в аралдит. Полутонкие срезы (толщина 0,5-1,0 мкм) изготавливали с помощью алмазных ножей на ультрамикротоме «Nova» LKB (Швеция), окрашивали метиленовым синим и основным фуксином. Подошвенные межкостные мышцы в области III плюсневой кости, иннервируемые подошвенным нервом, являющимся ветвью большеберцового нерва, фиксировали в 4 % растворе формалина, декальцинировали в смеси соляной и муравьиной кислот, обезвоживали в этаноле и заливали в парафин. Парафиновые срезы (5-7мкм) изготавливали на микротоме «Reichert» (Aвстрия), окрашивали трехцветным методом по Массону, гематоксилином и эозином. Микроскопию срезов и получение цифровых изображений осуществляли с помощью микроскопа «AxioScope.A1» и цифровой камеры «AxioCam» (Carl Zeiss MicroImaging GmbH, Германия).
В программе «ВидеоТесТ Мастер-Морфология, 4.0» определяли средние диаметры миелиновых волокон (выборка из 400-500 волокон у каждой крысы), их аксонов, коэффициент G (отношение диаметра аксона к диаметру волокна), толщину миелиновой оболочки, долю измененных миелиновых нервных волокон (в %), средние диаметры эндоневральных микрососудов, их просветов, толщину стенки и рассчитывали модифицированный индекс Керногана (отношение диаметра просвета к толщине сосудистой стенки), численные плотности миелиновых волокон и эндоневральных микрососудов в 1 мм2 площади среза. Строили гистограммы распределения миелиновых волокон по диаметрам (шаг – 1 мкм). С помощью программного обеспечения «Zen blue» (Carl
Zeiss MicroImaging GmbH, Германия) в полноцветных изображениях парафиновых поперечных срезов подошвенных межкостных мышц при увеличении ×400 измеряли средний диаметр каждого мышечного волокна (D, мкм), анализировали в среднем 200 волокон от одного случая. Строили гистограммы распределения волокон по диаметрам (шаг – 10 мкм). Определяли численную плотность микрососудов и мышечных волокон, рассчитывали индекс васкуляризации (Iv).
Статистическую обработку данных выполняли в компьютерной программе Attestat, версия 9.3.1 (разработчик И.П. Гайдышев, сертификат о регистрации в Роспатенте № 2002611109). С учётом значимых отличий распределения некоторых выборок от нормального, табличные данные представляли в виде медиан (Me) и квартилей (Q1; Q3). Для проверки статистических гипотез о различиях при попарном сравнении опытных серий между собой и с нормой применяли критерий Хи-квадрат, критерий Манна-Уитни, для выявления отличий функций распределения – критерий Смирнова.
РЕЗУЛЬТАТЫ
Микроскопическое исследование поперечных по-лутонких срезов седалищных и большеберцовых нервов крыс серии 1 (внутренний невролиз) показало, что большинство миелиновых волокон, как и в интактных нервах, имело нормальную структуру, в некоторой части волокон отмечались демиелинизация либо утолщение, расслоение и неравномерная окраска миелина, а в отдельных волокнах – деформация и потемнение аксонов (рис. 1, а, б). В серии 2 (аутонейропластика) в трансплантате большеберцовой порции седалищного нерва, в большеберцовой порции дистальнее трансплантата, а также в большеберцовом нерве на уровне средней трети голени регенерировавшие миелиновые нервные волокна были более мелкими по сравнению с нормой и серией 1, некоторые волокна формировали регенерационные кластеры (рис. 1, в). В серии 2 в эн-доневрии чаще встречались фибробласты, макрофаги и тучные клетки, а также ядросодержащие профили миелиновых и безмиелиновых нервных волокон.
Анализ количественных показателей популяции миелиновых волокон большеберцового нерва (табл. 1) выявил в серии 1 снижение медианы их численной плотности по сравнению с нормой на 11,78 % (р = 0,041). Доля реактивно-деструктивно измененных волокон в серии 1 достоверно превышала норму на 3,19 % (р = 0,003). Медиана диаметров миелиновых волокон в серии 1 увеличена на 28,26 % (р = 0,002), медиана диаметров аксонов – на 9,22 % (р = 0,000), медиана толщины миелиновых оболочек – на 18,63 % (р = 0,000)
В серии 2 отличия от нормы имели противоположную направленность – численная плотность миелиновых проводников превышала норму на 34,36 % (р = 0,001) при достоверном снижении процента измененных волокон относительно нормы на 2,70 % (р = 0,000). Медиана диаметров миелиновых волокон уменьшена в сравнении с нормой на 52,00 % (р = 0,000), медиана диаметров аксонов – на 51,05 % (р = 0,000) и толщины миелиновых оболочек – на 52,94 % (р = 0,000) (табл. 1).
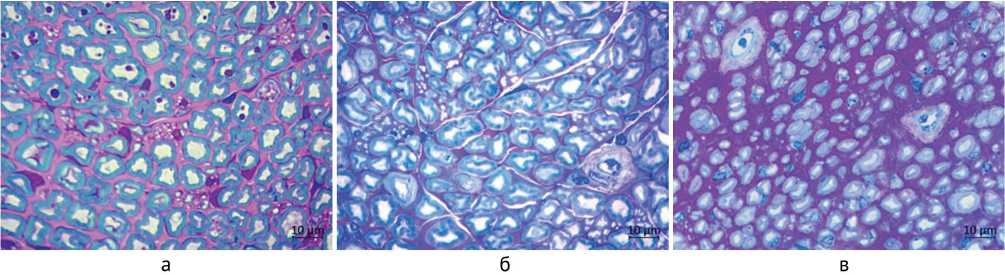
Рис. 1. Фрагменты поперечных эпоксидных полутонких срезов большеберцовых нервов крыс: а – интактный нерв; б – серия 1 (внутренний невролиз); в – серия 2 (аутонейропластика). Окраска метиленовым синим, азуром II и основным фуксином, ×500
Таблица 1
Численные и размерные характеристики миелиновых нервных волокон большеберцового нерва крыс в норме и опытных сериях Me (Q1; Q3)
|
Параметр |
Норма (интактные крысы) n = 7 |
Серия 1 (внутренний невролиз) n = 6 |
Серия 2 (аутонейропластика) n = 8 |
|
Численная плотность миелиновых волокон (в 1 мм2) |
15040 (12859; 15499) рн-1 = 0,041*; pн-2 = 0,001* |
13261 (11825; 14237) р1-2 = 0,000* |
20207 (18140; 22618) |
|
Доля измененных миелиновых волокон (%) |
6,75 (5,70; 8,13) рн-1 = 0,003*; рн-2 = 0,000* |
9,94 (7,82; 10,68) P1-2 = 0,000* |
4,05 (2,38; 5,06) |
|
Диаметр миелиновых волокон (мкм) |
6,73 (5,50; 8,75) рн-1 = 0,002*; рн-2 = 0,000* |
7,35 (5,41; 8,51) р1-2 = 0,000* |
3,50 (2,79; 4,04) |
|
Диаметр аксонов миелиновых волокон (мкм) |
4,34 (3,54; 5,18) рн-1 = 0,000*; рн-2 = 0,000* |
4,74 (3,50; 5,64) р1-2 = 0,000* |
2,42 (1,84; 2,84) |
|
Толщина миелина (мкм) |
1,02 (0,72; 1,30) рн-1 = 0,000*; рн-2 = 0,000* |
1,21 (0,87; 1,53) р1-2 = 0,000* |
0,54 (0,44; 0,62) |
Список литературы Гистоморфометрическая оценка большеберцового нерва и мелких мышц стопы после внутреннего невролиза и аутогенной пластики большеберцовой порции седалищного нерва крыс
- Analysis of upper and lower extremity peripheral nerve injuries in a population of patients with multiple injuries / J. Noble, C.A. Munro, V.S. Prasad, R. Midha // J. Trauma. 1998. Vol. 45, No 1. P. 116-122. DOI: 10.1097/00005373-199807000-00025.
- Traumatic injuries of peripheral nerves: a review with emphasis on surgical indication / R.S. Martins, D. Bastos, M.G. Siqueira, C.O. Heise, M.J. Teixeira // Arq. Neuropsiquiatr. 2013. Vol. 71, No 10. P. 811-814. DOI: 10.1590/0004-282X20130127.
- Nerve injury in severe trauma with upper extremity involvement: evaluation of 49,382 patients from the TraumaRegister DGU(R) between 2002 and 2015 / T. Huckhagel, J. Nüchtern, J. Regelsberger, R. Lefering; TraumaRegister DGU // Scand. J. Trauma Resusc. Emerg. Med. 2018. Vol. 26, No 1. P. 76. DOI: 10.1186/s13049-018-0546-6.
- Neuroprotective activity of thioctic acid in central nervous system lesions consequent to peripheral nerve injury / D. Tomassoni, F. Amenta, L. Di Cesare Mannelli, C. Ghelardini, I.E. Nwankwo, A. Pacini, S.K. Tayebati // Biomed. Res. Int. 2013. Vol. 2013. Р. 985093. DOI: 10.1155/2013/985093.
- Sunderland S. A classification of peripheral nerve injuries producing loss of function // Brain. 1951. Vol. 74, No. 4. Р. 491-516. DOI: 10.1093/ brain/74.4.491.
- Siemionow M., Brzezicki G. Chapter 8: Current techniques and concepts in peripheral nerve repair // Int. Rev. Neurobiol. 2009. Vol. 87. Р. 141-172. DOI: 10.1016/S0074-7742(09)87008-6.
- Biomedical engineering strategies for peripheral nerve repair: surgical applications, state of the art, and future challenges / B.J. Pfister, T. Gordon, J.R. Loverde, A.S. Kochar, S.E. Mackinnon, D.K. Cullen // Crit. Rev. Biomed. Eng. 2011. Vol. 39, No 2. Р. 81-124. DOI: 10.1615/critrevbiomedeng. v39.i2.20.
- Mazal P.R., Millesi H. Neurolysis: is it beneficial or harmful? // Acta Neurochir. Suppl. 2005. Vol. 92. Р. 3-6. DOI: 10.1007/3-211-27458-8_1.
- Microsurgical neurolysis: its anatomical and physiological basis and its classification / H. Millesi, T. Rath, R. Reihsner, G. Zoch // Microsurgery. 1993. Vol. 14, No 7. Р. 430-439. DOI: 10.1002/micr.1920140703.
- Matejcik V. Neurolyzy perifernych nervov dolnych koncatin // Rozhl. Chir. 2004. Vol. 83, No 9. Р. 463-466.
- An assessment of the effects of internal neurolysis on a chronically compressed rat sciatic nerve / S.E. Mackinnon, J.P. O'Brien, A.L. Dellon, A.R. McLean, A.R. Hudson, D.A. Hunter // Plast. Reconstr. Surg. 1988. Vol. 81, No 2. Р. 251-258. DOI: 10.1097/00006534-198802000-00020.
- Shu N. The effect of neurolysis on the recovery of experimentally induced entrapment neuropathy // Nihon Seikeigeka Gakkai Zasshi. 1995. Vol. 69, No 7. Р. 517-527.
- Internal neurolysis or ligament division only in carpal tunnel syndrome - results of a randomized study / H. Holmgren-Larsson, W. Leszniewski, U. Linden, L. Rabow, I. Thorling // Acta Neurochir. (Wien). 1985. Vol. 74, No 3-4. Р. 118-121. DOI: 10.1007/BF01418799.
- Neurolysis for the treatment of sciatic nerve palsy associated with total hip arthroplasty / G.J. Regev, M. Drexler, R. Sever, T. Dwyer, M. Khashan, Z. Lidar, K. Salame, S. Rochkind // Bone Joint J. 2015. Vol. 97-B, No 10. Р. 1345-1349. DOI: 10.1302/0301-620X.97B10.35590.
- Construction and effect evaluation of different sciatic nerve injury models in rats / Q. Siwei, N. Ma, W. Wang, S. Chen, Q. Wu, Y. Li, Z. Yang // Transl. Neurosci. 2022. Vol. 13, No 1. P. 38-51. DOI: 10.1515/tnsci-2022-0214.
- Combat injury of the sciatic nerve - an institutional experience / P.E. Jones, R.M. Meyer, W.J. Faillace, M.E. Landau, J.K. Smith, P.L. McKay, LJ. Nesti // Mil. Med. 2018. Vol. 183, No 9-10. Р. e434-e441. DOI: 10.1093/milmed/usy030.
- Тотальное эндопротезирование у пациентов с последствиями переломов вертлужной впадины (обзор литературы) / А.А. Пронских, К.Н. Харитонов, А.А. Корыткин, С.В. Романова, В.В. Павлов // Гений ортопедии. 2021. Т. 27, № 5. С. 620-627. DOI: 10.18019/1028-44272021-27-5-620-627.
- Укорачивающая подвертельная остеотомия бедренной кости при эндопротезировании тазобедренного сустава у пациентов с врожденным вывихом бедра / Л.С. Шнайдер, О.И. Голенков, Э.У. Тургунов, М.В. Ефименко, М.А. Степанькова, В.В. Павлов // Гений ортопедии. 2020. Т. 26, № 3. С. 340-346. DOI: 10.18019/1028-4427-2020-26-3-340-346.
- Nerve injuries associated with total hip arthroplasty / R. Hasija, J.J. Kelly, N.V. Shah, J.M. Newman, J.J. Chan, J. Robinson, A.V. Maheshwari // J. Clin. Orthop. Trauma. 2018. Vol. 9, No 1. Р. 81-86. DOI: 10.1016/j.jcot.2017.10.011.
- Park C.W., Cho W.C., Son B.C. Iatrogenic injury to the sciatic nerve due to intramuscular injection: a case report // Korean J. Neurotrauma. 2019. Vol. 15, No 1. Р. 61-66. DOI: 10.13004/kjnt.2019.15.e4.
- Application of fetal neural stem cells transplantation in delaying denervated muscle atrophy in rats with peripheral nerve injury / S. Gu, Y. Shen, W. Xu, L. Xu, X. Li, G. Zhou, Y. Gu, J. Xu // Microsurgery. 2010. Vol. 30, No 4. Р. 266-274. DOI: 10.1002/micr.20722.
- Rydevik B., Lundborg G., Nordborg C. Intraneural tissue reactions induced by internal neurolysis. An experimental study on the blood-nerve barrier, connective tissues and nerve fibres of rabbit tibial nerve // Scand. J. Plast. Reconstr. Surg. 1976. Vol. 10, No 1. Р. 3-8. DOI: 10.1080/02844317609169741.
- Myelin sheath decompaction, axon swelling, and functional loss during chronic secondary degeneration in rat optic nerve / S.C. Payne, C.A. Bartlett, A.R. Harvey, S.A. Dunlop, M. Fitzgerald // Invest. Ophthalmol. Vis. Sci. 2012. Vol. 53, No 10. Р. 6093-6101. DOI: 10.1167/iovs.12-10080.
- Intraoperative electrophysiological studies to predict the efficacy of neurolysis after nerve injury-experiment in rats / J.G. Yan, M.P. Eldridge, W.W. Dzwierzynski, Y.H. Yan, S. Jaradeh, L.L. Zhang, J.R. Sanger, H.S. Matloub // Hand (NY). 2008. Vol. 3, No 3. Р. 257-262. doi: 10.1007/ s11552-008-9094-2.
- Goth D. Tierexperimentelle Untersuchungen zur Neurolyse peripherer Nerven // Handchir. Mikrochir. Plast. Chir. 1987. Vol.19, No 4. Р. 212-216.
- Karpati G., Engel W.K. "Type grouping" in skeletal muscles after experimental reinnervation // Neurology. 1968. Vol. 18, No 5. Р. 447-455. DOI: 10.1212/wnl.18.5.447.
- Vascularized nerve grafts: an experimental study / R. Donzelli, C. Capone, F.G. Sgulo, G. Mariniello, F. Maiuri // Neurol. Res. 2016. Vol. 38, No 8. Р. 669-677. DOI: 10.1080/01616412.2016.1198527.
- The role of vascularization in nerve regeneration of nerve graft / T.M. Saffari, M. Bedar, C.A. Hundepool, A.T. Bishop, A.Y. Shin // Neural Regen. Res. 2020. Vol. 15, No 9. Р. 1573-1579. DOI: 10.4103/1673-5374.276327.
- Blood Vessels: The pathway used by Schwann cells to colonize nerve conduits / B.E. Fornasari, F. Zen, G. Nato, M. Fogli, F. Luzzati, G. Ronchi, S. Raimondo, G. Gambarotta // Int. J. Mol. Sci. 2022. Vol. 23, No 4. Р. 2254. DOI: 10.3390/ijms23042254.
- Quantitative assessment of intraneural vascular alterations in peripheral nerve trauma using high-resolution neurosonography: technical note / P. Dömer, U. Janssen-Bienhold, B. Kewitz, T. Kretschmer, C. Heinen // Sci. Rep. 2021. Vol. 11, No 1. Р. 13320. DOI: 10.1038/s41598-021-92643-9.


