Гистоновый код и эпигенетическая регуляция гена PTEN в злокачественных глиомах
Автор: Семенова Е.В., Волницкий А.В., Филатов М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (51), 2012 года.
Бесплатный доступ
Представлен анализ транскрипционной активности PTEN в 7 первичных культурах глиом с помощью 2 эпигенетических мар- керов посттрансляционных модификаций гистона Н3: Н3К9me3 и Н3К4ас. Продемонстрировано наличие маркера подавления транскрипционной активности Н3К9me3 вблизи сайтов инициации транскрипции гена PTEN (1-й экзон) в подавляющем боль- шинстве (6 из 7) исследованных клеточных линий. Маркер активной транскрипции Н3К4ас в области 1-го экзона нами обнаружен только в одной клеточной линии. В области гена PTEN, кодирующей фосфотазный домен (5-й экзон), модификация Н3К9me3 зафиксирована во всех проанализированных линиях глиом. Анализ статуса ацетилирования гистона Н3 в данной области PTEN показал полное отсутствие модификации Н3К4ас. Полученные результаты указывают на подавление транскрипционной активности гена PTEN в абсолютном большинстве (6 из 7) клеточных линий глиом посредством измененного гистонового кода. Кроме того, по всей видимости, они свидетельствуют о значительной универсальности эпигенетических механизмов регуляции экспрессии антионкогена PTEN в глиомах.
Белок-онкосупрессор pten, гистоновый код, глиомы, метод иммунопреципитации хроматина, эпигенетические механизмы
Короткий адрес: https://sciup.org/14056226
IDR: 14056226 | УДК: 616-006.484:575.113
Текст научной статьи Гистоновый код и эпигенетическая регуляция гена PTEN в злокачественных глиомах
Нарушение по той или иной причине нормального функционирования гена PTEN – характерная черта злокачественных глиом [18, 20], соответственно, уровень экспрессии PTEN – важнейший показатель злокачественной трансформации глиом [1, 6, 7, 9, 11, 18]. Соматические мутации PTEN – достаточно частое явление для глиобластом (IV степень злокачественности глиом по классификации ВОЗ) [12, 19, 27]. Кроме того, генетические изменения PTEN обнаружены в незначительной группе (менее 10 %) анапластических астроцитом и анапластических олигодендроглиом (III степень злокачественности глиом по классификации ВОЗ), но они практически отсутствуют в глиомах более низких степеней злокачественности [6, 12, 27]. По всей видимости, появление мутаций PTEN – относительно позднее событие в злокачественной прогрессии глиом. Однако существенное изменение экспрессионного профиля PTEN зафиксировано в значительной части не только глиобластом, но и глиом более низких степеней злокачественности, и этот показатель намного превосходит частоту встречаемости мутаций PTEN [6, 26]. Эти данные указывают на существование альтернативных механизмов инактивации гена PTEN в злокачественных глиомах. По-видимому, таковыми являются эпигенетические нарушения, в том числе промоторное метилирование ДНК и изменение гистонового кода. Действительно, публикации последних лет подтверждают важную роль ДНК-метилирования в регуляции экспрессии PTEN в глиомах [9, 12, 14, 16, 26]. Однако нам не удалось обнаружить в литературе сведений об изучении транскрипционной активности PTEN в глиомах с помощью анализа посттрансляционных модификаций коровых гистонов, так называемого гистонового кода.
Целью исследования является определение эпигенетических изменений гена PTEN в клеточных линиях глиом посредством посттрансляционных модификаций гистона Н3. Используя метод иммунопреципитации хроматина с дальнейшим ПЦР-анализом, мы исследовали трансрипционную активность PTEN в 7 первичных культурах глиом с помощью 2 эпигенетических маркеров: маркера транскрипционной инертности Н3К9me3 и маркера активно транскрибируемого хроматина Н3К4ас.
Материал и методы
Первичные культуры глиом . Исследовали 7 первичных культур глиом человека, полученных в нашей лаборатории из хирургического материала пациентов Российского научно-исследовательского нейрохирургического института им. проф. А.Л. Поленова. Образцы опухолевых тканей были идентифицированы как глиомы III (анапластическая астроцитома) и IV (глиобластома мультиформная) степени по классификации ВОЗ с помощью морфологического и гистологического анализов (две глиомы № 4 и № 7 – III степени, остальные – IV степени злокачественности). Клетки культивировали в среде DMEM и DMEM/F-12 (1:1) с добавлением 10 % сыворотки крови плодов коровы (БиолоТ, Россия), 0,1 % L-глутамина (Invitrogen, Великобритания), 100 ед/мл пенициллина и 0,1 мг/мл стрептомицина и снимали с помощью 0,02 % раствора Версена (БиолоТ, Россия).
Процедура иммунопреципитации хроматина (CHIP). Процедура CHIP (Chromatin Immunoprecipitation Assay) была строго стандартизирована. В каждом эксперименте использовался хроматин, полученный из 3×106 клеток. С целью образования ковалентных сшивок между ДНК и гистонами клетки 10 мин инкубировали с 1 % формальдегидом при комнатной температуре. Реакция останавливалась добавлением 2,5 М глицина (1/20 объема реакционной смеси) с последующей инкубацией на льду в течение 20 мин. Клетки осаждались 5 мин центрифугированием при 4ºС на 1500g, дважды про- мывались в холодном растворе РВС. После этого клетки инкубировались по 10 мин в промывочных растворах 1 (0,25 % Triton X-100, 10 mM EDTA, 10 mM Hepes; pH 7Ю5) и 2 (0,2 M NaCl, 1,5 M EDTA, 10 mM Hepes; pH 7,5) с добавлением ингибиторов протеаз: PMSF и коктейля ингибиторов протеаз (Thermo scientific,США). Затем в течение 20 мин клетки лизировали на льду в 600 μl буфера, содержащего 150 mM NaCl; 25 mM Tris-HCl, pH 7,5; 5 mM EDTA; 1 % Triton X-100; 0,1 % SDS; 0,5 % sodium deoxycholate и ингибиторы протеаз. Лизат «озвучивали» на дезинтеграторе УЗДН-2Т 8×10 сек, после чего центрифугировали при 13000 g в течение 15 мин при 4ºС. Супернатант разводили 1:5 буфером, содержащим 25 mM Tris-HCl, pH 7,5; 1 mM EDTA; 1 % Triton X-100 и ингибиторы протеаз, и делили на 3 равные части. Первая часть использовалась в качестве негативного контроля, ко второй части добавляли анти-Н3К9me3 антитела (Upstate, США), к третьей – анти-Н3К4ас (Upstate, США) и при постоянном вращении инкубировали ночь при 4ºС. Затем иммунокомплексы адсорбировали на протеин А-агарозу в течение 1 ч. После нескольких промывок агарозы иммунокомплексы элюировали буфером, содержащим 1 % SDS и 0,1 M NaHCO3. Затем элюаты инкубировали в течение 6 ч при 65ºС. в присутствии 200 mM NaCl для разрушения сшивок между ДНК и гистонами. После обработки элюатов РНКазой (конечная концентрация 50 мкг/мл) и протеиназой К (Fisher, США) (конечная концентрация 100 мкг/мл) осуществляли экстракцию ДНК смесью фенол-хлороформ с последующим осаждением этанолом по стандартной методике. Выделенную ДНК ресуспендировали в 20 мкл H2O и использовали для ПЦР-анализа. Для каждой линии глиом выполнено по три независимых процедуры CHIP.
ПЦР-анализ . Полимеразную цепную реакцию проводили в 20 мкл смеси, содержащей: 62 мМ Tris-HCl, pH 8,5; 1,5 мM MgCl2; 35 мМ КCl; 0,01 мМ EDTА; 10 мM 2-меркаптоэтанол; 0,15 % Triton X-100; 0,1 мМ DTT; 5 % глицерин; по 250 мМ каждого из четырех dNTP (Медиген, Россия); по 10 пМ каждого праймера (НПО «Синтол», Россия); фиксированный объем выделенной в процессе CHIP ДНК (5 мкл); 1 ед. Taq-полимеразы (НПО «СибЭнзим», Россия). В работе использовались праймеры к 1-му и 5-му экзонам гена PTEN (табл.1).
Таблица 1
Праймеры к 1-му и 5-му экзонам гена PTEN
|
Последовательность праймера |
Температура отжига |
Размер продукта, п.н |
Локализация в геноме |
|
F: 5`-CAAGCGGCGGACGAGCGAGG-3` R: 5`-AGGTCAAGTCTAAGTCGAATC-3` |
57ºС |
210 |
1-й экзон гена PTEN |
|
F: 5`-CTTATTCTGAGGTTATCTTTTTTACC-3` R: 5`-CTCAGAATCCAGGAAGAGGA-3` |
58ºС |
304 |
5-й экзон гена PTEN |
Таблица 2
Результаты исследования транскрипционной активности гена PTEN в первичных культурах глиом с помощью 2 эпигенетических маркеров посттрансляционных модификаций гистона Н3: Н3К9me3 и Н3К4ас
|
Порядковый номер клеточной линии |
Наличие модификации Н3К9me3 в 1-м экзоне PTEN |
Наличие модификации Н3К4ас в 1-м экзоне PTEN |
Наличие модификации Н3К9me3 в 5-м экзоне PTEN |
Наличие модификации Н3К4ас в 5-м экзоне PTEN |
|
1 |
+ |
- |
+ |
- |
|
2 |
- |
+ |
+ |
- |
|
3 |
+ |
- |
+ |
- |
|
4 |
+ |
- |
+ |
- |
|
5 |
+ |
- |
+ |
- |
|
6 |
+ |
- |
+ |
- |
|
7 |
+ |
- |
+ |
- |
Последовательности праймеров для 1-го экзона взяты из литературы [15]. Последовательности праймеров для 5-го экзона собственного дизайна. При конструировании праймеров использовались данные о структуре гена PTEN , полученные из международной базы данных NCBI (США).
ПЦР-продукты разделяли электрофоретически в 6 % акриламидном геле.
Фрагменты ДНК визуализировали с помощью окрашивания азотнокислым серебром AgNO3.
Результаты и обсуждение
Белок PTEN считается специфическим молекулярным маркером патогенеза глиом [1, 6, 18, 24]. В 60–70 % глиобластом утрачена нормальная функция PTEN вследствие генетических и эпигенетических нарушений [10, 27]. Изменение экспрессионного уровня PTEN коррелирует со степенью злокачественности глиом и, как следствие, с продолжительностью жизни пациентов, страдающих опухолями головного мозга данного типа [9, 19, 27].
Наше исследование посвящено определению эпигенетических изменений гена PTEN посредством посттрансляционных модификаций корового гистона Н3 в клеточных линиях глиом. Ацетилирование и метилирование – два наиболее хорошо изученных к настоящему времени типа модификаций коровых гистонов. Ацетилирование связывают с транскрипционно активным эухроматином, деацетилирование способствует образованию транскрипционно инертных гетерохроматиновых структур. Метилирование гистонов может быть связано как с транскрипционной активностью, так и с подавлением таковой, в зависимости от типа гистонов, порядкового номера аминокислотных остатков, по которым происходит метилирование, и количества присоединенных метильных групп [2, 3, 8]. Известно, что модификация Н3К4ас является эпигенетическим маркером активной транскрипции, а модификация Н3К9me3 – маркером транс-крипционно инертного хроматина [2, 3, 13]. Для определения транскрипционной активности антионкогена PTEN в глиомах мы проанализировали 1-й экзон PTEN в 7 первичных культурах глиом с помощью антител к этим двум противоположным по своим функциям модификациям гистона Н3. Для этих целей была применена процедура иммунопреципитации хроматина с последующим ПЦР-анализом выделенных фрагментов ДНК.
Было показано, что в 6 из 7 проанализированных клеточных линиях область вблизи сайтов инициации транскрипции PTEN (1-й экзон) обогащена маркером стабильной генной репрессии Н3К9me3. Уровень ацетилирования гистона Н3 в области 1-го экзона PTEN, определяемый с помощью маркера активной транскрипции Н3К4ас, оказался ниже порога чувствительности используемого метода также в 6 из 7 исследованных клеточных культурах. При этом в области 1-го экзона PTEN модификация транскрипционной активности Н3К4ас обнаружена именно в той клеточной линии (№ 2), в которой отсутствовала модификация Н3К9me3. Данные этого анализа на примере 3 клеточных линий глиом представлены на рис. 1А. Полученные результаты свидетельствуют о подавлении транскрипционной активности PTEN с помощью эпигенетических механизмов в абсолютном большинстве исследованных клеточных линий глиом. Кроме того, нами обнаружено антагонистическое распределение двух противоположных по своим функциям посттрансляционных модификаций гистона Н3 (Н3К9me3 и Н3К4ас) вблизи сайтов инициации транскрипции PTEN. В ряде исследований также указывается на необходимость деацетилирования гистона Н3 для поддержания определенного уровня Н3К9 метилирования в гетерохроматине [17, 25].
Модификации Н3К9me3, Н3К27me1 и Н4К20me1 являются маркерами транскрипционно инертного хроматина [5, 22], однако в ряде работ зафиксировано наличие данных модификаций в кодирующих областях транскрипционно активных генов [4, 21, 23, 25]. То есть позитивно регулирующие промоторную активность модификации коровых гистонов не всегда сохраняют высокую степень обогащения вдоль всей транскрибируемой области, замещаясь модификациями, связанными с генной репрессией. Анализ области гена, кодирующей коровый домен липидной фосфатазной активности белка PTEN (5-й экзон) во всех исследованных нами клеточных линиях глиом, показал наличие маркера транскрипционной инертности Н3К9me3. Ацетилирование гистона Н3 в области 5-го экзона PTEN (модификация Н3К4ас) нами не обнаружено (рис.1Б). То есть, по-видимому, для поддержания определенного уровня Н3К9 метилирования в кодирующей области гена PTEN необходимо удаление модификации Н3К4ас. Обобщенные результаты исследования представлены в табл. 2.
Таким образом, эпигенетический маркер стабильной генной репрессии Н3К9me3 зафиксирован нами вблизи промоторной области гена PTEN (1-й
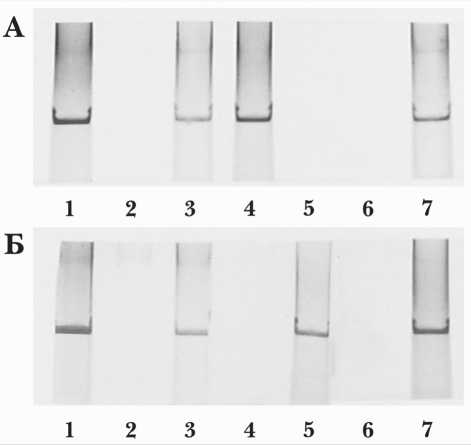
Рис. 1. Анализ транскрипционной активности гена PTEN в 3 первичных культурах глиом с помощью посттрансляционных модификаций гистона Н3: маркера активной транскрипции Н3К4ас и маркера генной репрессии Н3К9me3. Примечание: А – Результаты, полученные для области 1-го экзона гена PTEN в глиомах № 1
(дорожки 2, 3), № 2 (дорожки 4, 5) и № 3 (дорожки 6, 7); Б – Результаты, полученные для области 5-го экзона гена PTEN в глиомах № 1 (дорожки 2, 3), № 2 (дорожки 4, 5) и № 3 (дорожки 6, 7).
Дорожка 1 – результат амплификации геномной ДНК (контроль); дорожки 2, 4, 6 – результат амплификации ДНК, полученной в результате процедуры иммунопреципитации хроматина с анти-Н3К4ас антителами; дорожки 3, 5, 6 – результат амплификации
ДНК, полученной в результате процедуры иммунопреципитации хроматина с анти-Н3К9me3 антителами экзон) в абсолютном большинстве проанализированных клеточных линий, и в области гена, кодирующей фосфатазный домен белка PTEN (5-й экзон), во всех без исключения проанализированных клеточных линиях, что, по всей видимости, свидетельствует о значительной универсальности эпигенетических механизмов регуляции экспрессии антионкогена PTEN в глиомах. Полученные данные об измененном «гистоновом коде» гена PTEN в 6 из 7 исследованных клеточных линиях глиом (подавление транскрипционной активности посредством эпигенетического механизма регуляции экспрессии) подтверждают важность инактивации этого антионкогена для процессов злокачественной трансформации глиом.


