Гистопатологические параллели в нативных створках аортальных клапанов и биопротезах митральных клапанов при инфекционном эндокардите и приобретенных пороках развития
Автор: Синицкая А.В., Костюнин А.Е., Асанов М.А., Хуторная М.В., Поддубняк А.О., Понасенко А.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Обоснование. Возрастает потребность в пристальном изучении гистопатологических событий и механизмов, сопровождающих инфекционный процесс в нативных клапанах сердца и их биологических протезах (БП) в связи с изменчивостью клинической картины инфекционного эндокардита (ИЭ).Цель исследования: изучение клеточной инфильтрации пораженных инфекцией аортальных клапанов (АК) и БП, а также поиск общих физиологических особенностей или различий нативных и протезных клапанов, имеющих дегенеративные изменения в створчатом аппарате.Материал и методы. Исследованы створки нативных АК, удаленных по причине ИЭ (n = 10) или кальцинирующего аортального стеноза (КАС) (n = 11), а также створки БП, удаленные из митральной позиции при репротезировании из-за ИЭ (n = 5) или структурной дегенерации (СД) (n = 10). Гистологические срезы подготавливали на микротомкриостате. Методом иммуногистохимического анализа проводили типирование клеток путем окрашивания антителами к маркерам CD45, CD68 CD3, CD19, MPO, CD31. Путем окрашивания гистологических срезов по Граму осуществляли визуализацию бактерий. Экспрессию миелопероксидазы (MPO) в исследуемых образцах определяли методом вестерн-блоттинга.Результаты. Ткани нативных АК с ИЭ характеризуются колониями грамположительных кокков, а также скоплениями грамотрицательных палочковидных бактерий. В БП с признаками СД встречались смешанные колонии, состоящие из грамположительных кокков и грамотрицательных палочек. Иммунофенотипирование продемонстрировало инфильтрацию клеток лейкоцитарного ряда (CD45+) во всех изученных клапанах. В створках АК и БП с инфекционным поражением, а также БП с признаками СД воспалительные инфильтраты состояли из макрофагов (CD68+) и нейтрофилов (MPO+), а также единичных T-лимфоцитов (CD3+). В кальцинированных АК нейтрофилы отсутствовали, а скопления иммунных клеток представлены макрофагами и единичными Т-лимфоцитами. В обоих группах АК в фиброзном слое отмечены единичные CD31+ (маркер эндотелия сосудов) клетки. Наибольшая экспрессия MPO наблюдалась в створках АК с ИЭ по сравнению с другими исследуемыми створками.Заключение. Для АК, пораженных инфекцией, характерна агрессивная инфильтрация нейтрофилами по сравнению с нативными клапанами с КАС. В створках БП также выявлены нейтрофилы и бактериальные агенты вне зависимости от диагностированного ИЭ. Эти наблюдения указывают на вовлеченность бактериальной инвазии в развитие СД биологического элемента БП и свидетельствуют о необходимости подробного изучения этого явления.
Клапаны сердца, биологические протезы клапанов сердца, инфекционный эндокардит, кальцинирующий аортальный стеноз, структурная дегенерация клапанов, иммуногистохимия, вестерн-блоттинг
Короткий адрес: https://sciup.org/149145647
IDR: 149145647 | УДК: 616.126-002-022:616.126.42-77:616.126.52 | DOI: 10.29001/2073-8552-2024-39-2-166-174
Текст научной статьи Гистопатологические параллели в нативных створках аортальных клапанов и биопротезах митральных клапанов при инфекционном эндокардите и приобретенных пороках развития
исследование выполнено на средства гранта Российского научного фонда № 23-7510020 «Молекулярно-генетические основы патогенеза инфекционного эндокардита нативных клапанов сердца и их биопротезов»,
Приобретенные пороки клапанов сердца являются одной из важных причин снижения трудоспособности, качества и продолжительности жизни [1]. Как правило, за их возникновением стоит воспаление в тканях пораженных клапанов, имеющее как септическую (при инфекционном эндокардите (ИЭ)), так и асептическую (при развитии дегенеративных пороков, например, кальцинирующего аортального стеноза (КАС)) природу [2, 3]. Воспалительные механизмы формирования пороков нативных клапанов сердца находят параллели с механизмами, ответственными за развитие дисфункций их биологических протезов (БП). Так, проведенные нами исследования показали, что и для кальцинированных аортальных клапанов (АК), и для БП с признаками структурной дегенерации (СД) характерна инфильтрация тканей створчатого аппарата различными типами лейкоцитов (прежде всего макрофагами и производными от них пенистыми клетками). При этом в отличие от кальцинированных АК для дегенерировавших БП свойственны агрессивная инвазия нейтрофилов и присутствие бактериальных агентов [4], что сближает гистопатологическую картину СД с инфекционным поражением нативных клапанов [5, 6].
ИЭ – типичное инфекционное заболевание, связанное с гематогенной диссеминацией бактерий в ткани клапана сердца [7]. Оно характеризуется нарушением структуры пораженных клапанов и образованием вегетаций, чаще всего требуя радикальной хирургической коррекции в связи с неэффективностью принимаемых антибиотиков [3]. Показано, что ИЭ может развиваться как в нативных здоровых клапанах сердца, так и у пациентов с ранее диагностируемыми пороками сердца, а также в равной степени на биологических и механических протезах клапанов и кардиостимуляторах [8]. ИЭ считается достаточно редким явлением – его распространенность по разным оценкам варьирует от 3 до 15 случаев на 100 000 человек в год, однако высокая летальность обусловливает внимание к этому заболеванию со стороны медицинского сообщества [3, 9]. Необходимо отметить, что в связи с затруднительностью диагностики встречаемость ИЭ может быть недооценена, что особенно актуально для БП [9].
Протезный ИЭ отмечают примерно у 5% пациентов в течение 10 лет после имплантации биологических или механических заменителей клапанов сердца [9]. При этом результаты, полученные нами ранее, указывают на значительную распространенность (до 90% исследованных образцов) бактериальной контаминации БП с классическими признаками СД, но не ИЭ [4]. Это является неожиданным открытием, поскольку большинство исследователей рассматривают СД, в частности инфильтрацию БП лейкоцитами, как асептический процесс, обусловленный остаточной иммуногенностью ксенобиоматериала [10].
Клиническая картина ИЭ изменчива и зависит от природы возбудителя и типа клапана, что крайне усложняет диагностику этого заболевания. Таким образом, возрастает потребность в пристальном изучении гистопатологических событий и механизмов, сопровождающих инфек- ционный процесс в нативных клапанах сердца и их БП. Настоящее исследование направлено на изучение клеточной инфильтрации пораженных инфекцией АК и БП, а также на поиск общих физиологических особенностей или различий нативных и протезных клапанов, имеющих дегенеративные изменения в створчатом аппарате.
Материал и методы
Исследуемые аортальные клапаны сердца и клапанные биопротезы
Материалом для настоящей работы послужили АК, которые были иссечены по причине ИЭ ( n = 10) или КАС ( n = 11). Также в исследование включены БП, удаленные из митральной позиции при репротезировании из-за ИЭ ( n = 5) или СД ( n = 10). Средний возраст пациентов с инфекционными и дегенеративными поражениями АК был равен 40 и 65 лет, с аналогичными изменениями в БП – 65 и 69 лет соответственно. Средние сроки функционирования БП с ИЭ составили 63 мес., клапанов со СД – 156 мес. Диагноз ИЭ, КАС или СД был поставлен на основе клинических данных, результатов эхокардиографии, а также микробиологического исследования образцов крови. По данным эхокардиографии, у всех пациентов, включенных в исследование, визуализировались подвижные вегетации на клапанах. Кроме того, диагноз верифицировали по международным модифицированным критериям Duke [11]. Позднее он был подтвержден макро- и микроскопически при изучении иссеченных АК и БП. Исследование проводили в соответствии с принципами Надлежащей клинической практики и Хельсинкской декларации Всемирной медицинской ассоциации, оно было одобрено локальным этическим комитетом НИИ КПССЗ (протокол № 1 от 26.01.2024 г.). Все пациенты подписали письменное информированное согласие на участие в исследовании.
Иссеченные клапаны помещали в стерильный 0,9% раствор натрия хлорида и доставляли в лабораторию для дальнейшего изучения. Для выполнения микроскопического анализа и вестерн-блота вырезали фрагменты створок с вегетациями или признаками дегенеративных изменений (участками фиброза, кальцификации или повреждения биологической ткани). Образцы, отобранные для изучения гистологическим и иммуногистохимическим методами, фиксировали в среде для быстрого замораживания тканей Neg-50 (6502, Thermo Fisher Scientific, США), подготавливая затем серийные криосрезы толщиной 7 мкм с использованием микротом-криостата HM525 (Thermo Fisher Scientific). Готовые срезы последовательно располагали на предметные стекла.
Детекция бактерий и типирование клеток в исследуемых клапанах
Присутствие бактериальных агентов в клапанах выявляли посредством окрашивания гистологических срезов по Граму, для чего использовали коммерческий набор реактивов (ab150672, Abcam, Великобритания) в соответствии с протоколом производителя.
Типирование клеточных элементов в исследуемых образцах выполняли посредством иммуногистохимической реакции с доокрашиванием гематоксилином, использованием коммерческого набора Novolink Polymer Detection Systems (RE7150-CE, Leica Biosystems, Германия) и первичных антител к основным маркерам иммунных клеток: пан-лейкоцитарному маркеру CD45 (ab10558, Abcam, в разведениях 1 : 4000), маркерам макрофагов CD68 (ab227458, Abcam, 1 : 1000), Т-лимфоцитов CD3 (ab16669, Abcam, 1 : 1000), B-лимфоцитов CD19 (MA5-32544, Invitrogen, 1 : 1000) и миелопероксидазе нейтрофилов (MPO) (ab208670, Abcam, 1 : 4000). Помимо этого, срезы тканей обрабатывали антителом к маркеру эндотелия сосудов CD31 (ab9498, Abcam, 1 : 500) для оценки интенсивности неоваскуляризации.
Перед окрашиванием срезы тканей 10 мин фиксировали в 4% параформальдегиде при комнатной температуре, далее их трижды (по 5 мин) отмывали в фосфатно-солевом буфере на шейкере Polymax 1040 (Heidolph) при 50 об/мин. Дальнейшее окрашивание выполняли в соответствии с протоколом производителя вышеуказанного набора Novolink Polymer DS. Первичные антитела разводили в 1% солевом растворе бычьего сывороточного альбумина, оптимальные разведения подбирали путем серийных окрашиваний. Инкубацию образцов в растворе первичных антител производили в течение ночи в закрытом коробе при температуре +4 °C. Окрашенные срезы заключали под покровное стекло посредством монтирующей среды Витрогель (HM-VI-A250, БиоВитрум, Россия).
Анализ окрашенных срезов осуществляли на световом микроскопе AxioImager.A1 (Zeiss, Германия), обработку изображений проводили в программе AxioVision (Zeiss).
Иммуноблоттинг
Часть фрагментов створчатого аппарата исследуемых клапанов сердца использовали для оценки интенсивности нейтрофильной инфильтрации методом иммуноблоттинга. Перед выполнением вестерн-блоттинга производили выделение белка из исследуемых образцов тканей. Для этого их гомогенизировали в специальных пробирках (116913050-CF, MP Biomedicals, США) и охлажденном растворе T-PER (78510, Thermo Fisher Scientific, США) с добавлением смеси ингибиторов протеаз и фосфотаз Halt™ (78444, Thermo Fisher Scientific, США) в соотношении 1 : 100, используя гомогенизатор FastPrep-24 5G (MP Biomedicals). Далее на протяжении 10 мин образцы центрифугировали при 14000 g на микроцентрифуге 20R (Beckman Coulter, США). Полученный надосадок в течение получаса центрифугировали на ультрацентрифуге Optima MAX-XP (Beckman Coulter, США) при 200 000 g. Измерение концентрации белка проводили с использованием коммерческого набора BCA Protein Assay Kit (23227, Thermo Fisher Scientific, США) на спектрофотометре Multiskan Sky (Thermo Fisher Scientific, США) в соответствии с протоколом производителя.
С целью определения экспрессии белковых молекул одинаковое количество белка (15 мкг) смешивали с буфером на основе додецилсульфата лития NuPAGE (NP0007, Invitrogen, США) и восстановителем NuPAGE (NP0009, Invitrogen, США) в соотношении 4 : 1 и 10 : 1 соответственно. Далее полученную смесь денатурировали при температуре 99 °C в течение 5 мин с последующей загрузкой в гель NuPAGE 4–12% Bis-Tris толщиной 1,5 мм (NP0335BOX, Invitrogen). В качестве маркера молекулярных масс использовали смесь (1 : 1) белковых стандартов Novex Sharp Pre-Stained (LC5800, Invitrogen, США) и MagicMark XP Western Protein Standard (LC5602, Invitrogen, США). Разделение белков осуществляли путем электрофореза в полиакриломидном геле с додецилсульфатом натрия (SDS-PAGE) в течение 2 ч при напряжении 150 В. Перенос белка выполняли с использованием мембран из поливинилидендифторида (IB24001, Invitrogen, США) на приборе для сухого переноса iBlot 2 (Invitrogen) согласно протоколу производителя. Затем мембраны инкубировали в растворе iBind Flex (SLF2020, Invitrogen, США) для предотвращения неспецифического связывания. Для детекции MPO и глицераль-дегид-3-фосфатдегидрогеназы (GAPDH, контроль загрузки) применяли соответствующие первичные антитела (MAA601Hu22, Cloud-Clone Corp., Китай, в разведении 1 : 250) и (SLM33033M, Sunlong Biotech, Китай, в разведении 1 : 500), а также вторичные противомышиные козьи антитела, конъюгированные с пероксидазой хрена (AP130P, Sigma-Aldrich, США, в разведении 1 : 1000).
Инкубацию с антителами проводили с помощью набора реагентов iBind Flex Solution Kit (SLF2020, Invitrogen, США), карточек iBind Flex Cards (SLF2010, Invitrogen, США) и прибора Bind Flex Western Device (SLF2000, Invitrogen) в соответствии с протоколами производителя. Хемилюминесцентную детекцию осуществляли с использованием субстрата SuperSignal West Pico PLUS 945 (34580, Thermo Fisher Scientific, США) и цифрового сканера блотов C-DiGit (LI-COR Biosciences, США) в высокочувствительном режиме (12-минутное сканирование).
Статистическая обработка данных
Статистическую обработку полученных результатов осуществляли с использованием программы GraphPad Prism 8 (GraphPad Software, США). Денситометрию результатов вестерн-блота проводили в программе ImageJ (National Institutes of Health, США). Нормальность распределения оценивали при помощи критерия Колмогорова – Смирнова. В группах наблюдали распределение, отличное от нормального (р < 0,01). Сравнительный анализ между группами осуществляли с помощью критерия Кра-скела – Уоллиса с поправкой FDR (False Discovery Rate) на множественные сравнения.
Результаты
Макроскопический анализ иссеченных клапанов
Макроскопический анализ иссеченных клапанов сердца, доставленных в лабораторию, продемонстрировал, что АК с КАС имели типичные для этого заболевания признаки: в основании и куполе створок располагались крупные кальциевые депозиты, тогда как свободные от кальция участки характеризовались значительным фиброзным утолщением. АК с ИЭ также имели утолщенные створки с признаками внутристворочных кровоизлияний.
Наиболее выраженное утолщение створок наблюдали у свободного края, там же отмечены единичные вегетации. Кальцификатов в этой группе образцов не выявлено. Обе группы БП (дегенеративные и с ИЭ) имели классические признаки СД, заключающиеся в наличии кальциевых депозитов в основании и куполе створок, а также разрывов в коммиссуральной зоне. Только у БП, эксплантированных по причине ИЭ, отмечены единичные вегетации на поверхности створок.
Детекция бактерий в нативных тканях клапанов сердца и биологических протезах
Окрашивание срезов створок по Граму выявило присутствие бактериальных агентов во всех АК и БП с ИЭ, а также в створках 9 из 10 БП, удаленных по причине развития СД. В тканях 8 (80%) АК отмечены плотные колонии грамположительных кокков, тогда как в 2 (20%) образцах присутствовали рассеянные скопления грамо-трицательных палочковидных бактерий. В БП с признаками СД встречались как смешанные колонии, состоящие из грамположительных кокков и грамотрицательных палочек (в 4 образцах; 40%), так и моноколонии первых (2; 20%) или вторых (3; 30%). Наконец, в одном БП с ИЭ отмечено присутствие грамотрицательных бацилл, в 2 БП обнаружены только грамположительные кокки, еще в 2 БП – смешанные колонии тех и других. В тканях, кальцинированных АК, микроорганизмы не выявлены (рис. 1).
Бактериальные агенты в АК располагались в поверхностных слоях тканей створок у свободного края и в куполе, преимущественно в фиброзном слое клапана и в составе вегетаций. Только в 2 исследованных АК скопле- ния микроорганизмов отмечены в толще внеклеточного матрикса у свободного края створок. В БП микроорганизмы локализовались главным образом в микротромбах, сформированных на поверхности створчатого аппарата, наиболее крупные их колонии располагались в куполе створок со стороны оттока. Также бактериальные колонии отмечены в составе вегетаций у БП с ИЭ.
Иммуногистохимический анализ
Иммунофенотипирование продемонстрировало инфильтрацию клеточными элементами лейкоцитарного ряда (CD45+) во всех изученных клапанах. В створках АК и БП с инфекционным поражением, а также БП с признаками СД воспалительные инфильтраты состояли из макрофагов (CD68+) и нейтрофилов (MPO+), а также единичных T-лимфоцитов (CD3+). В кальцинированных АК нейтрофилы отсутствовали, а скопления иммунных клеток были представлены макрофагами и единичными Т-лимфоцитами (рис. 2). В-лимфоциты (CD19+) отсутствовали во всех исследованных образцах (данные не показаны).
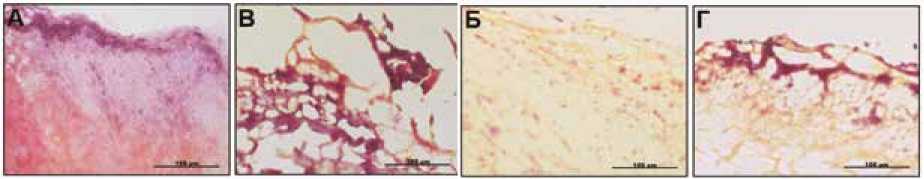
Рис. 1. Примеры бактериальной контаминации створок исследуемых клапанов: А – аортальные клапаны с диагностированным инфекционным эндокардитом, Б – кальцинированные аортальные клапаны без признаков инфекции, В – биопротезы клапанов сердца с диагностированным ин- фекционным эндокардитом, Г – биопротезы клапанов сердца, удаленные по причине структурной дегенерации. Обратите внимание на присутствие колоний микроорганизмов (отмечены стрелками) во всех группах за исключением аортальных клапанов, иссеченных ввиду кальцинирующего аортального стеноза. В группах биопротезов бактериальная инвазия связана с микротромбами (розовое окрашивание) на поверхности коллагеновой основы створок (желтое окрашивание). Окрашивание по Граму
Fig. 1. Bacterial contamination in the leaflets of the studied heart valves: A – aortic valves affected by infective endocarditis, Б – calcified aortic valves without signs of infection, B – bioprosthetic heart valves affected by infective endocarditis, Г – bioprosthetic heart valves removed due to structural degeneration.
Note the colonies of microorganisms (marked by arrows) in all groups, with the exception of the aortic valves removed due to calcific aortic stenosis. In bioprostheses, bacterial invasion is associated with microthrombi (pink coloring) on the surface of the collagen base of the valves (yellow coloring). Gram staining
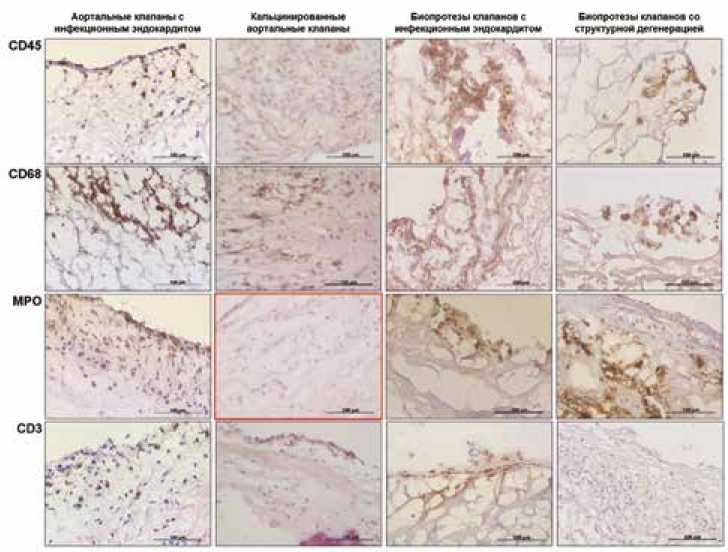
Рис. 2. Результаты типирования иммунных клеток в створках исследуемых клапанов: CD45 – пан-лей-коцитарный маркер, CD68 – маркер макрофагов, MPO – маркер нейтрофилов, CD3 – маркер Т-лимфоцитов. Обратите внимание на отсутствие положительного окрашивания к маркеру нейтрофилов (MPO) в аортальных клапанах, удаленных по причине кальцинирующего аортального стеноза (выделено красной рамкой) Fig. 2. Typing of immune cells in the leaflets of the studied heart valves: CD45 – pan-leukocyte marker, CD68 – macrophage marker, MPO – neutrophil marker, CD3 – T-lymphocyte marker. Note the lack of positive staining for neutrophil marker (MPO) in aortic valves removed due to calcific aortic stenosis (highlighted in red)
Характер локализации клеточных инфильтратов несколько различался между исследуемыми группами. В АК с ИЭ иммунные клетки отмечены преимущественно у свободного края створок в со-локализации с колониями бактерий. В кальцинированных АК крупные макрофагальные инфильтраты находились в фиброзном слое клапана в основании и куполе створок, преимущественно вблизи кальцификатов. Наконец, в БП скопления иммунных клеток располагались в разрыхленных предповерхностных слоях биоматериала, главным образом на стороне оттока, а также вблизи крупных кальцификатов и по краям перфораций. Наиболее крупные клеточные инфильтраты выявлены в основании створок.
Следует отметить, что в обоих группах АК в фиброзном слое отмечены единичные CD31+ (маркер эндотелия сосудов) клеточными элементами. Также ткани трех АК с ИЭ (30%) характеризовались плотными скоплениями CD31+ клеток в толще внеклеточного матрикса и очагами интенсивной неоваскуляризации (рис. 3). Эндотелиальные клетки в БП не обнаружены.
Полуколичественный анализ экспрессии нейтрофильной миелопероксидазы в исследуемых клапанах
Для оценки интенсивности инфильтрации исследуемых клапанов нейтрофилами мы выполнили анализ содержания в образцах MPO методом вестерн-блот-тинга. Результаты демонстрируют, что наибольшая экспрессия MPO наблюдается в створках АК с ИЭ (рис. 4).
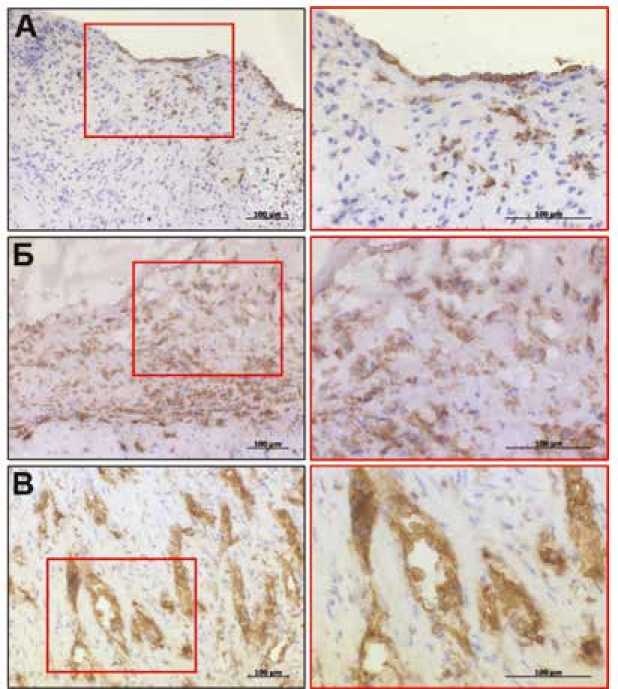
Рис. 3. Результаты иммуногистохимического окрашивания створок аортальных клапанов антителом к маркеру эндотелия сосудов (CD31): А – признаки эндотелиально-мезенхимального перехода в створках кальцинированного аортального клапана, Б – скопления CD31-положительных клеток в толще внеклеточного матрикса пораженного инфекцией аортального клапана, В – пример интенсивной неоваскуляризации в створках пораженного инфекцией аортального клапана. Изображения справа демонстрируют увеличение участков интереса на изображениях слева
Fig. 3. Immunohistochemical staining of the aortic valve leaflets with an antibody to the vascular endothelial marker (CD31): A – signs of endothelial-to-mesenchymal transition in the leaflets of the calcified aortic valve, Б – accumulations of CD31-positive cells in the thickness of the extracellular matrix of the aortic valve affected by infection, B – intense neovascularization in the leaflets of the infected aortic valve. The images on the right are an enlargement of the areas of interest in the images on the left. The images on the right show an enlargement of the areas of interest in the images on the left
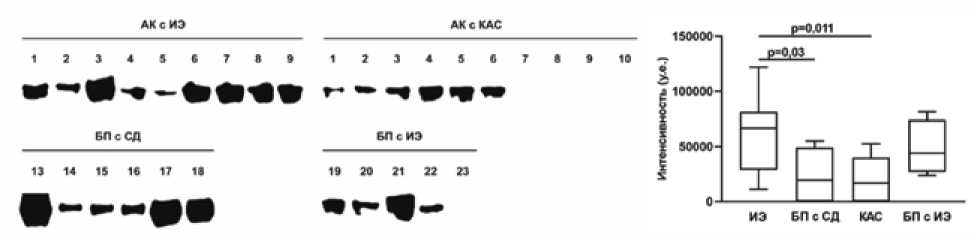
Рис . 4. Определение экспрессии МPO методом вестерн-блота. Слева представлены сканы блотов, справа – полуколичественный анализ интенсивности полос блоттинга
Fig. 4. MPO expression evaluated by Western blot. Scans of the blots are presented on the left, semi-quantitative analysis of the intensity of the blot bands is presented on the right
В этой группе значения достоверно отличаются от таковых, полученных для кальцинированных АК ( p = 0,011) и БП с признаками СД ( p = 0,03). Вместе с тем не было выявлено достоверных различий в уровнях экспрессии MPO между тканями пораженных инфекцией АК и БП ( p = 0,59). Кроме того, показано, что БП и АК, удаленные по причине СД и КАС соответственно, не отличались по этому показателю между собой ( p = 0,81), также каждая из этих групп не отличалась от БП с ИЭ ( p = 0,13 для АК с КАС и p = 0,09 для БП с признаками СД).
Обсуждение
ИЭ является тяжелым воспалительным заболеванием эндокарда инфекционного генеза, которое приводит к нарушению структуры и функционирования как нативных, так и протезных клапанов сердца. Несмотря на значительные успехи в диагностике и лечении ИЭ, летальность от данного заболевания остается на высоком уровне [8]. Выявлено, что в 80% случаев возбудителями ИЭ являются грамположительные стафилококки и стрептококки, а также слабовирулентные бактерии группы HACEK, в более редких случаях – грамотрицательные бактерии и грибки [12]. Прикрепляясь к поверхности клапана сердца, бактериальные колонии могут образовывать так называемые вегетации, которые зачастую ассоциированы с развитием эмболических осложнений [13]. Активация иммунного ответа в ответ на патогены индуцирует хемо-аттрактацию иммунных клеток, провоцируя интенсивную воспалительную реакцию и неоангиогенез [14].
Результаты настоящего исследования показывают значительные морфологические и гистопатологические различия между АК, пораженными ИЭ, и таковыми, удаленными по причине КАС. Для образцов из первой группы была характерна инфильтрация нейтрофилами. Кроме того, в 30% из них отмечены выраженные очаги неоваскуляризации. В свою очередь в кальцинированных АК не выявлено признаков ангиогенеза, а присутствие нейтрофилов отмечено лишь косвенно по экспрессии MPO только в половине (55%) образцов. Очевидно, указанные различия обусловлены разными триггерами воспалительной реакции между АК, пораженными ИЭ и КАС. В частности, окрашивание по Граму подтвердило наличие микроорганизмов в клапанах с ИЭ, но продемонстрировало их отсутствие при КАС.
Вышеприведенные данные хорошо согласуются с результатами, представленными другими авторами. Так, нейтрофилы являются преобладающим типом иммунных клеток в створках клапанов с ИЭ, но не КАС [15]. Они являются самыми многочисленными лейкоцитами крови и первыми иммунными клетками, прибывающими в очаг воспаления и распознающими патогены через толл-по-добные рецепторы и NOD-подобные рецепторы, производя большое количество активных форм кислорода для их уничтожения [16, 17]. Более того, считается, что нейтрофилы отчасти ответственны за формирование вегетаций на поверхности створок благодаря высвобождению нейтрофильных внеклеточных ловушек. Последние становятся каркасом для осаждения тромбоцитов и колоний микроорганизмов [6, 7]. Хотя нейтрофилы присутствуют в тканях клапанов с дегенеративными пороками, такими как КАС, они относительно немногочисленны и, вероятно, играют меньшую роль в воспалительном процессе по сравнению с макрофагами и пенистыми клетками [18, 19]. Роль нейтрофилов в патогенезе КАС неизвестна, однако результаты недавних исследований указывают на присутствие бактериального компонента и в кальцинированных АК, что может объяснить их нейтрофильную инфильтрацию как минимум в части случаев [20]. Впрочем, распространенность бактериальной контаминации АК остается неизученной, поэтому говорить о связи этого явления с развитием КАС преждевременно.
Любопытным фактом, установленным нами в ранних работах [4] и подтвержденным в ходе настоящего исследования, стало обнаружение нейтрофилов и бактериальных агентов в БП с классическими признаками СД, но без клинических или морфологических проявлений ИЭ. Согласно результатам иммуноблоттинга, интенсивность нейтрофильной инфильтрации БП с бессимптомной контаминацией бактериями и АК без бактериальной контаминации статистически не отличалась от таковой для БП с диагностированным ИЭ. Эти данные могут указывать на слабо выраженную латентную инфекцию как в БП с признаками СД, так и АК с КАС. Требуются дополнительные исследования на больших выборках с применением полногеномного секвенирования, чтобы установить, имеет ли место бактериальный компонент в патогенезе СД и КАС.
Заключение
В противоположность АК с КАС, для пораженных инфекцией АК характерна агрессивная инфильтрация нейтрофилами. В створках БП также выявлены нейтрофилы и бактериальные агенты вне зависимости от диагностированного ИЭ (в том числе в клапанах с классическими признаками СД при отсутствии типичных клинических и морфологических проявлений инфекционного поражения). Эти наблюдения указывают на вовлеченность бактериальной инвазии в развитие СД биологического элемента БП и свидетельствуют о необходимости подробного изучения этого явления. Потенциально улучшение методов антибактериальной обработки БП может как уменьшить риск развития ИЭ, так и замедлить темпы СД.
Ограничения исследования
Проведенное исследование имеет некоторые ограничения. Так, нами не изучена жизнеспособность микроорганизмов, детектируемых в клапанах гистологическим методом. Таким образом, последние могут быть представлены бактериальным дебрисом, что объясняет отсутствие характерных для эндокардита клинических и морфологических проявлений в АК и БП с КАС и СД соответственно. Кроме того, следующим этапом данного исследования станет проведение секвенирования 16S, которое позволит в полной мере оценить таксономический состав бактерий в исследуемых образцах. Тем не менее, указанные недостатки не влияют на основные выводы настоящей работы.
Список литературы Гистопатологические параллели в нативных створках аортальных клапанов и биопротезах митральных клапанов при инфекционном эндокардите и приобретенных пороках развития
- Coffey S., Roberts-Thomson R., Brown A., Carapetis J., Chen M., Enriquez-Sarano M. et al. Global epidemiology of valvular heart disease. Nat. Rev. Cardiol. 2021;18(12):853-864. https://doi.org/10.1038/s41569-021-00570-z.
- Lindman B.R., Clavel M.A., Mathieu P., Iung B., Lancellotti P., Otto C.M. et al. Calcific aortic stenosis. Nat. Rev. Dis. Primers. 2016;2:16006. https://doi.org/10.1038/nrdp.2016.6.
- Cahill T.J., Baddour L.M., Habib G., Hoen B., Salaun E., Pettersson G.B. et al. Challenges in infective endocarditis. J. Am. Coll. Cardiol. 2017;69:325-344. https://doi.org/10.1016/j.jacc.2016.10.066.
- Kostyunin A.E., Glushkova T.V., Lobov A.A., Ovcharenko E.A., Zainullina B.R., Bogdanov L.A. et al. Proteolytic degradation is a major contributor to bioprosthetic heart valve failure. J. Am. Heart Assoc. 2023;12(1):e028215. https://doi.org/10.1161/JAHA.122.028215.
- Castelli J.B., Almeida G., Siciliano R.F. Sudden death in infective endocarditis. Autops. Case Rep. 2016;6(3):17-22. https://doi.org/10.4322/acr.2016.045.
- Goldins N.R., Meidrops K., Apine L., Petrosina E., Stradins P., Groma V. Neutrophilic leukocytes and neutrophil extracellular traps in native aortic valve endocarditis. Proceedings of the Latvian Academy of Sciences (Section B). 2023;77(1):41-48. https://doi.org/10.2478/prolas-2023-0005.
- Jung C.J., Yeh C.Y., Hsu R.B., Lee C.M., Shun C.T., Chia J.S. Endocarditis pathogen promotes vegetation formation by inducing intravascular neutrophil extracellular traps through activated platelets. Circulation. 2015;131(6):571-581. https://doi.org/10.1161/CIRCULATIONAHA.114.011432.
- Habib G., Lancellotti P., Erba P.A., Sadeghpour A., Meshaal M., Sambola A., et al. The ESC-EORP EURO-ENDO (European Infective Endocarditis) registry. Eur. Heart J. Qual. Care Clin. Outcomes. 2019;5(3):202-207. https://doi.org/10.1093/ehjqcco/qcz018.
- Tarkin J.M., Chen W., Dweck M.R., Dilsizian V. Molecular imaging of valvular diseases and cardiac device infection. Circ. Cardiovasc. Imaging. 2023;16(1):e014652. https://doi.org/10.1161/CIRCIMAGING.122.014652.
- Senage T., Paul A., Le Tourneau T., Fellah-Hebia I., Vadori M., Bashir S. et al. The role of antibody responses against glycans in bioprosthetic heart valve calcification and deterioration. Nat. Med. 2022;28(2):283- 294. https://doi.org/10.1038/s41591-022-01682-w.
- Fowler V.G. Jr., Durack D.T., Selton-Suty C., Athan E., Bayer A.S., Chamis A.L. et al. The 2023 Duke-International Society for Cardiovascular Infectious Diseases criteria for infective endocarditis: updating the modified Duke criteria. Clin. Infect. Dis. 2023;77(4):518-526. https://doi.org/10.1093/cid/ciad271.
- Liesenborghs L., Meyers S., Vanassche T., Verhamme P. Coagulation: At the heart of infective endocarditis. J. Thromb. Haemost. 2020;18(5):995- 1008. https://doi.org/10.1111/jth.14736.
- Meidrops K., Groma V., Goldins N.R., Apine L., Skuja S., Svirskis S. et al. Understanding Bartonella-associated infective endocarditis: examining heart valve and vegetation appearance and the role of neutrophilic leukocytes. Cells. 2023;13(1):43. https://doi.org/10.3390/cells13010043.
- Meyers S., Lox M., Kraisin S., Liesenborghs L., Martens C.P., Frederix L. et al. Neutrophils protect against Staphylococcus aureus endocarditis progression independent of extracellular trap release. Arterioscler. Thromb. Vasc. Biol. 2023;43(2):267-285. https://doi.org/10.1161/ATVBAHA.122.317800.
- Liu Y., Jiang P., An L., Zhu M., Li J., Wang Y. et al. The role of neutrophil elastase in aortic valve calcification. J. Transl. Med. 2022;20(1);167. https://doi.org/10.1186/s12967-022-03363-1.
- Stark K., Massberg S. Interplay between inflammation and thrombosis in cardiovascular pathology. Nat. Rev. Cardiol. 2021;18:666-682. https://doi.org/10.1038/s41569-021-00552-1.
- Wang L., Luqmani R., Udalova I.A. The role of neutrophils in rheumatic disease-associated vascular inflammation. Nat. Rev. Rheumatol. 2022;18(3):158-170. https://doi.org/10.1038/s41584-021-00738-4.
- Broeders W., Bekkering S., El Messaoudi S., Joosten L.A.B., van Royen N., Riksen N.P. Innate immune cells in the pathophysiology of calcific aortic valve disease: lessons to be learned from atherosclerotic cardiovascular disease? Basic Res. Cardiol. 2022;117(1):28. https://doi.org/10.1007/s00395-022-00935-6.
- Bartoli-Leonard F., Zimmer J., Aikawa E. Innate and adaptive immunity: the understudied driving force of heart valve disease. Cardiovasc. Res. 2023;117(13):2506-2524. https://doi.org/10.1093/cvr/cvab273.
- Oberbach A., Friedrich M., Lehmann S., Schlichting N., Kullnick Y., Gräber S. et al. Bacterial infiltration in structural heart valve disease. J. Thorac. Cardiovasc. Surg. 2020; 159(1):116-124.e4. https://doi.org/10.1016/j. jtcvs.2019.02.019.


