Глазодвигательные нарушения у больных и преманифестных носителей гена болезни гентингтона
Автор: Светозарский С.Н., Копишинская С.В., Сметанкин И.Г.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 4 т.14, 2018 года.
Бесплатный доступ
Цель: установить особенности глазодвигательных нарушений у больных и преманифестных носителей гена болезни Гентингтона (БГ) по сравнению с группой контроля. Материал и методы. В исследовании участвовали 23 пациента на манифестной стадии БГ, 21 преманифестный носитель гена БГ и 31 здоровый доброволец. Выполняли оценку характера зрения с помощью теста Уорса, исследование прямой и содружественной реакции зрачка на свет, конвергенцию и аккомодацию, оценку положения головы, подвижности, положения и отклонения глазных яблок. Проводили также исследование медленных следящих движений глаз и саккад, исследование конвергенции. Критерием клинической недостаточности конвергенции считали расстояние до ближайшей точки конвергенции более 5 см. Пациенты из целевых групп прошли исследование ДНК на наличие мутации в гене гентингтина, обследование по двигательной шкале UHDRS (Unified Huntington's Disease Rating Scale - Унифицированная шкала оценки БГ) и определение длительности течения заболевания. Результаты. Исследование показало наличие нарушений медленных следящих движений глаз, инициации, скорости и объема саккад более чем у половины манифестных пациентов. У преманифестных носителей БГ выявлена высокая частота (33%) нарушений вертикальных следящих движений. Клиническая недостаточность конвергенции обнаруживалась у больных БГ и носителей значительно чаще, чем в группе контроля (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Болезнь гентингтона, глазодвигательные нарушения, конвергенция, нейроофтальмология, саккады
Короткий адрес: https://sciup.org/149135227
IDR: 149135227 | УДК: 617.7-07-06:616.851.7-02-07
Текст научной статьи Глазодвигательные нарушения у больных и преманифестных носителей гена болезни гентингтона
-
1 Вв едение. Движения глаз обеспечивают поиск и стабилизацию изображений объектов внешнего мира на области центральной ямки сетчатки (фовеа), несмотря на передвижения объекта или изменение положения головы человека. Контроль движений глаз осуществляется сложной системой, включающей структуры ствола мозга, мозжечок, базальные ганглии и кору больших полушарий [1]. Результатом работы системы является согласованная активация ядер глазодвигательных нервов: глазодвигательного, блокового и отводящего. Глазодвигательные нарушения несут информацию о локализации повреждений, причем при подробном рассмотрении не только о дисфункции ядер глазодвигательных нервов, но и о структурах, отвечающих за контроль и координацию движений глаз.
Существует несколько вариантов классификации движений глаз. Среди произвольных движений глаз выделяют верзионные, вергентные и дукционные. Среди непроизвольных движений выделяют дрейф, тремор и саккады [2]. По амплитуде выделяют микродвижения (тремор, дрейф, микросаккады) и макродвижения (саккады, плавные следящие движения, вергентные движения, нистагм) глаз. По функции разделяют движения, стабилизирующие изображение движущегося объекта (оптокинетический рефлекс), и стабилизирующие изображение при движениях тела (вестибулоокулярный рефлекс). В 2016 г. Khazali et
al. выделили новый тип движений глаз, представляющий физиологическую моторную синергию, — корректирующие движения, ассоциированные с морганием (blink-associated resetting eye movement) [3].
Болезнь Гентинтона (БГ) — неуклонно прогрессирующее нейродегенеративное заболевание, вызванное мутацией в гене гентингтина в виде увеличения количества ЦАГ-повторов (цитозин-аденин-гуанин) [4, 5]. Заболевание характеризуется аутосомно-доминантным механизмом наследования, полной пенетрантностью, прогрессирующими двигательными, когнитивными и психическими нарушениями. БГ обычно манифестирует в зрелом возрасте и приводит к инвалидизации и уменьшению продолжительности жизни [4]. Болезнь распространена повсеместно, распространенность оценивается порядка 4,6–13,7 на 100 тыс. населения [6–9]. Выделяют последовательно развивающиеся преманифестную (асимптомную) стадию и манифестную (клиническую) стадию [4, 5].
Глазодвигательные симптомы представляются одними из наиболее ранних проявлений нейродеге-неративных заболеваний, в частности болезни Пар-киносона и БГ [10–13]. При БГ поражаются фиксация взора и вестибулоокулярный рефлекс, на манифестной стадии страдают медленные следящие движения глаз [14–16]. Вестибулоокулярный рефлекс, обеспечивающий фиксацию взора и стабильное изображение на сетчатке при движениях головы, опосредован путями от вестибулярных ядер к ядру отводящего нерва, а также к ядрам глазодвигательного и блокового
Таблица 1
Типы движений глаз и их нарушения при БГ
|
Тип движений глаз |
Функции |
Нарушения при БГ |
|
Фиксации |
Удержание изображения неподвижного объекта на области фовеа за счет уменьшения дрифта и подавления саккад |
Прерывание неподавляемыми саккадами |
|
Следящие движения |
Медленные конъюгатные движения глаз, которые сопровождают перемещение объекта в поле зрения, удерживая его изображение на области фовеа |
Снижение скорости, прерывание неподавляемыми саккадами |
|
Саккады |
Быстрые конъюгатные движения глаз, которые перемещают изображение интересующего объекта на область фовеа |
Нарушение инициации, замедление, ограничение амплитуды |
|
Вергенции |
Дисконъюгатные движения глаз, направленные друг к другу (конвергенция) или друг от друга (дивергенция), обеспечивают одновременное расположение изображения объекта в области фовеа обоих глаз |
Слабость / отсутствие конвергенции |
|
Вестибулоокулярный рефлекс |
Конъюгатные движения глаз, удерживающие изображение в области фовеа при движении головы, состоят из медленной и быстрой фазы |
Снижение скорости медленной фазы |
|
Оптокинетический рефлекс |
Конъюгатные движения глаз фиксируют взор на движущихся в одну сторону предметах, состоят из медленной и быстрой фазы |
Снижение скорости медленной или быстрой фазы, исчезновение оптокинетического нистагма |
Таблица 2
Демографическая характеристика исследуемых групп
Таким образом, глазодвигательные функции на манифестной стадии БГ изучены достаточно подробно, за исключением конвергенции. Недостаточно исследована также проблема клинической оцен- ки глазодвигательных функций у преманифестных носителей. В контексте исследования офтальмологических проявлений БГ интерес представляют дальнейшее изучение глазодвигательных функций у преманифестных носителей гена БГ, количественная и качественная оценка конвергенции, а также поиск связей между генетическими и клинико-демографическими параметрами и результатами стандартизированной оценки глазодвигательных функций по шкале UHDRS.
Цель: установить особенности глазодвигательных нарушений у больных и преманифестных носителей гена болезни Гентингтона по сравнению с группой контроля.
Материал и методы. В исследование были включены 78 испытуемых в возрасте от 20 до 59 лет, разделенных на три группы: 1-я целевая группа из 23 пациентов на манифестной стадии БГ; 2-я целевая группа из 21 преманифестного носителя гена БГ; группа контроля, состоявшая из 31 здорового добровольца (табл. 2).
Критерием включения пациентов в целевые группы было молекулярно-генетическое подтверждение носительства патологической экспансии в гене ген-тингтина. В 1-ю целевую группу включали пациентов с установленным диагнозом манифестной стадии БГ. Критерием преманифестной стадии считали отсутствие характерной неврологической симптоматики, балл по двигательной шкале UHDRS не более 5. Критерий включения в группу контроля: отсутствие значимой офтальмологической и неврологической патологии, известных наследственных заболеваний, нейродегенеративных заболеваний у родителей по данным наследственного анамнеза.
Критерии исключения. Офтальмологические критерии: наилучшая корригированная острота зрения ниже 0.8, аметропия и астигматизм средней и высокой степени, внутриглазное давление более 22 мм рт.ст. или разница между глазами более 2 мм рт.ст., любое значимое помутнение оптических сред на момент обследования, наличие в анамнезе или по данным обследования заболеваний, в первую очередь глаукомы, последствий травм и оперативных вмешательств (в том числе лазерных) на органе зрения, могущих повлиять на результаты исследования. Неврологические и общесоматические критерии исключения: для группы контроля — балл по шкале оценки когнитивных функций Mini-Mental State Examination (MMSE) менее 26; для всех пациентов — наличие в анамнезе черепно-мозговой травмы, нарушений мозгового кровообращения, сахарного диабета, гипертонической болезни, ишемической болезни сердца и других системных заболеваний с поражением органа зрения. Пациенты с очаговой патологией головного мозга по данным компьютерной томографии или магнитно-резонансной томографии головного мозга исключались из исследования.
Стандартное офтальмологическое обследование включало авторефрактометрию, визометрию, исследование цветового зрения с помощью псевдоизохро-матических таблиц (таблицы Е. Б. Рабкина), тонометрию, биомикроскопию, биомикроофтальмоскопию в условиях мидриаза, статическую автоматизированную периметрию.
Оценку характера зрения проводили с помощью четырехточечного теста Уорса. Характер зрения определяли как бинокулярный, одновременный или монокулярный. Оценивали прямую и содружественную реакцию зрачка на свет, а также реакцию на конвергенцию и аккомодацию. Проводилась оценка положения головы, выполнялись исследование подвижности, положения и отклонения глазных яблок, исследование медленных следящих движений глаз и саккад. Отмечалось наличие вынужденного наклона или поворота головы. Исследование подвижности проводилось монокулярно в 9 диагностических позициях взора. Положение и отклонение глазных яблок оценивались бинокулярно по Гиршбергу.
Клиническое исследование конвергенции проводилось бинокулярно в соответствии с рекомендациями Scheiman M. et al. (2003) [26]. Исследование выполняли в условиях искусственного освещения, используя линейку и аккомодационный тест-объект. В качестве тест-объекта выступала шариковая ручка с наклеенной на нее меткой в виде буквы размера 12 пт. Медленно приближая ручку к носу пациента (1–2 см/с), определяли ближайшую точку конвергенции (в см). Ближайшей точкой конвергенции считали расстояние от переносицы до тест-объекта, на котором у пациента возникало двоение или объективно определялось отклонение глазного яблока. Исследование повторяли трижды, фиксировали среднее значение. Критерием клинической недостаточности конвергенции, согласно имеющимся нормативным значениям для взрослых, считали расстояние до ближайшей точки конвергенции более 5 см [26–27].
Исследование медленных следящих движений глаз и саккад проводилось в соответствии с двигательной шкалой UHDRS в условиях одинаковой стабильной освещенности (искусственный свет) в одно и то же время суток (12–13 часов).
Для оценки следящих движений глаз пациенту в условиях бинокулярности предлагалось следить за небольшим движущимся объектом, плавно перемещаемым на расстоянии около 80 см от испытуемого в диапазоне 20–30 градусов со скоростью не более 10 градусов в секунду, что соответствует перемещению объекта на расстояние около 40 см за 3 секунды. Названный диапазон обусловлен тем, что меньшая амплитуда не позволяет оценить объем движений, а большая может вызвать установочный нистагм. Наблюдения повторялись трижды в вертикальном и трижды в горизонтальном направлении. При проверке вертикальных движений при взгляде вниз врач удерживал приподнятыми верхние веки пациента. Вертикальные и горизонтальные движения оценивались отдельно по следующей шкале: 0 = полные плавные (нормальные); 1 = толчкообразные движения; 2 = прерывистые движения в полном объёме; 3 = ограничение движений; 4 = движения отсутствуют.
Дополнительно отмечалось возникновение диплопии.
Для оценки инициации саккад пациенту в условиях бинокулярности предлагалось переводить взгляд в сторону звукового сигнала — щелчка пальцев, который подавался на том же расстоянии и с той же амплитудой, что для исследования следящих движений. Оценивались инициация, объем или точность и скорость саккад. У здорового человека саккады характеризуются быстрым и точным переводом взора на объект. Наблюдения повторялись трижды в вертикальном и трижды в горизонтальном направлении с темпом около 1 Гц. Инициация саккад в вертикальном и горизонтальном направлении оценивалась отдельно по следующей шкале: 0 = нормальная; 1 = увеличение только латентности; 2 = начинается подавляемое моргание или подавляемые движения головой; 3 = неподавляемые движения головой; 4 = невозможно инициировать саккады.
Скорость и объем саккад в вертикальном и горизонтальном направлении оценивались отдельно по следующей шкале: 0 = нормальная скорость, полный объем; 1 = легкое замедление; 2 = умеренное замедление; 3 = значительное замедление, полный объем; 4 = неполный объем (гипометрия).
При выполнении статистического анализа результатов исследования глазодвигательных функций проводили анализ по каждому элементу обследования, принимая балл, равный 0, за отсутствие нарушений, а наличие 1–4 баллов за наличие нарушений [28].
Пациенты из целевых групп прошли исследование ДНК на наличие мутации в гене гентингтина (HTT) в виде патологической экспансии ЦАГ-повторов в гене гентингтина с оценкой количества ЦАГ-повторов в данном гене (Центр молекулярной генетики, Москва, Россия). Субъектам с подтвержденной мутацией проводилось обследование по двигательной шкале UHDRS и определение длительности течения заболевания. Шкала UHDRS включает 4 раздела, посвященных оценке двигательных, когнитивных, поведенческих и функциональных нарушений при БГ. Балл по двигательной шкале UHDRS может колебаться от 0 до 128, максимальное значение соответствует наибольшему неврологическому дефициту. Длительность заболевания считали с момента клинической манифестации — появления характерных двигательных симптомов.
Статистический анализ проводился с помощью пакета прикладных программ SPSS 22.0. Непрерывные переменные представлены как M±SD, где M — среднее арифметическое, SD — стандартное отклонение. Нормальность распределения оценивали с помощью графиков квантилей (Q-Q plots, QuantileQuantile plots) и критерия Шапиро — Уилка. Для
Таблица 3
Характеристика конвергенции пациентов в исследуемых группах
|
Параметр |
Носители (n=21) |
БГ (n=23) |
Группа контроля (n=31) |
p1 (ANOVA) |
p2 |
|
Ближайшая точка конвергенции, см, M±SD |
5,3±1,7 |
8,8±3,7 |
3,2±1,4 |
<0,001 |
<0,001* <0,001** <0,001*** |
П р и м еч а н и е : * — носители vs контроль, ** — БГ vs контроль, *** — носители vs БГ.
Таблица 4
Нарушения глазодвигательных функций в исследуемых группах
|
Исследуемые группы Нарушения глазодвигательных функций |
Носители (n=21) |
БГ (n=23) |
Группа контроля (n=31) |
|
Клиническая недостаточность конвергенции, % (абс.) |
38 (8) * |
91 (21) ** |
3 (1) |
|
Нарушение вертикальных следящих движений, % (абс.) |
33 (7) * |
65 (15) ** |
3 (1) |
|
Нарушение горизонтальных следящих движений, % (абс.) |
14 (3) |
56 (13) ** |
0 (0) |
|
Нарушение инициации вертикальных саккад, % (абс.) |
10 (2) |
87 (20) ** |
3 (1) |
|
Нарушение инициации горизонтальных саккад, % (абс.) |
5 (1) |
83 (19) ** |
0 (0) |
|
Нарушение скорости и объема вертикальных саккад, % (абс.) |
5 (1) |
70 (16) ** |
0 (0) |
|
Нарушение скорости и объема горизонтальных саккад, % (абс.) |
0 (0) |
61 (14) ** |
0 (0) |
П р и м еч а н и е : * — уровень значимости p<0,05 для точного критерия Фишера; ** — уровень значимости p<0,05 для критерия Хи-квадрат.
проверки значимости различий в трех исследуемых группах применяли однофакторный дисперсионный анализ (ANOVA). При выявлении значимых различий с помощью ANOVA выполняли попарные апостериорные сравнения с поправкой Бонферрони для множественных сравнений. Категориальные бинарные переменные представляли в виде четырехпольных таблиц. Если ожидаемое число в любой из клеток четырехпольной таблицы было больше или равно 5, данные сравнивали с помощью критерия хи-квадрат Пирсона, в противном случае использовали точный критерий Фишера. Если ожидаемое число в любой из клеток было меньше 10, применяли поправку Йейтса для критерия хи-квадрат Пирсона. Связи между параметрами исследовали с помощью коэффициента корреляции Пирсона (r). Принятый уровень значимости p<0,05.
Результаты. Количество ЦАГ-повторов в гене гентингтина у носителей и манифестных пациентов варьировалось от 37 до 56 (44,3±3,8). Балл по двигательной шкале UHDRS у манифестных пациентов составил 36,3±29,7, длительность заболевания 13,7±7,2 года.
У всех обследуемых субъектов определялся бинокулярный характер зрения. Оценка прямой и содружественной реакции зрачка на свет, а также реакции на конвергенцию и аккомодацию показала сохранность зрачковых реакций у всех обследуемых. Вынужденный наклон или поворот головы, явное косоглазие и ограничения подвижности глазных яблок отсутствовали.
При исследовании конвергенции в группе контроля ближайшая точка конвергенции находилась на расстоянии 1–6 см от переносицы, у преманифест-ных носителей — на расстоянии 2–8 см, у манифестных пациентов — 5–19 см (табл. 3). Статистически значимая разница обнаружена между расстоянием до ближайшей точки конвергенции в группах носителей и больных БГ по сравнению с контролем, а также при сравнении преманифестных носителей и пациентов на манифестной стадии БГ (см. табл. 3). Клиническая недостаточность конвергенции (ближайшая точка конвергенции >5 см, по Scheiman) обнаруживалась у больных БГ и носителей значительно чаще, чем в группе контроля (р<0,001) (табл. 4). У 8 из 23 манифестных пациентов (35%) конвергентные движения глаз прерывались неконтролируемыми саккадами.
Исследование показало наличие нарушений медленных следящих движений глаз, инициации, скорости и объема саккад более чем у половины больных БГ и отсутствие нарушений в группе контроля. Значимые различия при сравнении носителей и контроля обнаружены лишь в отношении вертикальных следящих движений, в то время как в отношении больных на манифестной стадии обнаружены нарушения всех исследуемых параметров (см. табл. 4).
Выявлена положительная корреляция между расстоянием до ближайшей точки конвергенции и клинико-генетическими показателями: баллом по двигательной шкале UHDRS (r=0,648, p<0,001, рисунок) и количеством ЦАГ-повторов (r=0,389, p=0,012).
Обсуждение. В то время как классическое описание глазодвигательных проявлений манифестной БГ известно с 1970-х гг., их характеристика у према-нифестных носителей стала предметом изучения в последние годы. В настоящей работе выявлена высокая частота (33%) нарушений вертикальных следящих движений у преманифестных носителей БГ. Кроме того, впервые представлена характеристика конвергенции на разных стадиях БГ. Высокая встречаемость клинической недостаточности конвергенции обнаружена как на манифестной, так и на пре-манифеснтой стадии БГ.
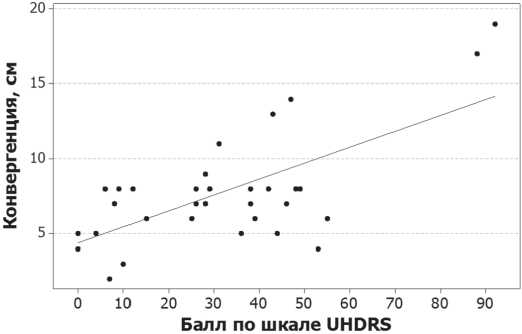
График рассеяния демонстрирует корреляцию между баллом по двигательной шкале UHDRS и ближайшей точкой конвергенции
В рутинной клинической практике офтальмологи исследуют глазодвигательные функции в объеме, позволяющем установить ограничения подвижности, наличие и вид скрытого или явного косоглазия и нарушения конвергенции. Исследование показало, что больные манифестной БГ и носители гена БГ не имеют ограничений движения глазных яблок, явного косоглазия, нарушений зрачковых реакций и отличались сохранностью бинокулярного зрения. В то же время подтверждено снижение способности к конвергенции и нарушение следящих движений и саккад на манифестной стадии заболевания, описанное раннее [10–20].
Количественное исследование конвергенции с оценкой частоты клинической недостаточности конвергенции проведена впервые. Установлено, что подавляющее большинство пациентов с БГ (91 %) и значительная доля преманифестных носителей (38%) имеют недостаточность конвергенции. В работе Leigh R. et al. (1983) нарушение конвергенции неконтролируемыми саккадами у пациентов с манифестной БГ отмечались в 30% случаев [29], что согласуется с полученными нами данными (35%). Установленная корреляция между баллом по двигательной шкале UHDRS и ближайшей точкой конвергенции указывает на синхронность развития различных двигательных нарушений.
Результаты исследования глазодвигательных функций по шкале UHDRS оказались близки к результатам, представленным в аналогичных исследованиях [10, 16–21]. Интерес представляют результаты сравнения преманифестных носителей и контроля, показавшие наличие значимых различий лишь в отношении вертикальных следящих движений. Близкий дизайн исследования, отличающийся менее чувствительным к ошибкам первого рода статистическим методом (отношение шансов), представлен в исследовании Winder JY et al. (2018) [28]. Наиболее часто в группе из 70 преманифестных пациентов также обнаруживались нарушения вертикальных следящих движений.
Недостаточность конвергенции вкупе с прерывистостью медленных следящих движений и трудностями при инициации саккад может вызывать у пациента трудности при рассматривании объектов на близком и дальнем расстоянии, создавать проблемы при чтении. Учитывая выявленные нарушения, актуальной задачей предстоящих исследований является оценка влияния недостаточности конвергенции на качество жизни и возможность коррекции нарушений конвергенции.
Синдром глазодвигательных нарушений является наиболее ярким клиническим синдромом, характеризующим изменения в офтальмологическом статусе пациентов [30]. Не находя в отечественной литературе термина, обобщающего такие симптомы, как снижение скорости и несоразмерность саккад, нарушение инициации саккад и характера следящих движений, объединенные общим механизмом развития, мы считаем возможным предложить для обсуждения описательный термин: «синдром гиперкинетических глазодвигательных нарушений». По международной классификации болезней 10-го пересмотра данный синдром может кодироваться как «Другие уточненные нарушения содружественного движения глаз», код H51.8. Потребность в подобном термине объясняется необходимостью отразить в диагнозе выявленную у пациента совокупность глазодвигательных нарушений, имеющую высокую диагностическую ценность для установления или уточнения неврологического диагноза. Необходимо отметить, что данный синдром может быть диагностирован как офтальмологом, так и неврологом, и не является патогномоничным для БГ, но может развиваться при ряде экстрапирамидных расстройств.
Выводы:
-
1. При обследовании пациента с подозрением или установленным диагнозом нейродегенеративно-го заболевания в дополнение к исследованию подвижности и положения глазных яблок целесообразно оценивать инициацию и скорость саккад и следящих движений согласно описанной ранее стандартизированной методике.
-
2. Клиническая недостаточность конвергенции выявляется не только при манифестной БГ, но и у преманифестных носителей. Представляется целесообразным включить исследование конвергенции, не входящее в стандарт оценки глазодвигательных функций по шкале UHDRS, в алгоритм обследования при БГ.
-
3. Отмечена положительная корреляция между расстоянием до ближайшей точки конвергенции и клинико-генетическими показателями: баллом по двигательной шкале UHDRS и количеством ЦАГ-повторов.
-
4. Нарушения скорости и инициации саккад и следящих движений в вертикальном и горизонтальном направлении характеризует манифестную БГ. У пре-манифестных носителей определяется только нарушение вертикальных следящих движений.
-
5. Для обозначения комплекса симптомов, представленного снижением скорости и несоразмерностью саккад, нарушением инициации саккад и характера следящих движений, объединенных общим механизмом развития, предлагается описательный термин: «синдром гиперкинетических глазодвигательных нарушений».
Список литературы Глазодвигательные нарушения у больных и преманифестных носителей гена болезни гентингтона
- Клюшников С. А., Азиатская ГА. Глазодвигательные расстройства в практике невролога. Нервные болезни 2015; (4): 41-7
- Шамшинова A. M., Волков В. В. Функциональные методы исследования в офтальмологии. М.: Медицина, 1999; 416 с.
- Khazali М, Pomper J, Smilgin A, etal. A new motor synergy that serves the needs of oculomotor and eye lid systems while keeping the downtime of vision minimal. eLife 2016; (5): e16290
- McColgan P, Tabrizi S. Huntington's disease: a clinical review. Eur J Neurol 2018; 25 (1): 24-34
- Иллариошкин С. H., Клюшников С. А., Селиверстов Ю.А. Болезнь Гентингтона. М.: Атмосфера, 2018; 472 с.
- Селиверстов Ю.А., Клюшников С. А., Иллариошкин С. Н. Эпидемиология болезни Гентингтона: состояние вопроса в мире и России. Неврология и нейрохирургия. Восточная Европа 2015; (S): 72-3
- Demetriou С, Heraclides A, Salafori С, et al. Epidemiology of Huntington disease in Cyprus: A 20-year retrospective study. Clin Genet 2018; (93): 656-64
- Fisher E, Hayden M Multisource ascertainment of Huntington disease in Canada: Prevalence and population at risk. Mov Disord 2013; (29): 105-14
- Evans S, Douglas I, Rawlins M, et al. Prevalence of adult Huntington's disease in the UK based on diagnoses recorded in general practice records. J Neurol Neurosurg Psychiatry 2013; (84): 1156-60
- Rub U, Heinsen H, Brunt E, et al. The human premotor oculomotor brainstem system - can it help to understand oculomotor symptoms in Huntington's disease? Neuropathol Appl Neurobiol 2009; (35): 4-15
- Hicks SL, Robert MP, Golding CV, et al. Oculomotor deficits indicate the progression of Huntington's disease. Progress in Brain Research 2008; (171): 555-8
- Gorges M, Pinkhardt EH, Kassubek J. Alterations of eye movement control in neurodegenerative movement disorders. J Ophthalmol 2014; (2014): 658243
- Aimer Z, Klein KS, Marsh L, et al. Ocular motor and sensory function in Parkinson disease. Ophthalmology 2012; 119 (1): 178-82
- Henderson T, Georgiou-Karistianis N, White O, et al. Inhibitory control during smooth pursuit in Parkinson's disease and Huntington's disease. Mov Disord 2011; 26 (10): 1893-99
- Becker W, Jurgens R, Kassubek J, et al. Eye-head coordination in moderately affected Huntington's disease patients: do head movements facilitate gaze shifts? Experimental Brain Research 2009; 192 (1): 97-112
- Fielding J, Georgiou-Karistianis N, Bradshaw J, et al. Impaired modulation of the vestibulo-ocular reflex in Huntington's disease. Mov Disord 2004; 19 (1): 68-75
- Turner TH, Goldstein J, Hamilton JM, et al. Behavioral measures of saccade latency and inhibition in manifest and premanifest Huntington's disease. Journal of Motor Behavior 2011; 43 (4): 295-302
- Fielding J, Georgiou-Karistianis N, White O. The role of the basal ganglia in the control of automatic visuospatial attention. Journal of the International Neuropsychological Society 2006; 12 (5): 657-67
- Blekher T, Johnson SA, Marshall J, et al. Saccades in presymptomatic and early stages of Huntington disease. Neurology 2006; 67 (3): 394-9
- Patel SS, Jankovic J, Hood AJ, et al. Reflexive and volitional saccades: biomarkers of Huntington disease severity and progression. Journal ofthe Neurological Sciences 2012; 313 (1-2): 35-41
- Say MJ, Jones R, Scahill Rl, et al. Visuomotor integration deficits precede clinical onset in Huntington's disease. Neuropsychologia 2011; 49 (2): 264-70
- Blekher T, Yee R, Kirkwood S, etal. Oculomotor control in asymptomatic and recently diagnosed individuals with the genetic marker for Huntington's disease. Vision Res 2004; (44): 2729-36
- Hicks SL, Robert MP, Golding CV, et al. Oculomotor deficits indicate the progression of Huntington's disease. Progress in Brain Research 2008; (171): 555-8
- Antoniades C,Altham P, Mason S, et al. Saccadometry: a new tool for evaluating presymptomatic Huntington patients. Neuroreport 2007; (18): 1133-6
- Huntington Study Group. Unified Huntington's disease rating scale: reliability and consistency. Mov Disord 1996; (11): 136-42
- Scheiman M, Gallaway M, Frantz K, et al. Nearpoint of convergence: test procedure, target selection, and normative data. Optom Vis Sci 2003; 80 (3): 214-25
- Shippman S, Infantino J, Cimbol D, et al. Convergence insufficiency with normal parameters. J Pediatr Ophthalmol Strabismus 1983; (20): 158-161
- Wnder JY, Roos RAC Premanifest Huntington's disease: examination of oculomotor abnormalities in clinical practice. PLoS ONE 2018; 13 (3): e0193866
- Leigh R, Newman S, Folstein S, et al. Abnormal ocular motor control in Huntington's disease. Neurology 1983; 33 (10): 1268-8
- Светозарский С. H., Копишинская С. В., Густов А. В. и др. Офтальмологические проявления болезни Гентингтона. Вестник офтальмологии 2015; 131 (5): 82-6.


