Глиомы зрительного пути у детей: диэнцефальная кахексия
Автор: Валиахметова Эндже Фаварисовна, Мазеркина Надежда Александровна, Папуша Людмила Ивановна, Быданов Олег Иванович, Тарасова Екатерина Михайловна, Медведева Ольга Александровна, Серова Наталья Константиновна, Лазарева Людмила Александровна, Шишкина Людмила Валентиновна, Трунин Юрий Юрьевич, Новичкова Галина Анатольевна, Горелышев Сергей Кириллович, Карачунский Александр Исаакович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Диэнцефальная кахексия (ДК) - нарушение обмена веществ, характеризующееся снижением массы тела при нормальном самочувствии и нормальном потреблении калорий. Наиболее часто данное состояние встречается при глиомах зрительного пути (ГЗП) и является фактором неблагоприятного прогноза. Цель исследования - проанализировать особенности течения глиом зрительного пути у пациентов с ДК и без неё. Материал и методы. В исследование вошли 264 пациента в возрасте от 0 до 18 лет с первичным диагнозом «глиома зрительного пути», зарегистрированные в НМИЦ нейрохирургии им. академика Н.Н. Бурденко в период с 01.01.2003 по 31.12.2015. Больные были разделены на две группы: без ДК (204 ребенка) и с наличием ДК (60 детей). Результаты. Нейрофиброматоз I типа (НФ!) достоверно чаще встречался у детей без ДК, а детей с пиломиксоидным гистологическим вариантом было достоверно больше в группе с ДК. Пятилетняя ОВ и БСВ оказались достоверно ниже в группе детей с ДК - 82 ± 5 % и 96 ± 1 % и 37 ± 7 % и 62 ± 3 % соответственно. Выяснилось, что у девочек, пациентов без НФI пациентов без гистологической верификации и с пилоидными астроцитомами в группе с ДК достоверно ниже как ОВ, так и БСВ. Также оказалось, что у детей до 1 года в группе с ДК достоверно ниже ОВ, а у старших детей (более 12 мес) в группе с ДК достоверно ниже БСВ. Количество пациентов без событий оказалось достоверно выше в группе без ДК (р=0,001). Количество летальных исходов в послеоперационном периоде оказалось достоверно выше у детей с ДК (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Глиомы зрительного пути, глиомы низкой степени злокачественности, дети, диэнцефальная кахексия
Короткий адрес: https://sciup.org/140254450
IDR: 140254450 | УДК: 617.75-006.484:616-056.5]-053.2 | DOI: 10.21294/1814-4861-2021-20-1-34-45
Текст научной статьи Глиомы зрительного пути у детей: диэнцефальная кахексия
Глиомы зрительного пути (ГЗП) – это доброкачественные глиальные опухоли, наиболее частым гистологическим вариантом которых является пилоидная астроцитома (ПА) [1]. ГЗП возникают в 1 случае на 100 000 новорожденных в год и составляют 0,6–1,0 % от всех интракраниальных опухолей среди всех больных и 3–5 % среди детей. В возрасте до 2 лет их частота среди интракраниальных опухолей возрастает до 20 % [2]. В 75 % случаев эти опухоли диагностируются в течение первого десятилетия жизни, примерно в 60 % случаев диагноз выставляется в возрасте до 5 лет [1].
Глиомы зрительного пути проявляются 3 группами симптомов: зрительными нарушениями (снижение остроты зрения, дефекты полей зрения, атрофия зрительных нервов, нистагм, отек диска зрительного нерва), неврологическими нарушениями (гемипарез, псевдобульбарные нарушения, микроцефалия, симптомы внутричерепной гипертензии) и эндокринными нарушениями, такими как задержка роста, дефицит гормонов гипофиза, несахарный диабет (НД), преждевременное половое развитие (ППР), ожирение, диэнцефальная кахексия (ДК). Снижение веса у детей с опухолями мозга может быть обусловлено разными причинами, наиболее часто рвотой на фоне внутричерепной гипертензии, реже интоксикацией при злокачественных опухолях или надпочечниковой недостаточностью при опухолях гипофиза/диэнцефальной области. Особое место занимает ДК. В отличие от снижения веса при гипертензионной симптоматике и интоксикации при злокачественных опухолях, ДК характеризуется нормальным самочувствием и нормальным потреблением калорий.
Наиболее часто ДК встречается у детей при глиомах зрительного пути [3–5]. Реже данный синдром описан при других опухолях головного мозга, расположенных в области III желудочка: краниофарингиомах, эпендимомах, злокачественных глиомах и герминативно-клеточных опухолях [6, 7], редки описания ДК у взрослых пациентов [8].
ДК остается клинической загадкой, ее точная этиология и патогенез неизвестны. В то время как дисбаланс в гормональной регуляции обмена веществ может быть опосредован опухолью [3, 9], до сих пор неясно, что является причиной кахексии – анорексия или гиперметаболическое состояние [10]. Высказывалось предположение о том, что ДК развивается при поражении гипоталамической области [11], однако другие авторы после стабилизации основного заболевания и исчезновении симптомов ДК при полихимиотерапии (ПХТ) предположили, что в основе ДК лежит не только поражение гипоталамической области опухолью. Учитывая, что ДК в основном встречается у детей меньше года, она может быть связана также с какой-то незрелостью гипоталамуса, что делает его более восприимчивым к сжимающему эффекту растущей опухоли. Более редкая встречаемость ДК у детей старшего возраста может быть объяснена тем, что гипоталамус становится все более зрелым и «нечувствительным» к сжимающему эффекту смежной опухоли. Более простое объяснение исчезновения ДК без исчезновения и даже уменьшения опухоли может быть связано с тем, что существуют минимальные вариации объема опухоли, не обнаруживаемые на стандартных изображениях МРТ [5, 12]. По данным ряда исследований [5, 13], диэнцефальная кахексия может быть фактором, ухудшающим прогноз заболевания.
Мы провели ретроспективное исследование, оценивающее различные клинические параметры у детей с ГЗП, влияющие на течение заболевания, в том числе ДК.
Цель исследования – проанализировать особенности течения глиом зрительного пути у пациентов с ДК и без неё.
Материал и методы
Критериями включения в анализ являются: первичный диагноз глиома зрительного пути; подтверждение диагноза методом МРТ с контрастом в референсной радиологической лаборатории либо гистологическое подтверждение доброкачественной глиомы; полная информация о наличии/ отсутствии ДК; лечение в период с 1 января 2003 г. по 31 декабря 2015 г.; возраст от 0 до 18 лет; информированное согласие пациента и/или родителей/ опекунов на проведение данного исследования. База данных была заморожена 31 декабря 2016 г.
Гистологические диагнозы были сформулированы в соответствии с классификацией Всемирной организации здравоохранения (ВОЗ) для опухолей ЦНС (2007) [14]:
– пилоидная астроцитома (ПА) (grade I); пиломиксоидная астроцитома (ПМА) (grade II); плеоморфная ксантоастроцитома (grade II); диффузная астроцитома (grade II); олигодендроглиома (grade II);
– олигоастроцитома (grade II); ганглиоглиома (grade I); ганглиоастроцитома (grade I);
– десмопластическая инфантильная астроцито-ма/ганглиоглиома (grade I).
Эндокринологическое обследование заключалось в осмотре эндокринолога и исследовании гормонов крови на момент постановки диагноза и далее 1 раз в 6 мес. При гормональном исследовании оценивался базальный уровень гормонов (пролактин, свободный Т3, Т4, ТТГ, ИФР-1 кортизол, ЛГ, ФСГ, прогестерон, эстрадиол, тестостерон, СТГ). По показаниям для оценки функции надпочечников и гормона роста проводилась проба с инсулином (глюкагоном), при подозрении на ППР проба с аналогом гонадолиберина. Костный возраст оценивался по данным рентгенографии кистей рук. Для оценки ростового процесса использовались стандартные ростовые показатели: SDS роста по хронологическому возрасту. Масса тела измерялась в килограммах, для оценки весового показателя использовался индекс массы тела (ИМТ), а также SDS ИМТ по хронологическому возрасту. Половое развитие детей оценивалось по шкале Tanner.
Снижение SDS массы тела ниже 2, а также отсутствие прибавки массы тела у грудного ребенка при отсутствии других причин расценивались как диэнцефальная кахексия (ДК).
Офтальмологический осмотр определялся возрастом и общим состоянием пациента. Исследовали остроту зрения, поле зрения (статическая автоматическая периметрия, мануальная кинетическая периметрия, ориентировочное исследование), глазодвигательную и зрачковосуживающую функции, проводили экзофтальмометрию. Состояние глазного дна оценивали с помощью обратной и прямой офтальмоскопии. Офтальмологическое исследование проводили до операции, в 1-е и 6-е сут (при необходимости чаще) послеоперационного периода. При проведении цитостатической терапии осмотр осуществляли в процессе лечения 1 раз в 3–6 мес, при проведении лучевой терапии – до и после окончания лечения и далее каждые 6 мес. За улучшение принимали повышение остроты зрения в 2 раза, но не менее чем на 2 строчки хотя бы одного глаза и/или расширение границ поля зрения. При оценке динамики зрительных функций в отдаленном периоде наблюдения принимали во внимание, что повышение остроты зрения может быть связано с взрослением ребенка.
Химиотерапия состояла из 10-недельной индукционной фазы с внутривенным струйным введением винкристина (1,5 мг/м2, максимум 2 мг), 1 раз в нед, с 1-й по 10-ю нед; карбоплатина (550 мг/м2) в виде внутривенных инфузий в течение 1 ч в 1, 4, 7 и 10-ю нед. Во время консолидации (13–53 нед) оба препарата вводились одновременно в вышеуказанной дозировке каждые 4 нед. Детям младше 6 мес и детям с весом <10 кг расчёт всех химиопрепаратов проводился не на площадь поверхности тела, а на массу: карбоплатин – 18,3 мг/кг/день; винкристин – 0,05 мг/кг/день. Редукция доз цитостатиков была рекомендована в случаях гематологической или органной токсичности. Степень гематологической токсичности определялась, согласно критериям ВОЗ, по шкале токсичности Common Toxicity Criteria (CTC) [15].
Локальная лучевая терапия проводилась с клиническим объемом мишени (англ. CTV, clinical target volume), который составил +1,0 см от основного объема опухоли (англ. GTV, gross tumor volume), определявшегося по МРТ в режимах Т2 и Т1 с контрастным усилением, планируемый объем мишени (англ. PTV, planning target volume) составил +0,5 см к CTV. Разовая очаговая доза составила 1,8 Гр, суммарная очаговая доза – 54 Гр.
Статистический анализ данных выполнялся с использованием пакета программ R-statistics версии 3.4.2 в соответствии с рекомендациями. Описательная статистика количественных признаков представлена медианами и квартилями (в формате Me [Q1; Q3]). Описательная статистика качественных признаков представлена абсолютными и относительными частотами. Для сравнения несвязанных групп по количественным и порядковым признакам применялся непараметрический тест Манна–Уитни (U-test). Сравнение несвязанных групп по качественным признакам проводилось с использованием теста χ2. Анализ общей выживаемости (ОВ) и бессобытийной выживаемости (БСВ) проводился с использованием метода Каплана–Майера. ОВ была рассчитана от даты постановки диагноза до смерти пациента, независимо от ее причин. БСВ была рассчитана от даты постановки диагноза до даты события. Событием после постановки диагноза считались: продолженный рост остаточной опухоли, рецидив после достижения полного ответа, появление новых или увеличение в размерах уже существующих метастатических очагов, смерть независимо от её причин. Сравнение времени до события (ОВ, БСВ) в двух группах выполняли с использованием LogRank теста. Пороговым уровнем статистической достоверности считали р=0,05.
Результаты исследования
В ФГАУ «НМИЦ нейрохирургии им. ак. Н.Н. Бурденко» Минздрава России в период с 1 января 2003 г. по 31 декабря 2015 г. обследование и лечение по поводу глиом низкой степени злокачественности зрительного пути прошли 296 пациентов, в соответствии с вышеописанными критериями включения в анализ вошли 264 пациента, 32 – не соответствовали критериям включения из-за отсутствия данных о наличии диэнцефальной кахексии на момент постановки диагноза. Пациенты были разделены на 2 группы: 1-я группа (n=204) – дети без ДК, 2-я группа – дети (n=60) с ДК.
Медиана возраста на момент постановки диагноза в 1-й группе составила 65 мес, во 2-й – 16 мес. Различий по полу между группами не обнаружено (табл. 1). Однако НФI достоверно чаще встречался у детей без ДК – 19 % и 5 % (р=0,009), а детей с пиломиксоидной астроцитомой было значимо больше во 2-й группе – 14,2 % и 30 % соответственно (р=0,005). У 14 пациентов на момент постановки диагноза было метастатическое распространение, из них у 9 была ДК. Однако выполнение МРТ спинного мозга не входит в рутинное исследование данных пациентов, и, возможно, не все случаи с метастатическим поражением были диагностированы.
Пятилетняя ОВ и БСВ для всех пациентов составили 93 ± 2 % и 57 ± 3 % соответственно. В группе с ДК как 5-летняя, так и 16-летняя ОВ оказались значимо ниже – 82 ± 5 % и 79 ± 6 % (р=0,001), чем в группе без ДК – 96 ± 1 % и 93 ± 2 % соответственно. Также в группе с ДК значимо ниже оказались 5-летняя и 16-летняя БСВ – 37 ± 7 % и 29 ± 8 % (р=0,003), чем в группе без ДК – 62 ± 3 % и 55 ± 4 % соответственно (рис. 1).
При анализе выживаемости в зависимости от пола у девочек в группе с ДК оказались достоверно ниже как ОВ, так и БСВ (р=0,011, р=0,003 соответственно), чем в группе без ДК. Также выяснилось, что в группе с ДК ОВ достоверно ниже у детей младшей возрастной группы (менее 12 мес) – 94 ± 6 % и 71 ± 11 % сoответственно (р=0,0156), чем в группе без ДК. Всего 6 погибшим пациентам было менее 1 года на момент постановки диагноза, из них у 5 была ДК. Двое с ДК погибли от прогрессирования заболевания, трое погибли от тяжелых электролитных нарушений, сопровождавшихся гипертермией у 1 пациента. Пациент без ДК погиб от ротавирусной инфекции на фоне нейтропении IV степени на последней неделе ПХТ.
Среди пациентов старше года на момент манифестации заболевания БСВ достоверно ниже у пациентов с ДК, чем у пациентов с нормальным весом, – 46 ± 9 % и 63 ± 4 % (р=0,034). У пациентов без НФ1 в группе с ДК как ОВ – 95 ± 2 % и 81 ± 5 % (р=0,012), так и БСВ – 60 ± 4 % и 37 ± 7 % (р=0,0031) были достоверно ниже, чем в группе без ДК. У пациентов с НФ1 достоверных различий между пациентами без ДК и с ДК не было. При анализе выживаемости в зависимости от гистологического варианта опухоли выяснилось, что и ОВ и БСВ у пациентов без верификации опухоли и у пациентов с ПА достоверно ниже в группе с ДК,
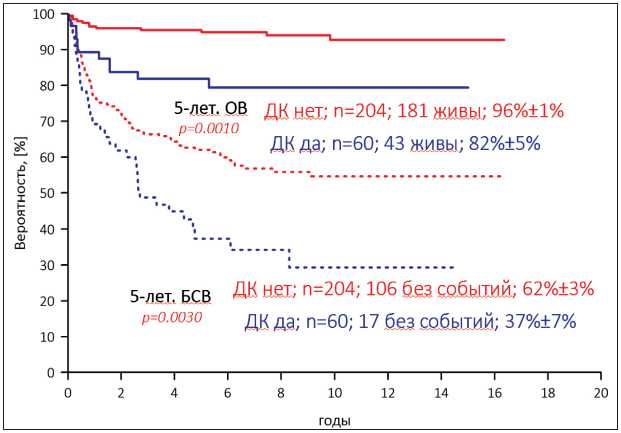
Рис. 1. Общая выживаемость (ОВ) и бессобы-тийная выживаемость (БСВ) пациентов с ГЗП в зависимости от наличия диэнцефальной кахексии
Fig. 1. Overall survival (OS) and event-free survival (EFS) of patients with OPG depending on the presence of diencephalic cachexia
Таблица 1/table 1
Клинические характеристики и выживаемость пациентов с ГЗП в 1-й и 2-й группах clinical characteristics and survival of patients with opgs in groups 1 and 2
|
Показатели выживаемости/ Survival of patients |
Пациенты без ДК/ Patients without DС |
Пациенты с ДК/ Patients with DС |
р |
|
|
В целом по группе/ |
ОВ |
96 ± 1 % |
82 ± 5 % |
0,0010 |
|
Group as a whole |
БСВ |
62 ± 3 % |
37 ± 7 % |
0,0030 |
|
Возраст/Age |
||||
|
До 12 мес/ |
ОВ |
94 ± 6 % |
71 ± 11 % |
0,0156 |
|
Under 12 months |
БСВ |
52 ± 13 % |
18 ± 9 % |
0,0687 |
|
Старше 12 мес/ |
ОВ |
96 ± 2 % |
87 ± 5 % |
0,1530 |
|
Over 12 months |
БСВ |
63 ± 4 % |
46 ± 9 |
0,034 |
|
Нейрофиброматоз I типа/ Neurofibromatosis type I |
||||
|
НФI есть/ NFI/yes |
ОВ |
97 ± 3 % |
100 % |
0,6070 |
|
БСВ |
69 ± 8 % |
67 ± 27 %* |
0,7820 |
|
|
НФI нет/ NFI/no |
ОВ |
95 ± 2 % |
81 ± 5 % |
0,0120 |
|
БСВ |
60 ± 4 % |
37 ± 7 % |
0,0031 |
|
|
Пол/Sex |
||||
|
Мужской/Male |
ОВ |
95 ± 2 % |
83 ± 7 % |
0,882 |
|
БСВ |
58 ± 5 % |
41 ± 9 % |
0,839 |
|
|
Женский/Female |
ОВ |
96 ± 2 % |
81 ± 8 % |
0,011 |
|
БСВ |
66 ± 5 |
33 ± 10 % |
0,0030 |
|
|
Гистология/Histology |
||||
|
Б/в/ |
ОВ |
89 ± 2 % |
50 ± 25 % |
0,0088 |
|
W/v |
БСВ |
52 ± 9 % |
25 ± 22 % |
<0,0001 |
|
ПА/PA |
ОВ |
98 ± 1 % |
82 ± 7 % |
0,0565 |
|
БСВ |
65 ± 4 % |
48 ± 8 % |
0,0004 |
|
|
ПМА/PMA |
ОВ |
79 ± 8 % |
89 ± 7 % |
0,2590 |
|
БCВ |
49 ± 10 % |
12 ± 11 % |
0,3890 |
|
Примечание: БСВ – бессобытийная выживаемость, ОВ – общая выживаемость, Б/в – без верификации; * – 1-летняя бессобытийная выживаемость.
Note: EFS – event-free survival, OS – overall survival, W/v – without verification, PA –pilocytic astrocytoma, PMA – pilomyxoid astrocytoma; * – 1-year event-free survival.
в то время как выживаемость у пациентов с ПМА статистически не отличалась (табл. 1).
Результаты лечения представлены в табл. 2, 3. Продолженный рост был зарегистрирован у 107 (40,5 %) пациентов, причем никаких различий между двумя группами не обнаружено. В то же время выяснилось, что смерть в послеоперационном периоде встречалась чаще у пациентов с ДК (р<0,001). На момент завершения исследования 123 (46,6 %) ребенка были живы без событий. Количество пациентов без каких-либо событий оказалось достоверно выше в группе больных без
Таблица 2/table 2
Результаты 1-й линии лечения
Results of first line treatment
treatment
Примечания: БСВ – бессобытийная выживаемость, ОВ – общая выживаемость; удал-ДН – удаление опухоли с последующим динамическим наблюдением, удал-ХТ – удаление опухоли с последующей химиотерапией, удал-ЛТ – удаление опухоли с последующей лучевой терапией, удал-ХТ-ЛТ – удаление опухоли с последующими лучевой и химиотерапией, ДН – динамическое наблюдение, ХТ – химиотерапия, ЛТ – лучевая терапия, ХТ-ЛТ – химиотерапия с последующей лучевой терапией.
Notes: EFS – event-free survival, OS – overall survival; TR-FU – tumor removal with subsequent follow-up, TR-CT – tumor removal followed by chemotherapy, TR-RT – tumor removal with subsequent radiation therapy, TR-CT-RT – tumor removal followed by radiotherapy and chemotherapy, FU – follow-up, CT – chemotherapy, RT – radiation therapy, CT-RT – chemotherapy followed by radiation therapy.
Таблица 3/table 3
Результаты лечения пациентов с ГЗПResults of treatment for patients with opgs
|
Результаты лечения/ Results of treatment |
Все пациенты/ All patients (n=264) |
Пациенты без ДК (группа 1)/ Patients without DС (group 1) (n=204) |
Пациенты с ДК (группа 2)/ Patients with DС (group 2) (n=60) |
p |
|
Продолженный рост/Continued growth |
107 (40,5 %) |
78 (38,2 %) |
29 (48,3 %) |
0,161 |
|
Смерть в послеоперационном периоде/ Death in the postoperative period |
6 (2,3 %) |
1 (0,5 %) |
5 (8,3 %) |
<0,001 |
|
Смерть в отдаленном периоде/ Long-term death |
9 (3,4 %) |
6 (2,9 %) |
3 (5 %) |
0,439 |
|
Смерть от осложнений лечения/ Death from complications of treatment |
2 (0,8 %) |
2 (1 %) |
- |
0,441 |
|
Потеря катамнеза/Loss of Follow-up |
17 (6,4 %) |
11 (5,4 %) |
6 (10 %) |
0,201 |
|
Живы без событий/Alive without events |
123 (46,6 %) |
106 (52 %) |
17 (28,4 %) |
0,001 |
ДК (р=0,001). В группе пациентов с ДК, которым после хирургического удаления не проводилось дальнейшее адъювантное лечение, ОВ оказалась достоверно ниже – 94 ± 2% и 74 ± 9% соответственно (р=0,0109) (табл. 2). На момент завершения исследования ДК регрессировала у 55 (91,7 %) пациентов. Из 5 (8,3 %) больных у кого ДК не регрессировала, 2 пациента погибли, у троих было зарегистрировано прогрессирование заболевания после завершения исследования.
При оценке динамики зрения в сравниваемых группах значимых различий в количестве пациентов со стабильными зрительными функциями и с ухудшением зрения не выявлено (табл. 4). Однако в группе без ДК пациентов с улучшением зрения было достоверно больше (р=0,0258).
Таблица 4/table 4
Динамика зрительных функций changes in visual functions
|
Динамика зрительных функций/ Changes in visual functions |
Все пациенты/ All patients (n=264) |
Пациенты без ДК (группа 1)/ Patients without DС (group 1) (n=204) |
Пациенты с ДК (группа 2)/ Patients with DС (group 2) (n=60) |
p |
|
Без динамики/No dynamics |
172 (65,2 %) |
129 (63,3 %) |
43 (71,7 %) |
0,228 |
|
Улучшение/Improvement |
30 (11,3 %) |
28 (13,7 %) |
2 (3,3 %) |
0,0258 |
|
Ухудшение/Deterioration |
62 (23,5 %) |
47 (23 %) |
15 (25 %) |
0,753 |
Таблица 5/table 5
|
Эндокринные нарушения/ Endocrine disorders |
Все пациенты/ All patients (n=264) |
Пациенты без ДК (группа 1)/ Patients without DС (group 1) (n=204) |
Пациенты с ДК (группа 2)/ Patients with DС (group 2) (n=60) |
p |
|
Несахарный диабет/Diabetes insipidus |
49 (18,6 %) |
33 (16,2 %) |
17 (28,3 %) |
0,0346 |
|
Ожирение/Obesity |
25 (9,5 %) |
18 (8,8 %) |
7 (11,7 %) |
0,508 |
|
Дефицит гормона роста/ Deficit of growth hormone |
40 (15,2 %) |
39 (19,1 %) |
1 (1,67 %) |
0,0009 |
|
Гипотиреоз/Hypothyroidism |
43 (16,3 %) |
31 (15,2 %) |
12 (20 %) |
0,376 |
|
Гипокортицизм/Hypocorticism |
33 (12,5 %) |
23 (11,3 %) |
10 (16,7 %) |
0,267 |
|
Гипогонадизм/Hypogonadism |
14 (5,3 %) |
11 (5,4 %) |
3 (5 %) |
0,905 |
|
Преждевременное половое развитие/ Premature sexual development |
32 (12,1 %) |
24 (11,8 %) |
8 (13,3 %) |
0,743 |
|
Гипонатриемия/Hyponatremia |
36 (13,6 %) |
12 (5,9 %) |
24 (40 %) |
<0,001 |
Эндокринные нарушения после лечения endocrine disorders after treatment
При оценке эндокринного статуса выявлено, что у пациентов с ДК достоверно чаще встречаются несахарный диабет (р=0,0346) и гипонатриемия как на момент манифестации заболевания, так и в послеоперационном периоде (р<0,001) (табл. 5). Ожирение в отдаленном периоде зарегистрировано у 25 пациентов: у 18 (8,8 %) – в группе без ДК, у 7 (11,75) – с ДК, значимых различий между группами не обнаружено. Различий в частоте встречаемости гипотиреоза, гипокортицизма, гипогонадизма, преждевременного полового развития в катамнезе не выявлено.
Клинический случай
Пациент, 2004 г.р. В возрасте 12 мес было замечено прогрессирующее снижение веса ребенка на фоне хорошего аппетита. Вес ребенка в 8 мес составлял 8070 г, в 1 год – 8400 г. За последующие 5 мес ребенок перестал прибавлять в весе, далее началось снижение веса, появились кожные складки, дряблость кожи в ягодичной области. При МРТ головного мозга (24.10.05) была выявлена опухоль хиазмально-селлярной области (рис. 2), направлен для хирургического лечения в Институт нейрохирургии им. Н.Н. Бурденко.
Клиническая картина заболевания: на фоне умеренной гипертензионной симптоматики в виде увеличения окружности головы до 50 см, признаки диэнцефальной кахексии: в возрасте 1 год
5 мес масса тела –8200 г, ИМТ –13,8 (SDS – 4,0) на фоне нормального питания ребенка. Рост – 79 см. SDS – 0,7.
Осмотр нейроофтальмолога: острота зрения (с коррекцией): OD=0,5, вблизи 1,0; OS=1,0. Описание полей зрения: левосторонняя гомонимная гемианопсия (периметрия). Глазное дно: OD – диск зрительного нерва бледный, границы четкие, сосуды без особенностей; OS – диск зрительного нерва с выраженным побледнением, границы четкие, сосуды без особенностей.
В ноябре 2005 г. выполнено удаление опухоли хиазмально-селлярной области. Гистологическое заключение: астроцитарная глиома.
С марта 2006 г. по июль 2007 г. проводилась двухкомпонентная ПХТ (карбоплатин и винкри-стин) по Протоколу SIOP-LGG/2004. Отмечалась гематологическая токсичность III–IV степени, проводилась корригирующая терапия. Аллергической реакции на карбоплатин не было. С августа 2008 г. – динамическое наблюдение. По данным МРТ с февраля по ноябрь 2009 г. выявлен продолженный рост опухоли в виде увеличения объемного образования в области III желудочка с распространением на хиазму и медиальные отделы правой височной доли, правый зрительный тракт.
В декабре 2009 г. выполнено повторное удаление опухоли. Гистологическое заключение: пилоидная астроцитома с высоким пролиферативным
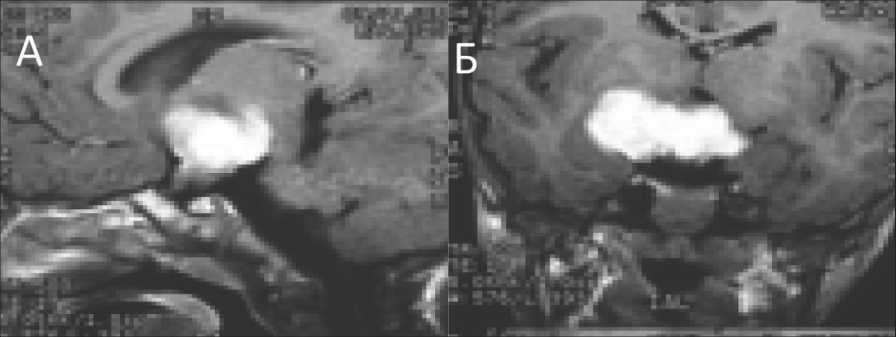
Рис. 2. МРТ пациента на момент постановки диагноза: А – сагиттальный срез в режиме Т1 с контрастным усилением;
Б – коронарный срез в режиме Т1 с контрастным усилением
Fig. 2. MRI image. A – sagittal slice in T1 mode with contrast enhancement. B – coronal section in T1 mode with contrast enhancement
индексом, Ki67 до 10 %. С марта по апрель 2010 г. проведена локальная лучевая терапия: к мишени подведены 30 фракций по 1,8 Гр, методикой DARC до СОД 54 Гр в изоцентре.
В возрасте 5 лет родители отметили увеличение полового члена и яичек, в январе 2011 г. появились единичные стержневые волосы. По данным рентгенографии кистей костный возраст соответствует 8,5 годам. При обследовании в феврале 2011 г. выявлен гипопитуитаризм: вторичный гипотиреоз, вторичный гипокортицизм. Назначена заместительная гормональная терапия.
С мая 2010 г. находился на динамическом наблюдении, получал заместительную гормональную терапию. Зрительные функции были без отрицательной динамики весь период наблюдения.
В марте 2019 г. при МРТ головного мозга выявлен метастаз в левом мосто-мозжечковом углу. Выполнено радиохирургическое лечение на аппарате Гамма-нож.
В данном случае ГЗП манифестировала типичными клиническими признаками – ДК и снижением зрения. Несмотря на пилоидный гистологический вариант, возраст и наличие ДК являются факторами неблагоприятного прогноза, поэтому была назначена ПХТ сразу после хирургического лечения. Однако через 2,5 года после завершения ПХТ был выявлен продолженный рост, пациент был повторно оперирован с облучением остаточной опухоли. При этом через 9 лет после облучения появился отдаленный метастаз, что подтверждает агрессивное течение данного заболевания у пациентов с ДК.
Обсуждение
Диэнцефальная кахексия – редкий синдром, который был впервые описан английским педиатром А. Расселом в 1951 г. [16]. Наиболее часто ДК встречается в младенчестве и у маленьких детей, характеризуется снижением SDS массы тела ниже 2, линейный рост при этом сохраняется. Этот синдром также характеризуется отсутствием подкожно-жировой клетчатки, характерны вегетативные нарушения, больные могут стать раздражительными, расторможенными, излишне общительными. Несмотря на глубокое истощение, для пациентов характерно хорошее самочувствие и двигательная активность [11].
В мировой литературе работы о ДК, как правило, заключаются в описании клинических случаев. Только в 2 проспективных европейских исследованиях включено достаточно большое количество пациентов с ДК HIT-LGG-1996 (n=28), SIOP-LGG/2004 (n=59) [13, 15]. Основанием для написания этой статьи стало, с одной стороны, наличие достаточно большого количества пациентов, с другой стороны, собранный уникальный материал с оценкей зрительных и эндокринных функций у данной когорты больных. Данное исследование – самое большое в мире по количеству пациентов с ДК при глиомах зрительного пути. Главной отличительной чертой нашей работы является разделение пациентов на две группы: без ДК и с наличием ДК, и последующий сравнительный анализ клинических данных, результатов лечения, зрительных функций и эндокринных нарушений.
При ГЗП ДК наиболее часто встречается в течение первых 2 лет жизни. В нашем исследовании медиана возраста на момент постановки диагноза у пациентов с ДК составила 16 мес, что совпадает с данными других авторов [3, 5, 14], в то время как у больных без ДК средний возраст составил 65 мес.
У пациентов с ДК глиомы зрительного пути, как правило, чаще имеется пиломиксоидный гистологический вариант, нежели у пациентов без ДК [17]. В нашей работе мы подтвердили, что пиломиксоидная астроцитома значимо чаще встречается у пациентов с ДК, нежели без нее, – 14,2 % и 30 % (р=0,005). ДК реже описывается у детей с ГЗП при нейрофиброматозе I типа, нежели при спорадических ГЗП. При анализе литературы мы нашли описание только 10 случаев ДК у детей с оптическими глиомами в контексте НФI при более чем 50 случаев при спорадических ГЗП [5, 12]. В нашей когорте НФI также значимо чаще встреча- ется у детей без ДК – 19 % и 5 % (р=0,009).
По данным проведенного исследования установлено, что наличие ДК является фактором плохого прогноза. БСВ оказалась достоверно ниже в группе пациентов с ДК – 37 ± 7 % и 62 ± 3 % (р=0,003), что не противоречит данным проспективных исследований [13, 15]. Также мы выяснили, что в группе с ДК по сравнению с группой без наличия ДК бессобытийная выживаемость ниже у девочек – 33 ± 10 % и 66 ± 5 % (р=0,003), у детей старшего возраста (более 12 мес) – 46 ± 9 % и 63 ± 4 % (р=0.034), у пациентов без НФI – 37 ± 7 % и 60 ± 4 % (р=0,0031), без гистологической верификации – 25 ± 22 % и 52 ± 9 % (р<0,0001) и с пилоидной астроцитомой – 48 ± 8 % и 65 ± 4 % (р=0,0004) соответственно. В литературе подобного анализа выживаемости у пациентов с ДК в зависимости от пола, возраста, наличия нейрофиброматоза I типа, гистологического варианта опухоли не выявлено. Наличие ДК достоверно влияло на БСВ у больных с ПА, но не с пиломиксоидными астроцитомами. Возможно, этот гистотип опухоли является независимым фактором, негативно влияющим на прогноз. При пиломиксоидных астроцитомах отмечены более низкие показатели БСВ [18, 19]. В литературе описано, что у детей старшего возраста (≥12 мес) более высокие показатели БСВ [13], наши данные могут свидетельствовать о том, что ДК негативно влияет на бессобытийную выживаемость в старшей возрастной группе. В литературе указывается, что, в целом, НФI является фактором хорошего прогноза. Мы не выявили значимых различий выживаемости у пациентов с НФ I типа в зависимости от ДК. Однако следует отметить малое количество пациентов с НФI и ДК, что усложняет анализ.
По нашим данным, наличие ДК также ухудшало показатели общей выживаемости. У девочек, детей младшего возраста (менее 12 мес), у пациентов без НФI, без гистологической верификации и у пациентов с пилоидной астроцитомой ОВ в группе с ДК была достоверно ниже. J. Rakotonjanahary et al. после анализа смертности пациентов с ГЗП выяснили, что у детей младшего возраста (менее 12 мес) в 3 раза выше риск летального исхода (из 45 детей младше года – у 15 была ДК) [20], однако сравнительного анализа ОВ между группами с и без ДК в младшей возрастной группе авторы не проводили. В указанной работе, помимо возраста, наличие внутричерепной гипертензии и ДК были неблагоприятными факторами прогноза для общей выживаемости. У мальчиков без ДК оказался лучший прогноз для ОВ по сравнению с девочками с и без ДК и мальчиками с ДК [20]. В нашем исследовании мы также выявили зависимость ОВ от пола. Общая выживаемость у девочек с ДК оказалась значимо ниже. У детей до 1 года ДК также ухудшала прогноз общей выживаемости: из 6 погибших 5 были с ДК (3 погибли от электролитных нарушений, 2 – от прогрессирования основного заболевания). Одной из возможной причин более высокой летальности при ДК у детей младшего возраста могут быть эндокринные нарушения, в частности более частая гипонатриемия. В нашей когорте пациентов гипонатриемия значимо чаще встречалась у детей с ДК (р>0,001). Мы, так же как и J. Rakotonjanahary et al., не выявили значимой разницы в показателях выживаемости в зависимости от проведенного лечения, за исключением того, что у пациентов с ДК, которым после хирургического удаления не проводилось адъювантное лечение, ОВ оказалась достоверно ниже. Возможно, сама кахексия – фактор, неблагоприятно влияющий на состояние здоровья. В предыдущей работе мы выяснили, что у детей с ДК, получавших карбоплатин + винкристин, гематологическая токсичность III–IV степени встречалась значимо чаще [21]. В представленном исследовании выявлено, что послеоперационная летальность была значимо выше у пациентов с ДК.
Кроме того, нами выявлено, что несахарный диабет достоверно чаще встречался у пациентов с ДК, вероятно, это связано с поражением гипоталамической области, где находятся супраоптические и паравентрикулярные ядра, где синтезируется вазопрессин. D.K. Singh et al. показали, что при глиомах зрительного пути, поражающих гипоталамическую область, значимо чаще встречается НД, однако в указанной работе количество пациентов с ДК невелико и не анализировалась зависимость между НД и ДК [22]. J.P. Kilday et al. отмечают, что у 3 (33 %) из 9 пациентов после разрешения кахексии с течением времени отмечена парадоксальная прибавка в весе [5]. В нашей когорте ожирение в отдаленном периоде зарегистрировано у 25 пациентов: у 18 (8,8 %) – в группе без ДК, у 7 (11,75 %) – с ДК, однако значимых различий между группами не обнаружено.
При оценке зрительных функций было выявлено, что у пациентов без диэнцефальной кахексии улучшение зрения наблюдалось значимо чаще (р=0,0258). В литературе мы не нашли подобных данных. Вероятно, более частое улучшение зрения у пациентов без ДК можно объяснить менее агрессивным поведением опухоли и, соответственно, меньшей необходимостью в лечении. По данным J.P. Kilday et al., ДК регрессирует у большинства пациентов после лечения, что согласуется с нашими данными [5], и, вероятнее всего, связано с исчезновением сдавления гипоталамической области.
Заключение
Таким образом, результаты проведенного исследования показывают, что глиомы зрительного пути у пациентов с ДК имеют более агрессивное клиническое течение, требующее более тщательного лечения и последующего наблюдения для профилактики нарастания зрительных нарушений и коррекции эндокринных расстройств. Необходимы проспективные клинические исследования для определения частоты метастатического распро- странения опухоли, влияния генетических аберраций, отдаленных результатов у этих пациентов.
Список литературы Глиомы зрительного пути у детей: диэнцефальная кахексия
- Opocher E., Kremer L.C., Da Dalt L., van de Wetering M.D., Viscardi E., Caron H.N., Perilongo G. Prognostic factors for progression of childhood optic pathway glioma: a systematic review. Eur J Cancer. 2006 Aug; 42(12): 1807-16. https://doi.org/10.1016/j.ejca.2006.02.022.
- Mishra M.V., Andrews D.W., Glass J., Evans J.J., Dicker A.P., Shen X., Lawrence Y.R. Characterization and outcomes of optic nerve gliomas: a population-based analysis. J Neurooncol. 2012 May; 107(3): 591-7. https://doi.org/10.1007/s11060-011-0783-2.
- Brauner R., Trivin C., Zerah M., Souberbielle J.C., Doz F., Kalifa C., Sainte-Rose C. Diencephalic syndrome due to hypothalamic tumor: a model of the relationship between weight and puberty onset. J Clin Endocrinol Metab. 2006 Jul; 91(7): 2467-73. https://doi.org/10.1210/jc.2006- 0322.
- Marec-Berard P., Szathmari A., Conter C., Mottolese C., Berlier P., Frappaz D. Improvement of diencephalic syndrome after partial surgery of optic chiasm glioma. Pediatr Blood Cancer. 2009; 53(3): 502-4. https://doi.org/10.1002/pbc.22085.
- Kilday J.P., Bartels U., Huang A., Barron M., Shago M., Mistry M., Zhukova N., Laperriere N., Dirks P., Hawkins C., Bouffet E, Tabori U. Favorable survival and metabolic outcome for children with diencephalic syndrome using a radiation-sparing approach. J Neurooncol. 2014 Jan; 116(1): 195-204. https://doi.org/10.1007/s11060-013-1284-2.
- Villares J.M., Carrión F., Gallego F.M.E., Muñoz G.A., LópezManzanares J., Alfageme R.M. Diencephalic syndrome: An uncommon cause of malnutrition. An Esp Pediatr. 2002 May; 56(5): 466-71.
- Stival A., Lucchesi M., Farina S., Buccoliero A.M., Castiglione F., Genitori L., de Martino M., Sardi I. An infant with hyperalertness, hyperkinesis, and failure to thrive: a rare diencephalic syndrome due to hypothalamic anaplastic astrocytoma. BMC Cancer. 2015; 15: 616. https://doi.org/10.1186/s12885-015-1626-x.
- Klochkova I.S, Astaf'eva L.I., Konovalov A.N., Kadashev B.A., Kalinin P.L., Sharipov O.I., Kutin M.A., Sidneva Yu.G., Shishkina L.V., Pronin I.N. Redkii sluchai razvitiya dientsefal'noi kakheksii u vzrosloi zhenshchiny s kraniofaringiomoi. Voprosy neirokhirurgii imeni N.N. Burdenko. 2017; 81(5): 84-95. https://doi.org/10.17116/neiro201781584-9.
- Fleischman A., Brue C., Poussaint T.Y., Kieran M., Pomeroy S.L., Goumnerova L., Scott R.M., Cohen L.E. Diencephalic syndrome: a cause of failure to thrive and a model of partial growth hormone resistance. Pediatrics. 2005 Jun; 115(6): e742-8. https://doi.org/10.1542/peds.2004-2237.
- Gropman A.L., Packer R.J., Nicholson H.S., Vezina L.G., Jakacki R., Geyer R., Olson J.M., Phillips P., Needle M., Broxson E.H. Jr., Reaman G., Finlay J. Treatment of diencephalic syndrome with chemotherapy: Growth, tumor response, and long term control. Cancer. 1998 Jul 1; 83(1): 166-72. https://doi.org/10.1002/(SICI)1097-0142(19980701)83:1-166::AIDCNCR22-3.0.CO;2-U
- Scalzone M., Coccia P., Ruggiero A., Lazzareschi I., Mastrangelo S., Riccardi R. Diencephalic syndrome and brain tumours: A rare cause of growth failure. Eur J Oncol 2009; 14(1): 53-56.
- Cavicchiolo M.E., Opocher E., Daverio M., Bendini M., Viscardi E., Bisogno G., Perilongo G., Da Dalt L. Diencephalic syndrome as sign of tumor progression in a child with neurofibromatosis type 1 and optic pathway glioma: a case report. Childs Nerv Syst. 2013 Oct; 29(10): 1941-5. https://doi.org/10.1007/s00381-013-2109-5.
- Gnekow A.K., Walker D.A., Kandels D., Picton S., Giorgio Perilongo, Grill J., Stokland T., Sandstrom P.E., Warmuth-Metz M., Pietsch T., Giangaspero F., Schmidt R., Faldum A., Kilmartin D., De Paoli A., De Salvo G.L.; of the Low Grade Glioma Consortium and the participating centers. A European randomised controlled trial of the addition of etoposide to standard vincristine and carboplatin induction as part of an 18-month treatment programme for childhood (≤16 years) low grade glioma A final report. Eur J Cancer. 2017 Aug; 81: 206-225. https://doi.org/10.1016/j.ejca.2017.04.019. Epub 2017 Jun 22.
- Russell A.A. A diencephalic syndrome of emaciation in infancy and childhood. Arch Dis Child 1951; 26: 274.
- Gnekow A.K., Falkenstein F., von Hornstein S., Zwiener I., Berkefeld S., Bison B., Warmuth-Metz M., Driever P.H., Soerensen N., Kortmann R.D., Pietsch T., Faldum A. Long-term follow-up of the multicenter, multidisciplinary treatment study HIT-LGG-1996 for low- grade glioma in children and adolescents of the German Speaking Society of Pediatric Oncology and Hematology. Neuro Oncol. 2012 Oct; 14(10): 1265-84. https://doi.org/10.1093/neuonc/nos202.
- Pillai M.G., Unnikrishnan A.G., Nair V., Jayakumar R.V., Kumar H. Diencephalic cachexia: a rare cause for failure to thrive. J Pediatr. 2005 Nov; 147(5): 713. https://doi.org/10.1016/j.jpeds.2005.04.024.
- Perilongo G., Carollo C., Salviati L., Murgia A., Pillon M., Basso G., Gardiman M., Laverda A. Diencephalic syndrome and disseminated juvenile pilocytic astrocytomas of the hypothalamic-optic chiasm region. Cancer. 1997 Jul 1; 80(1): 142-6. https://doi.org/10.1002/(sici)1097-0142(19970701)80:1-142::aid-cncr19-3.0.co;2-y.
- Johnson M.W., Eberhart C.G., Perry A., Tihan T., Cohen K.J., Rosenblum M.K., Rais-Bahrami S., Goldthwaite P., Burger P.C. Spectrum of pilomyxoid astrocytomas: intermediate pilomyxoid tumors. Am J Surg Pathol. 2010 Dec; 34(12): 1783-91. https://doi.org/10.1097/PAS.0b013e3181fd66c3.
- Mahore A., Kammar A., Dange N., Epari S., Goel A. Diencephalic juvenile pilomyxoid astrocytoma with leptomeningeal dissemination. Turk Neurosurg. 2011; 21(2): 222-5. https://doi.org/10.5137/1019-5149.JTN.2638-09.1.
- Rakotonjanahary J., De Carli E., Delion M., Kalifa C., Grill J., Doz F., Leblond P., Bertozzi A.I., Rialland X.; Brain Tumor Committee of SFCE. Mortality in Children with Optic Pathway Glioma Treated with UpFront BB-SFOP Chemotherapy. PLoS One. 2015 Jun 22; 10(6): e0127676. https://doi.org/10.1371/journal.pone.0127676.
- Valiakhmetova E.F., Bydanov O.I., Gorelyshev S.K., Serova N.K., Lazareva L.A., Shishkina L.V., Mazerkina N.A., Trunin Yu.Yu., Chulkova S.V., Grishchenko N.V., Egorova A.V., Papusha L.I., Novichkova G.A., Karachunskii A.I. Gliomy zritel'nogo puti u detei: prognosticheskie faktory, otsenka otveta i rol' dvukhkomponentnoi khimioterapii. Voprosy gematologii/onkologii i immunopatologii v pediatrii. 2019; 18(1): 62-72. https://doi.org/10.24287/1726-1708-2019-18-1-62-72.
- Singh D.K., Behari S., Jaiswal A.K., Sahu R.N., Srivastava A.K., Mehrotra A., Dabadgaon P. Pediatric anterior visual pathway gliomas: trends in fluid and electrolyte dynamics and their management nuances. Childs Nerv Syst. 2015 Mar; 31(3): 359-71. https://doi.org/10.1007/s00381-014-2606-1.


