Глутатион-редуктаза вакуоли. Сравнение активности глутатионредуктазы вакуолей и тканевого экстракта красной свеклы (Beta vulgaris L.)
Автор: Прадедова Е.В., Нимаева О.Д., Саляев Р.К.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 1 т.12, 2016 года.
Бесплатный доступ
Глутатионредуктаза (GR, EC 1.8.1.7) представляет собой фермент, который уменьшает окисленный глутатион (GSSG) и, таким образом, регулирует окислительно-восстановительное состояние глутатиона (GSH / GSSG). GR изучалась на большинстве растений. Этот фермент идентифицирован в хлоропластах и цитозоле, поэтому эти клеточные компартменты считаются основным местом локализации фермента. В то же время известно немного о вакуолях GR. Нет никаких убедительных доказательств для доказательства наличия или отсутствия этого фермента в вакуолях. Активность GR была обнаружена в вакуолях корневых клеток красной свеклы (Beta vulgaris L.). Уровень активности, оптимальный рН и изоферментный состав ГР сравнивали в вакуолях и тканевом экстракте корня свеклы. Активность Vacuolar GR была довольно высокой, она была в 1,5-2 раза выше активности тканевого экстракта. Оптимальный рН фермента всех объектов был идентичен. рН-оптимум зависит от природы пиридинового нуклеотида: рН 7,0-8,0 является оптимальным диапазоном с NADPH; pH 5,0 - с помощью NADH. Активность GR вакуолей и тканевых экстрактов снижалась в присутствии неконкурентного ингибитора 1-хлор-2,4-динитробензола (CDNB), что указывало на специфичность этой ферментативной реакции. Две зоны с активностью глутатионредуктазы были идентифицированы в вакуолях и тканевых экстрактах с использованием метода зимографии для определения ферментативной активности в ПААГ после электрофореза белков. Принадлежность к изоформам GR этих полос подтверждена иммуноферментным анализом (вестерн-блоттинг). Электрическая подвижность изоформ объектов исследования существенно не отличалась. Сделан вывод о том, что биохимические характеристики вакуолярной глутатионредуктазы по существу идентичны биохимическим характеристикам других локализационных GR.
Короткий адрес: https://sciup.org/14323986
IDR: 14323986
Текст научной статьи Глутатион-редуктаза вакуоли. Сравнение активности глутатионредуктазы вакуолей и тканевого экстракта красной свеклы (Beta vulgaris L.)
Одной из многочисленных функций центральной вакуоли клеток растений является защитная функция. Вакуоль вовлечена в детоксикацию ксенобиотиков, активных форм кислорода (АФК), радикальных форм эндогенных метаболитов (прооксидантов) и др. Основную роль вакуоли в детоксикационных процессах видят в депонирование некоторых токсичных соединений в виде конъюгатов с углеводами, аминокислотами и глутатионом (GSH) (Abhilash et al., 2009). Отмечено, что вакуоль аккумулирует не только конъюгаты с глутатионом, но и окисленный глутатион (GSSG), который является довольно эффективным прооксидантом (Dixon et al., 1998; Noctor et al., 2011). Эти и ряд других фактов послужили основанием для обсуждения большого вклада центральной вакуоли в регуляцию внутриклеточных редокс-процессов. Не исключают участие вакуоли в тех процессах, в которых GSH играет ключевую роль. Подтвердить это участие можно в ходе всестороннего изучения вакуолярной редокс-системы глутатиона. Эта система представлена самим GSH и глутатион-зависимыми ферментами. В рамках системы глутатиона, наряду с другими ферментами, функционирует фермент глутатионредуктаза (EC 1.8.1.7) (Kulinskiy, Kolesnichenko, 2009). Относимая к семейству флавопротеиновых оксидоредуктаз глутатионредуктаза (GR), катализирует восстановление дисульфида глутатиона GSSG до его сульфгидрильной формы GSH в присутствии NAD(P)H. Восстанавливая глутатион, GR повышает редокс-соотношение GSH/GSSG. В связи с этим, от активности фермента в определенной мере зависят редокс-гомеостаз клетки, функционирование редокс-зависимых белков и защита клеток от активных форм кислорода (АФК) (Carlberg, Mannervik, 1985).
На сегодняшний день GR является одним из самых изученных ферментов животных и человека. В то же время для GR растений недостаточно исследованы детали строения ферментативного комплекса, функционирования активного центра, регуляции и компартментации (Edwards et al., 1990). Основным местом локализации GR у растений принято считать хлоропласты (70-80%), однако глутатионредуктазная активность обнаружена в цитозоле, митохондриях и пероксисомах (Edwards et al., 1990; Rao, 2008). Для GR перечисленных компартментов определены изоферментный состав и кинетические характеристики. Следует отметить, что на сегодняшний день о GR вакуолей практически нет информации. Лишь единичные факты говорят о возможности присутствия фермента в этой клеточной структуре (Rautenkranz et al., 1994). Однако имеются дополнительные основания, позволяющие предположить функционирование GR в вакуолях. К ним можно отнести упомянутое выше участие вакуоли в детоксикации, опосредованной GSH, и депонирование GSSG. Кроме того, в вакуолях некоторых растений определена концентрация свободного глутатиона и выявлено преобладание пула GSH над пулом GSSG, несмотря на довольно низкое редокс-соотношение GSH/GSSG (Noctor et al., 2011). Преимущественная аккумуляция в вакуолях GSSG с одной стороны и преобладание восстановленного пула GSH с другой, позволяют предположить функционирование систем, восстанавливающих GSSG и поддерживающих восстановленный пул глутатиона (Noctor et al., 2011). Немаловажное значения в ряду таких систем имеет GR. В связи с эти, изучение активности GR в вакуолях представляется целесообразным. Одна из первоочередных задач настоящего исследования состояла в выявлении активности GR в вакуолях клеток корнеплодов столовой свеклы (Beta vulgaris L.). Другая задача заключалась в изучении биохимических характеристик GR вакуолей в сравнении с характеристиками GR тканевого экстракта корнеплодов столовой свеклы.
MATERIALS AND METHODS
Объектом исследования служили корнеплоды столовой свеклы ( Beta vulgaris L.) в период их физиологического покоя. Корнеплоды хранили при 4ºС.
Вакуоли выделяли из тканей корнеплодов с помощью модифицированного макрообъемного метода (Salyaev et al., 1981). Фракцию изолированных органелл дополнительно очищали от примесей в ступенчатом градиенте плотности сахарозы-KCl (1.050–1.080–1.145–1.180 г/см3). Растворы разной удельной плотности для градиента готовили, смешивая два матричных раствора: 1 М КCl и 1.8 М сахароза (20 мМ трис-HCl, рН 7.4) (Salyaev et al., 1981). Чистоту выделенных фракций вакуолей контролировали под световым микроскопом (“Carl Zeiss”, Германия), а также с помощью биохимических маркеров. Вакуолярные фракции считали чистыми, поскольку в них не выявляли активность маркерных ферментов клеточных структур, потенциальных контаминантов: каталазы (К.Ф. 1.11.1.6) – маркера пероксисом; HAD- и HADP-зависимые малатдегидрогеназы (К.Ф. 1.1.1.37 и 1.1.1.82 ) – маркеры цитозоля, митохондрий и пластид (Edwards et al., 1985; Levites, 1986) (Рис. 1).
Изолированные вакуоли разрушали в гипотоническом растворе, содержащем: 100 мМ K.Na-фосфатный буфер (pH 7.0), 1 мМ дитиотрейтола (DTT), 1 мМ EDTA, 1% поливинилпирролидона (PVP). Экстракт центрифугировали при 13500 g в течение 10 мин.
Водные экстракты ткани получали в ходе гомогенизации ткани корнеплода в среде: 100 мМ K.Na-фосфатный буфер (pH 7.8); 1 мМ DTT; 1 мМ EDTA; 1% PVP. Фильтраты центрифугировали 15 мин при 13500 g .
Активность GR определяли спектрофотометрическим методом в реакционной среде: 50 мМ K-фосфатный буфер (рН 7.0); 1 мМ EDTA; 0.1 мМ NADPH или NADH; 0.5 мМ GSSG (Anderson et al. , 1990). Окисление NAD(P)H определяли на спектрофотометре S100 (“Karl Zeis”, Jena, Германия) при длине волны 340 нм. Ферментативную активность рассчитывали с учетом коэффициента экстинкции для NAD(P)H, который соотвествует 6.22 мМ-1 см-1.
В том случае, когда исследовали рН- зависимость фермента, использовали среды с рН: 5.0–6.0–7.0–8.0.
Для GR на сегодня не выявлены узко специфичные ингибиторы. Отмечено снижение ферментативной активности в присутствие нитрофуранов и 1-хлор-2.4-динитробензола (CDNB). Ингибиторный анализ проводили с фурацилином (0.1 мг/мл) и CDNB (2 мМ) (Buzard, Kopko, 1964; Bilzer et al., 1984)
Для определения кинетических характеристик Km и Vm использовали грубые экстракты тканей и вакуолей. Кинетические параметры определяли для GSSG в отсутствии или присутствии CDNB. В среды вносили GSSG в конечной концентрации 0.0625–0.125–0.25–0.5 мМ и CDNB в концентрации 2 мМ. Для расчета Km и Vm применяли уравнения линейной регрессии и графический способ в системе обратных координат Лайнуивера-Берка.
Относительную активность GR выражали в нмолях субстрата на мг белка в мин. Количество белка определяли по методу Bradford (1976).
Зимографическим методом выявляли активность GR в полиакриламидном геле (PAAG). Электрофорез белков осуществляли с помощью стандартных методов в 7.5% PAAG при неденатурирующих условиях (Gaal et al. , 1980). Ферментативную активность в геле визуализировали двумя способами. Первый предусматривал развитие окраски в агаровом слое, который наносили на PAAG. Этот слой содержал: 200 мМ трис-HCl (pH 8.0); 1 мМ EDTA; 2 мМ 5.5'-дитиобис-2-нитробензойной кислоты (DTNB); 1мМ
GSSG, 0.5 мМ NADPH; 15 мг/мл агара. Разогретую до 45°C смесь наносили на гель, агар застывал и формировал слой, в котором в зонах локализации GR появлялось желтое окрашивание, вызванное образованием в ходе реакции 5-тио-2-нитробензойной кислоты (Levites, 1986). Другой способ предусматривал инкубацию гелей в темноте в реакционной среде: 0.25 М трис-HCl (рН 7.5); 3.4 мМ GSSG; 0.5 мМ NADPH; 1 мг/мл 3-(4.5-диметилтриазол-2-4)2.5-дифенилтетразолиум бромида (MTT); 1 мг/мл 2.6-дихлорофенолиндофенола (DCPIP) (Aravind et al. , 2005). В местах локализации GR появлялись синие полосы. Маркером ферментативных реакций служила GR из пекарских дрожжей (Sigma).
Для вестерн-блот анализа изоформ GR использовали поликлональные антитела мыши, полученные для GR пекарских дрожжей (Sigma). Иммунизацию мышей проводили в 2 этапа, вводя антиген внутрибрюшинно дважды с двухнедельным интервалом. Вводимый антиген объединяли с равным количеством полного адъюванта Фрейнда. После 50-60 дней иммунизации производили забор крови, содержащей поликлональные антитела (Catty, 1988).
Для разделения белков вакуолей и тканевого экстракта использовали метод изоэлектрического фокусирования (ИЭФ) в PAAG (Т 5%; С 3%). Гель содержал 10% глицерин и 3% амфолита (рН 3.510.5). Анолитом служила 0.06 N H3PO4, католитом – 0.1 N NaOH (Righetti,1983). После ИЭФ в геле определяли активность изоформ с помощью зимографического метода. Гели фотографировали. Затем осуществляли перенос белков из PAAG на нитроцеллюлозную мембрану. Вестерн-блот анализ проводили согласно общепринятому методу (Yannarelli et al., 2007). Первичные антитела мыши, как упоминалось, получали самостоятельно, а вторичные антитела мыши – производства фирмы Sigma. Так как вторичные антитела были конъюгированны с пероксидазой хрена, активность последней определяли в реакционном растворе, содержащем: 100 мМ цитратно-фосфатный буфер (рН 5.5), 0.01% Н2О2, 0.1 мМ о-диаминобензидин.
Полученные электрофореграммы фотографировали с помощью системы DigiDoc-It® Imaging System (“Bio-Rad”), а также сканировали на сканере марки Epson perfection 2480 Photo.
Все эксперименты выполнены в 4–5 биологических повторностях, каждая из которых была представлена тремя аналитическими. На графиках приведены средние арифметические значения и их квадратичные отклонения.
RESULTS
В вакуолярном содержимом клеток корнеплодов столовой свеклы впервые выявили глутатионредуктазную активность. Она оказалась довольно высокой и при нейтральном pH реакционной среды почти в 2 раза превосходила активность GR из тканевого экстракта (Рис. 2).
Предстояло установить специфичность обнаруженной ферментативной активности. Для этого применили ряд традиционных подходов, в числе которых ингибиторный анализ. Специфичных внутриклеточных ингибиторов или активаторов для GR не обнаружено. Показано ингибирующее действие некоторых нитрофуранов и ароматических нитросоединений (Bilzer et al., 1984). Из нитрофуранов в качестве ингибитора для GR, выявленной в вакуолях и тканях корнеплодов столовой свеклы, использовали фурацилин. В присутствии фурацилина ферментативная активность снижалась как в тканевом, так и вакуолярном экстракте (Рис. 2). Ингибирование вакуолярного фермента было более выраженным. Его активность снижалась в среднем на 50%, тогда как активность фермента из экстракта ткани – на 25%.
Эффективными ингибиторами GR принято считать ароматические нитросоединения. Например, для GR животных организмов в качестве неконкурентного ингибитора довольно часто используют CDNB (Bilzer et al., 1984). Это соединение подавляло активность GR вакуолей и тканевого экстракта (Рис. 2). Как показали результаты дальнейшего исследования, уровень снижения ферментативной активности с CDNB зависел от концентрации GSSG (данные не приводятся). С CDNB кинетические параметры изменялись, происходило снижение максимальной скорости (Vm) в среднем в 1.5 раза. Следует отметить, что, несмотря на снижение Vm, сродство к субстрату оставалось прежним, т.е. значения Km для GSSG практически не изменялись (Табл. 1). Графическое выражение полученных величин в обратных координатах Лайнуивера-Берка позволило определить тип взаимоотношений фермента и ингибитора как неконкурентное ингибирование (данные не приводятся). Известно, что неконкурентный ингибитор не мешает связыванию субстрата с ферментом. Он способен присоединяться как к свободному ферменту, так и к фермент-субстратному комплексу с одинаковой эффективностью. Такой ингибитор вызывает конформационные изменения, которые не позволяют ферменту превращать субстрат в продукт, но не влияют на сродство фермента к субстрату (Bilzer et al., 1984).
Флавинсодержащий фермент GR характеризуется выраженной зависимостью от pH-условий. Восстанавливая GSSG, GR в качестве субстрата может использовать как NADPH, так и NADH. Ферментативная активность с NADPH в несколько раз выше, чем с NADH (Vanoni et al. , 1990). Сродство фермента к пиридиннуклеотидам определяется условиями pH. Для эффективного взаимодействия с NADPH требуются нейтральные и слабощелочные условия, а с NADH – кислые (Shigeoka et al. , 1987; Rautenkranz et al. , 1994; Noctor et al. , 2011). Результаты исследования показали, что активность GR вакуолей и экстрактов тканей с NADPH была намного выше, чем с NADH. Оптимумы pH ферментативных реакций с NADPH приходились на 7.0-8.0, а с NADH – на 5.0 (Рис. 3 А, Б). Ранее обращали внимание на то, что при низких значениях pH уровни активности GR с NADPH и NADH как правило были одинаковыми
(Boggaram et al. , 1978). В наших экспериментах активность GR с NADPH и NADH при pH 5.0 также оказалась одинаковой, в среднем она составляла: 5 нмолей NAD(P)H/мг белка – у вакуолей; 6 нмолей NAD(P)H /мг белка – у экстрактов ткани (Рис. 3 А, Б).
Широко применяемый способ идентификации ферментативной активности – зимографический метод. Он позволяет выявлять активность фермента в PAAG после электрофореза, проводимого при неденатурирующих условиях (так называемого нативного электрофореза). Как уже упоминалось выше, применяли два способа выявления ферментативной активности в PAAG: в одном случае визуализация проходила с MTT и DCPIP (Рис. 4, I); в другом – с DTNB (Рис. 4, II). Широко используемый метод с MTT и DCPIP не отличался высокой специфичностью. В PAAG наряду с активностью GR могла проявляться активность других NADPH-дегидрогеназ (данные не приводятся). В то же время метод с DTNB был более специфичным (Levites, 1986). Однако этот метод менее популярен так как является довольно трудоемким. С помощью используемых методов в исследуемых образцах выявили по две зоны активности GR, которые по всей видимости соответствовали двум изоформам фермента. У вакуолярного и тканевого экстрактов зоны локализация изоформ GR в PAAG практически совпадали (Рис. 4). Хорошо были заметны различия в интенсивности окраски разных изоформ (Рис. 4, II). В вакуолярных образцах изоформа с высокой электроподвижностью (Rf 0.47) как правило была выражена слабее, чем изоформа с низкой электроподвижностью (Rf 0.36). Причинами наблюдаемого эффекта могли быть как разная активность изоформ, так и разное их количество в вакуолярном содержимом. У GR экстрактов ткани выраженность аналогичных изоформ (Rf 0.36 и Rf 0.047) была прямо
Величины Rf для изоформы GR пекарских дрожжей, которая в этом эксперименте служила контрольным вариантом, составляли: 0.33 – при окраске белка Кумасси R-250 (Рис. 4 а); 0.33-0.36 – при зимографическом определении (Рис. 4 б). Значения Rf одной из изоформ GR вакуолей и тканевого экстракта, отличающихся меньшей электроподвижностью (Rf 0.36), совпадали со значениями Rf для GR пекарских дрожжей.
противоположной (Рис. 4, II ).
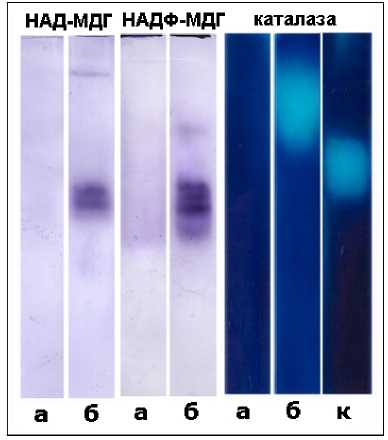
Figure 1. Активность НАД-малатдегидрогеназы, НАДФ-малатдегидрогеназы и каталазы в PAAG: а – вакуоли, б – тканевой экстракт, к – каталаза из бычьей сыворотки.
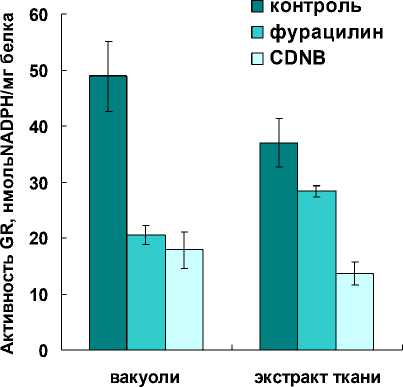
Figure 2. Активность глутатионредуктазы (GR) в вакуолях и тканевом экстракте, и ее ингибирование фурацилином (0.1 мг/мл) и CDNB (2 мМ).
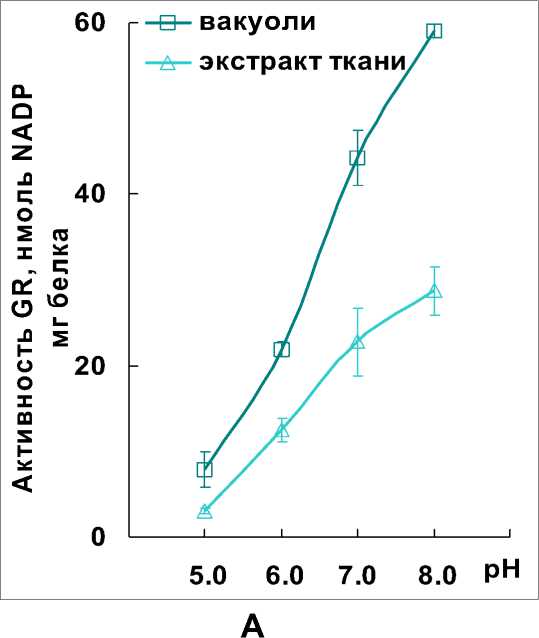
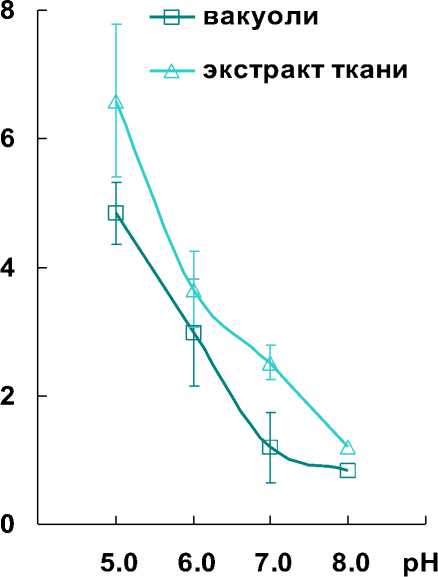
Figure 3. Изменение активности глутатионредуктазы (GR) в зависимости от pH-условий: А – с
NADPH. Б – с NADH.
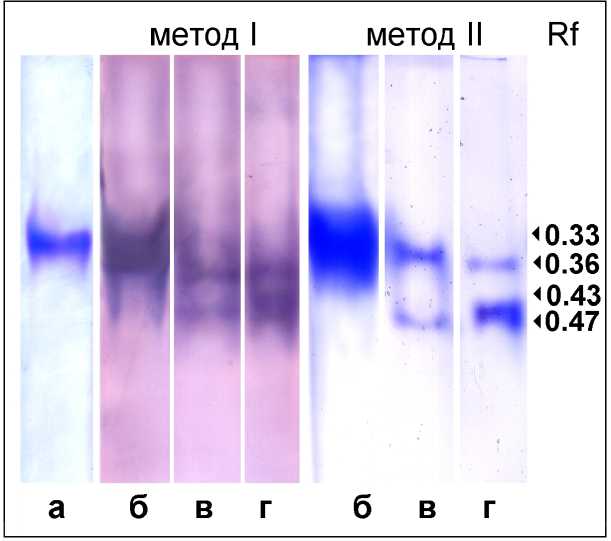
Figure 4. Определение активности глутатионредуктазы (GR) в PAAG двумя методами: метод I – с применением MTT и DCPIP; метод II – с DTNB. а – GR пекарских дрожжей, окрашенная Кумасси R-250, служила маркером электроподвижности; б – GR пекарских дрожжей в качестве маркера ферментативной активности; в – активность изоформ GR вакуолей; г – активность изоформ GR экстракта ткани.
Table 1. Кинетические параметры глутатионредуктазы
|
Объект исследования |
Контроль |
CDNB (2 мМ) |
||
|
Km, мкМ |
Vm, мкМ мин-1 |
Km, мкМ |
Vm, мкМ мин-1 |
|
|
Вакуоли |
16.2±2.9 |
113.4±18.5 |
16.3±1.6 |
78.7±6.9 |
|
Экстракт ткани |
20.6±4.9 |
60.9±9.2 |
21.1±2.9 |
36.7±6.1 |
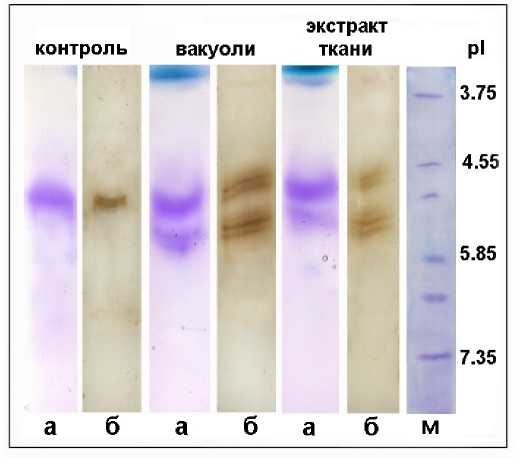
Figure 5. Изоэлектрическое фокусирование белков в PAAG (а) с последующим зимографическим окрашиванием c DTNB и (б) иммуноферментным анализом (Вестерн-блоттинг) с антителами на GR пекарских дрожжей. контроль – GR дрожжей. м – маркерные белки.
Зимографическое исследование активности фермента в PAAG проводили и после ИЭФ, в ходе которого разделение происходит не по молекулярным массам, а по величинам поверхностного заряда белков (Рис. 5 а). Как видно из рисунка, даже при таком разделении белков также формировались две зоны активности GR. Зоны раздваивались, что являлось особенностью метода ИЭФ. Все выявленные зоны ферментативной активности располагались в области p I ~ 4.0–5.0. После зимографического окрашивания эти же гели использовали для вестерн-блоттинга с антителами, полученными на
GR пекарских дрожжей. Результаты этого анализа подтвердили присутствие в вакуолях GR, которая также как и GR тканевого экстракта была представлена двумя изоформами (Рис. 5 б).
DISCUSSION
В клетках растений глутатион транспортируется в вакуоли в основном в дисульфидной форме (GSSG). Установлено, что скорость переноса GSSG заметно выше скорости переноса GSH (Tommasini et al., 1993; Noctor et al., 2011). Транспорт GSSG в вакуоли может усиливаться при окислительном стрессе (Queval et al., 2011). Высказывалось предположение о важной роли вакуолей в поддержании редокс-статуса глутатиона в растительной клетке (Tommasini et al., 1993). В качестве основного пути метаболизма транспортируемого в вакуоль GSSG рассматривали его гидролиз до аминокислот вакуолярными ферментативными системами (Tommasini et al., 1993; Zechmann et al., 2006; Queval et al., 2011). Однако при этом неоднократно отмечали преобладание восстановленного пула глутатиона над окисленным (Noctor et al., 2011), что могло указывать на другой путь метаболизма, а именно, на активное восстановление GSSG до GSH. Главную роль в поддержании восстановленного пула глутатиона играют специфичные глутатионредуктазы, имеющие высокое сродство к GSSG и NADPH. В клетках растений GR, т.е. изоформы этого фермента обнаружены в цитозоле, пластидах, митохондриях и пероксисомах (Noctor et al., 2011). В вакуолярном содержимом также выявлена глутатионредуктазная активность, однако сведений о ней крайне мало (Rautenkranz et al., 1994). Известно только то, что в проростках ячменя (Hordeum vulgare L.) активность GR вакуолей в несколько раз ниже активности GR хлоропластов и экстрактов ткани (Rautenkranz et al., 1994). Эти данные не соответствовали данным, полученным для GR вакуолей клеток корнеплодов столовой свеклы, активность которой была довольно высокой и при определенных условиях превосходила активность GR экстрактов ткани.
В целом GR корнеплодов столовой свеклы практически не отличалась от GR других растительных организмов. Ее оптимумы рН совпадали с оптимумами рН GR других растений. У разных организмов оптимумы рН для GR с NADPH обычно находятся в пределах 7.0–8.0. Например, для GR клеток игл сосны (Pinus strobus L.) оптимальными были рН 7.25–7.75, а эвглены (Euglena viridis) – pH 8.2 (Shigeoka et al., 1987; Anderson et al., 1990). Следует отметить, что GR не всех организмов взаимодействовали с NADH как с альтернативным донором электронов. Например, для GR эвглены донором электронов являлся только NADPH (Shigeoka et al., 1987). Тогда как для GR шпината (Spinacia oleracea L.), дрожжей (Saccharomyces cerevisiae) и Escherichia coli при восстановлении GSSG наряду с NADPH субстратом служил и NADH (Vanoni et al., 1990). Для GR клеток корнеплодов столовой свеклы, как показали результаты, NADH также являлся альтернативным донором электрона.
Ингибиторный анализ необходим для определения специфичности ферментативных реакций. Как упоминалось выше, для GR не установлены природные или узко специфичные ингибиторы. Однако показано ингибирующее действие некоторых широко используемых соединений. Так для GR животных был установлен неконкурентный тип ингибирования CDNB. Высказывалось предположение, что ингибитор связывается с GR в одном из промежуточных состояний, в которое фермент переходит в ходе катализа (Pai, Schulz, 1983; Bilzer et al., 1984). Также установлено, что CDNB при длительном инкубировании приводит к необратимому подавлению фермента. Следует отметить, что CDNB часто используют в качестве модельного субстрата для глутатион-S-трансфераз (GST), которые катализируют конъюгацию соединения с GSH. Ранее в вакуолярном содержимом клеток корнеплодов столовой свеклы была обнаружена GST, проявляющая довольно высокую активность с CDNB (Pradedova et al., 2010). В водных экстрактах вакуолей и тканей из-за участия CDNB в реакциях конъюгации выраженное ингибирующее действие можно было ожидать только при более высоком содержании соединения. Возможно в связи с этим заметный эффект CDNB отмечен при концентрации 2 мМ. Тогда как на других объектах показана высокая эффективность CDNB при более низких концентрациях. Например, в тех случаях, когда изучали подавление CDNB активности очищенной GR из клеток животных, ингибитор использовали в мкмолярных концентрациях. Так в реакционных условиях с 200 мкМ GSSG, 100 мкМ NADPH и 50 мкМ CDNB активность GR клеток печени крыс снижалась в среднем на 25% (Bilzer et al., 1984). В наших экспериментах при концентрациях CDNB, которые были на несколько порядков выше, происходило снижение активности в среднем на 60%. CDNB является неконкруентным ингибитором, он не конкурирует в виде глутатионового S-конъюгата с GSSG за место связывание в активном центре фермента. Следует отметить, что эффективная концентрация CDNB (2 мМ) значительно превышала внутриклеточную концентрацию субстрата GSSG (определяемую в мкмолях), обычно это характерно для аллостерического ингибиторования (Bilzer et al., 1984).
Специфичность ферментативных реакций также подтвердили результаты зимографического и иммуноферментного исследования. Локализация GR в PAAG практически совпадала с локализацией маркера – GR пекарских дрожжей с молекулярной массой 118 кДа. В отличие от GR дрожжей, фермент вакуолей и экстрактов ткани корнеплодов столовой свеклы был представлен двумя изоформами. Две изоформы (GRA и GRB) идентифицированы в листьях Pinus strobus (Anderson et al. , 1990). У Arabidopsis thaliana тоже определены две изоформы GR, кодируемые аллельными генами (Marty et al. , 2009). У Triticum aestivum две изоформы GR выявлены в листьях, тогда как в корнях оказалось три изоформы (Yannarelli et al. , 2007).
Значения pI для выявленных в вакуолях изоформ GR находились в пределах 4.0–5.0. Близкие значения получены для GR других видов растений, у которых обнаруживали две и более изоформ этого фермента с pI от 4.1 до 4.9 (Edwards et al., 1990; Anderson et al., 1995; Marty et al., 2009). Несмотря на существенные различия в изоферментном составе, для GR разного происхождения характерна высокая степень гомологии аминокислотной последовательности апофермента (Contour-Ansel et al., 2006). Кроме того, третичная структура GR, включающая четыре домена, у ферментов разных организмов крайне консервативна (Rao, Reddy 2008). Поэтому антитела, полученные для GR дрожжей, оказались специфичными для GR растительного объекта. Сходство в электроподвижности с GR дрожжей и взаимодействие с антителами, полученными для нее, говорит о том, что вакуолярные изоформы GR близки по третичной структуре к изоформе GR дрожжей.
В целом результаты ингибиторного, зимографического и иммуноферментного анализа подтвердили присутствие GR в вакуолях. Фермент вакуолярной локализации при определенных условия способен довольно эффективно восстанавливать GSSG до GSH. По всей видимости, транспортируемый в вакуоль GSSG не просто депонируется в этом компартменте, а после восстановления вовлекается во внутривакуолярные метаболические процессы.
ACKNOWLEDGMENT
Работа выполнена при поддержке Российского фонда фундаментальных исследований и Правительства Иркутской области, проект № 14-4404059 р_сибирь_а.
Список литературы Глутатион-редуктаза вакуоли. Сравнение активности глутатионредуктазы вакуолей и тканевого экстракта красной свеклы (Beta vulgaris L.)
- Abhilash P.C., Jamil S., Singh N. (2009) Transgenic plants for enhanced biodegradation and phytoremediation of organic xenobiotics. Biotechnology Advances, 27, 474-488
- Anderson J.V., Hess J.L., Chevone B. (1990) Purification, Characterization, and Immunological Properties for Two Isoforms of Glutathione Reductase from Eastern White Pine Needles. Plant Physiol., 94, 1402-1409
- Aravind P., Narasimha M., Prasad V. (2005) Modulation of cadmium-induced oxidative stress in Ceratophyllum demersum by zinc involves ascorbate-glutathione cycle and glutathione metabolism. Plant Physiol. Biochem., 43, 107-116
- Bilzer M., Krauth-Siegel R.L., Schirmer R.H., Akerboom T.P.M., Sies H., Schulz G.E. (1984) Interaction of a glutathione S-conjugate with glutathione reductase Kinetic and X-ray crystallographic studies. Eur. J. Biochem., 138, 373-378
- Boggaram V., Larson K., Mannervik B. (1978) Characterization of glutathione reductase from porcine erythrocytes. Biochim. Biophys. Acta, 527, 337-347
- Bradford M. (1976) A rapid and sensitive method for the quantitation of protein utilising the principal of protein-dye binding. Anal. Biochem., 72, 248-254
- Buzard J.A., Kopko F. (1963) The Flavin Requirement and Some Inhibition Characteristicsof Rat Tissue Glutathione Reductase. J. of Biol. Chemistry, 238, 464-468
- Carlberg I., Mannervik B. (1985) Glutathione reductase. Methods Enzymol. 113, 484-490
- Catty D. (1988) Antibodies, Volume 1: A practical approach. D. Catty (ed), IRL Press: Oxford and Washington, 203 p
- Dixon D.P., Cummins I., Cole D.J., Edwards R. (1998) Glutathione-mediated detoxification systems in plants. Current Opinion in Plant Biology., 1, 258-266
- Edwards G.E., Nakamoto H., Bunell J.N., Hatch M.D. (1985) Pyruvate, Pi dikinase and NADP-malate dehydrogenase in C4 photosynthesis: properties and mechanism of light/dark regulation. Annu. Rev. Plant Physiol., 36, 255-286
- Edwards E.A., Rawsthorne S., Mullineaux P.M. (1990) Subcellular distribution of multiple forms of glutathione reduetase in leaves of pea (Pisum sativum L.). Planta, 180, 278-284
- Gaal O., Medgyesi G.A., Vereczkey L. (1980) Electrophoresis in the separation of biological macromolecules. New York: John Wiley & Sons Ltd, 422 p
- Kulinskiy V.I., Kolesnichenko L.S. (2009) System of glutathione I. Synthesis, transport, glutathione transferase, glutathione peroxidase. Biomedical Chemistry, 55, 255-277
- Levites E.V. (1986) Genetics of plant isozymes. Nauka: Sibir. Dep., 144 p
- Marty L., Siala W., Schwarzlander M., Fricker M.D., Wirtz M., Sweetlove L.J., Meyer Y., Meyer A.J., Reichheld J.P., Hell R. (2009) The NADPH-dependent thioredoxin system constitutes a functional backup for cytosolic glutathione reductase in Arabidopsis. Proc. Natl. Acad. Sci. U.S.A., 106, 9109-9114
- Noctor G., Queval G., Mhamdi A. Chaouch S., Foyer C.H. (2011) Glutathione. The Arabidopsis Book. Published By: The American Society of Plant Biologists 9, 2-32. URL: http://www.bioone.org/doi/full/10.1199/tab.0142
- Pai E.F., Schulz G.E. (1983) The catalytic mechanism of glutathione reductase as derived from X-ray diffraction analyses of reaction intermediates. J. Biol. Chem., 258, 1752-1757
- Pradedova E.V., Tolpygina O.A., Isheeva O.D., Putilina T.E., Salyaev R.K. (2010) Glutathione and glutathione-S-transferase activities of the vacuoles of the beet roots (Beta vulgaris L.). Doklady Biological Sciences, 433, 275-278
- Queval G., Jaillard D., Zechmann B., Noctor G. (2011) Increased intracellular H2O2 availability preferentially drives glutathione accumulation in vacuoles and chloroplasts. Plant Cell and Environ., 34, 21-32
- Rao C., Reddy A.R. (2008) Glutathione reductase: a putative redox regulatory system in plant cells/Sulfur assimilation and abiotic stress in plants. N.A. Khan, S. Singh, S. Umar (ed). The Netherlands: Springer-Verlag,111-147
- Rautenkranz A.F., Li L., Machler F., Martinoia E., Oertli J. J. (1994) Transport of Ascorbic and Dehydroascorbic Acids across Protoplast and Vacuole Membranes Isolated from Barley (Hordeum vulgare l. cv Gerbel) Leaves. Plant Physiol., 106, 187-193
- Righetti P.G. (1983). Isoelectric Focusing: Theory, Methodology and Applications. Elsevier: Amsterdam, 385 c
- Salyaev R.K., Kuzevanov V.Y., Khaptogaev S.B. and Kopytchuk V.N. (1981) Isolation and purification of vacuoles and vacuolar membranes from plant cells. Russ. J. Plant Physiol., 25, 1295-1305
- Shigeoka S., Onishi T., Nakano Y. and Kitaoka S. (1987) Characterization and physiological function of glutathione reductase in Euglena gracilisz. Biochem. J., 242, 511-515
- Tommasini R., Martinoia E., Grill E., Dietz K.J. and Amrhein N. (1993) Transport of oxidized glutathione into barley vacuoles: evidence for the involvement of the glutathione-S-conjugate ATPase. Zeitschrift Naturforsch., 48, 867-871
- Vanoni M.A., Wong K.K., Ballou D.P. and Blanchard J.S. (1990) Glutathione reductase: comparison of steady-state and rapid reaction primary kinetic isotope effects exhibited by the yeast, spinach, and Escherichia coli enzymes. Biochemistry, 29, 5790-5796
- Yannarelli G.G., Fernandez-Alvarez A.J., Santa-Cruz D.M. and Tomaro M.L. (2007) Glutathione reductase activity and isoforms in leaves and roots of wheat plants subjected to cadmium stress. Phytochemistry, 68, 505-512
- Zechmann B., Zellnig G. and Muller M. (2006) Immunocytochemical localization of glutathione precursors in plant cells. J. Electron Microscopy, 55, 173-181


