Гормональный и липидный дисбаланс в формировании миопической хориоретинальной неоваскуляризации у женщин
Автор: Григорьева А.В., Щуко А.Г., Курсакова Ю.В., Иванова Е.И., Самсонов Д.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: определить роль гормонального и липидного дисбаланса в формировании миопической хориоретинальной неоваскуляризации у женщин. Материал и методы. В первую клиническую группу включены результаты исследования пациенток с активной формой хориоретинальной неоваскуляризации (ХНВ), во вторую - результаты исследования их парного глаза. Отдельно сформированы группы контроля. Всем пациенткам и лицам групп контроля проведено всестороннее обследование офтальмологического и соматического статуса. Результаты. Установлено повышение уровня пролактина до 501,7±28,2 мМЕ/мл, в группе контроля до 272,9±33,4 мМЕ/мл; уровня фолликулостимулирующего гормона до 13,0±0,1 мМЕ/мл, в группе контроля до 4,6±1,2 мМЕ/мл. Концентрация эстрадиола снижена до 35,2±3,1 пг/л, прогестерона до 2,8±0,1 нмоль/л, в сравнении с группой контроля, где значения данных гормонов составили соответственно 66,8±8,1 и 6,3±1,1 нмоль/л. Выявлено повышение уровня острофазовых белков: фибриногена в 3,8 (14,0±0,5) и С-реактивного белка в 2 раза (5,7±2,3) по сравнению с группой контроля, где значения данных белков составило соответственно 3,6±0,5 и 2,5±0,7. Наблюдалось повышение уровня липопротеина (а) до 50,2±1,2 г/л и АпоВ/АпоА до 0,6±0,1 г/л по сравнению с группой контроля, где данные показатели составили 9,1±1,1 и 0,4±0,1 г/л. Заключение. Полученные данные подтверждают патогенетическую значимость системных факторов риска в развитии хориоидальной дисфункции и, как следствие, формирование хориоретинальной неоваскуляризации.
Гипоэстрогенемия, миопия, оптическая когерентная томография
Короткий адрес: https://sciup.org/149135321
IDR: 149135321 | УДК: 617.753:612.018
Текст научной статьи Гормональный и липидный дисбаланс в формировании миопической хориоретинальной неоваскуляризации у женщин
корригированная миопия создает трудности при выполнении зрительной работы, снижает профессиональную адаптацию и ухудшает качество жизни [1]. По оценкам T. Y. Wong (2014), патологическая миопия поражает до 3% населения мира [2].
Основной причиной необратимого снижения зрительных функций у пациентов с близорукостью является формирование дегенеративных процессов центральных отделов сетчатки на фоне хориоидальной неоваскуляризации. Распространенность миопической хориоретинальной неоваскуляризации (мХНВ) достигает 5,2% и в 34% случаев поражает оба глаза [3]. В 35% случаев отмечено двустороннее развитие
ХНВ у пациентов с миопией, парный глаз поражался в течение 8 лет [4]. Миопическая ХНВ составляет до 62% от всех видов ХНВ, возникающих у этих пациентов [5], и демографические исследования подтверждают, что это чаще заболевание среднего, чем пожилого возраста [6].
Золотым стандартом лечения мХНВ является своевременное интравитреальное введение ингибиторов ангиогенеза. Однако механизмы анти-VEGF-терапии при этом заболевании до сих пор до конца не выяснены. Отсутствуют единые схемы лечения и прогностические критерии, определяющие эффективность и резистентность терапии, возможность формирования рецидивов и развития патологического процесса на парном глазу.
Цель: определить роль гормонального и липидного дисбаланса в формировании миопической хориоретинальной неоваскуляризации у женщин.
Материал и методы. Исследование проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» (1964 г., с поправками 2000 г.) и «Правилами клинической практики в Российской Федерации» (приказ Минздравсоцразвития РФ №266 от 19.06.2003 г.). Письменное информированное согласие получено от всех пациентов. Работа состояла из двух этапов. Первый этап: ретроспективный анализ историй болезни пациентов с диагнозом «миопия», обратившихся за диагностикой и лечением в ИФ МНТК «Микрохирургия глаза» с 2006 по 2017 г. Второй этап: проспективное нерандомизированное обследование пациентов с диагнозом «миопическая хориоретинальная неоваскуляризация».
В первую клиническую группу включены пациентки с активной формой ХНВ (n=25), средний возраст 33,5±5,1 года. Вторую клиническую группу составили результаты обследования парного глаза в том случае, если в нем отсутствовали признаки хориоретинальной неоваскуляризации (n=15), средний возраст 33,5±5,1 года. В связи с тем что в 25% случаев наблюдался двусторонний процесс, количество объектов исследования в первой и второй группах отличалось. Отдельно сформированы группы контроля. Участники первой группы контроля были сопоставимы с основной клинической группой по возрасту и степени миопии: n=21, средний возраст 33,6±4,7 года. Вторую группу контроля составили женщины с эмметропией (n=22), средний возраст 33,6±0,5 года. Все пациентки с мХНВ получали анти-VEGF-терапию в режиме «по потребности». Наблюдение проводилось в течение 12 месяцев.
Для всесторонней оценки структурно-функционального состояния зрительной системы применялись стандартные офтальмологические исследования, а также оптическая когерентная томография (ОКТ) и оптическая когерентная томография в сосудистом режиме (ОКТА) (RTVue XR Avanti; Optovue, USA), флюоресцентная ангиогафия (FA Topcon TRС-50DX, Japan).
Для исследования центральных отделов сетчатки использовали протокол сканирования Retina Map, с помощью которого оценивали толщину сетчатки от ретинального пигментного эпителия (РПЭ) до внутренней пограничной мембраны (ВПМ). Структуру хориоидеи оценивали в протоколе Сross Line, выполненном через центр фовеа в горизонтальном и вертикальном меридианах. Измерения проводили в 5 точках по стандартной методике от наружной границы пигментного эпителия до внутренней границы склеры в проекции фовеа, пара-фовеа и перифовеа с шагом в 500 мкм с назальной и темпоральной сторон.
Структуру хориоидеи оценивали с учетом сегментации на 3D-сканах и En Face [7]. Площадь мХНВ измеряли вручную с использованием стандартных функций прибора ОКТА. Данные флюоресцентной ангиографии и ОКТА использовали в качестве основных критериев диагностики ХНВ, определения ее активности и показаний к лечению.
Изучение концентрации гормонов проводилось с целью оценки уровня стрессорных реакций и гормональных изменений, определяющих нарушение репродуктивных функций. Исследование гормонального статуса включало определение концентрации соматотропного (СТГ), фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ), тиреотропного (ТТГ) гормонов, пролактина, тестостерона, 17-ОН прогестерона, прогестерона, эстрадиола, трийодтиронина (Т3), тироксина или тетрайодтиронина (Т4). Исследование проводили методом твердофазного ИФА (Im-munochem-2100 Microplate Reader, USA). Кроме того, изучали липидограмму второго уровня с определением липопротеина (а), соотношения АпоА/АпоВ (Accent-200 Cormay, Poland), коагулограммы (Helena C-2, UK), показателей окислительного стресса (Formplus Callegari, Italy). Забор крови для исследования проводился из локтевой вены у женщин с сохраненным менструальным циклом с 5-го по 9-й день.
Статистический анализ полученных результатов исследования проводился с использованием пакета прикладных программ Statistica 6.0 и включал дескриптивный и корреляционный анализ. Показатели групп проверены на нормальное распределение по критерию Колмогорова — Смирнова. Рассчитывали среднее значение (М), стандартное отклонение (s), ошибку средней (m). Вариационные ряды сравнивались с применением критерия Манна — Уитни, критерия Уилкоксона и Z-критерия. Выбранный критический уровень значимости равнялся 5% (
P
<0,05). Корреляционный анализ по методу Спирмена позволил определить фактическую степень параллелизма между двумя количественными рядами изучаемых признаков и оценить тесноту установленной связи с помощью количественно выраженного коэффициента. Сила, степень или теснота корреляционной связи определялись по абсолютному значению коэффициента корреляций и не зависели от ее направленности. При коэффициенте r>0,7 связь считалась высокой, при 0,5
Результаты. Установлено, что группу больных составляли в преобладающем большинстве женщины репродуктивного возраста (91,8%). Это послужило основанием включить в основную клиническую группу исследования пациентов именно женского пола, изучая у них концентрации основных гормонов.
Результаты сравнительного анализа показали, что у пациенток основной клинической группы длина глазного яблока варьировалась от 26,5 до 30,0 мм, но в 75% случаев преобладала выраженная элонгация глазного яблока более 28 мм.
Формирование мХНВ закономерно сопровождалось снижением центральной корригированной остроты зрения в среднем до 0,3±0,9, что в 2 раза ниже значений парного «условно здорового» глаза, в 2,6 раза ниже значений группы контроля у лиц с миопической рефракцией и в 3,3 раза ниже контроля с эмметропией (рис. 1).
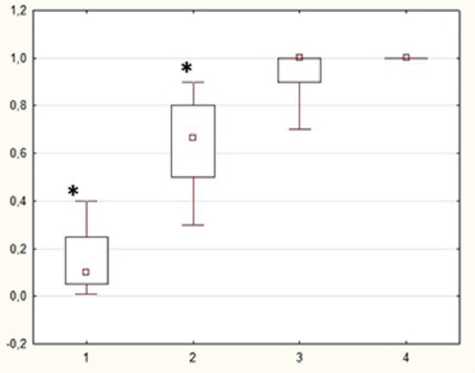
Рис. 1. Изменение корригированной остроты зрения: МКОЗ — максимальная корригированная острота зрения; 1 — основная клиническая группа; 2 — группа сравнения (парный «условно здоровый» глаз); 3 — контроль (миопическая рефракция); 4 — контроль (эмметропия); * — p<0,01
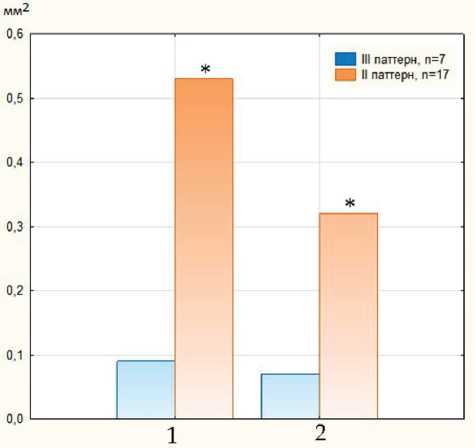
Рис. 2. Оценка площади хориоретинальной неоваскулярной мембраны: 1 — выделенная область (select area); 2 — выделенный сосуд (select vessel); * — p<0,01
Всесторонняя оценка структуры хориоретинального комплекса позволила выявить следующее: в 24% случаев пациенты с мХНВ имели так называемый мозаичный, или паркетный, тип глазного дна, причиной формирования которого является частичная утрата пигментного эпителия и хориокапилляр-ного слоя. У пациентов группы контроля при миопической рефракции такие изменения встречались лишь в 5% случаев, а у эмметропов не выявлены ни в одном случае. Кроме того, у пациенток основной клинической группы как на больном в 72% случаев, так и на парном «условно здоровом» глазу в 66,7% случаев офтальмоскопировались так называемые «лаковые трещины», происхождение которых связано с механическим повреждением комплекса «пигментный эпителий — стекловидная пластинка — хориокапилляры». У группы контроля с миопией такие изменения выявлены лишь у 5% пациентов, а при эмметропии также отсутствовали. При офтальмоскопии на глазах с мХНВ визуализировался небольшой очаг, расположенный в 95% случаев юкстафовеолярно, активность которого подтверждалась данными ФАГ.
Обращало на себя внимание выраженное уменьшение толщины хориоидеи, как на глазах с ХНВ, так и на парных «условно здоровых» глазах. В основной клинической группе практически в 3 и 4 раза по сравнению с группами контроля (p=0,01), на парном глазу в 2 раза по сравнению с контролем. У каждой 8-й пациентки основной клинической группы толщина хори-оидеи не превышала 50 мкм, что свидетельствовало о серьезных дистрофических процессах, лежащих в основе хориоретинальной ишемии.
Оценка относительной плотности сосудистого сплетения в режиме ОКТ-ангио продемонстрировала отсутствие статистически достоверных отличий данного показателя в поверхностном сосудистом сплетении, как у лиц основной клинической группы, так и лиц групп сравнения. В то же время установлено уменьшение относительной плотности глубокого сосудистого сплетения на глазах с мХНВ на 20% и более чем на 30% по сравнению с группами контроля с миопией и эмметропией соответственно в проекции парафовеолярной области.
У всех пациенток с мХНВ на уровне хориокапил-ляров и наружной сетчатки диагностирована классическая субретинальная неоваскулярная мембрана (II типа). В ходе исследования установлено, что в преобладающем большинстве случаев ХНВ соответствовала 2-му типу паттернов так называемой «sea fan» по классификации Elsa Bruyère (2018), для которого характерно наличие фидерного сосуда и хорошо визуализирующиеся сосудистые петли, которые окаймлены темным ореолом, соответствующим зонам ишемии хориокапилляров. Менее чем в 30% случаев строение ХНВ соответствовало третьему типу паттерна и имело вид «tree-in-bud», для которого характерна плотная сосудистая сеть, при котором фидерный сосуд и ореол не визуализировались или слабо визуализировались. При этом площадь так называемой выделенной области, соответствующая СНМ и выделенной площади сосудов при втором типе паттерна, превышала соответствующее значение третьего типа паттерна практически в 5 раз (рис. 2).
Тщательный сбор анамнеза vitae, исследование концентрации гормонов и биохимических показателей крови позволили установить, что пациентки основной клинической группы имели выраженные нарушения менструально-овариального цикла по типу опсо- и олигоменореи. Сравнительный анализ концентрации изучаемых гормонов в сыворотке крови обнаружил отсутствие патологических изменений в показателях тиреотропных гормонов, кортизола и СТГ, ЛГ, тестостерона.
В то же время установлены значимые изменения половых гормонов: пролактина в 1,5 раза, а ФСГ в 3 раза превышал значения групп контроля.
Концентрация эстрадиола была снижена в полтора раз и прогестерона в 2 раза, что свидетельствует о дисбалансе основных половых гормонов у пациенток с ХНВ (табл. 1).
Анализ биохимических показателей крови установил у пациенток с мХНВ повышение уровня острофазовых белков, являющихся лабораторными маркерами воспаления и тканевого повреждения: фибриногена в 3,8 раза и С-реактивного белка в 2,5 раза по сравнению с группами контроля.
Таблица 1
Сравнительный анализ концентрации гипофизарных и половых гормонов в сыворотке крови, M±m
|
Показатель |
Миопическая ХНВ1, n=25 |
Контроль, миопия, рефр. 2, n=21 |
Контроль, эмметропия, рефр. 3, n=22 |
Критерий Манна–Уитни, р |
|
Пролактин, мМЕ/мл |
501,7±28,2 |
341,0±81,1 |
272,9±33,4 |
р 1–2, 2–3, 1–3 =0,001 |
|
ФСГ, мМЕ/мл |
13,0±0,1 |
5,6 ±1,4 |
4,6±1,2 |
р 1–2, 2–3, 1–3 =0,001 |
|
Эстрадиол, пг/л |
35,2±3,1 |
59,0±5,1 |
66,8±8,1 |
р 1–2, 2–3, 1–3 =0,001 |
|
Прогестерон, нмоль/л |
2,8±0,1 |
4,0±1,7 |
6,2±1,1 |
р 1–2, 2–3, 1–3 =0,001 |
|
Таблица 2 |
||||
|
Сравнительный анализ концентрации острофазовых белков и липопротеинов 2-го уровня в сыворотке крови, M±m |
||||
|
Показатель |
Миопическая ХНВ1, n=25 |
Контроль, миопия, рефр. 3, n=21 |
Контроль, эмметропия рефр. 4, n=22 |
Критерий Манна–Уитни, р |
|
Фибриноген, г/л |
14,0±0,5 |
3,6±0,5 |
3,6±1,1 |
р 1-2 =0,04; p 2-3 =0,5; p1-3=0,04 |
|
С-реактивный белок, г/л |
5,7±2,3 |
2,5±0,7 |
1,9±0,7 |
р 1-2 =0,05; p 2-3 =0,6; p1-3=0,04 |
|
Липопротеин (а), г/л |
50,2±1,2 |
13,7±0,9 |
9,1±1,1 |
p 1-2 <0,01; p 2-3 =0,3; p1-3<0,01 |
|
АпоВ/АпоА, г/л |
0,6±0,1 |
0,4±0,1 |
0,4±0,1 |
p 1-2 =0,01; p 2-3 =0,5; р1-3=0,001 |
Таблица 3
Корреляционный анализ показателей, характеризующих изменения липидного и гормонального профиля и аксиальной длины глазного яблока у больных с мХНВ
|
Показатель |
ПЗО |
Толщина хориоидеи, мкм |
Пролактин, мМЕ/л |
Эстрадиол, пг/мл |
Прогестерон, нмоль/л |
Липопр. (а), г/л |
АпоВ/АпоА, г/л |
Фибриноген, г/л |
|
ПЗО |
1,00 |
–0,44 |
–0,06 |
0,03 |
0,35 |
0,00 |
–0,11 |
0,40 |
|
Толщина хориои-деи, мкм |
–0,44 |
1,00 |
–0,43 |
0,40 |
–0,06 |
0,09 |
–0,23 |
–0,03 |
|
Пролактин, мМЕ/л |
–0,06 |
–0,43 |
1,00 |
–0,64 |
–0,58 |
0,06 |
0,58 |
–0,07 |
|
Эстрадиол, пг/мл |
0,03 |
0,40 |
–0,64 |
1,00 |
0,11 |
–0,64 |
–0,60 |
–0,45 |
|
Прогестерон, нмоль/л |
0,35 |
–0,06 |
–0,58 |
0,11 |
1,00 |
0,13 |
–0,05 |
0,37 |
|
Липопр. (а), г/л |
0,00 |
0,09 |
0,06 |
–0,64 |
0,13 |
1,00 |
–0,26 |
0,63 |
|
АпоВ/АпоА, г/л |
0,32 |
–0,23 |
0,58 |
–0,60 |
–0,05 |
–0,26 |
–0,01 |
–0,09 |
|
Фибриноген, г/л |
0,40 |
–0,03 |
–0,07 |
–0,45 |
0,37 |
0,63 |
–0,09 |
1.00 |
П р и м еч а н и е : ПЗО — переднезадняя ось (аксиальная длина глазного яблока); желтым цветом выделены корреляции с r>0,4 (p<0,001).
На современном этапе еще одними высокочувствительным маркёрами и предикторами наследственной предрасположенности к сердечно-сосудистым и микрососудистым заболеваниям являются липопротеин (а) и аполипопротеины.
У больных с мХНВ выявлено практически шестикратное повышение концентрации липопротеина (а) и умеренное повышение соотношения АпоВ/АпоА (табл. 2).
Корреляционный анализ между показателем, характеризующим степень миопии (длина глазного яблока), толщиной хориоидеи и основными критериями исходной реактивности организма, показал наличие достоверных взаимосвязей у больных с мХНВ между толщиной хориоидеи, концентрацией пролактина, эстрадиола и их взаимосвязь с липопротеином (а), соотношением АпоВ/АпоА и фибриногеном, что отсутствовало у пациенток групп контроля (табл. 3).
Полученные данные подтверждают патогенетическую значимость не только местных, но и системных факторов риска в развитии хориоидальной дисфункции и, как следствие, формирование ХНВ.
Обсуждение. Выявлены выраженная дезорганизация хориоидеи, нарушение сегментации, изменение калибра и хода сосудов среднего и крупного калибра. Сегментация хориоидеи на парном «условно здоровом» глазу была частично сохранена. В группах контроля подобные изменения отсутствовали. Такое нарушение толщины и топографии сосудистой сети является важным фактором, позволяющим говорить о выраженных гемодинамических расстройствах у больных с мХНВ, которые обусловливали грубые дистрофические изменения ретинального пигментного эпителия, наружных слоев сетчатки.
Таким образом, выявленные изменения у пациенток основной клинической группы как на глазу с ХНВ, так и на парном «условно здоровом» глазу можно рассматривать как местные факторы риска и особенности формирования данного заболевания.
Известно, что недостаточность эстрогена запускает процессы эндотелиальной дисфункции и инициирует явления вазоспазма. В то же время эстроген снижает уровень воспалительных процессов в сосудистой стенке, стимулирует релаксацию сосудов путем стимуляции и высвобождения оксида азота и воздействует непосредственно на гладкую мускулатуру сосудистой стенки [8].
Результаты, полученные в работах K. Kobayashi (2002), показали наличие рецепторов эстрогена в СНМ у больных с миопией [9]. Следовательно, ги-поэстрогенемия и гормональный дисбаланс в целом являются важным механизмом сосудистых изменений формирования ХНВ.
Сходство строения липопротеина (а) и белков острой фазы позволяет рассматривать его как специфический белок, характеризующий наличие и степень воспалительных процессов в сосудистой стенке. При этом повышение данных показателей и изменения соотношения АпоВ/АпоА-1 характеризует повышенный риск развития атеросклерза и ишемических инсультов даже при низких уровнях ЛПНП и холестерина крови.
Заключение. Таким образом, результаты проведенного исследования показали, что к ключевым местным факторам риска формирования ХНВ у больных с миопией можно отнести наличие дефектов комплекса «пигментный эпителий — стекловидная пластинка — хориокапилляры» на фоне элонгации глазного яблока. Кроме того, одним из основных звеньев патогенеза данного заболевания является выраженная хориоидальная дисфункция, выявленная на обоих глазах у пациентов с мХНВ. Данные структурные и гемодинамические изменения обусловливают дистрофические изменения пигментного эпителия и нейросенсорной сетчатки. В то же время отсутствие подобных изменений у лиц контрольной группы с миопической рефракцией указывает на то, что триггером к формированию данных изменений является исходно измененная реактивность организма, о чем свидетельствуют высокий уровень липопротеина (а) и соотношение аполипротеинов.
Гипоэстрогенемия и дисбаланс половых гормонов являются серьезными предрасполагающими факторами формирования васкулярных осложнений: с одной стороны, формирования эндотелиальной дисфункции, а с другой — длительного вазоспазма. При этом хориоидея выступает органом-мишенью в реализации патологического процесса, а хориоидальная ишемия инициирует формирование СНМ, которая, как было вы- яснено, преимущественно протекает по второму типу с формированием паттерна «seafan».
Список литературы Гормональный и липидный дисбаланс в формировании миопической хориоретинальной неоваскуляризации у женщин
- Юрьева Т. Н., Григорьева А. В., Пятова Ю. С. Миопия и ее осложнения. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук 2015; 6 (106): 75-82
- Wong T Y, Ferreira A, Hughes R, et al. Epidemiology and disease burden of pathologic myopia and myopic choroidal neovascularization: an evidence-based systematic review. Am J Ophthalmol 2014; 157: 9-25
- Ohno-Matsui T. Myopic Choroidal Neovascularization. In: Ophthalmology: Ocular Angiogenesis: Diseases, Mechanisms, and Therapeutics. Springer Nature Switzerland, 2006; p. 430-86
- Ohno-Matsui K, Yoshida T, Futagami S, et al. Patchy atrophy and lacquer cracks predispose to the development of choroidal neovascularization in pathological myopia. Br J Ophthalmol 2003; 87: 570-3
- Silva R. Myopic maculopathy: a review. Ophthalmologica 2012; 228: 197-213
- Wolf S, Balciuniene VJ, Laganovska G, et al. Radiance: a randomized controlled study of ranibizumab in patients with choroidal neovascularization secondary to pathologic myopia. Ophthalmology 2014; 121: 682-92
- Аверьянов Д. А., Алпатов С. А., Жукова С. И. и др. Оптическая когерентная томография в диагностике глазных болезней. М.: ГЭОТАР-Медиа, 2010; 128 c.
- Григорьева А. В., Юрьева Т. Н., Курсакова Ю. В., Иванова Е. И. Роль изменения гормонального статуса в формировании миопической хориоретинальной неоваскуляризации. Современные технологии в офтальмологии 2017; 4: 61-4
- Kobayashi K, Mandai M, Suzuma I, et al. Expression of Estrogen Receptor in the Choroidal Neovascular Membranes in Highly Myopic Eyes. Retina 2002; 22: 418-22.


