Градиентный феномен экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы при проведении неоадъювантной химиотерапии: связь с прогрессированием заболевания
Автор: Литвяков Н.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Обследовано 106 больных раком молочной железы (РМЖ), получавших неоадъювантную химиотерапию (НАХТ). При помощи количественной ПЦР с обратной транскрипцией в режиме реального времени изучена экспрессия 8 генов множественной лекарственной устойчивости (МЛУ) ABCB1, АВСВ2, ABCC1, ABCC2, АВСС5, ABCG1, ABCG2 и MVP в биопсийном материале до лечения и в операционном материале после НХТ. Установлено, что у 75 % больных наблюдается однонаправленное изменение экспрессии 5 генов МЛУ ABCB1, ABCC1, ABCC2, ABCG1 и ABCG2 в соответствии с эффектом НАХТ: снижение экспрессии при хорошем ответе и повышение экспрессии при отсутствии клинического эффекта предоперационной химиотерапии, которое было названо градиентным феноменом. У 25 % больных изменение экспрессии генов было разнонаправленным и не коррелировало с непосредственным эффектом НАХТ, при этом констатировали отсутствие градиентного феномена. Показано, что наличие градиентного феномена является благоприятным прогностическим признаком, 5-летняя безметастатическая выживаемость у таких пациенток составила 73 %, против 39 % у больных без градиентного феномена (log-rank test p=0,0018). Предполагается, что градиентный феномен является маркером наличия или отсутствия в опухолевых клетках сбалансированной системы генной регуляции и реактивности на химиопрепараты. С практической точки зрения сочетание оценки эффекта предоперационной химиотерапии и изменения экспрессии генов МЛУ в процессе НАХТ может существенно повысить эффективность прогнозирования исхода заболеваний у больных РМЖ.
Гены множественной лекарственной устойчивости, рак молочной железы, неоадъювантная химиотерапия, безметастатическая выживаемость
Короткий адрес: https://sciup.org/14056351
IDR: 14056351 | УДК: 618.19-006.6-036.17:575.113:615.28
Текст научной статьи Градиентный феномен экспрессии генов множественной лекарственной устойчивости в опухоли молочной железы при проведении неоадъювантной химиотерапии: связь с прогрессированием заболевания
В опухолевых клетках в ответ на действие даже одного цитостатика может развиться множественная лекарственная устойчивость (МЛУ) к большому количеству других препаратов, еще не воздействовавших на опухоль. В эксперименте показано, что МЛУ обусловлена работой ABC-транспортеров (ATP-Binding Cassette) лекарств, осуществляющих выброс цитостатических и тар-гетных препаратов из опухолевых клеток против градиента их концентрации, с затратой энергии АТФ [18, 21]. В клинических исследованиях предпринимались попытки связать исходный уровень экспрессии генов и белков ABC-транспортеров с эффектом химиотерапии и прогрессированием заболевания, но их результаты оказались крайне противоречивыми и не позволили сделать однозначные выводы о роли АВС-транспортеров в реализации химиорезистентности опухоли [7, 11, 12, 20, 21].
Нами было показано, что эффективность неоадъювантной химиотерапии (НАХТ), в том числе при раке молочной железы, связана с направлением изменения экспрессии индивидуальных генов МЛУ в опухоли в процессе лечения, а не с исходным уровнем экспрессии каждого из этих генов. Уменьшение экспрессии (или отрицательный градиент) генов МЛУ в опухоли молочной железы после НАХТ по сравнению с биопсийными образцами до лечения ассоциировалось с хорошим ответом на НАХТ. Повышение экспрессии (или положительный градиент) этих генов связано с отсутствием непосредственного эффекта НАХТ. Направление изменения экспрессии отдельных генов МЛУ в опухоли молочной железы при НАХТ имеет значение не только для ответа на химиотерапию, но и ассоциировано с безметастатической выживаемостью. Ранее также было установлено, что снижение экспрессии любого из генов ABCB1 , ABCC2 или ABCG1 в процессе НАХТ является благоприятным прогностическим фактором, а повышение экспрессии – неблагоприятным фактором [3]. Следует отметить, что формирование МЛУ – это процесс, который обусловлен комплексной работой нескольких ключевых генов МЛУ [8, 18].
Целью исследования явилось изучение изменения экспрессии комплекса основных генов МЛУ в процессе НХТ больных раком молочной железы и оценка связи этих изменений с безметастатической выживаемостью.
Материал и методы
Было обследовано 106 больных с морфологически верифицированным раком молочной железы IIA–IIIC стадий (T1–4N0–3M0), в возрасте 28–68 лет (средний возраст – 47,43 ± 0,78 года), получавших лечение в клинике ФГБУ «НИИ онкологии СО РАМН» в 2006–2010 гг. Исследование проходило в соответствии с Хельсинкской декларацией 1964 г. (исправленной в 1975 и 1983 гг.) и с разрешения локального этического комитета института. Были получены информированные согласия пациентов. Более 85 % больных имели инвазивный протоковый рак, у 75 % размер опухоли составил 2–5 см (Т2) и у 64 % пациенток были лимфогенные метастазы. Иммуногистохимическое исследование включало оценку экспрессии рецепторов эстрогена, прогестерона и HER2/neu на опухолевых клетках.
Все больные получили 2–4 курса неоадъювантной химиотерапии по схемам FAC (фторурацил, доксорубицин, циклофосфан), CAX (циклофосфан, доксорубицин, кселода) или монотерапию таксотером [19]. Через 3–5 нед после НАХТ проводилась операция в объеме радикальной мастэктомии, радикальной резекции или секторальной резекции с аксиллярной лимфаденэктомией, затем больным проводили 4 курса адъювантной химиотерапии по схеме FAC. Лучевая терапия и/или гормонотерапия назначались по показаниям.
Эффективность предоперационной химиотерапии оценивали по критериям ВОЗ с помощью УЗИ и маммографии, которые проводили до лечения, после 2 курсов НАХТ и перед операцией. Регистрировали полную регрессию, частичную регрессию (уменьшение объема опухоли более чем на 50 %), стабилизацию (снижение объема менее чем на 50 % или увеличение не более чем на 25 %) и прогрессирование (увеличение объема опухоли более чем на 25 %). Для оценки экспрессии генов МЛУ были использованы биопсийные опухолевые об-
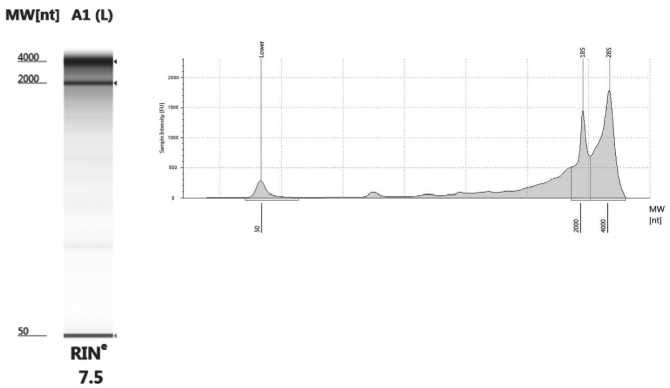
Рис. 1. Электрофореграмма и денситограмма тотальной РНК, выделенной из опухоли молочной железы при помощи набора Rneasy Mini Kit Plus (Qiagen, Germany). Капиллярный электрофорез выполнен на приборе TapeStation (Agilent Technologies, USA). Видны бенды 28S и 18S рибосомальной РНК, показатель целостности РНК – RIN (RNA Integrity Number) составил 7,5.
Спектрофотометрические показатели этого образца РНК – А260/280=1,95, А260/230=2,34; концентрация – 153 нг/мкл
разцы (~10 мм3), взятые до лечения под контролем УЗИ, а также операционный материал (~60–70 мм3). Больные, у которых в процессе НАХТ была достигнута полная морфологическая регрессия, не были включены в исследование, поскольку не представлялось возможным оценить уровень экспрессии генов МЛУ в опухоли после терапии. Частичная регрессия отмечена у 58 больных, стабилизация – у 39, прогрессирование – у 9 пациенток.
Исследуемые образцы помещали в раствор RNAlater (Ambion, USA) и сохраняли при температуре –80ºС (после 24-часовой инкубации при +4ºС) для дальнейшего выделения РНК. Тотальная РНК была выделена с помощью набора RNeasy mini Kit Plus, содержащего ДНК-азу I (Qiagen, Germany) с использованием ингибитора РНК-аз Ribolock (Fermentas, Lithuania). Качество выделенной РНК проверяли при помощи капиллярного электрофореза на приборе TapeStation (Agilent Technologies, USA), и RIN (RNA Integrity Number) составил 5,6–7,6 (рис. 1). Для получения кДНК на матрице РНК проводили реакцию обратной транскрипции с помощью набора RevertAid™ (Fermentas, Lithuania) со случайными гексануклеотидными праймерами в соответствии с инструкцией к набору. Остальные манипуляции, последовательность праймеров и методика оценки относительной экспрессии генов МЛУ описаны ранее [13]. В качестве результата оценивался уровень экспрессии 8 генов МЛУ:
ABCB1 , АВСВ2 , ABCC1 , ABCC2 , АВСС5 , ABCG1 , ABCG2 и MVP относительно гена-рефери GAPDH и нормальной ткани молочной железы, вычисляемый по методу Pfaffl (2001) [16] в биопсии до лечения и операционном материале после НАХТ. Сравнивая уровень экспрессии генов МЛУ до лечения и после НАХТ, определяли направление ее изменения: повышение или снижение в процессе НАХТ.
Для проверки гипотезы о значимости различий по частоте признака использовали критерий χ2 («STATISTICA 8.0», StatSoft Inc., США) и , показатель относительного риска – RR с 95 % доверительным интервалом (CI) вычислялся на калькуляторе http://vassarstats. net/ Для анализа безметастатической выживаемости использовались кривые выживаемости, построенные по методу Каплана–Майера [10]. Оценка значимости различий между группами производилась с помощью log-rank теста («STATIS-TICA 8.0», StatSoft Inc., США).
Результаты и обсуждение
На первом этапе были изучены закономерности изменения экспрессии комплекса основных генов МЛУ в процессе НАХТ и отмечено интересное явление: у большинства пациенток – 80 (75 %) случаев – экспрессия 5 из 8 изучаемых генов МЛУ (ABCB1, ABCC1, ABCC2, ABCG1 и ABCG2) изменялась в одном направлении и в строгом со- ответствии с эффектом НАХТ, т.е. наблюдалось снижение экспрессии всех 5 генов при хорошем ответе на НАХТ, либо повышение их экспрессии при отсутствии ответа. Это явление однонаправленного изменения экспрессии комплекса 5 генов МЛУ ABCB1, ABCC1, ABCC2, ABCG1 и ABCG2 в строгом соответствии с эффектом НХТ было названо нами градиентным феноменом. Примечательно, что вектор изменения экспрессии в процессе НАХТ именно этих генов показал наибольшую связь с эффективностью НАХТ [13]. У 25 % (26 из 106) больных не наблюдалось однонаправленного изменения экспрессии генов МЛУ в соответствии с эффектом НАХТ. Изменение экспрессии 2 или более из 5 выявленных генов МЛУ было разнонаправленным и не соответствовало эффекту НАХТ. По-видимому, у этих пациенток при проведении НАХТ происходило разобщение регуляции комплекса 5 генов МЛУ, и градиентный феномен не наблюдался.
Для того чтобы установить патогенетическую значимость градиентного феномена, была изучена его связь с безметастатической выживаемостью. Всех больных в зависимости от наличия/отсутствия градиентного феномена при проведении НАХТ разделили на две группы: 1-ю группу составили 80 больных с наличием феномена, 2-ю группу – 26 больных с его отсутствием. Сравниваемые группы больных не различались по основным клиникопатологическим параметрам (таблица). Можно отметить только тенденцию к увеличению частоты всречаемости отрицательного рецепторного статуса (ER- и PR-) у больных без градиентного феномена. Также группы не различались по среднему уровню экспрессии генов ABCB1 , ABCC1 , ABCC2 , ABCG1 и ABCG2 в биопсийном образце опухоли до лечения и операционном материале после НАХТ (данные не представлены). Это дает основания полагать, что наличие/отсутствие градиентного феномена не ассоциировано с основными клиникопатологическими параметрами, в том числе и молекулярными подтипами РМЖ, и позволяет корректно провести сравнение показателей безме-тастатической выживаемости в обеих группах.
На следующем этапе была изучена связь градиентного феномена с показателями безметаста-тической выживаемости. В общей группе из 106 обследованных пациентов отдаленные метастазы развились у 35 (33 %) больных в сроки 3–48 мес от момента постановки диагноза. Трехлетняя безметастатическая выживаемость составила 72 %, 5-летняя – 65 %. При наличии градиентного феномена 5-летняя безметастатическая выживаемость составила 73 % против 39 % у больных без градиентного феномена (log-rank test p=0,0018) (рис. 2А). Частота метастазирования – 25 % и 58 % соответственно (р=0,0021, критерий χ2). Это позволяет рассматривать наличие градиентного феномена у пациентов в качестве благоприятного прогностического фактора. При отсутствии градиентного феномена относительный риск развития гематогенных метастазов RR=1,77 (95% CI 1,11–2,83, уровень доверительной значимости с поправкой Йетса р=0,005).
Градиентный феномен является независимым прогностическим фактором, который успешно работает и позволяет дифференцировать больных по возможному исходу заболевания в таких, казалось бы, клинически «однородных» группах, как пациентки с местным распространением опухоли, соответствующей Т2 (рис. 2Б) (RR=2,32 (95 % CI 1,19–4,52), р=0,001), с наличием лимфогенного метастазирования (рис. 2В) (RR=2,45 (95 % CI 1,12–5,36), р=0,01) и больные с люминальным РМЖ (рис. 2Г) (RR=1,74 (95 % CI 0,90–3,38), р=0,03).
Таким образом, градиентный феномен имеет выраженную связь с прогрессией заболевания при раке молочной железы. Примечательно, что безме-тастатическая выживаемость была высокой (73 %) у больных РМЖ с наличием градиентного феномена при проведении НАХТ вне зависимости от того, достигнута частичная регрессия, стабилизация или прогрессирование. Низкая безметастатическая выживаемость (39 %) у больных с отсутствием градиентного феномена также не зависела от эффекта НАХТ (таблица). Это в определенной мере объясняет результаты исследования N. Wolmark et al. (2001) [22], которые показали, что только достижение полной морфологической регрессии при проведении НАХТ является благоприятным прогностическим фактором, а группы с частичной регрессией, стабилизацией или прогрессированием значимо не различались по показателям общей и безметастатической выживаемости.
Учитывая высокую прогностическую значимость градиентного феномена, можно предположить, что его наличие при проведении НАХТ является маркером сохранения в опухолевых клетках «нормальной» (сбалансированной) системы генной регуляции и клеточного ответа на химиопрепараты. Все 5 генов МЛУ локализованы в разных хромосомах (АВСВ1 – 7q21.12; ABCC1 – 16p13.11; ABCC2 – 10q24.2; ABCG1 – 21q22.3; ABCG2 – 4q22.1 http://www. , соответственно, они не являются сцепленными, но имеют общие сигнальные и метаболические пути [18]. Однонаправленность из- менений экспрессии этого комплекса 5 генов МЛУ показывает сохранение интактности системы их регуляции и, по всей вероятности, свидетельствует о сохранности в опухолевых клетках баланса многих систем жизнеобеспечения, реактивности и гибели.
Отсутствие градиентного феномена при проведении НАХТ предположительно является маркером серьезных нарушений в реакции на химиопрепараты (включая такие процессы, как
Таблица
Клинико-патологические параметры в группах больных рМж с наличием и отсутствием градиентного феномена
|
Клинико-патологические параметры |
Градиентный феномен |
p-value |
|
|
Есть |
Нет |
||
|
≤45 лет |
26 (33 %) |
10 (38 %) |
0,577 |
|
>45 лет |
54 (67 %) |
16 (62 %) |
|
|
Пременопауза |
45 (56 %) |
17 (65 %) |
0,412 |
|
Постменопауза |
35 (44 %) |
9 (35 %) |
|
|
т . 1–2 |
71 (89 %) |
21 (81 %) |
0,296 |
|
T3–4 |
9 (11 %) |
5 (19 %) |
|
|
N 0 |
32 (40 %) |
7 (27 %) |
0,229 |
|
N1–3 |
48 (60 %) |
19 (73 %) |
|
|
Инвазивный протоковый рак |
68 (85 %) |
23 (88 %) |
0,660 |
|
Другие гистотипы |
12 (15 %) |
3 (12 %) |
|
|
1-я степень злокачественности |
3 (5 %) |
1 (4 %) |
0,455 |
|
2-я степень злокачественности |
55 (87 %) |
19 (79 %) |
|
|
3-я степень злокачественности |
5 (8 %) |
4 (17 %) |
|
|
ER+ |
44 (59 %) |
10 (40 %) |
0,105 |
|
ER- |
31 (41 %) |
15 (60 %) |
|
|
PR+ |
46 (61 %) |
10 (40 %) |
0,063 |
|
PR- |
29 (39 %) |
15 (60 %) |
|
|
HER2 (- или +) |
53 (71 %) |
18 (72 %) |
0,971 |
|
HER2 (++ или +++) |
21 (29 %) |
7 (28 %) |
|
|
Люминальный |
52 (66 %) |
11 (44 %) |
0,129 |
|
Трижды негативный |
15 (19 %) |
9 (36 %) |
|
|
HER2 позитивный |
12 (15 %) |
5 (20 %) |
|
|
Уницентрический |
57 (71 %) |
15 (58 %) |
0,198 |
|
Мультицентрический |
23 (29 %) |
11 (42 %) |
|
|
НХТ по схемам CAX или FAC |
60 (75 %) |
22 (85 %) |
0,308 |
|
НХТ по схеме таксотер |
20 (25 %) |
4 (15 %) |
|
|
Частичная регрессия |
45 (56 %) |
13 (50 %) |
0,587 |
|
Стабилизация + прогрессирование |
35 (44 %) |
13 (50 %) |
|
Примечание: p-value – уровень статистической значимости различий по критерию χ2, в группе люминальный рак – в основном больные с люминальным В подтипом.
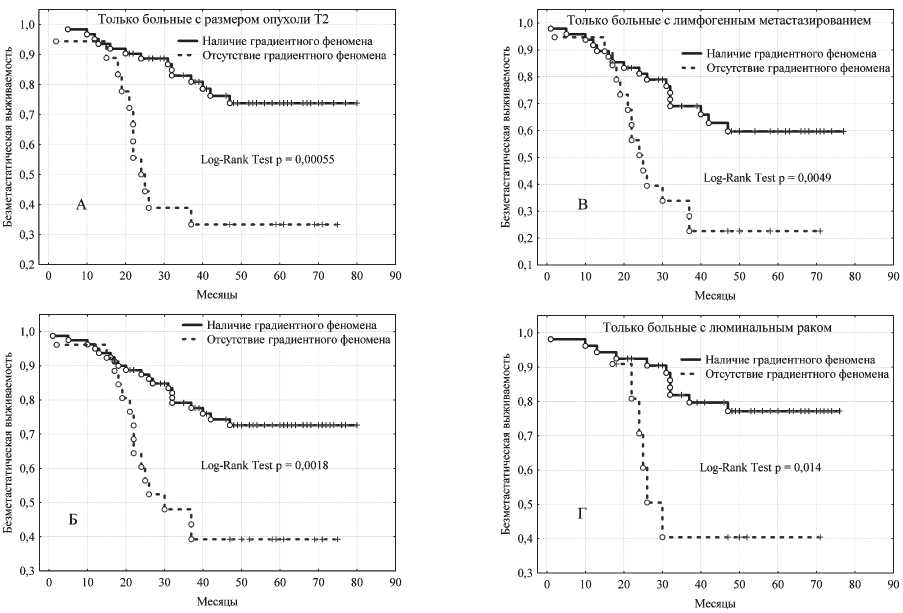
Рис. 2. Безметастатическая выживаемость больных РМЖ в зависимости от наличия/отсутствия градиентного феномена. А – общая группа, Б – больные с опухолью Т2, В – больные с лимфогенным метастазированием, Г – больные с люминальным раком молочной железы
метаболическая активация, детоксикация и удаление ксенобиотиков, остановка клеточного цикла, репарация и апоптоз) и в системе генной регуляции (дизрегуляция и дисбаланс) опухолевых клеток, показывая их высокий агрессивный потенциал. В отсутствие градиентного феномена при НАХТ могут играть роль такие нарушения процесса апоптоза, индуцируемого лекарственными средствами, как неадекватность ответа на химиопрепараты, вплоть до стимуляции пролиферации вместо апоптоза. Возможны нарушения в трансдукции сигнала вплоть до реверсии реактивности клеточных рецепторов адгезии (кадхеринов, интегринов, катенинов), рецепторов факторов роста, frizzled (G-белок связанных) рецепторов и др. [8]. Высокая внутриопухолевая гетерогенность, свойственная РМЖ, с большим числом клонов, несущих разные первичные и вторичные драйверные мутации и мутации-«пассажиры» [4, 23], может вносить вклад в формирование градиентного феномена. Например, драйверные мутации гена-супрессора опухо- левого роста ТР53 могут приводить к инактивации или парадоксальной реализации (активации вместо ингибирования и наоборот) многих клеточных функций, таких как апоптоз, репарация, регуляциия экспрессии множества генов, в том числе и генов МЛУ [1, 5, 6, 9, 14, 17]. При этом интересно, что частота мутаций ТР53 при РМЖ составляет 25 % [15], и это совпадает с частотой отсутствия у больных градиентного феномена (25 %). Полученные результаты свидетельствуют об актуальности дальнейшего исследования механизмов, определяющих наличие/отсутствие градиентного феномена, и его значения для клеточной регуляции.
Заключение
Установлен новый потенциальный прогностический фактор, не зависящий от основных клиникопатологических факторов прогноза – наличие или отсутствие градиентного феномена, который наблюдается при проведении НАХТ и характеризуется однонаправленными изменениями экспрессии генов МЛУ ABCB1 , ABCC1 , ABCC2 , ABCG1 и
ABCG2 в строгом соответствии с эффектом НАХТ. Наличие у больной РМЖ градиентного феномена является благоприятным прогностическим признаком независимо от клинического ответа на химиотерапию. Если градиентный феномен не наблюдался при проведении НАХТ, то у таких пациенток почти в 2 раза увеличивался относительный риск гематогенного метастазирования (RR=1,77). Предполагается, что градиентный феномен является маркером наличия или отсутствия в опухолевых клетках сбалансированной системы генной регуляции и реактивности на химиопрепараты. Это требует дальнейших исследований, актуальность которых обусловлена прогностической значимостью градиентного феномена. С практической точки зрения сочетание оценки эффекта предоперационной химиотерапии и градиента экспрессии генов МЛУ в процессе НАХТ может существенно повысить эффективность прогноза при раке молочной железы.
Работа поддержана грантом ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 гг.» по теме «Оптимизация стратегии химиотерапии рака молочной железы на основе факторов химиорезистентности и химиочувствительности», соглашение № 8291 от 27 августа 2012 г.
Автор выражает глубокую признательность за помощь в выполнении работы сотрудникам ФГБУ «НИИ онкологии» СО РАМН Н.В.Чердынцевой, Е.М. Слонимской, М.М. Цыганову, Е.Ю. Гарбукову, Е.В. Денисову, М.В. Завьяловой, В.М. Перельмутеру.


