Грамотрицательные галофильные бактерии - деструкторы ортофталевой кислоты
Автор: Ястребова Ольга Викторовна, Плотникова Елена Генриховна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Из рабочей коллекции микроорганизмов лаборатории молекулярной микробиологии и биотехнологии Института экологии и генетики микроорганизмов УрО РАН было отобрано 5 штаммов грамотрицательных бактерий-деструкторов орто-фталата, выделенных из донных отложений водных объектов и поверхности шламохранилища, в районе добычи калийных солей (г. Березники, Пермский край). На основании филогенетического анализа (гены 16S рРНК), штаммы были отнесены к родам Pseudomonas, Idiomarina, Alcanivorax, Martelella, Breoghania. Установлено, что они являются галотолерантными микроорганизмами и способны к росту на полноценной среде в присутствии до 100 г/л NaCl, а также к росту на орто-фталевой кислоте в качестве субстрата при содержании до 70 г/л соли в среде культивирования. При выращивании в среде с повышенным засолением (30 г/л NaCl) у большинства штаммов наблюдались более высокие значения ростовых характеристик (максимальное значение ОП600, удельная скорость роста), чем в среде без добавления соли. У штамма Idiomarina sp. PSH17-1 выявлены повышенные параметры оптической плотности и удельной скорости роста в среде с 50 и 70 г/л соли. Полученные результаты исследования могут служить основой разработки эффективных биотехнологий для детоксикации и мониторинга фталатов в загрязненных/засоленных почвах.
Аэробные бактерии, орто-фталевая кислота, деструкция, хлорид натрия
Короткий адрес: https://sciup.org/147227109
IDR: 147227109 | УДК: 579.66:661.8 | DOI: 10.17072/1994-9952-2019-4-434-440
Текст научной статьи Грамотрицательные галофильные бактерии - деструкторы ортофталевой кислоты
в частности, в отходах и избыточных рассолах соледобывающих производств (г. Березники, Соликамск, Пермский край). Обогащение и переработка калийных руд сопровождается использованием ряда реагентов, продуктами трансформации которых являются фталаты [Бачурин, Одинцова, 2006].
Фталаты и их метаболиты обладают гепатоток-сичными, канцерогенными свойствами, способны накапливаться в организме и признаны опасными для здоровья человека и животных [Куценко, 2002].
Способность к деструкции данных веществ обнаружена у ряда бактерий различных родов, в том числе Pseudomonas, Burkholderia, Sphingomonas, Arthrobacter , Rhodococcus [Liang, Zhang, Fang, 2008; Jin et al., 2010; Stanislauskienė et al., 2011]. Описан метаболический путь деструкции орто фталевой кислоты ( орто -ФК) грамотрицательны-ми штаммами (родов Pseudomonas, Burkholderia ) через цис -4,5-дигидро-4,5-дигидроксифталат и 4,5-дигидроксифталат до протокатеховой кислоты [Chang, Zylstra, 1998; Vamsee-Krishna, Mohan, Phale, 2006]. В то же время, биодеградация фталатов в средах с экстремальными физическими или химическими параметрами, в частности, при повышенном засолении среды, изучена недостаточно. В ряде исследований показано, что значительную долю культивируемых микроорганизмов гиперсоленых местообитаний составляют грамотрица-тельные бактерии классов Gammaproteobacteria и Alphaproteobacteria [Ventosa, Nieto, Oren, 1998; Oren, 2008] . В литературе представлены немного-
Таблица 1
Штаммы бактерий, выделенные из образцов шламов и донных отложений (г. Березники)
|
Образец |
Штаммы |
Типовой штамм ближайшего родственного вида и номер в базе данных GenBank |
Сходство генов 16S рРНК, % |
|
Донные отложения промышленных стоков, Промканал |
PG2 |
Pseudomonas xanthomarina KMM 144T (AB176954) |
100 |
|
Поверхность шламохрани-лища, БКПРУ-3 |
PSH17–1 |
Idiomarina fontislapidosi F23T (AY526861) |
99.43 |
|
PSH17-52 |
Martelella radices BM5-7T (KF560339) |
96.72 |
|
|
Донные отложения рассо-лосборника, БКПРУ-3 |
PP22–31 |
Breoghania corrubedonensis UBF-P1T (CQ272328) |
99.37 |
|
B23 |
Alcanivorax dieselolei B5T (DSM16502) |
100 |
Среды и условия культивирования. Для роста микроорганизмов использовали минеральную среду Раймонда (МСР) [Raymond, 1961] без NaCl и c добавлением 30–100 г/л соли. В качестве субстрата использовали орто-ФК или одно из следующих соединений (1 г/л): дибутилфталат (ДБФ), диэтилфталат (ДЭФ), протокатеховую кислоту (ПКК), бензоат, салицилат, нафталин. Для приготовления богатой среды Раймонда (БСР) в минеральную среду Раймонда добавляли 5 г/л триптона и 2.5 г/л дрожжевого экстракта в качестве росто- численные данные о способности бактерий данных классов (в частности, родов Alteromonas, Marinomonas, Marinovum) к росту на орто-ФК в условиях осмотического стресса [Iwaki, Nishimura, Hasegawa, 2012]. Не исследованы физиологические и молекулярно-биологические особенности деструкции фталатов данными бактериями. Такие исследования представляют интерес как для получения новых данных о механизмах солеустойчиво-сти, так и для разработки методов биоремедиации природных и техногенных экосистем с высоким засолением среды, загрязненных устойчивыми ксенобиотиками.
Цель работы – идентификация, физиологические и деградационные характеристики грамотри-цательных бактерий-деструкторов орто -фталата, выделенных из района солеразработок (г. Березники, Пермский край).
Материалы и методы исследования
Объекты исследования . Для проведения исследований из рабочей коллекции микроорганизмов лаборатории молекулярной микробиологии и биотехнологии «Института экологии и генетики микроорганизмов УрО РАН» было отобрано 5 штаммов грамотрицательных бактерий-деструкторов фталатов, выделенных из донных отложений водных объектов и поверхности шламохранилища, расположенных в районе добычи и переработки калийных солей (г. Березники, Пермский край) (табл. 1).
вых субстратов. Культивирование бактерий в жидких средах проводили при 28°С на термостатируемой качалке при 100 об/мин. Длительность культивирования – 2–7 сут.
Для получения агаризованных сред использовали агар («Helicon», Россия) до конечной концентрации 15 г/л. Культивирование микроорганизмов осуществляли в термостате при 28 ° С.
Рост бактерий на орто-фталате при разных концентрациях хлорида натрия. Ростовые характеристики бактерий изучали в периодической культуре в жидкой МСР с орто-ФК (1 г/л) в качестве субстрата в присутствии NaCl (30, 50, 70 и 90 г/л) и без соли в среде.
Культуры бактерий выращивали в колбах Эр-ленмейера объемом 250 мл (объем среды – 100 мл) при 28 ° С, с аэрацией на термокачалке при 100 об/мин.
В качестве инокулята использовали культуры в экспоненциальной фазе роста, выращенные на среде Раймонда, содержащей 3% NaCl, с орто -ФК в качестве субстрата.
Оптическую плотность (ОП) культуральной жидкости определяли на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см.
Расчет удельной скорости роста (μ) и длительности lag -фазы (T l ) проводили по стандартным формулам [Нетрусов и др., 2005].
Рост бактерий при разных рН среды определяли при концентрации 3%-ного NaCl в буферных системах, приготовленных на основе БСР. Штаммы культивировались на чашках Петри на агари-зованной среде при рН 5.0, 6.0, 7.0, 8.0, 9.0. Рост учитывали на седьмой день культивирования [Методы общей бактериологии, 1983].
Идентификацию бактерий проводили на основании анализа генов 16S рРНК. Амплификацию гена 16S рРНК осуществляли с использованием бактериальных праймеров 27F (5`-AGAGTTTGATC (A/C)TGGCTCAG-3`) и 1492R (5`-АСGG(C/T) TACCTTGTTACGACTT-3`) на амплификаторе My Cycler “Bio-Rad Laboratories” (США) согласно описанию [Lane, Stackebrandt, Goodfellow, 1991]. Определение нуклеотидных последовательностей проводили с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit v. 3.1 на автоматическом секвенаторе Genetic Analyser 3500XL “Applied Biosystems” (США) согласно рекомендациям производителя, в лаборатории молекулярной биологии и генетики при кафедре ботаники и генетики растений ПГНИУ. Филогенетический анализ полученных нуклеотидных последовательностей 16S рДНК осуществляли с использованием программ CLUSTAL W clustalw), Sequence Scanner v 2.0. Поиск гомологичных последовательностей проводили при использовании баз данных GenBank и EzTaxon .
Статистическая обработка результатов . Э ксперименты были выполнены в трехкратной повторности. Полученные данные обрабатывали с использованием стандартных пакетов компьютерной программы Microsoft Excel.
Результаты и их обсуждение
Идентификация штаммов-деструкторов орто-ФК
Отобранные для исследований грамотрица-тельные бактерии были выделены из образцов донных отложений и шламов района солеразработок методом накопительного культивирования в минеральной среде с добавлением 3%-ного NaCl и орто- ФК в качестве субстрата. Было показано, что все пять штаммов, обозначенные как PSH17-1, PG2, B23, PSH17-52 и PP22-31, были способны к эффективному росту в жидкой минеральной среде на орто -ФК (1 г/л) в качестве единственного источника углерода и энергии.
На основании проведенного анализа гена 16S рРНК три штамма были отнесены к классу Gammaproteobacteria филума « Proteobacteria »: штамм PSH17–1 имеет наибольшее филогенетическое сходство (99.43%) со штаммом типового вида Idi-omarina fontislapidosi F23T , штамм PG2 – 100%-ное сходство с типовым штаммом Pseudomonas xanthomarina KMM 144T, штамм B23 – 100%-ное сходство с типовым штаммом Alcanivorax dieselolei B5T.
Два штамма отнесены к классу Alphaproteobacteria : штамм PSH17-52 показал наибольший уровень филогенетического сходства (96.72%) со штаммом Martelella radices BM5-7T; и штамм PP22-31, наиболее филогенетически близкий типовому штамму Breoghania corrubedonensis UBF-P1T (99.37%) (см. табл. 1).
Физиологические характеристики и способность штаммов расти на ароматических субстратах
Поскольку штаммы были выделены из донных отложений и шлама района солеразработок, была исследована способность штаммов к росту в условиях повышенной минерализации среды. Установлено, что штаммы-деструкторы были способны к росту в богатой среде Раймонда как без добавления соли, так и при повышенном засолении среды (до 90–100 г/л NaCl) (табл. 2) и относятся к гало-толерантным микроорганизмам [Кашнер 1981]. Штаммы Idiomarina sp. PSH17-1 и Martelella sp.PSH17-52 растут на БСР в присутствии до 120 г/л NaCl.
Установлено, что исследуемые штаммы способны к росту на БСР в диапазоне рН 6.0–8.0 с оптимальным значением рН 7.0. Штамм Idiomarina sp. PSH17-1 рос на БСР при рН 5.0.
Все исследуемые штаммы-деструкторы ортоФК способны к росту на протокатеховой кислоте (ПКК) – основном метаболите разложения фталатов, который утилизируется с расщеплением ароматического кольца по мета- или орто-пути до основных метаболитов клетки [Liang, Zhang, Fang, 2008]. Три штамма (PG2, PSH17-1 и PSH17-52) растут на сложном эфире фталевой кислоты – дибутилфталате (ДБФ), а штаммы PG2 и PSH17-52
растут на диэтилфталате (ДЭФ). Штамм Breogha-nia sp. PP22-31 способен также к росту на бифениле, нафталине и салицилате.
Таблица 2
Рост бактерий в присутствии различных концентраций соли
|
Штамм |
Концентрация NaCl (г/л), БСР |
||||
|
Без NaCl |
30 |
60 |
100 |
120 |
|
|
Idiomarina sp. PSH17-1 |
++ |
+++ |
++ |
++ |
+ |
|
Pseudomonas sp. PG2 |
++ |
++ |
+ |
+ |
– |
|
Alcanivorax sp. B23 |
++ |
+++ |
++ |
+ |
– |
|
Martelella sp. PSH17-52 |
++ |
+++ |
++ |
+ |
+ |
|
Breoghania sp. PP22-31 |
++ |
+++ |
++ |
+ |
– |
Примечание. «–» – отсутствие роста бактерий; слабый рост «+» – колонии размером менее 1 мм; средний рост «++» – колонии размером 1–2 мм; хороший рост «+++» – колонии размером более 3 мм.
Рост бактерий на орто-ФК при разной солености среды
Установлено, что все штаммы способны к эффективному росту в жидкой минеральной среде на орто- ФК в присутствии до 70 г/л NaCl в среде культивирования. Для штамма PG2 наблюдался слабый рост при 90 г/л NaCl.
Для всех исследованных штаммов установлена прямая зависимость между повышением содержания соли в среде культивирования и увеличением длительности лаг-фазы роста. Наиболее продолжительная лаг-фаза роста наблюдалась при содержании 70 г/л NaCl в среде культивирования (от 30 ч.
Таблица 3
Удельная скорость роста μ (ч-1) и максимальная оптическая плотность (ОП600) бактерий в присутствии различных концентраций хлорида натрия
|
Штамм |
Без NaCl |
30 г/л |
50 г/л |
70 г/л |
90 г/л |
|||||
|
μ |
ОП 600 |
μ |
ОП 600 |
μ |
ОП 600 |
μ |
ОП 600 |
μ |
ОП 600 |
|
|
PP22-31 |
0,012 |
0,74 |
0,019 |
0,75 |
0,012 |
0,73 |
0,011 |
0,72 |
0,001 |
0,22 |
|
PSH17-52 |
0,011 |
0,79 |
0,032 |
0,95 |
0,005 |
0,56 |
0,002 |
0,32 |
0,001 |
0,15 |
|
PSH17-1 |
0,012 |
0,73 |
0,007 |
0,72 |
0,011 |
0,75 |
0,013 |
0,76 |
0,001 |
0,25 |
|
PG-2 |
0,026 |
1,04 |
0,024 |
1,06 |
0,018 |
0,96 |
0,012 |
0,94 |
0,004 |
0,45 |
|
B23 |
0,015 |
1,01 |
0,023 |
0,88 |
0,016 |
0,93 |
0,020 |
0,89 |
0,001 |
0,22 |
Скорость экспоненциального роста культуры (μ) также незначительно менялась с повышением концентрации соли в среде культивирования штаммов (табл. 3). Наиболее высокая удельная скорость роста зафиксирована для штамма Mar-telella sp. PSH17-52 (μ=0.032ч-1) в присутствии 30 г/л NaCl в среде.
Как показано в ряде исследований для штаммов родов Pseudomonas, Halomonas, снижение параметров роста, а также степень утилизации ксенобиотиков в условиях повышенного засоления среды могут быть обусловлены адаптационными процессами, протекающими в клетках, а также снижением доступности ароматических субстратов при засолении среды [Xu, Li, Gu, 2007; Oie, Al- для штамма Martelella sp. PSH17-52 до 118 ч. для штамма Idiomarina sp. PSH17-1) (рисунок).
При этом с повышением засоления среды величина максимальной оптической плотности культуры для исследуемых штаммов снижалась незначительно (табл. 3). Для большинства штаммов наиболее высокие значения максимальной ОП 600 зафиксированы при росте в среде с 30 г/л NaCl, а для штамма Idiomarina sp. PSH17-1 – в среде с 50 и 70 г/л соли. Максимальная оптическая плотность штамма Alcanivorax sp B23В зафиксирована в среде без добавления соли. Наиболее высокие значения максимальной оптической плотности наблюдались у штамма Pseudomonas sp PG-2 (ОП 600 = 1.06 при концентрации соли 30 г/л).
baugh, Peyton, 2007].
Заключение
Исследованные грамотрицательные штаммы разных таксономических групп (родов Pseudomonas, Idiomarina, Alcanivorax, Martelella, Breogha-nia), выделенные из района солеразработок, являются галотолерантными микроорганизмами и способны к росту на полноценной среде в присутствии до 100 г/л NaCl, а также к росту на орто-ФК в качестве субстрата при содержании до 70 г/л соли в среде культивирования. Для большинства исследуемых штаммов зафиксированы более высокие ростовые показатели при выращивании в среде с по- вышенным засолением (30 г/л NaCl), чем в среде без добавления соли. Штамм Idiomarina sp. PSH17-1 имеет наиболее высокие ростовые характеристики в среде с 50 и 70 г/л соли. Ранее не были описаны особенности деструкции орто-ФК для штаммов рода Martelella. Наши исследования по- казали, что рост штамма Martelella sp. PSH17-52 на орто-ФК наблюдался практически без подготовительной фазы, при этом максимальная удельная скорость роста и максимальное значение ОП600 зафиксированы в среде с 30 г/л NaCl.
Б
А
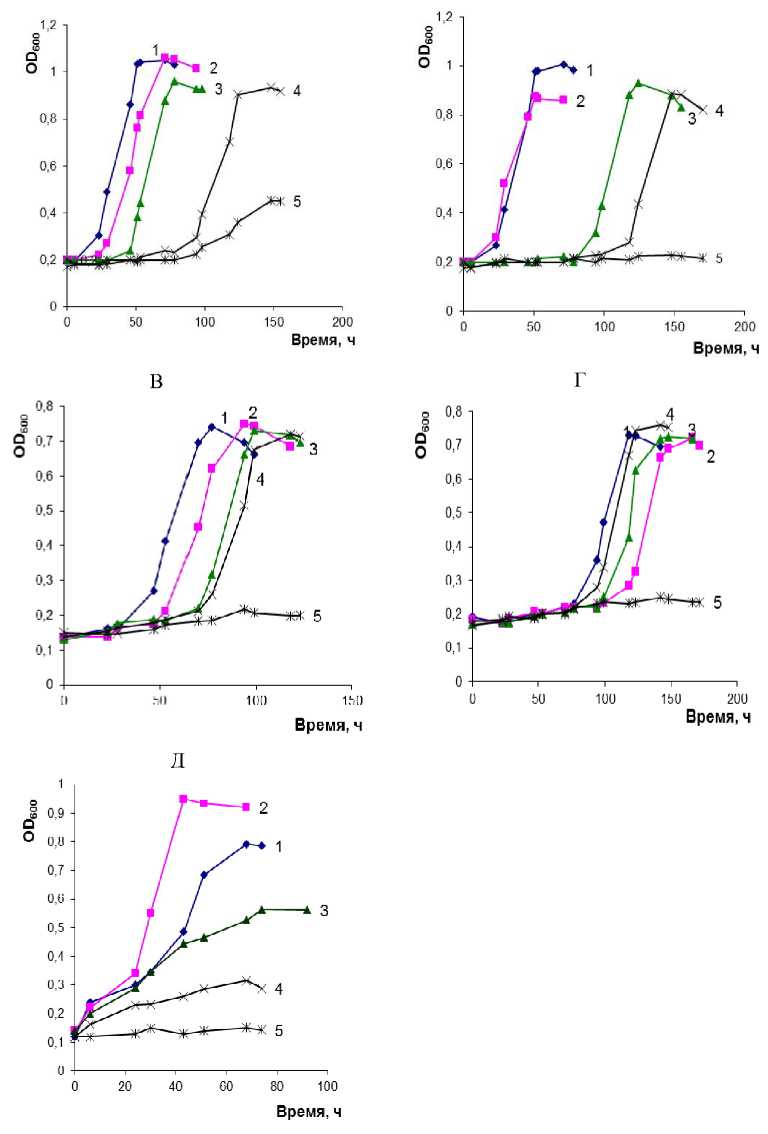
Рост штаммов Pseudomonas sp. PG2 (А), Alcanivorax sp. B23 (Б), Breoghania sp. PP22-31 (В), Idiomarina sp. PSH17-1 (Г), Martelella sp. PSH17-52 (Д) в МСР на орто- ФК (1 г/л) при разных концентрациях хлорида натрия (г/л): 1 – без NaCl; 2 – 30; 3 – 50; 4 – 70; 5 – 90
Три исследуемых штамма способны к росту на сложных эфирах орто- ФК – дибутилфталате
(ДБФ) и диэтилфталате (ДЭФ). Наибольшей субстратной специфичностью обладает штамм Breoghania sp. PP22-31, способный к росту на орто- ФК, бифениле, нафталине и салицилате. Показано, что данные штаммы-деструкторы орто -ФК способны к росту на протокатеховой кислоте – основном метаболите разложения фталатов.
Приведенные результаты исследования галото-лерантных штаммов-деструкторов фталатов могут быть использованы для разработки новых инновационных биотехнологических методов мониторинга и очистки объектов окружающий среды от устойчивых токсичных ароматических соединений (в том числе, фталатов) в условиях высокого засоления.
Работа выполнена в рамках государственного задания, номер госрегистрации темы: 01201353247.
Список литературы Грамотрицательные галофильные бактерии - деструкторы ортофталевой кислоты
- Барштейн Р.С., Кирилович В.И., Носовский Ю.Е. Пластификаторы для полимеров. М.: Химия, 1982. 200 с.
- Бачурин Б.А., Одинцова Т.А. Стойкие органические загрязнители в отходах горного производства // Современные экологические проблемы Севера. Апатиты, 2006. Ч. 2. С. 7-9.
- Кашнер Д. Жизнь микробов в экстремальных условиях. М.: Мир, 1981. 365 с.
- Куценко С.А. Основы токсикологии, СПб., 2002. Т. 4. 119 с.
- Нетрусов А.И. Практикум по микробиологии. М.: Академия, 2005. 608 с.
- Chang H.-K., Zylstra G. Novel Organization of the Genes for Phthalate Degradation from Burkholderia cepacia DBO1 // J. Bacteriology. 1998. Vol. 180, № 24. P. 6529-6537.
- Iwaki H., Nishimura A., Hasegawa Y. Isolation and characterization of marine bacteria capable of utilizing phthalate // World J. Microbiol. Biotechnol. 2012. Vol. 28. P. 1321-1325
- Jin D.-C. et al. Biodegradation of di-n-butyl phthalate by Rhodococcus sp. JDC-11 and molecular detection of 3,4-phthalate dioxygenase gene // J. Microbiol. Biotechnol. 2010. Vol. 20, № 10. P 1440-1445.
- Lane D.J., Stackebrandt E., Goodfellow M. 16S/23S rRNA sequencing // Nucleic acid techniques in bacterial systematics / ed. D.J. Lane. New York: John Wiley and Sons, - 1991. P. 115-175.
- Liang D.W., Zhang T., Fang H. Phthalates biodegradation in the environment // Appl. Microbiol. Biotechnol. 2008. Vol. 80. P. 183-198.
- Oie C.S.I., Albaugh C.E., Peyton B.M. Benzoate and salicylate degradation by Halomonas campisalis, an alkaliphilic and moderately halophilic microorganism // Water Res. 2007. Vol. 41, № 6. P. 1235-1242.
- Oren A. Microbial life at high salt concentrations: phylogenetic and metabolic diversity // Saline Systems. 2008. Vol. 4, № 2.
- DOI: 10.1186/1746-1448-4-2
- Raymond R.L. Microbial oxidation of n-paraffinichydrocarbons // Develop. Ind. Microbiol. 1961. Vol. 2, № 1. P. 23-32.
- Stanislauskienė R. et al. Analysis of phthalate degradation operon from Arthrobacter sp. 68B // Biologija. 2011. Vol. 57, № 3. P. 45-54.
- Vamsee-Krishna C., Mohan Y., Phale P. Biodegradation of phthalate isomers by Pseudomonas aeruginosa PP4, Pseudomonas sp. PPD and Acinetobacter lwoffii ISP4 // Appl. Microbiol. Biotechnol. 2006. Vol. 72. P. 1263-1269.
- Ventosa A., Nieto J.J., Oren A. Biology of moderately halophilic aerobic bacteria // Microbiol. Molec. Biol. Rev. 1998. Vol. 62, № 2. P. 504-544.
- Xu X.R., Li H.B., Gu J.D. Metabolism and biochemical pathway of N-Butyl Benzyl Phthalate by Pseudomonas fluorescens B-1 isolated from a mangrove sediment // Ecotoxicol. Environ. Safety. 2007. Vol. 68, № 3. P. 379-385.


