Гуминовые вещества как регуляторы экологического гомеостаза
Автор: Аввакумова Надежда Петровна, Кривопалова Мария Ариевна, Глубокова Мария Николаевна, Катунина Елена Евгеньевна, Жданова Алина Валитовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Общая биология
Статья в выпуске: 2-2 т.18, 2016 года.
Бесплатный доступ
Гуминовые вещества низкоминерализованных иловых сульфидных грязей выполняют важнейшую роль в поддержании металло-ионного гомеостаза озер санатория «Сергиевские минеральные воды», иммобилизуя ионы-токсиканты и нивелируя антропогенные факторы, влияющие на естественный характер функционирования экосистемы и процессы формирования лечебных грязей. Определена предельная концентрация металлов-токсикантов, вызывающая коагуляцию наиболее значимой части специфических органических веществ - гуминовых, гиматомелановых и гумусовых кислот пелоидов.
Гуминовые кислоты, гиматомелановые кислоты, гумусовые кислоты, металлы-токсиканты, экологический гомеостаз
Короткий адрес: https://sciup.org/148204466
IDR: 148204466 | УДК: 547.992.2:615.838.7:616-073.584
Текст научной статьи Гуминовые вещества как регуляторы экологического гомеостаза
источникам ТМ относятся осадочные породы Самарского региона и термальные воды. Техногенные источники поступления ТМ весьма разнообразны. Среди приоритетных можно отметить сельскохозяйственные удобрения, сточные воды, металлообрабатывающие предприятия, автотранспорт. По данным ФГБУ «Приволжское УГМС» средние концентрации металлов на территории Самарского региона наблюдаются на уровне 0,1-1,3 ПДК, максимальные – 0,2-3,6 ПДК. Среднее содержание свинца в 1,3 раза превысило уровень ПДК, максимальное содержание свинца и цинка превысило нормативы в 3,6 и 1,1 раза, никеля – составило 1,0 ПДК. В почвах Самары только среднее содержание кадмия и марганца не превышает фоновое. По другим металлам отмечались превышения фоновых значений в диапазоне 1,7-2,5, для никеля среднее содержание в единицах фона составило 1,0.
При интенсивной антропогенной нагрузке происходит накопление значительного количества ТМ, оказывающих негативное влияние на равновесие в биогеоценозах. Аккумуляция ТМ происходит как почвами агрофитоценозов, так и органическим веществом водоемов [8, 9]. Следует отметить, что не все ТМ являются одинаково опасными и по абиотичности, можно выделить свинец, кадмий, медь, цинк, кобальт, молибден, олово, ртуть, мышьяк. Механизм токсичности ТМ связан с их коагулирующим действием на белки и другие макромолекулы, выполняющие ферментативную и регуляторную функции.
Особенностью гидрологического режима формирования иловых сульфидных грязей озер санатория «Сергиевские минеральные воды» является восстановительная среда в условиях максимальной гидро-термальности. Поступление ТМ может привести к флокуляции и образованию рыхлых хлопьевидных скоплений, с последующей седиментацией и образованием твердого осадка [4, 6, 7]. Ежегодное снижение запасов пелоидов объясняется не только их постоянной добычей, но и деградацией грязевых залежей вследствие экологической загрязненности. Наиболее часто месторождения лечебных грязей подвергаются загрязнению ТМ. Являясь природными комплексонами, гумусовые кислоты лечебных грязей необратимо связывают ионы ТМ, при этом сами становятся потенциально опасными при их использовании.
Цель работы: изучение динамики взаимодействия в ряду гумусовых кислот пелоидов с ионами различных металлов.
Материалы и методы. Анализу подвергались образцы нативной грязи, высушенные воздушносухим методом. Выделение и фракционирование гумусовых кислот осуществляли согласно методикам, приведенной в работе [7]. Содержание металлов определяли рентгенофлуоресцентным методом с помощью энергодисперсионного анализатора БРА-18.
Результаты и обсуждение . Проведенные нами исследования свидетельствуют об отсутствии в нативной грязи озер «Сергиевские минеральные воды»
наиболее опасных экотоксикантов, таких как кадмий, свинец, барий, селен. В образцах грязи также не обнаружены ионы марганца и серебра. Наиболее представлены, как и ожидалось, ионы железа, присутствующие в виде сульфидов и гидросульфидов (табл. 1). Содержание стронция примерно на порядок ниже, чем железа, но преобладает среди других определяемых элементов. Присутствие ионов меди, цинка, хрома, никеля, кобальта сопоставимо между собой и составляет тысячные доли процента от воздушно-сухого образца.
Таблица 1. Содержание ТМ (%масс.) в нативной грязи и пелоидопрепаратах
|
Элемент г*10-5 |
Нативная грязь |
Суммарный препарат |
Фульвокис-лоты |
Гуминовые кислоты |
|
медь |
0,115 ± 0,03 |
4,50 ± 1,28 ⋅ 10-5 |
3,00 ± 0,85 ⋅ 10-7 |
1,43 ± 0,41 ⋅ 10-5 |
|
цинк |
0,28 ± 0,05 |
1,63 ± 0,32 ⋅ 10-5 |
7,60 ± 1,49 ⋅ 10-6 |
9,40 ± 1,86 ⋅ 10-6 |
|
ртуть |
0,56 ± 0,09 ⋅ 10-3 |
1,60 ± 0,25 ⋅ 10-7 |
1,2 ± 0,19 ⋅ 10-7 |
3,70 ± 0,59 ⋅ 10-7 |
|
хром |
0,16 ± 0,03 |
5,40 ± 1,11 ⋅ 10-5 |
3,00 ± 0,61 ⋅ 10-7 |
3,43 ± 0,70 ⋅ 10-5 |
|
железо |
28,00 ± 4,39 |
3,00 ± 0,47 ⋅ 10-7 |
- |
- |
|
никель |
0,20 ± 0,04 |
4,66 ± 0,97 ⋅ 10-5 |
- |
1,06 ± 0,22 ⋅ 10-5 |
|
кобальт |
0,04 ± 0,008 |
- |
- |
- |
|
стронций |
0,42 ± 0,008 |
- |
- |
- |
Обращает на себя внимание содержание большего количества металлов в низкоминерализованной гидрофобной фракции гуминовых кислот, зольность которой не превышает 1% по сравнению с высокозольными фульвокислотами (зольность выше 30%), что подтверждает высокую комплексообразовательную способность гуминовых кислот, отличающихся от фульвокислот как строением, так и размерами макромолекул. Результаты определения элементов в мольных выражениях приведены в табл. 2. Количество моль-ионов исследуемых металлов в гумусовых кислотах колеблется от 10 -9 % до 10 -6 % и неравномерно распределяется между фульвовыми и гуминовыми кислотами. Содержание металлов в гуминовых кислотах и суммарном препарате сопоставимо между собой. Исключение составляет железо, которое не переходит в очищенные фракции.
Определение указанных элементов в мольных процентах свидетельствует об их различном содержании в гуминовых и фульвокислотах. Количество ионов цинка в гуминовых кислотах превышает в пять раз, меди – в 170 раз, ртути – в десять раз по сравнению с аналогичными показателями фульвокислот. Соединения никеля и хрома практически полностью переходят в группу гуминовых кислот. Фульвокислоты, включающие большее число карбоксильных групп, но менее выраженное ароматическое ядро, обладают относительно слабой комплексообразовательной способностью. Данное обстоятельство позволяет предположить, что наиболее прочными являются комплексные соединения, в которых задействованы ароматические структуры наиболее высокомолекулярных фракций.
Таблица 2. Распределение ионов металлов в воздушно-сухой навеске по фракциям низкоминерализованных иловых сульфидных грязей (%% мольн.)
|
Хим. элемент |
Воздушно-сухой образец |
Декальци-рованный образец |
Суммарный препарат |
Фульво-кислоты |
Гуминовые кислоты |
|
медь |
4,375 ⋅ 10-5 |
1,114 ⋅ 10-5 |
2,188 ⋅ 10-6 |
4,375 ⋅ 10-9 |
7,500 ⋅ 10-7 |
|
цинк |
1,082 ⋅ 10-4 |
4,431 ⋅ 10-6 |
8,154 ⋅ 10-7 |
1,077 ⋅ 10-7 |
5,492 ⋅ 10-7 |
|
ртуть |
7,000 ⋅ 10-8 |
5,000 ⋅ 10-12 |
2,550 ⋅ 10-9 |
5,500 ⋅ 10-10 |
7,000 ⋅ 10-9 |
|
хром |
7,692 ⋅ 10-5 |
2,308 ⋅ 10-5 |
3,269 ⋅ 10-6 |
5,365 ⋅ 10-11 |
2,500 ⋅ 10-6 |
|
железо |
1,250 ⋅ 10-2 |
2,143 ⋅ 10-3 |
1,714 ⋅ 10-8 |
- |
- |
|
никель |
8,373 ⋅ 10-5 |
7,373 ⋅ 10-6 |
2,542 ⋅ 10-6 |
- |
6,780 ⋅ 10-7 |
|
кобальт |
1,663 ⋅ 10-5 |
- |
- |
- |
- |
|
стронций |
1,182 ⋅ 10-4 |
- |
- |
- |
- |
Экспериментальные исследования показали зависимость пороговой концентрации электролита от времени экспозиции, поэтому мы сочли корректным определять количество металла, способное максимально связаться с пелоидопрепаратами. Для гуминовых кислот динамическое равновесие устанавливается через 1 час (рис. 1). Гиматомелановые кислоты характеризуются меньшим содержанием функциональных групп кислотного характера, поэтому для установления равновесия необходимо более длительное время – 24 часа (рис. 2). Динамика процесса коагуляции для всех компонентов гумусовых кислот имеет сходный харак- тер (рис. 3) и отличается только пороговыми концентрациями.
Анализ зависимости коагулирующей способности ионов металлов от различных факторов не обнаружил корреляционной зависимости от заряда ядер элементов, энергии ионизации, величины электроотрицательности металлов. Активно происходит иммобилизация токсичных металлов: свинца, хрома, меди с образованием высоко устойчивых соединений. Устойчивость образующихся гумусонатов доказывается практически полным обесцвечиваем раствора над осадком и значением оптической плотности ниже 0,1.
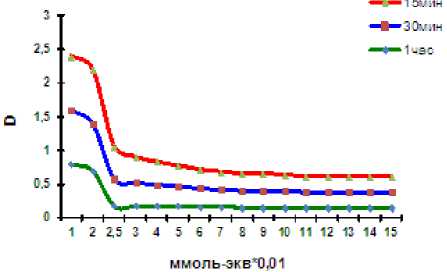
Рис. 1. Динамика коагуляции гуминовых кислот ионами Со(II).
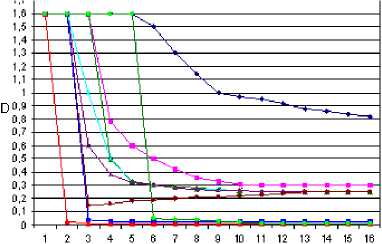
-—Mg(ll)
Ca(ll)
—Zh(ll) ^Mn(ll)
-—Cr(lll)
—— Cu(ll) ~*~ Pb(ll)
-^Ag(l)
ммоль-экв*0,01
Рис. 3. Динамика процесса коагуляции гумусовых кислот различными металлами
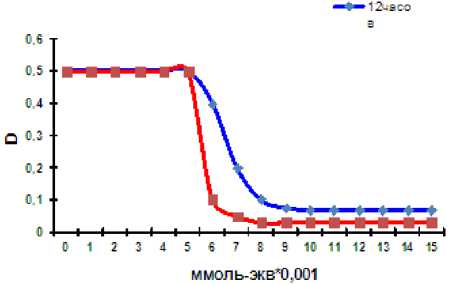
Рис. 2. Динамика коагуляции гиматомелановых кислот ионами Со(II).
Следует особо отметить, что ионы магния, как компонента хлорофилла, практически не депонируются гуминовыми веществами (рис. 3), что свидетельствует о существовании тонкого динамического равновесия в экосистемах. Обращает на себя внимание динамика коагулирующей способности ионов серебра. Сравнительно долго серебросодержащие комплексы остаются растворимыми, но при достижении критической концентрации образуют чрезвычайно устойчивые соединения, о чем свидетельствует практически полное отсутствие окрашивания остаточного раствора, оптическая плотность которого составляет 0,02. Взаимодействие в системе «гумусовые кислоты – металл», по-видимому, имеет сложный характер, включающий процессы солеобразования за счет кислотных функциональных групп и комплексообразовательные процессы (таблицы 3-5).
Таблица 3. Коагуляция гиматомелановых кислот ионами различных металлов
|
Характер иона |
С (иона) ммоль-экв./г |
С (иона) ммоль/ г |
1/С |
С (иона) мг/г |
Оптическая плотность раствора |
|
Ag+ |
7,50 |
7,50 |
0,13 |
810,00 |
0,020 |
|
Cu2+ |
0,75 |
0,375 |
2,67 |
24,00 |
0,025 |
|
Ni2+ |
2,00 |
1,00 |
1,00 |
59,00 |
0,065 |
|
Mg2+ |
10,00 |
5,00 |
0,20 |
120,00 |
0,350 |
|
Co2+ |
2,00 |
1,00 |
1,00 |
59,00 |
0,045 |
|
Mn2+ |
2,50 |
1,25 |
0,80 |
68,75 |
0,065 |
|
Pb2+ |
0,375 |
0,187 |
5,35 |
38,71 |
0,050 |
|
Zn2+ |
4,00 |
2,00 |
0,50 |
130,00 |
0,100 |
|
Ca2+ |
2,50 |
1,25 |
0,80 |
50,00 |
0,065 |
|
Ba2+ |
1,25 |
0,625 |
1,60 |
85,63 |
0,035 |
|
Cr3+ |
0,75 |
0,25 |
4,00 |
13,00 |
0,025 |
Таблица 4. Коагуляция гуминовых кислот ионами различных металлов
|
Характер иона |
С (иона) ммоль-экв./г |
С (иона) ммоль/ г |
1/С |
С (иона) мг/г |
Оптическая плотность раствора |
|
Ag+ |
7,50 |
7,50 |
0,13 |
810,00 |
0,020 |
|
Cu2+ |
0,75 |
0,375 |
2,67 |
24,00 |
0,050 |
|
Ni2+ |
2,50 |
1,35 |
0,80 |
73,75 |
0,120 |
|
Mg2+ |
10,00 |
5,00 |
0,20 |
120,00 |
0,550 |
|
Co2+ |
2,00 |
1,00 |
1,00 |
59,00 |
0,130 |
|
Mn2+ |
2,50 |
1,25 |
0,80 |
68,75 |
0,140 |
|
Pb2+ |
0,375 |
0,187 |
5,35 |
38,71 |
0,050 |
|
Zn2+ |
4,00 |
2,00 |
0,50 |
130,00 |
0,110 |
|
Ca2+ |
4,00 |
2,00 |
0,50 |
80,00 |
0,120 |
|
Ba2+ |
2,00 |
1,00 |
1,00 |
137,00 |
0,060 |
|
Cr3+ |
0,50 |
0,167 |
5,99 |
8,68 |
0,100 |
Комплексные соединения могут образовываться посредством ближайших молекул или их частей, если между ними происходит процесс перехода электронов, в результате чего возникают электронные донорно- акцепторные комплексы, которые стабилизируются посредством внутримолекулярной мезомерии. Динамика коагуляции гумусовых кислот ионами магния свидетельствует об ином механизме взаимодействия. Комплексообразовательная способность пелоидопре-паратов коррелирует со степенью бензоидности и возрастает в ряду: гиматомелановые, гуминовые кислоты. Характер взаимодействия «металл – гумусовые кислоты» не укладывается в классические подходы комплек- сообразования, когда определяющей является природа лиганда. Мы получаем соединения примерно одинаковой агрегативной устойчивости в ряду: гиматомелано-вые, гуминовые кислоты, суммарный препарат, но внутри ряда схожие по электронной структуре металлы значительно различаются по их растворимости. Например, гуматы и гиматомеланаты кальция (табл. 3, 4) вдвое устойчивее аналогичных соединений бария.
Таблица 5. Коагуляция гумусовых кислот ионами различных металлов
|
Характер иона |
С (иона) ммоль-экв./г |
С (иона) ммоль/ г |
1/С |
С (иона) мг/г |
Оптическая плотность раствора |
|
Ag+ |
7,50 |
7,50 |
0,13 |
810,00 |
0,050 |
|
Cu2+ |
1,00 |
0,50 |
2,00 |
32,00 |
0,030 |
|
Ni2+ |
2,00 |
1,00 |
1,00 |
59,00 |
0,070 |
|
Mg2+ |
10,00 |
5,00 |
0,20 |
120,00 |
0,130 |
|
Co2+ |
2,00 |
1,00 |
0,50 |
118,00 |
0,075 |
|
Mn2+ |
2,50 |
1,25 |
0,80 |
68,75 |
0,060 |
|
Pb2+ |
0,375 |
0,187 |
5,35 |
38,71 |
0,005 |
|
Zn2+ |
5,00 |
2,50 |
0,40 |
162,50 |
0,120 |
|
Ca2+ |
3,75 |
1,87 |
0,53 |
74,80 |
0,070 |
|
Ba2+ |
1,50 |
0,75 |
1,33 |
102,75 |
0,030 |
|
Cr3+ |
0,375 |
0,123 |
8,13 |
6,40 |
0,075 |
Анализ коагулирующей способности двухзарядных ионов свидетельствует о большом разбросе данного показателя, то есть заряд иона не является определяющей характеристикой указанного свойства. Если коагулирующую способность иона свинца принять за 100%, то для магния она составит у всех гумусовых кислот всего 3,75%, для марганца – 14,95%. Для остальных ионов характерны колебания коагулирующей способности гумусовых препаратов, но они незначительны. Агрегативная устойчивость гиматомелановых кислот (таблица 3), содержащих меньшее количество функциональных групп, как правило, ниже, чем гуминовых кислот и суммарного препарата. Это свидетельствует о том, что величина молекулярной массы также не является определяющим фактором в агрегативной устойчивости для этих соединений. Коагулирующая способность ионов серебра составляет всего 2,43% от аналогичного показателя свинца. Коагулирующая способность ионов хрома (III) составила в ряду: гиматоме-лановые, гуминовые кислоты, суммарный препарат – 74,77%, 111,98%, 151,96% соответственно (таблицы 3,4,5). Этот факт свидетельствует о некой (об определенной) зависимости коагулирующей способности от величины заряда иона, которая, однако, не подчиняется правилу Дерягина.
Из данных табл. 3-5 следует, что коагулирующая способность ионов металлов пропорциональна заряду их иона, если не брать во внимание ионы свинца. Однако строгого соответствия правилу Дерягина не наблюдается: вместо классического соотношения коагулирующей способности ионов как 1 :64 : 729 для одно-, двух- и трехзарядных ионов соответственно, получаем отношение коагулирующей способности ионов для гуминовых и гиматомелановых кислот равное 1 : 6 : 8; и приблизительно, 1 : 6 : 11 для суммарного препарата. Устойчивость образующихся соединений определяется наличием азот- и кислород- содержащих функциональных групп, выраженностью системы сопряжения, величинами молекулярных масс, характером конфигурации и конформации макромолекул, а также степенью мягкости ионов металлов как кислот Льюиса. Существенный вклад в связывании металлов гуминовыми веществами пелоидов вносят процессы адсорбционного типа. Совокупность перечисленных факторов, определяет приближенное подчинение известным закономерностям химии комплексных и высокомолекулярных соединений. Вместе с тем имеется корреляция между степенью биотичности ионов и их способностью к миграции в составе гумусовых кислот имеется корреляция.
Гумусовые кислоты обладают высоким сродством к ионам металлов, являясь природными лигандами. Взаимодействие «гумусовые кислоты – металл» имеет многовариантный характер, обеспечивая природные объекты необходимыми питательными элементами и иммобилизируя экотоксиканты. Возникает уникальная картина природной избирательности: ионов-биогенов и экотоксикантов. Гуминовые вещества иммобилизируют экотоксиканты и способствуют миграции биогенных металлов.
Выводы:
-
1. Изучена кинетика поглощения ионов металлов гуминовыми веществами пелоидов.
-
2. Выяснены особенности поведения в системе «гумусовые кислоты- ионы металла» в зависимости от физико-химических характеристик металлов.
-
3. Показана высокая аккумулирующая способность гуминовых веществ пелоидов по отношению к метал-лам-токсикантам, определяющая металло-ионный
гомеостаз экосистем.
Список литературы Гуминовые вещества как регуляторы экологического гомеостаза
- Аввакумова, Н.П. Экопротекторная функция отдельных групп гуминовых веществ низкоминерализованных иловых сульфидных грязей/Н.П. Аввакумова, М.А. Кривопалова, А.А. Аввакумова//Сб. докл. Междун. эколог. форума «Сохраним планету Земля». -СПб., 2004. С. 369-373.
- Аввакумова, Н.П. Природа защитного действия гуминовых веществ различного генеза/Н.П. Аввакумова, М.А. Кривопалова, А.В. Жданова и др.//Известия Самарского научного центра Российской академии наук. 2012. Т. 14. № 1(8). С. 2104-2107.
- Аввакумова, Н.П. Амфифильность гумусовых кислот как фактор гомеостаза лечебных грязей/Н.П. Аввакумова, Е.Е. Катунина, М.А. Кривопалова и др.//Известия Самарского научного центра Российской академии наук. 2009. Т. 11. № 1-6. С. 1253-1255.
- Аввакумова, Н.П. Гуматы кальция и бария: синтез, физико-химические свойства/Аввакумова Н.П., Кривопалова М.А., Глубокова М.Н. и др.//Известия Самарского научного центра Российской академии наук. 2013. Т. 15. №3(3). С. 1163-1166.
- Беркович, A.M. Применение гуминовых и гуминоподобных препаратов в ветеринарии и медицине. Статья 14.09.2007. Найдено из Интернет: http://www.rambler.ru/.
- Бузлама, А.В. Экспериментальный анализ адаптогенной активности лигногумата/А.В. Бузлама, Ю.Н. Чернов, А.И. Сливкин, Н.Н. Бурденко//Вестник ВГУ. Серия: Химия. Биология. Фармация. 2010. № 2. С. 135-139.
- Орлов, Д.С. Гумусовые кислоты почв и общая теория гумификации. -М., 1990. 325 с.
- Плаксина, Т.И. Актуальные проблемы охраны природы Самарского края//Известия Самарского научного центра Российской академии наук. 2009. Т. 11. № 1(3). С. 1459-1462.
- Сучков, В.В. Риск здоровью от воздействия химических веществ, находящихся в питьевой воде из подземных источников//Аспирантский вестник Поволжья 2013. № 5-6, С. 218-220.


