Характер изменений вегетативной регуляции по вариабельности сердечного ритма при лапароскопических оперативных вмешательствах с использованием напряженного карбоксиперитонеума
Автор: Голубев Александр Александрович, Зуева Вера Александровна, Еремеев А.Г., Шпак Леда Викторовна, Кононова Алла Геннадьевна
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
Целью исследования явилось изучение степени стрессорности напряженного карбоксиперитонеума в ходе лапароскопических оперативных вмешательств. Использовался метод кардиоинтервалографии. Кардиоинтервалограммы снимались на следующих этапах оперативного вмешательства: до наложения карбоксиперитонеума, перед десуфляцией, через 5 и 15 минут после десуфляции. Изучались статистические, временные и частотные показатели вариабельности сердечного ритма с анализом скаттер- и гистограмм. Как показали результаты исследования, исходные показатели характеризовались состоянием вегетативной нормотонии. На высоте карбоксиперитонеума выявлялась избыточность центральных (гипоталамических) и симпатических влияний на регуляцию сердечного ритма. Через 5 минут после десуфляции отмечалось снижение симпатического доминирования. Через 15 минут после десуфляции выявлен сдвиг вегетативного равновесия в парасимпатическую сторону с развитием у некоторых пациентов нарушений сердечного ритма. Обнаруженные изменения кардиоинтервалограмм связаны с расстройством газового состава крови и кислотно-щелочного равновесия, а также перераспределением крови в кровеносном русле, вызванным влиянием напряженного карбоксиперитонеума. Необходим поиск путей минимизации этого негативного влияния.
Напряженный карбоксиперитонеума, негативный эффект, вариабельность ритма сердца
Короткий адрес: https://sciup.org/142211525
IDR: 142211525 | УДК: 617-089
Текст научной статьи Характер изменений вегетативной регуляции по вариабельности сердечного ритма при лапароскопических оперативных вмешательствах с использованием напряженного карбоксиперитонеума
Негативное влияние напряженного карбоксиперитонеума (НКП) на различные системы и органы при лапароскопических вмешательствах стало изучаться сравнительно недавно [1–6]. Известно, что в ходе выполнения лапароскопических операций с использованием НКП нарушается кислотнощелочной и газовый состав крови, происходит перераспределение объема циркулирующей крови в бассейнах нижней и верхней полых вен, сдавление нижней полой вены и нарушение кровотока в артериях и венах брюшной полости и забрюшинного пространства [3, 7–13]. При НКП страдает церебральный кровоток, повышается давление в спинномозговом канале и желудочках головного мозга [14–17]. При этом лапароскопические операции чаще всего проводятся пациен- там с уже имеющейся сопутствующей сердечно-сосудистой и бронхолегочной патологией [6, 18–20], поэтому необходимо минимизировать негативные эффекты применения НКП [1, 2, 6, 11, 20, 21]. Вместе с тем недостаточно изученными остаются вегетативные нарушения, развивающиеся у пациентов при наложении НКП, до настоящего времени не исследовались временные и частотные составляющие вариабельности сердечного ритма, не известны условия возникновения и длительность аритмогенной готовности миокарда в ходе лапароскопического вмешательства.
Целью исследования явилось изучение вегетативных нарушений и степени стрессорности напряженного карбоксипе-ритонеума при лапароскопических оперативных вмешательствах.
Материалы и методы
В условиях хирургического стационара ГБУЗ «Областная клиническая больница» г. Твери обследовано 90 пациентов (мужчин – 6, женщин – 84; средний возраст – 49±2 года). Всем больным проводилась лапароскопическая холецистэктомия с наложением НКП. Состояние вегетативной регуляции изучалось методом кардиоинтервалографии (прибор «КАД – 03», фирма «ДНК и К», Тверь) [23]. Кардиоинтервалограммы (КИГ) снимались в ходе операций с применением НКП на уровне 12 мм рт. ст. на следующих этапах оперативного вмешательства: исходно – до наложения НКП, перед десуфляцией, через 5 и 15 минут после десуфляции. Анализировалась выборка из 250 RR-интервалов, полученная при 10–15 минутной записи электрокардиограммы. Изучались статистические, временные и частотные показатели вариабельности сердечного ритма (ВСР) с визуальным анализом скаттер- и гистограмм [23]. Статистические параметры включали: частоту сердечных сокращений (ЧСС), дисперсию интервала QT (QTd), моду (Mo – наиболее часто встречающаяся величина кардиоинтервала RR (NN, с), амплитуду моды (AMo, % – количество наиболее часто встречающихся интервалов RR (NN) динамического ряда и характеризующий преимущественно активность симпатического отдела вегетативной нервной системы (ВНС); вариационный размах (ВР, ΔХ, с – разница между максимальным и минимальным значениями длительности кардиоинтервала, отражающий преимущественно парасимпатическую направленность регуляторных влияний), индекс напряжения (ИН, условных единиц (усл. ед.) – соотношение Мо, АМо и ΔХ – суммарный показатель напряженности регуляторных систем, чувствительный к усилению тонуса симпатического отдела ВНС), индекс вегетативного равновесия (ИВР, усл. ед. – отражает соотношение между активностью симпатического и парасимпатического отделов ВНС); вегетативный показатель ритма (ВПР, усл. ед. – позволяет судить о вегетативном балансе по активности автономного контура); показатель активности регуляторных процессов (ПАПР, усл. ед. – комплексная величина оценки ВСР, которая отражает степень централизации управления сердечным ритмом). Определялись показатели временного анализа: стандартное отклонение усредненных интервалов NN (SDNN, мс), квадратный корень из средней суммы квадратов разностей между последовательными NN интервалами (RMSSD, мс), пропорция NN интервалов между смежными, превосходящими 50 мс к общему количеству NN интервалов (рNN50, %), триангуляционный индекс ВСР (HRVtr, интеграл плотности распределения, отнесенный к максимуму плотности распределения). Из показателей частотного анализа оценивались: общая спектральная мощность реализации интервалов NN (TF, мс2), мощность сверхнизкочастотного компонента вариабельности ритма (VLF, мс2) и низкочастотного компонента (LF, мс2), мощность спектра высокочастотного компонента (HF, мс2), а также отношение низкочастотной к высокочастотной составляющей в абсолютных единицах (LF/HF, усл. ед., отражающее вагусносимпатический баланс) [1, 2, 23]. Достоверность полученных результатов оценивалась с помощью методов вариационной статистики с использованием t-критерия Стьюдента.
Результаты
Исходные показатели ВСР в группе наблюдения характеризовались нормальными ЧСС (76±5,0) и QTd (табл. 1), а математические, временные и частотные величины указывали на усиление вегетативной регуляции с незначительной активацией симпатического (увеличение АМо, ИН, ПАПР, ИВР при уменьшении SDNN, pNN50, HRVtr, HF) и парасимпатического (некоторое повышение по сравнению с нормой Мо, ВР, ВПР, RMSSD, TF при снижении LF) звеньев без явного преобладания каждого из них. Одновременное увеличение Мо с ВР и АМо с ИН при уменьшении соотношения LF/HF также подтверждало разнонаправленную симпатико-вагусную активацию. Полученные результаты, вероятно, объясняются формированием функционального антагонизма на фоне операционного стресса и премедикации. Усредненная скаттерграмма имела вид развернутого овала (нормотония), а график гистограмм чаще имел симметричную нормотоническую мономодальную форму. Таким образом, исходно суммарный эффект регуляции характеризуется вегетативным равновесием с устойчивым (тормозным) состоянием гуморально-гормонально-вегетативных звеньев регуляции и стабильностью тонуса блуждающего и симпатического нервов.
На высоте НКП регистрировалась синусовая тахикардия (ЧСС – 110±3,1 в мин.), укорочение QTd и признаки выраженной гиперсимпатикотонии (табл. 1) – уменьшение Мо при увеличении АМо и особенно значительно – ИН, ПАПР, ВПР, и ИВР (табл. 1). Это отражало преимущественно центральные (гипоталамические) и симпатические влияния на сердечный ритм. При этом практически полностью подавлялся автономный контур регуляции сердечного ритма (увеличение АМо и ИН в сочетании с многократным уменьшением ΔХ; р<0,001). Временные показатели отражали предельное напряжение регуляторных систем с вероятным риском сердечно-сосудистых осложнений: уменьшение SDNN, RMSSD, HRVtr (р<0,01). Известно, что снижение SDNN менее 50 мс и рNN50% ниже 1% и HRVtr менее 15 усл. ед. являются предикторами сердечных аритмий [1, 14], поэтому полученные данные подтверждали предположение об аритмогенном влиянии НКП. Частотный анализ обнаруживал значительное уменьшение вариабельности сердечного ритма, общей мощности спектра (TF) за счет практически исчезновения доли очень низкочастотных волн (VLF; р<0,001) и низкочастотных волн (LF; р<0,001), что отражало активацию гипоталамического (межсистемного) уровня центрального контура регуляции и свидетельствовало о напряжении механизмов гомеостаза. Усредненная скаттерграмма имела вид узкой точки, отражая ригидный ритм на фоне гипер-симпатикотонии, а график гистограмм у всех больных приобретал узкую мономодальную симпатотоническую (эксцессивную) форму. Таким образом, перед десуфляцией выявлена избыточность центральных (гипоталамических) и симпатических вли-
Динамика показателей ВСР у при лапароскопической холецистэктомии с применением НКП 12 мм рт. ст. (М+m)
Таблица 1
|
Показатели КИГ |
Период исследования |
|||
|
исходно |
Перед десуфляцией |
Через 5 минут после десуфляции |
Через 15 минут после десуфляции |
|
|
Математические |
||||
|
Mо, с |
0,97±0,005 |
0,56±0,012* |
0,45±0,01** |
0,49±0,36*** |
|
АМо, % |
42,0±4,1 |
98,0±3,2* |
87,3±3,2** |
81,6±11,2 |
|
ВР, с |
646,4±7,2 |
16,1±1,9* |
14,0±1,3** |
524,0±11,9 |
|
ИН, усл. ед. |
120,0±3,0 |
9091,1±21,5* |
6534,2±19,8** |
164,2±5,2 |
|
ПАПР, усл. ед. |
79,3±4,2 |
154,2±5,2* |
159,1±4,6** |
145,0±2,3 |
|
ВПР, усл. ед. |
13,6±0,2 |
201,5±0,85* |
189,6±0,36** |
13,9±0,4 |
|
ИВР, усл. ед. |
248,0±6,5 |
567,3±67,4* |
2693,0±54,6** |
196,2±9,3 |
|
Временные |
||||
|
SDNN, мс |
62,0±0,5 |
152,1±4,5* |
14,6±2,7** |
76,3±4,3 |
|
RMSSDмс |
32,1±0,7 |
16,4±0,45 |
1,2±0,3** |
93,5±1,5 |
|
pNN50% |
3,8±0,1 |
1,5±0,02* |
1,35±0,06** |
15,6±1,3*** |
|
HRVtr, усл. ед. |
12,1±1,2 |
4,3±0,12 |
3,9±0,01** |
2,6±0,04*** |
|
Частотные |
||||
|
TF, мс2 |
4678,0±45,9 |
4,21±1,51* |
5,3±1,5** |
6935,0±15,3 |
|
VLF, мс2 |
2166,2±15,2 |
1,23±0,01* |
3,3±0,003** |
1863,3±6,9 |
|
LF, мс2 |
814,3±19,8 |
0,98±0,02* |
0,93±0,09** |
1236,0±16,3 |
|
HF, мс2 |
301,2±25,6 |
4,53±0,15* |
0,99±0,26** |
3496,3±14,6 |
|
LF/HF |
2,02±0,015 |
0,74±0,12* |
0,97±0,32** |
0,45±0,09*** |
Достоверность различий (р<0,05-0,001) указана между периодами: перед десуфляцией (*), через 5 (**) и 15 (*** ) минут после десуфляции и исходными показател ями
яний на сердечный ритм, автономно – центральный вариант перенапряжения вегетативной регуляции с блокадой парасимпатических влияний, значительным уменьшением вариабельности сердечного ритма и формированием акцентированного симпатического синергизма, на пределе функциональных возможностей поддерживающего межсистемные гомеостатические механизмы.
Через 5 минут после десуфляции на фоне синусовой тахикардии (ЧСС – 119±2,1 в мин.) несколько улучшилась длительность QTd (табл. 1). Сохранялась выраженная симпатикотония (высокие значения ИН, АМо, ПАПР, ИВР, хотя и меньшие, по сравнению с предыдущим периодом исследования; р<0,05). Снижение ВПР отражало незначительное нарастание парасимпатической активности. Следовательно, уже в первые 5 минут после десуфляции выявлено ослабление степени централизации управления системы кровообращения и сохранение сдвига симпато-парасимпатического баланса в симпатическую сторону, несмотря на некоторое усиление вагусных влияний. Временные показатели практически не изменились (RMSSD, pNN50; р>0,05), оставаясь резко сниженными, указывая на сохраняющуюся ригидность сердечного ритма при очень незначительном увеличении SDNN и HRVtr. Частотный анализ ВСР показал недостоверное (р>0,05) увеличение общей мощности спектра (TF) за счет наибольшей доли очень низких частот (VLF – 65% от TF), подтверждало сохранение симпати-котонии. При этом увеличение доли высокочастотной составляющей мощности спектра (HF с 46 до 56%; р<0,02) свидетельствовало об усилении вагусной регуляции сердечного ритма. Вагосимпатический баланс был несколько ближе к равновесию (LF/HF=0,97; р>0,05), однако усредненная скаттерграмма также оставалась в виде сжатого (симпато-тонического) авторегрессивного «облака», а гистограмма также имела мономодальную (эксцессивную) форму. Таким образом, через 5 минут после десуфляции отмечается незначительное ослабление гиперсимпатикотонии и усиление вагусных влияний, свидетельствующие о сохраняющейся напряженности регуляторных систем с возможным срывом адаптации и переходом на автономный контур регуляции сердечного ритма, что создает условия для развития сердечных аритмий.
Через 15 минут после десуфляции (табл. 1) у 9 (10%) больных на фоне уменьшения тахикардии (ЧСС 98±1,3 в мин.) были выявлены нарушения сердечного ритма: желудочковая экстрасистолия – у 6 (в том числе бигеминия – у 3), предсердная экстрасистолия – у 3 пациентов. Повышался, но не достигал нормы QTd, а статистический анализ выявил нормальные значения ВПР и стремящийся к норме ИН, при этом высокие значения ПАПР (в 3 раза), АМо (в 2 раза) и ИВР свидетельствовали об ослабленной, но сохраняющейся централизации управления сердечным ритмом и выраженном напряжении гомеостаза. С другой стороны, временные показатели в виде увеличения RMSSD (в 3 раза) pNN50 (в 2 раза), при сниженных значениях HRVtr и, SDNN указывают на парасимпатическое доминирование. Выявленную разнонаправленность вегетативных влияний подтверждают частотные характеристики нарушения стационарности сердечного ритма. Резкое увеличение общей мощности спектра (TF; р<0,001 по сравнению с предыдущим периодом наблюдения), повышение до 50% доли высокочастотной вагусной составляющей спектра (HF) и сохраняющееся снижение LF/HF (до 0,45) отражало нарастающую дискоор-динацию в функционировании сердечно-сосудистой системы, наступающую на фоне мощных эфферентных парасимпатических влияний. Следовательно, через 15 мин. после десуфляции, симпатическое доминирование сменяется парасимпатическим, с угрозой развития нарушений сердечного ритма на пике ваго-тонии. Критериями прогностического риска в этих случаях являются признаки нарастающего парасимпатического доминирования (увеличение DX, RMSSD, pNN50, TF, HF при снижении ИН). Усредненная скаттерграмма приобретала вид рассеянного «облака», что также подтверждает усиление вагусных влияний, а гистограмма чаще имела полимодальную (ваготоническую) форму.
Как показал дальнейший анализ полученных результатов, описанные нарушения ВСР при использовании карбоксипе-ритонеума 12 мм рт. ст., регистрировались не только у пожилых, но и у лиц среднего и молодого возраста. Статистических различий показателей ВРС в возрастных группах получено не было (р>0,05).
Клинический пример: Пациентка З. Возраст – 57 лет, индекс массы тела (ИМТ) – 36. Сопутствующие заболевания: варикозное расширение вен нижних конечностей, ожирение экзогенно-конституциональное II степени. Уровень КП – 12 мм рт. ст. Длительность операции – 40 минут.
Исходно (рис. 1): нормальная ЧСC и QTd сочетаются с математическими признаками вегетативного равновесия (Mo, AMo, ВР, ИН, ВПР и ИВР соответствуют норме) с устойчивым состоянием вегетативной регуляции и стабильностью тонуса симпатического и блуждающего нервов, что, возможно, связанно с адекватной премедикацией. Этому соответствуют данные временного анализа ВСР: SDNN, RMSSD, pNN50 и HRVtr указывают на то, что суммарный эффект регуляции соответствует вегетативной эйтонии. Согласно частотному анализу, суммарный уровень активности отражает отсутствие напряженности регуляторных систем (TF, VLF в норме) и сниженную активность симпатического (LF) компонента и парасимпатического (HF) отдела ВНС с некоторым преобладанием симпатического (LF/HF=2,1).
Скаттерграмма имеет вид «облака» овальной формы, а гистограмма – нормотонический мономодальный тип. Таким образом, у пациентки исходно выявляется вегетативное равновесие со стабильностью тонуса блуждающего и симпатического нервов с некоторым преобладанием симпатического отдела.
Перед десуфляцией (рис. 2): регистрируется синусовая тахикардия (ЧСС – 110 в мин.), укорочение QTd в 11 раз (до 15 мс) и синдром выраженной симпатикотонии (уменьшение Мо при увеличении АМо и особенно значительно – ИН (в 139 раз), ПАПР (в 3 раза), ВПР (в 57), и ИВР (в 100 раз), указывая на избыточность центральных и симпатических влияний на сердечный ритм. При этом резкое увеличение АМо и ИН в сочетании с многократным уменьшением ΔХ (практически до 0) указывают на развитие автономно-центрального варианта перенапряжения вегетативной регуляции с возможным риском сердечно-сосудистых нарушений. Временные показатели также отражают предельное напряжение регуляторных систем, когда главную роль играют высокие уровни управления с полным подавлением активности автономного контура и блокадой парасимпатических влияний (уменьшение SDNN в 60 раз, RMSSD – в 20 раз, HRVtr – в 13 раз), при этом резкое снижение SDNN и HRVtr являются предиктором сердечных аритмий. Частотный анализ обнаруживает значительное уменьшение вариабельности сердечного ритма (RRd=6 мс), общей мощности
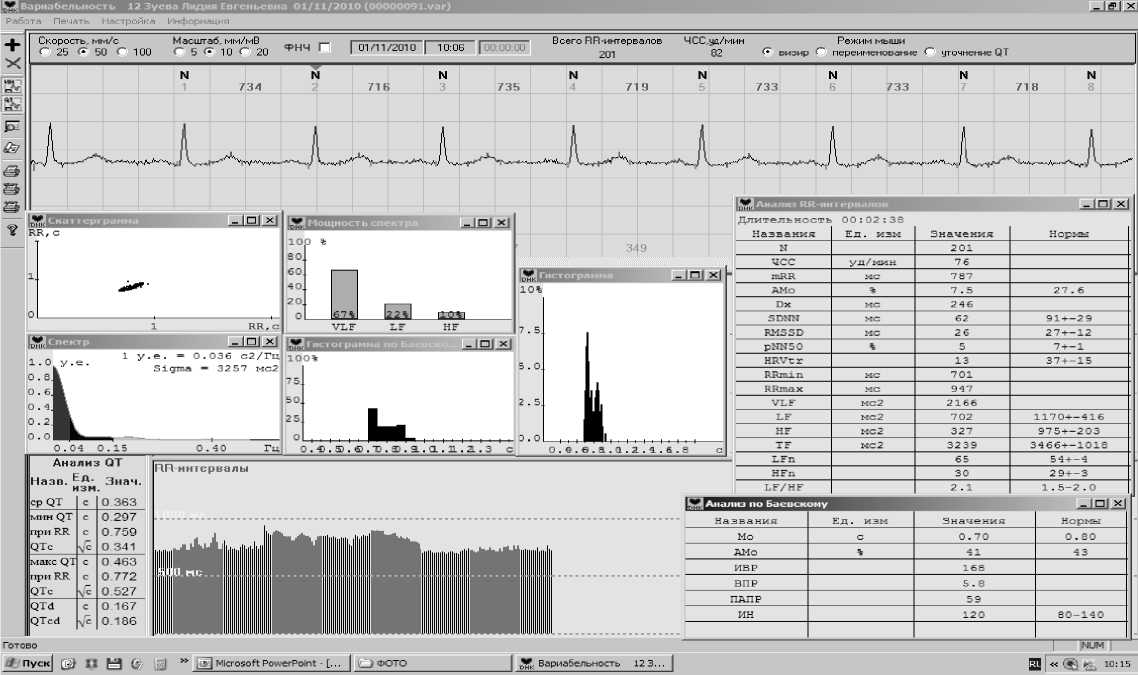
Рис. 1. Исходная кардиоинтервалограмма
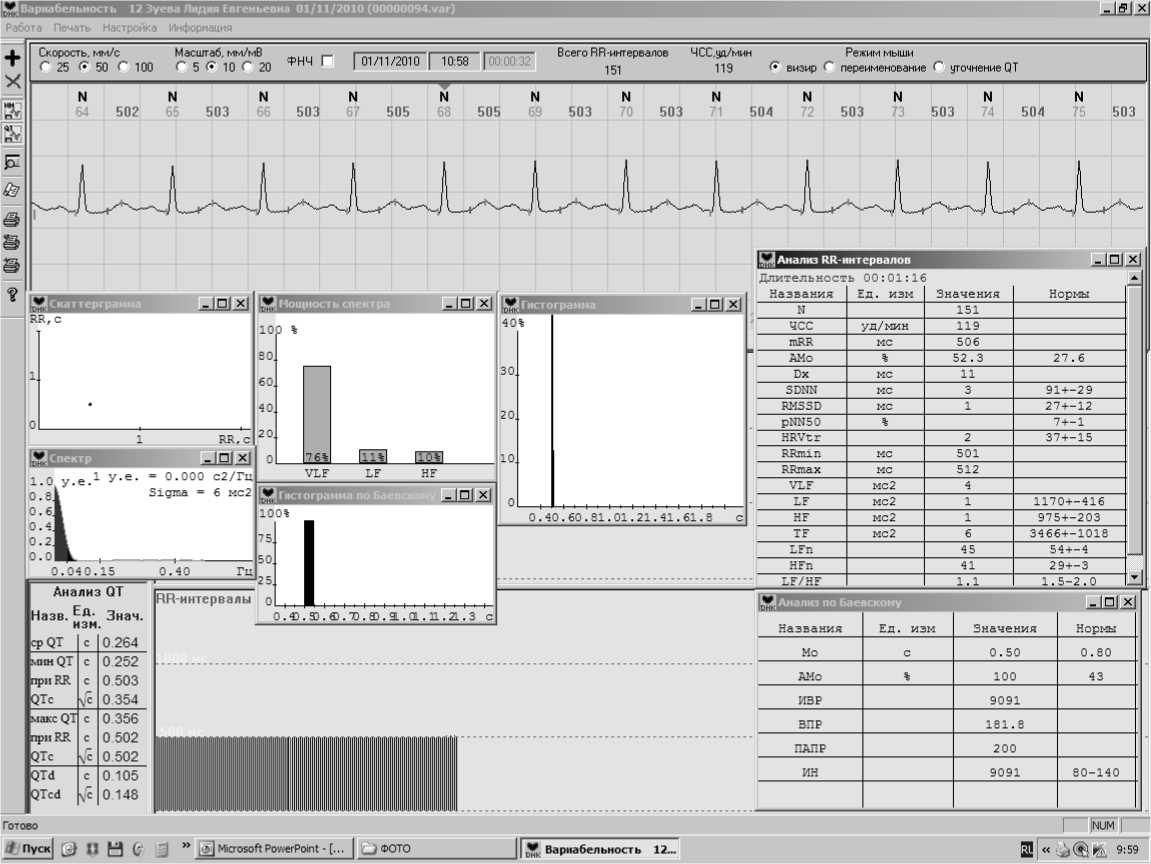
Рис. 2. Кардиоинтервалограмма перед десуфляцией
спектра (TF=1,0) за счет уменьшения доли очень низкочастотных волн (VLF – 14% от TF), что отражает активацию гипоталамического (межсистемного) уровня центрального контура регуляции и свидетельствует о напряжении механизмов гомеостаза. Усредненная скаттерграмма имеет вид точки, отражая ригидный ритм на фоне высокой симпатической активности, а гистограмма приобретает симпатотоническую (эксцессив-ную) форму. Таким образом, перед десуфляцией у больной подтвержден синдром выраженной симпатикотонии с преобладанием центрального контура регуляции сердечного ритма и блокадой вагусных влияний с формированием аритмогенной готовности миокарда.
Через 5 мин. после десуфляции (рис. 3), несмотря на увеличение тахикардии (119 в мин.), несколько улучшилась длительность QTd (0,105 c). Остаются без изменения влияния гуморального канала регуляции и выраженность симпатикотонии
(уменьшение Мо и увеличение АМо). Снизился (на 55%), но остается увеличенным ИН, указывая на ослабление степени централизации управления системы кровообращения, чему соответствует уменьшение ПАПР (так же на 54%). При этом снижение ВПР отражает некоторое нарастание парасимпатической активности. Следовательно, уже в первые 5 минут после десуфляции уменьшается напряженность надсегментарных структур, стимулирующих сердечно-сосудистую систему, но сохраняется сдвиг симпатопарасимпатического баланса в симпатическую сторону, несмотря на некоторое усиление вагусных влияний. Временные и частотные показатели остаются на низком уровне, отражая снижающуюся способность синусового узла отвечать на вегетативную стимуляцию. При этом временные характеристики практически не изменяются (RMSSD, pNN50), оставаясь резко сниженными и указывая на сохраняющуюся ригидность сердечного ритма при некотором увеличе-
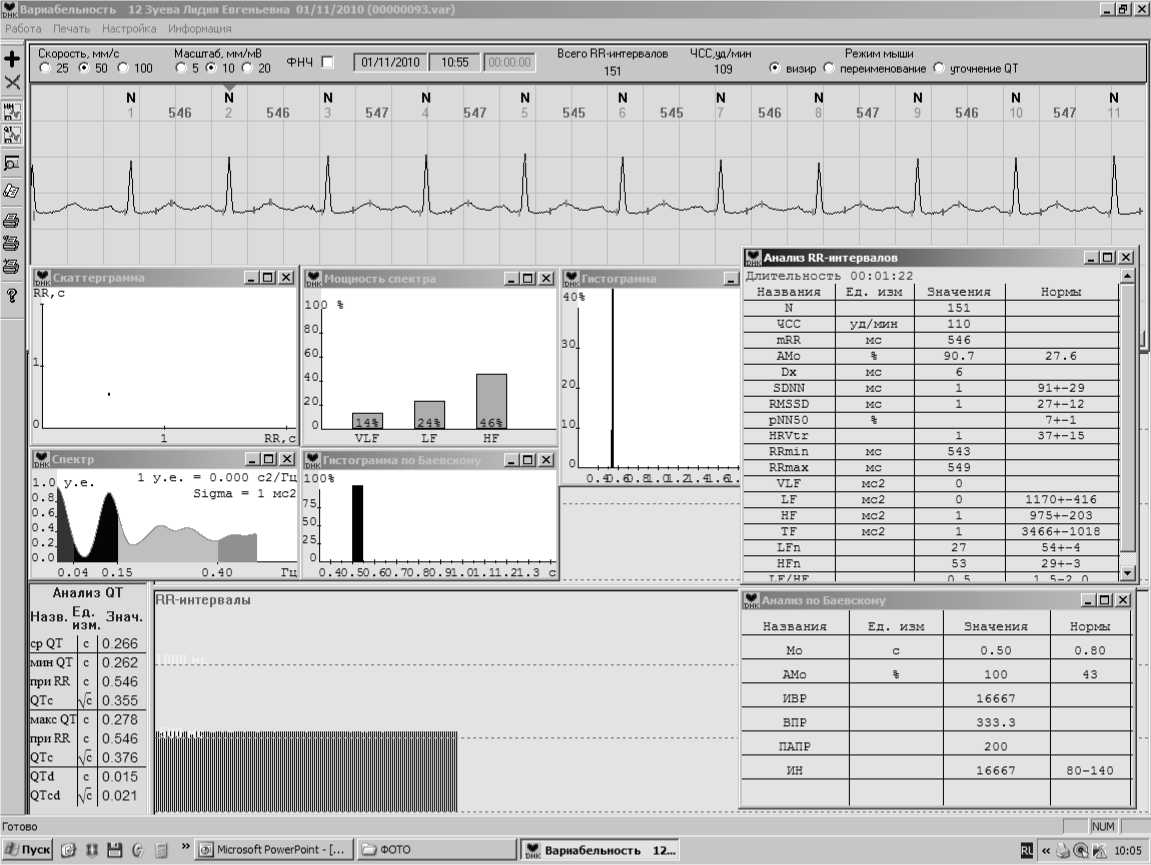
Рис. 3. Кардиоинтервалограмма через 5 минут после десуфляции
нии SDNN и HRVtr. Частотный анализ ВСР свидетельствует о слабом, но все же увеличении общей мощности спектра (TF) за счет наибольшей доли очень низких частот (VLF – 76% от TF), механизм появления которых состоит в снижении восприимчивости органа-мишени к насыщающим влияниям усиленной симпатикотонии на синусовый узел и в меньшей мере – сдвигом в сторону низкочастотной части спектра (доля HF снизилась с 46% до 10% от TF). Этому соответствует слабое преобладание симпатических влияний с приближением вагосимпатического баланса к равновесию (LF/HF=1,1). Тем не менее, скаттерграмма остается в виде сжатого (симпатотонического) авторегрессивного «облака», а гистограмма также имеет симпатотоническую (эксцессивную) форму. Следовательно, через 5 минут после десуфляции отмечается ослабление центральных (гипоталамических) влияний на сердечный ритм и реакции синусового узла на симпатическую стимуляцию, что создает относитель- ное усиление вагусных влияний и приближение реципрокных отношений к равновесию (LF/HF=1,1).
Через 15 минут после десуфляции (рис. 4) зарегистрировано урежение ЧСС (82 в мин.) и появление желудочковой бигеминии, которые сменяются тахикардией (106 в мин., а затем – восстановлением регулярного синусового ритма. Увеличение ВСР и, следовательно, дыхательных парасимпатических волн высокой частоты подтверждается удлинением RRd и восстановлением до нормы QTd. При этом статистический анализ выявляет однозначность сдвигов всех показателей в сторону парасимпатикото-нии: слабое увеличение Мо, значительное – ΔХ и многократное снижение ИВР (в 85 раз), ВПР (в 60 раз), ИН (в 94 раза) и ПАПР (в 1,5 раза), что указывает на сдвиг вегететативного равновесия в парасимпатическую сторону и усиление автономного контура регуляции при недостаточности центральных и симпатических влияний на синусовый узел. Однонаправленное изменение всех
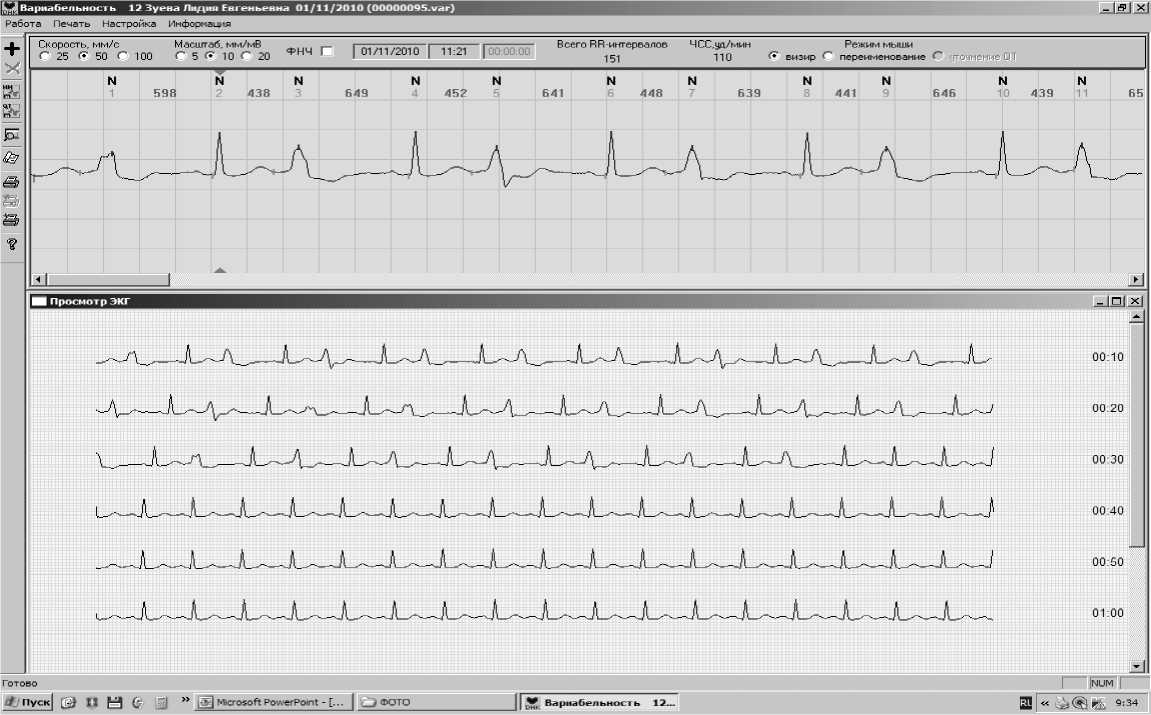
Рис. 4. Кардиоинтервалограмма через 15 минут после десуфляции
временных показателей в виде увеличения SDNN (в 33 раза), RMSSD (в 12 раз) и pNN50 (в 30 раз) при слабой симпатической активности также указывает на парасимпатическое доминирование. Механизм этого вегетативного сдвига раскрывает частотные характеристики нарушения стационарности сердечного ритма. Значительное увеличение общей мощности спектра (TF в 3,5 раза больше нормы и почти в 2000 раз больше показателей при синусовом ритме и 5-минутного периода десуфляции) в связи с увеличением вариабельности ритма, и наибольшей среди всех периодов исследования доли высокочастотной вагусной составляющей спектра (HF – 42%). Увеличение VLF даже в 2 раза имеет самостоятельное значение для оценки межсистемного гипоталамического уровня регуляции, а увеличение в 2000 раз отражает нарастающую дискоординацию в функционировании сердечно-сосудистой системы, наступающую на фоне мощных эфферентных парасимпатических влияний (увеличение HF в 2 раза по сравнению с нормой и снижение LF/HF до 0,5). Следовательно, через 15 мин. после десуфляции симпатическое доминирование сменяется парасимпатическим с нарушением сердечного ритма и развитием желудочковой бигеминии. Скат-терграмма приобретает вид рассеянного ваготонического «облака», а гистограмма становится широкой полимодальной.
Выводы
-
1. При лапароскопической холецистэктомии с наложением НКП исходная вегетативная нормотония «на высоте» использования карбоксиперитонеума перед десуфляцией сменяется гиперсимпатикотонией, а затем – нарастающей ваготонией, отражая срыв механизмов адаптации.
-
2. У ряда пациентов (9%) применение НКП может привести к срыву регуляции сердечного ритма и развитию аритмий.
-
3. Динамические изменения кардиоинтервалограмм на этапах выполнения лапароскопической холецистэктомии при использовании НКП свидетельствуют, что аритмогенная готовность миокарда возникает перед десуфляцией и максимальна – через 15 минут после десуфляции, что требует обязательного интраоперационного и периоперационного мониторирования сердечного ритма.
-
4. Критериями прогностического риска сердечных аритмий при НКП являются признаки нарастающего парасимпатического доминирования: увеличение DX, RMSSD, pNN50, TF, HF при снижении ИН.
-
5. Выраженные нарушения ВСР при использовании карбок-сиперитонеума 12 мм рт. ст. регистрируются не только у пожилых, но и у лиц среднего и молодого возраста.
-
6. Проблема негативного влияния карбоксиперитонеума диктует необходимость поиска способов минимизации этого влияния у пациентов, оперируемых с применением лапароскопических методик.
КЛИНИЧЕСКИЕ СЛУЧАИ. ДИСКУССИИ
Список литературы Характер изменений вегетативной регуляции по вариабельности сердечного ритма при лапароскопических оперативных вмешательствах с использованием напряженного карбоксиперитонеума
- Голубев А.А. Способ создания контролируемого ненапряженного карбоксиперитонеума, снижающего неблагоприятные влияния высокого внутрибрюшного давления на регуляцию сердечного ритма//Альманах института хирургии имени А.В. Вишневского. Материалы XIV Съезда Общества Эндоскопических хирургов России. М.: ООО «Вими реклама», 2011. Т. 6, №1 (1). С 16.
- Голубев А.А., Шпак Л.В., Зуева В.А. и др. Вариабельность сердечного ритма в зависимости от уровня давления в брюшной полости при лапароскопической холецистэктомии//Альманах института хирургии имени А.В. Вишневского. Материалы XIV Съезда Общества Эндоскопических хирургов России. М.: ООО «Вими реклама», 2011. Т. 6, №1 (1), С 17.
- Сердаров Н.О. Изменение функции внешнего дыхания при лапароскопической холецистэктомии//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. С. 307-308.
- Сало В.Н., Маликов Я.В. Изучение внутрибрюшного давления в эксперименте и клинике//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. С. 299-300.
- Коссович М.А., Бирюков А.Ю., Кузовахо В.В. Использование техники выполнения лапароскопической холецистэктомии в традиционной хирургии как фактор улучшения результатов лечения пациентов с холелитиазом.//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. С. 174-175.
- Касумьян С.А., Некрасов А.Ю., Зубарев В.В. и др. Применение веерообразного лапаролифта в лечении острого холецистита у лиц пожилого и старческого возраста//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. C. 158-159.
- Lindberg F., Bergqvist D., Rasmussen I. Incidence of thromboembolic complications after laparoscopic cholecystectomy: review of the literature//Surg. Endosc. 1997. Vol. 11.
- Мальчиков А.Я., Сигал З.М. Интраорганная гемопульсомоторо-оксидинамика при лапароскопических операциях//Эндоскопическая хирургия. Материалы IX Всероссийского съезда по эндоскопической хирургии. М.: Медиасфера, 2006. С. 81-82.
- Баулин А.А. Спорные вопросы профилактики послеоперационной тромбоэмболии легочной артерии//Альманах института хирургии имени А.В. Вишневского. Материалы XIV Съезда Общества Эндоскопических хирургов России. М.: ООО «Вими реклама», 29011. Т. 6, №1 (1). С. 13-14.
- Сердаров Н.О. Влияние карбоксиперитонеума на функцию внешнего дыхания//Альманах института хирургии имени А.В. Вишневского. Материалы XIV Съезда Общества Эндоскопических хирургов России. М.: ООО «Вими реклама», 2011. Т. 6, №1 (1). С. 23.
- Зуева В.А., Голубев А.А. и др. О проблемах тромбоэмболии легочной артерии при лапароскопической холецистэктомии//Сборник научных работ шестой научно-практической конференции врачей г. Твери, Тверской области и центрального Федерального округа России с участием ведущих специалистов Российской Федерации. г. Тверь, 1-2 апреля 2011. С. 53-56.
- Голубев А.А. и др. Тромбоэмболические осложнения при лечении желчекаменной болезни//Эндоскопическая хирургия. 2006. Т. 12, №2. С. 33-34.
- Голубев А.А., Еремеев А.Г., Волков С.В и др. Влияние напряженного карбоксиперитонеума на газовый состав и КЩС крови пациентов при выполнении лапароскопической холецистэктомии//ЦентральноАзиатский медицинский журнал. 2010. Т. XVI, Прил. 3. С. 22-24.
- Rosenthal R.J. et al. Intracranial pressure: effects ofpneumoperitoneum in a large-animal model//Surg. Endosc. 1997. Vol. 11. P 376-380.
- Halverson A. Evaluation of mechanism of increased intracranial pressure with insufflation//Surg. Endosc. 1998. Vol. 12. P. 266-269.
- Lindberg F., Bergqvist D., Rasmussen I. Laparoscopy and major retroperitoneal vascular injuries (MRVI)//Surg. Endosc. 1997. Vol. 11.
- Токин А.Н. Новые технологии как средство профилактики послеоперационных осложнений при лапароскопической холецистэктомии//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. С. 337.
- Малоштан О.В. Особливоси виконання лапароскошчних втручань у хворих iз супровщною патолопею сердцево-судинно! системи//Шпитальна хiрургiя. 2001. № 3. С. 45-47.
- Хитарьян А.Г. и соавт. Пути прогнозирования и профилактики послеоперационных осложнений лапароскопической холецистэктомии у больных с сопутствующей кардио-респираторной патологией//Эндоскопическая хирургия. Материалы XIV Всероссийского съезда по эндоскопической хирургии. М.: Медиасфера, 2011. С. 56.
- Голубев А.А., Еремеев А.Г. и др. Использование малоинвазивных технологий в лечении пациентов с калькулезным холециститом//Центрально-Азиатский медицинский журнал. 2010. Т. XVI, Прил. 3. С. 24-26.
- Дазаев Р.С. Оптимизация современных методов хирургического лечения желчнокаменной болезни и ее осложнений. М., 2000. 305 c.
- Измайлов С.Г., Рябков М.Г., Лукоянычев Е.Е. Возможности хирургической коррекции интраабдоминальной гипертензии в послеоперационном периоде при закрытой лапаротомной ране//Материалы XI съезда хирургов Российской федерации. Волгоград, 25-27 мая 2011. C. 141.
- Л.В.Шпак. Кардиоинтервалография и ее клиническое значение. Учебно-методическое пособие для врачей, интернов, ординаторов, аспирантов, терапевтов, кардиологов. Тверь: Издательство «Фактор», 2002. 232 с.


