Характеристика бактерий, выделенных из рудника Верхнекамского месторождения солей (Пермский край)
Автор: Пьянкова А.А., Усанина Д.И., Алеев В.С., Блинов С.М., Плотникова Е.Г.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Из глинистых отложений рассолоотводящих выработок и рассолосборников рудника Верхнекамского месторождения солей (Пермский край) было выделено 29 штаммов галофильных/галотолерантных бактерий. В результате филогенетического анализа, проведенного на основе сравнения последовательностей гена 16S рРНК, было установлено, что выделенные культуры являются представителями классов Gammaproteobacteria (семейств Halomonadaceae и Salinisphaeraceae) и Bacilli (семейства Bacillaceae). Три галофильных штамма SHV2, RV14 и SWV1 имели сходство с ближайшим типовым штаммом вида Salinisphaera hydrothermalis на уровне 95.94-96.62% (ген 16S рРНК), что указывает на принадлежность этих штаммов к новому таксону. Большинство выделенных бактерий семейств Halomonadaceae и Bacillaceae являются экстремофилами: растут при рН 9-10 и высокой солености среды (до 250-270 г/л NaCl). У двух галофильных штаммов рода Halomonas обнаружена способность к деструкции салициловой и бензойной кислот (продуктов разложения полиароматических соединений), что делает их перспективными для использования в биотехнологиях восстановления загрязненных территорий с высоким уровнем минерализации.
Верхнекамское месторождение солей, галофильные и галотолерантные бактерии, гены 16S рРНК
Короткий адрес: https://sciup.org/147229667
IDR: 147229667 | УДК: 579.26:57.083.18 | DOI: 10.17072/1994-9952-2020-4-312-320
Текст научной статьи Характеристика бактерий, выделенных из рудника Верхнекамского месторождения солей (Пермский край)
Верхнекамское месторождение солей (ВКМС) является одним из крупнейших в мире. На территории Пермского края с 1934 г. ведутся интенсивные работы по разработке и промышленной добыче калийных, калийно-магниевых и натриевых солей. В результате воздействия огромного количества отходов калийных предприятий происходит засоление почв, поверхностных и подземных вод, что способствует формированию на территории солеразработок специфических условий для выживания растений и микроорганизмов.
Ранее, из наземных экотопов (засоленных почв, грунтов, водоемов, отходов производства), а также из соляных пород (каменной соли, карналлита) ВКМС были выделены и охарактеризованы гало-фильные и галотолерантные бактерии и археи раз-
личных таксономических групп [Yastrebova et al., 2009; Корсакова и др., 2013, 2017; Карташова и др., 2017; Кашапова и др., 2018; Ястребова, Корсакова, Плотникова, 2018; Пьянкова, Кашапова, Плотникова, 2019]. Описаны новые таксоны бактерий, выделенных из техногенных вод шламохра-нилищ и продуктов обогащений калийных руд [Ананьина и др., 2007; Plotnikova et al., 2011; Реут-ских, Саралов, 2012]. Кроме того, обнаружено, что некоторые бактериальные штаммы способны к разложению ряда органических загрязнителей окружающей среды, таких как фталаты [Ястребова, Пьянкова, Плотникова, 2019], нафталин [Ананьина, и др., 2011], бифенил и хлорбифенилы [Егорова и др., 2018], что указывает на возможность их использования при разработке новых технологий восстановления загрязненных/засолен ных почв и водоемов. В настоящее время продолжаются работы по изучению разнообразия бактерий в микробных сообществах района солеразработок ВКМС.
Цель работы – выделение галофильных/гало-толерантных микроорганизмов из донных отложений рассолоотводящих выработок и рассолосбор-ников рудника ВКМС (Пермский край), их таксономическая и эколого-физиологическая характеристика.
Материалы и методы исследования
Образцы для исследований . Для выделения микроорганизмов были использованы образцы глинистых донных отложений, отобранные из рассолоотводящих выработок и рассолосборников в одном из рудников ВКМС (г. Соликамск, Пермский край). В образцах водных вытяжек глинистых осадков были определены значения pH и общее содержание водорастворимых солей [Практикум …, 2001].
Для выделения микроорганизмов использован метод накопительного культивирования в богатой среде Раймонда (БСР). Для приготовления БСР в минеральную среду Раймонда (МСР) [Raymond, 1961] добавляли триптон (5 г/л), дрожжевой экстракт (2.5 г/л) и хлорид натрия (100, 150 и 200 г/л). Для получения накопительных культур в колбы со 100 мл БСР, содержащей разные концентрации соли, добавляли 1 г глины. Культивирование проводили на шейкере при 100 об./мин. в течение 3 недель, после чего осуществляли высев суспензии на агаризованную БСР (15 г/л агара) с содержанием 150 г/л NaCl. Отдельные колонии микроорганизмов, отличавшихся по морфологии, были отобраны для дальнейших исследований.
ДНК-типирование чистых культур бактерий проводили методом BOX-ПЦР [Versalovic et al., 1994]. Для визуализации ПЦР-продуктов проводи- ли электрофорез в горизонтальном агарозном геле (2.0%) в буфере TBE x 1 (Трис – 10.8 г/л, борная кислота – 5.5 г/л, 0.5М ЭДТА – 4 мл, вода дистиллированная – 79.7 мл/л) при комнатной температуре, напряжении 5‒15 В/см в течение 1.5 ч. Агарозные гели окрашивали раствором бромистого этидия (0.5 мкг/мл) в течение 5‒10 мин. и фотографировали в УФ-свете с помощью системы гель-документирования BioDocAnalyze («Bio-Rad Laboratories», США). Для определения размеров фрагментов использовали маркер длин ДНК 100+ bp DNA Ladder («Евроген», Россия).
Идентификацию бактерий осуществляли на основе анализа гена 16S рРНК. Для выделения ДНК из чистых культур бактерий использовали метод «щелочного лизиса». Амплификацию фрагмента гена 16S рРНК проводили с универсальными бактериальными праймерами 27F и 1492R [Lane, 1991] на амплификаторе C1000 TouchTM Thermal Cycler («Bio-Rad Laboratories», США). Определение нуклеотидных последовательностей гена 16S рРНК было осуществлено с использованием праймера 27F и применением набора реактивов Big Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystem», США) в Пермском государственном национальном исследовательском университете (кафедра ботаники и генетики растений). Филогенетический анализ полученных нуклеотидных последовательностей размером 871‒952 п.н. проводился с использованием программ Sequence Scanner v. 2.0. MEGA 7.0 []. Поиск гомологичных последовательностей осуществлялся с помощью базы данных EzBioCloud []. Множественное выравнивание нуклеотидных последовательностей и построение филогенетических деревьев проводили с использованием программы MEGA 7.0. При построении филогенетических деревьев применяли кластерный метод «neighbor-joining». Оценку статистической достоверности ветвления («bootstrap»-анализ) проводили на основе 1000 альтернативных деревьев.
Изучение физиологических свойств бактериальных штаммов . Устойчивость выделенных бактерий к различным концентрациям хлорида натрия оценивали по появлению и размеру колоний при росте на агаризованной БСР с содержанием соли от 10 до 300 г/л. Оценку роста колоний проводили через две недели культивирования.
Рост бактерий при разных значениях pH определяли при концентрации 70 г/л NaCl в буферных системах, приготовленных на основе БСР. Штаммы культивировали на агаризованной среде БСР при рН 5.0, 6.0, 7.0, 8.0, 9.0, 10.0. Рост учитывали на 7-й день культивирования [Методы …, 1983].
Для оценки роста при разных температурах штаммы культивировали на агаризованной БСР (70 г/л NaCl) при +4, 28, 35, 40 и 45°С. Рост учитывали на 7-й день культивирования.
Способность бактерий разлагать ароматические углеводороды оценивали путём культивирования в жидкой минеральной среде Раймонда (МСР) (70 г/л NaCl) с добавлением бензойной и салициловой кислот (1 и 0.5 г/л, соответственно) в качестве единственного источника углерода и энергии. Рост оценивали при определении оптической плотности культуры (ОП 600 ) на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) на 7-й
Результаты и их обсуждение
Выделение чистых культур бактерий
Химический анализ водной вытяжки глинистых осадков показал, что образцы имеют высокое содержание водорастворимых солей – от 41 до 244 г/кг сухого грунта. Водородный показатель вытяжки в основном имеет значения, близкие к нейтральным рН~6.0‒7.6, за исключением более щелочной пробы из рассолосборника 2 с рН 8.8 (табл. 1).
день культивирования.
Таблица 1
Содержание водорастворимых солей и рН в образцах глинистых донных отложений
|
Место отбора |
Дата отбора |
Сумма водорастворимых солей, г/кг |
рН |
|
Рассолоотводящая выработка 1 |
25.06.2019 (глина рыжая) |
72 |
6.9 |
|
25.06.2019 (глина бурая) |
41 |
6.8 |
|
|
01.10.2019 |
63 |
7.6 |
|
|
Рассолоотводящая выработка 2 |
25.06.2019 |
46 |
6.9 |
|
01.10.2019 |
244 |
7.4 |
|
|
Рассолосборник 1 |
25.06.2019 |
52 |
6.6 |
|
01.10.2019 |
238 |
6.7 |
|
|
Рассолосборник 2 |
01.10.2019 |
226 |
8.8 |
Из высокоминерализованных образцов глинистых отложений было выделено 29 штаммов бактерий. Отбор изолятов основывался на различиях в морфологии колоний, выросших на агаризованной среде БСР, и сравнительном анализе ДНК чистых культур бактерий методом BOX-ПЦР. По результатам анализа BOX-профилей (данные не приводятся) представители разных геномогрупп были отобраны для секвенирования последовательностей гена 16S рРНК.
Штаммы семейства Halomonadaceae (класс Gammaproteobacteria )
В результате секвенирования и сравнения последовательностей гена 16S рРНК с типовыми штаммами из базы данных EzBioCloud [] было установлено, что 13 выделенных культур являются представителями семейства Halomonadaceae (класс Gammaproteobacteria) и относятся к родам Chromohalobacter (5 штаммов) и Halomonas (7 штаммов).
Все изоляты рода Chromohalobacter были близкородственны штамму C . canadensis ATCC43984T (табл. 2). Уровень идентичности по гену 16S рРНК у большинства штаммов с типовым штаммом составлял 99.89%, у штамма DK1K – 99.56%, в то же время, типирование методом BOX-ПЦР показало различие в структуре геномов этих штаммов (данные не приводятся).
Установлено, что все выделенные штаммы яв- ляются галофильными организмами, требующими для роста наличия соли в среде культивирования (выше 30 г/л) и способными расти при 300 г/л NaCl. Штаммы эффективно росли при высоких значениях pH среды – до 9.0, т.е. являются алка-лофилами. Интересно, что один из штаммов этой группы (штамм D10) был выделен из экотопа с рН 8.8, другие штаммы – из образцов с нейтральной рН (табл. 1, 2).
Три штамма рода Halomonas (DK1M, DG2M, D3A) имели 100%-ный уровень сходства по генам 16S рРНК с типовыми штаммами видов H . alka-liantarctica , H . titanicae , H . alimentaria , штаммы DR1, D2 – около 99.4% сходства с H . taeanensis и штамм DG2K – 99.02% сходства с H . utahensis (табл. 2). Интерес для дальнейших исследований представляет штамм D12, имеющий сходство по гену 16S рРНК с типовыми штаммами видов H . meridiana , H . piezotolerans , H . songnenensis ниже 99%. Штамм D12 был выделен из образца осадка рассолосборника, характеризующегося высоким уровнем минерализации (226 г/кг) и щелочными условиями среды (рН 8.8).
Большинство штаммов рода Halomonas (DK1M, DG2K, DG2M, DG3K) являются галотоле-рантными и могут расти как без соли в среде культивирования, так и в присутствии хлорида натрия – до 250 г/л. Исключением является штамм Halo-monas sp. DR1, не способный к росту без содержания соли в среде. Кроме того, представителей этого рода, выделенных из глинистых отложений, можно отнести к группе алкалофильных микроор- 10.0, кроме штамма Halomonas sp. DR1 (растет ганизмов, т.к. большинство из них характеризуется при рН 6.0‒8.0).
ростом при значении водородного показателя до
Таблица 2
Анализ нуклеотидных последовательностей генов 16S рРНК изолированных бактерий
|
Штамм |
Типовой штамм |
Номер в GenBank |
Сходство, % |
Источник выделения (дата отбора пробы) |
Класс Gammaproteobacteria , порядок Oceanospirillales , семейство Halomonadaceae , род Chromohalobacter
|
DK1K |
Chromohalobacter canadensis ATCC 43984T |
AJ295143 |
99.56 |
Рассолоотводящая выработка 1, глина бурая (25.06.19) |
|
DG3G |
Chromohalobacter canadensis ATCC 43984T |
AJ295143 |
99.89 |
Рассолоотводящая выработка 2 (25.06.19) |
|
D1 |
Chromohalobacter canadensis ATCC 43984T |
AJ295143 |
99.89 |
Рассолоотводящая выработка 2 (01.10.19) |
|
D5 |
Chromohalobacter canadensis ATCC 43984T |
AJ295143 |
99.89 |
Рассолоотводящая выработка 2 (01.10.19) |
|
D10 |
Chromohalobacter canadensis ATCC 43984T |
AJ295143 |
99.89 |
Рассолосборник 2 (01.10.19) |
Класс Gammaproteobacteria , порядок Oceanospirillales , семейство Halomonadaceae , род Halomonas
|
DK1M |
Halomonas alkaliantarctica CRSST |
AJ564880 |
100.00 |
Рассолоотводящая выработка 1, глина бурая (25.06.19) |
|
DR1 |
Halomonas taeanensis BH539T |
AY671975 |
99.45 |
Рассолоотводящая выработка 1, глина рыжая (25.06.19) |
|
DG2K |
Halomonas utahensis DSM 3051T |
AJ306893 |
99.02 |
Рассолосборник 1 (25.06.19) |
|
DG2M |
Halomonas titanicae BH1T |
AOPO010000 38 |
100.00 |
Рассолосборник 1 (25.06.19) |
|
D2 |
Halomonas taeanensis BH539T |
AY671975 |
99.43 |
Рассолоотводящая выработка 2 (01.10.19) |
|
D3A |
Halomonas alimentaria YKJ-16T |
AF211860 |
100.00 |
Рассолоотводящая выработка 2 (01.10.19) |
|
D12 |
Halomonas meridiana DSM 5425T Halomonas piezotolerans NBT06E8T Halomonas songnenensis NEAU-ST10-39T |
AJ306891 MN435603 JQ762289 |
98.96 |
Рассолосборник 2 (01.10.19) |
Класс Gammaproteobacteria , порядок Nevskiales , семейство Salinisphaeraceae , род Salinisphaera
|
SWV1 |
Salinisphaera hydrothermalis EPR70T |
EU740416 |
95.94 |
Рассолоотводящая выработка 2 (25.06.19) |
|
SHV1 |
Salinisphaera hydrothermalis EPR70T |
EU740416 |
99.89 |
Рассолоотводящая выработка 1, глина рыжая (25.06.19) |
|
SHV2 |
Salinisphaera hydrothermalis EPR70T |
EU740416 |
96.62 |
Рассолоотводящая выработка 1, глина рыжая (25.06.19) |
|
SHV6 |
Salinisphaera hydrothermalis EPR70T |
EU740416 |
99.89 |
Рассолоотводящая выработка 1 (01.10.19) |
|
RV14 |
Salinisphaera hydrothermalis EPR70T |
EU740416 |
96.63 |
Рассолосборник 1 (01.10.19) |
Класс Bacilli, порядок Bacillales, семейство Bacillaceae
|
DG3K |
Virgibacillus halodenitrificans DSM 10037T |
AY543169 |
100.00 |
Рассолоотводящая выработка 2 (25.06.19) |
|
D13A |
Oceanobacillus oncorhynchi subsp. incaldanensis 20AGT |
AJ640134 |
100.00 |
Рассолосборник 2 (01.10.19) |
Получены предварительные данные о способности штаммов рода Halomonas использовать в качестве ростовых субстратов моноароматические соединения. Так, Halomonas sp. DK1M эффективно рос на минеральной среде Раймонда с салициловой кислотой (0.5 г/л) в качестве единственного источника энергии, а штамм Halomonas sp. DR1 проявлял способности к деструкции бензойной кислоты (1 г/л).
Представители родов Chromohalobacter и Halomonas являются галофильными/галотоле-рантными бактериями, которые широко распространены в засоленных местообитаниях – морях, соленых озерах, солончаках, солеварнях, соленых пищевых продуктах, также были выделены из месторождений солей, соляных шахт [Ai, Huang, Wang, 2018; Megaw, Gilmore, 2018]. Известно использование штаммов родов Chromohalobacter и Halomonas в биотехнологических процессах, в том числе – в качестве продуцентов осмотротекторных соединений, аминокислот [Edbeib, Wahab, Huyop, 2016; Пьянкова, Ананьна, 2018] деструкторов загрязнителей окружающей среды [Кандаурова, Ястребова, Плотникова, 2017; Nanca et al., 2018].
Штаммы рода Salinisphaera
(класс Gammaproteobacteria )
Анализ нуклеотидных последовательностей гена 16S рРНК показал, что штаммы SHV1 и SHV6 имели наибольший уровень сходства (99.89%) с Salinisphaera hydrothermalis EPR70T (класс Gammaproteobacteria , порядок Nevskiales , семейство Salinisphaeraceae ). Данные штаммы, а также три других изолята (SHV2, RV14 и SWV1) имели незначительные различия по BOX-ПЦР профилям (данные не приводятся). Штаммы SHV2 и RV14 при анализе фрагмента гена 16S рРНК размером 895‒923 п.н. (секвенирование с использованием праймера 27F) имели сходство с типовым штаммом вида Salinisphaera hydrothermalis на уровне 96.62%, а сходство почти полного гена 16S рРНК (размер анализируемого фрагмента 1.411 п.н.) штамма SWV1 – на уровне 95.94% (табл. 2). На дендрограмме показано, что эти три штамма образуют отдельный кластер (рисунок). Полученные данные позволяют предположить, что штаммы SHV2, RV14 и SWV1 могут представлять новые таксономические единицы, поэтому дальнейшее их исследование вызывает несомненный интерес.
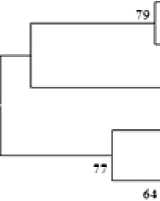
----------------Sahnisphoera doWonemis CL-E$53T [EF988634]
----------------- SaJtoiiiphaera shabawiist E1L3AT [AJ421425]
-
■ Salinisphaera aquimarina CCMM005T [KYO6OO12]
__I Salinisphaera haloplnla YIM 9Ч6П [JN020587] ioo* Salinisphaera orenit MK-B5T [HM137558]
------------- Salinispluwra iaponica YTM-1T [AB735546]
---------------SWV1, SHV2, RV14
rSHVl. SHV6
10» I— Sdlinisphaera Indrothermahi EPR70T [EU7404I6]
Филогенетическое древо, построенное с использованием метода neighbor-joining, показывающее положение исследуемых изолятов в роде Salinisphaera , основанное на сравнении нуклеотидных последовательностей гена 16S рРНК длиной 895‒1411 п.н.
Эволюционные расстояния рассчитаны с использованием метода Джукса-Кантора. Масштаб соответствует 5 нуклеотидным заменам на каждые 1000 нуклеотидов. Цифрами показана статистическая достоверность порядка ветвления, определенная с помощью «bootstrap» анализа 1 000 альтернативных деревьев (приведены значения выше 50%). Изоляты с идентичными генами 16S рРНК, перечислены через запятую
Ранее штаммы рода Salinisphaera были изолированы из воды, донных отложений, отходов производства калийных солей (г. Соликамск) [Корсакова, 2014].
Изолированные штаммы рода Salinisphaera являются галофильными бактериями, при этом у штаммов SHV1, SHV6 наблюдается рост при содержании 10‒270 г/л NaCl в среде, а у изолятов SHV2, SWV1, RV14 – при 10‒300 г/л. Выделенные штаммы рода Salinisphaera растут при pH среды
-
6.0‒7.0 и температуре от +28 до +40°C, но не растут при +4°C.
Штаммы семейства Bacillaceae(класс Bacilli)
Из образцов глинистых осадков рассолосбор-ника и рассолоотводящей выработки рудника выделено два штамма семейства Bacillaceae (класс Bacilli ). Штаммы DG3K и D13A имели 100%-ное сходство с Virgibacillus halodenitrificans DSM
10037T и Oceanobacillus oncorhynchi subsp. incaldanensis 20AGT, соответственно (табл. 2).
Штамм Virgibacillus sp. DG3K является галото-лерантным, алкалофильным организмом: может расти без соли в среде культивирования и в присутствии 250 г/л NaCl, а также при значениях pH среды 7.0‒10.0. Примечательно, что штамм Virgibacillus sp. DG3K не только является алкало-филом, но также способен к эффективному росту при температурах до +45°C.
Штамм Oceanobacillus sp. D13A был изолирован из образца осадочной глины, характеризующейся рН 8.8 и высоким содержанием солей (табл. 1). Типовой штамм Oceanobacillus on-corhynchi subsp. incaldanensis 20AGT, близкородственный штамму D13A, является галофильным, алкалотолерантным микроорганизмом: растет при 50‒200 г/л NaCl (с оптимальным ростом при 100 г/л соли) и при pH 6.5‒9.5 (оптимум pH 9.0) [Romano et al., 2006]. Из района солеразработок Верхнекамского месторождения (г. Соликамск, г. Березники) ранее были выделены солеустойчивые бактерии родов Virgibacillus и Oceanobacillus [Корсакова, 2014].
Заключение
В результате исследования образцов глинистых отложений водоотводящей выработки и рассоло-сборника рудника ВКМС были получены новые данные о разнообразии бактерий района солеразработок ВКМС. Выделено 29 штаммов, относящихся к классам Gammaproteobacteria (семейство Halomonadaceae , семейство Salinisphaeraceae ) и Bacilli (семейство Bacillaceae ). Филогенетический анализ показал, что штаммы SHV2, RV14, SWV1 представляют новые таксономические единицы в семействе Salinisphaeraceae ; исследование этих штаммов будет продолжено. Среди изолятов выявлены галофильные бактерии, способные к росту при концентрации хлорида натрия в среде до 300 г/л. Ряд штаммов родов Oceanobacillus , Virgibacillus , Chromohalobacter , Halomonas способны к росту в щелочной среде (рН 9.0‒10.0), являются алкалофилами. При изучении биодеграда-ционных свойств изолятов, у двух галофильных штаммов рода Halomonas обнаружена способность к деструкции моноароматических углеводородов – салициловой и бензойной кислот, что предполагает дальнейшее изучение этих штаммов с перспективой использования их в биотехнологиях восстановления загрязненных территорий с высоким уровнем минерализации.
Работа выполнена в рамках государственного задания, номер госрегистрации темы: АААА-А19-119112290008-4.
Список литературы Характеристика бактерий, выделенных из рудника Верхнекамского месторождения солей (Пермский край)
- Ананьина Л.Н. и др. Salinicola socius gen. nov., sp. nov. - умеренно галофильная бактерия из ассоциации микроорганизмов, утилизирующей нафталин // Микробиология. 2007. Т. 76, № 3. С. 369-376.
- Егорова Д. О. и др. Особенности разложения хлорированных бифенилов штаммом Rhodococcus wratislaviensis KT112-7 в условиях засоления // Прикладная биохимия и микробиология. 2018. Т. 54, № 3. С. 253-263.
- Кандаурова Ю.М., Ястребова О.В., Плотникова Е.Г. Новый галотолерантный штамм-деструктор фталатов Halomonas sp. PG1 // История и методология физиолого-биохимических и почвенных исследований: материалы конф. Пермь, 2017. С. 71-73.
- Карташова Ю.А. и др. Изучение некультивируе-мых бактерий глубинной породы мергеля (Верхнекамское месторождение, Пермский край) // Биология - наука XXI века: материалы 21 междунар. Пущинской школы-конф. молодых ученых. Пущино, 2017. С. 23.
- Кашапова Л.Э. и др. Молекулярно-генетические подходы к изучению микроорганизмов глубинной породы карналлита Верхнекамского месторождения солей // Высокие технологии, определяющие качество жизни: материалы междунар. науч. конф. Пермь, 2018. С. 52-55.
- Корсакова Е.С. Культивируемые аэробные бактерии из района промышленных разработок Верхнекамского месторождения солей: дис. ... канд. биол. наук. Пермь, 2014. 150 с.
- Корсакова Е.С. и др. Разнообразие бактерий семейства Halomonadaceae района разработок Верхнекамского месторождения солей // Микробиология. 2013. Т. 82, № 2. С. 247-250.
- Корсакова Е.С. и др. Микробное разнообразие в глинисто-солевых шламах калийного предприятия (г. Березники, Пермский край) // Вестник Пермского университета. Сер. Биология. 2017. Вып. 1. С. 70-79.
- Методы общей бактериологии: пер. с англ. М.: Мир, 1983. Т. 1-3.
- Практикум по агрохимии: учеб. пособие. М.: Изд-во МГУ, 2001. 689 с.
- Пьянкова А.А., Ананьина Л Н. Оптимизация условий культивирования штамма Chromohalobac-ter sp. TC193 для увеличения биосинтеза экто-ина // Материалы V международной конференции молодых ученых: биотехнологов, молекулярных биологов и вирусологов. Новосибирск, 2018. С. 97-99.
- Пьянкова А.А., Кашапова Л.Э., Плотникова Е.Г. Бактерии глубинной породы каменной соли (Верхнекамское месторождение солей) // Материалы XI Всерос. конгресса молодых ученыхбиологов с междунар. участием. Пермь, 2019. С. 65-66.
- Реутских Е.М., Саралов А.И. Exiguobacterium sp. RS34 - галоалкалотолерантная факультативно анаэробная неспорообразующая бактерия порядка Bacillales из шламохранилища калийного рудника // Вестник Пермского университета. Сер. Биология. 2012. Вып. 3. С. 49-53.
- Ястребова О.В., Пьянкова А.А., Плотникова Е.Г. Бактерии-деструкторы фталатов, выделенные из района промышленной добычи и переработки калийно-магниевых солей // Прикладная биохимия и микробиология. 2019. Т. 55, № 4. С. 378-385.
- Ястребова О.В, Корсакова Е.С., Плотникова Е.Г. Характеристика бактерий семейства Micrococ-caceae, выделенных из разных биотопов района солеразработок (Пермский край) // Известия Самарского научного центра РАН. 2018. Т. 20, №5(2). С. 300-306.
- Ai L., Huang Y., Wang C. Purification and characterization of halophilic lipase of Chromohalobacter sp. from ancient salt well // J. Basic. Microbiol. 2018. Vol. 58, № 8. P. 647-657.
- Anan'ina L.N. et al. Naphthalene-degrading bacteria of the genus Rhodococcus from the Verkh-nekamsk salt mining region of Russia // Antonie van Leeuwenhoek. 2011. Vol. 100. P. 309-316.
- Edbeib M.F., Wahab R.A., Huyop F. Halophiles: biology, adaptation, and their role in decontamination of hypersaline environments // World J. Microbiol. Biotechnol. 2016. Vol. 32. P. 135.
- Lane D.J. 16S/23S rRNA sequencing // Nucleic acid techniques in bacterial systematics / Eds Stackebrandt E., Goodfellow M. New York.: John Wiley and Sons. 1991. P. 115-175.
- Megaw J., Gilmore B.F. Draft genome sequence of Halomonas sp. CSM-2, a moderately halophilic bacterium isolated from a triassic salt mine // Microbiol. Resour. Announc. 2018. Vol. 26, № 7(3). P. e00836-18.
- Nanca C.L. et al. Degradation of polycyclic aromatic hydrocarbons by moderately halophilic bacteria from Luzon alt Beds // J. Health Pollut. 2018. Vol. 8, № 19. P. 180915.
- Plotnikova E.G. et al. Thalassospira permensis sp. nov., a novel halotolerant bacterium isolated from a naphthalene-utilizing microbial consortium // Microbiology. 2011. Vol. 80, № 5. Р. 703-712.
- Raymond R.L. Microbial oxidation of n-paraffinic hydrocarbons // Develop. Ind. Microbiol. 1961. Vol. 2, № 1. P. 23-32.
- Romano I. et al. Oceanobacillus oncorhynchi subsp. incaldanensis subsp. nov., an alkalitolerant halo-phile isolated from an algal mat collected from a sulfurous spring in Campania (Italy), and emended description of Oceanobacillus oncorhynchi // Int. J. Syst. Evol. Microbiol. 2006. Vol. 56. P. 805-810.
- Versalovic J. et al. Genomic fingerprinting of bacteria using repetitive sequence-based polymerase chain reaction // Meth. Cell Mol. Biol. 1994. Vol. 5. P. 25-40.
- Yastrebova O. V. et al. Aerobic spore forming bacteria from the region of salt mining // Russian Journal of Ecology. 2009. Vol. 40, № 7. P. 516-521.


